作者:Lei Li 同济大学博士后
本研究主要结果:
衰老主要与小鼠坐骨神经损伤后DRG中T细胞活化和信号传导的显著增加相关;衰老与坐骨神经损伤前后DRG中包括淋巴毒素在内的炎症细胞因子的增加相关。
淋巴毒素β对NF-κB的磷酸化而言是必需的,而NF-κB的磷酸化则可促进DRG感觉神经元中趋化因子CXCL13的表达。
在坐骨神经损伤后,CXCL13在过表达MHC-I的神经元附近招募表达CXCL13受体CXCR5的CD8+T细胞。
CXCR5+CD8+T细胞与表达MHC-I的感觉神经元之间的相互作用激活了caspase3,进一步阻碍pAKT和pS6信号转导,最终导致再生障碍。
通过药理学手段拮抗caspase 3的激活可以逆转老年小鼠的再生障碍及恢复AKT和S6的磷酸化水平。
过继性转移实验包括 Cxcl5-/-与野生型细胞之间的比较,直接表明CXCR5+ CD8+T细胞限制老年小鼠坐骨神经损伤后轴突再生。
通过单克隆抗体中和CXCL13阻断CXCR5+CD8+T细胞向DRG的募集可以使老年小鼠坐骨神经感觉神经元轴突的再生能力恢复到与年轻动物相当的水平。拮抗CXCL13能够显著促进皮肤神经再支配和感觉神经功能的恢复。


Simone Di Giovanni
Simone Di Giovanni就职于英国伦敦帝国理工学院神经科学系,是再生修复神经科学主席,同时还担任NHS神经病学系荣誉顾问职位。
其实验室主要研究方向为“研究控制轴突出芽和再生的分子信号转导和转录机制”,研究区分轴突再生和再生障碍(包括外周神经系统损伤和脊髓损伤)的分子信号机制。外周神经系统(PNS)与中枢神经系统(CNS)损伤后的轴突再生能力存在显著差异,其实验室优先研究脊髓背根神经节神经元损伤后的再生,因背根神经节的轴突同时投射到PNS与CNS,背根神经节为假单极感觉神经元,将具有外周再生能力的轴突投射到外周,将具有中枢轴突再生能力受限的轴突投射到脊髓。
其实验室的工作可以对创伤性、血管性、炎症性、退行性和代谢性疾病(如糖尿病)对脊髓、脊髓根部和周围神经的损害有广泛的影响。
近年来相关研究工作发表于Nature Reviews Neurology (2021/2019)、Nature Metabolism (2020)、Science Translational Medicine (2020)及Nature Neuroscience (2019)等。
✦
随着年龄的增长,轴突再生能力下降,老年人的轴突再生和神经功能恢复极为有限,神经系统损伤后通常导致严重的长期残疾(1-4)。衰老本身会引起细胞信号转导的广泛变化,包括代谢、免疫和组织内稳态的变化,这些变化在神经系统生理学和对损伤的反应中发挥关键作用(5-7)。然而,截止目前为止,与衰老相关的轴突再生能力下降的细胞和分子机制尚不十分清楚,而这无疑阻碍了有效的神经修复策略的发展。为了促进神经修复策略的开发,迫切需要确定导致衰老过程中导致轴突再生困难的关键分子和细胞机制。
来自英国伦敦帝国理工学院神经科学系的Simone Di Giovanni教授课题组假设:老年神经系统损伤后会发生独特的分子和细胞修饰。在损伤前即存在的衰老特异性分子、细胞机制的改变,将与损伤特异性信号结合,共同发挥抑制神经元再生的作用。对这些机制的深入了解有助于发现既往未被识别的分子靶标,从而对抗衰老依赖性的再生能力下降。基于对年轻小鼠与老年小鼠坐骨神经损伤(sciatic nerve injury, SNI)模型中的背根神经节(dorsal root ganglia, DRG)进行的RNA测序分析(RNA sequencing, RNA-seq)结果,研究者系统地研究了与衰老和神经系统损伤相关的分子和细胞特征。
2022年05月13日,Simone Di Giovanni教授课题组在Science杂志上公布了他们题为“Reversible CD8 T cell–neuron cross-talk causes aging-dependent neuronal regenerative decline”的研究成果,他们发现:衰老主要与小鼠坐骨神经损伤后DRG中T细胞活化和信号传导的显著增加相关,T细胞信号呈现出显著的衰老依赖性富集。淋巴毒素激活转录因子NF-κB,后者诱导神经元表达趋化因子CXCL13。CXCL3招募CXCR5+CD8+T细胞,前往过表达MHC-I的受损DRG神经元附近,CXCR5+CD8+T细胞与过表达MHC-I的感觉神经元间的相互作用激活了caspase3,后者阻碍pAKT和ps6信号转导,最终抑制DRG神经元的轴突再生。而且,中和CXCL13可抑制CXCR5+CD8+T细胞向DRG的聚集,进而够逆转衰老相关的再生能力下降,从而促进神经功能的恢复。
首先,研究者在坐骨神经损伤前(假手术)和损伤后(坐骨神经损伤造模组)对8-10周龄(年轻)和20-22个月龄(老年)小鼠的坐骨神经DRG进行RNA-seq,将基因表达情况分别与对照组(年轻小鼠假手术组)的基线表达情况进行了比较。随后通过GO和KEGG分析对差异表达的基因进行了功能分类。结果表明,坐骨神经损伤后的老年小鼠DRG中具有最多的差异表达基因;在稳态和损伤情况下,衰老均会诱导DRG细胞适应性免疫基因谱产生广泛变化,特别是T细胞和细胞因子/趋化因子信号通路在坐骨神经损伤后明显扩增,并呈现衰老依赖性富集(图1A)。
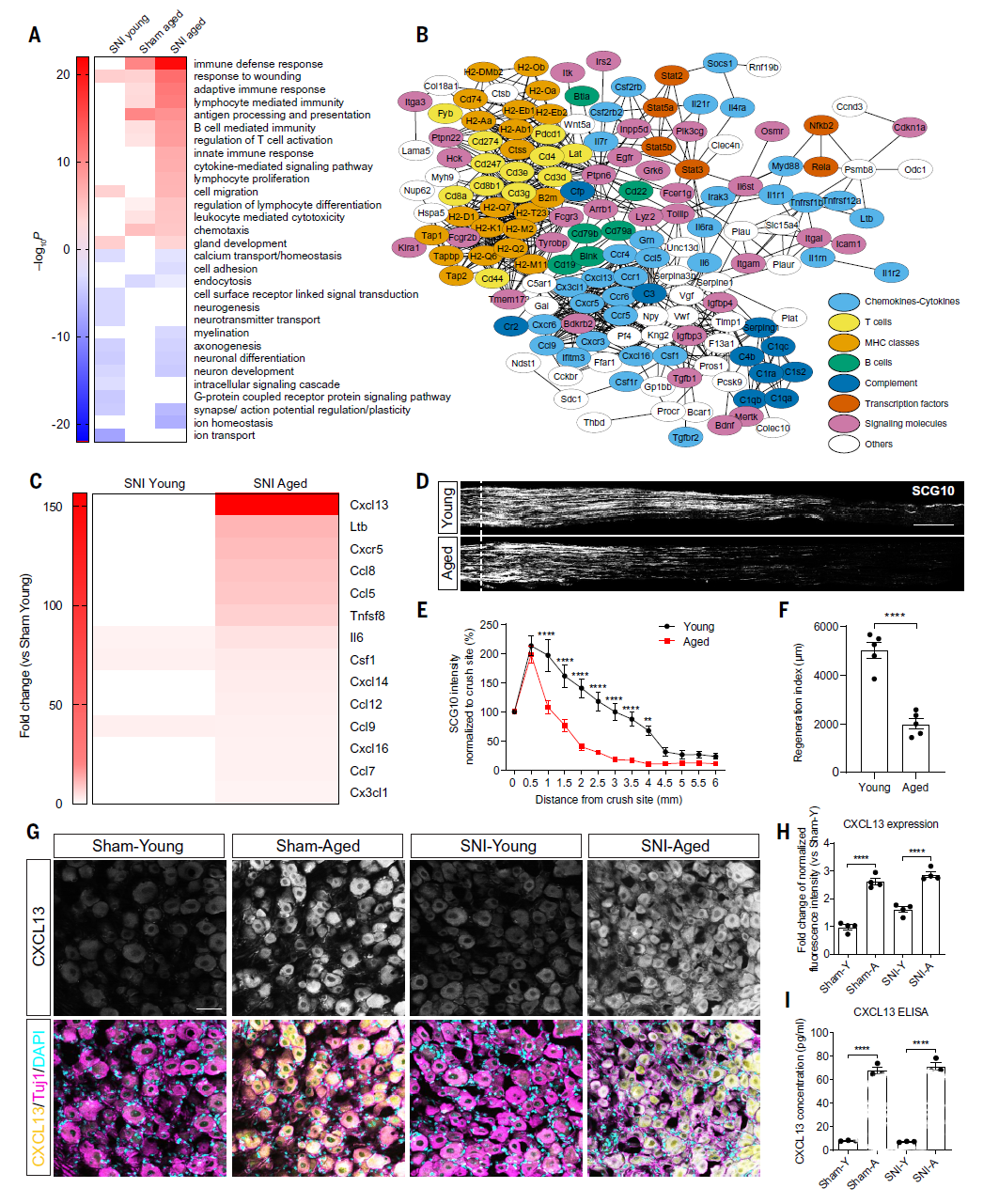
图1. 衰老诱导DRG中与趋化因子、细胞因子表达和适应性免疫应答相关的基因富集,同样比较了坐骨神经损伤前后的差异
研究者发现,测序结果显示CXCL13是坐骨神经损伤后上调表达最显著的基因(图1C),CXCL13的受体CXCR5在衰老小鼠DRG中也呈现显著的表达上调(图1C),这提示CXCL13-CXCR5信号轴可能参与衰老相关的神经再生抑制。随后,研究者比较了老年小鼠与年轻小鼠在基线状态与坐骨神经损伤造模3天后DRG神经元内CXCL13的表达情况(图1D-I),结果发现,相比于年轻小鼠,CXCL13在老年小鼠DRG神经元中显著增加。
考虑到CXCL13是CXCR5+ B和T细胞的趋化因子,研究者接下来评估了年轻小鼠和老年小鼠坐骨神经损伤3天后,DRG内B和T细胞的定位和免疫表型。结果提示,在老年小鼠DRG实质内,CXCR5+B细胞、 CXCR5+CD8+T细胞和CD4+T细胞数目显著增加(图2A-D)。相当大比例的CXCR5+CD8+T细胞为CD44+CD69+CD62L-细胞(效应记忆T细胞)(图2E-F);只有极少比例的CXCR5+CD8+T细胞或CD8+T细胞为CD103+和P2RX7+(迁移性T细胞)。
此外研究者还发现,记忆CXCR5+T细胞在老年小鼠血液的比例明显增加。与年轻小鼠相比,老年小鼠坐骨神经DRG中CD8+T细胞(包括CXCR5+CD8+T细胞)坐骨神经损伤3天前、后均显著增加(图2G-H)。所有的CD8+T细胞均为CD68-和CD3+,表明它们是T细胞而非巨噬细胞。
老年小鼠DRG内的B细胞数量增加,但这些细胞定位在DRG实质之外,可能在小静脉周围的间隙内。综上,老年小鼠DRG神经元中CXCL13表达增加,伴CXCR5+CD8+T细胞数增加,提示衰老与坐骨神经损伤前后神经元CXCL13表达增加和CXCR5+T细胞向DRG实质的募集相关。
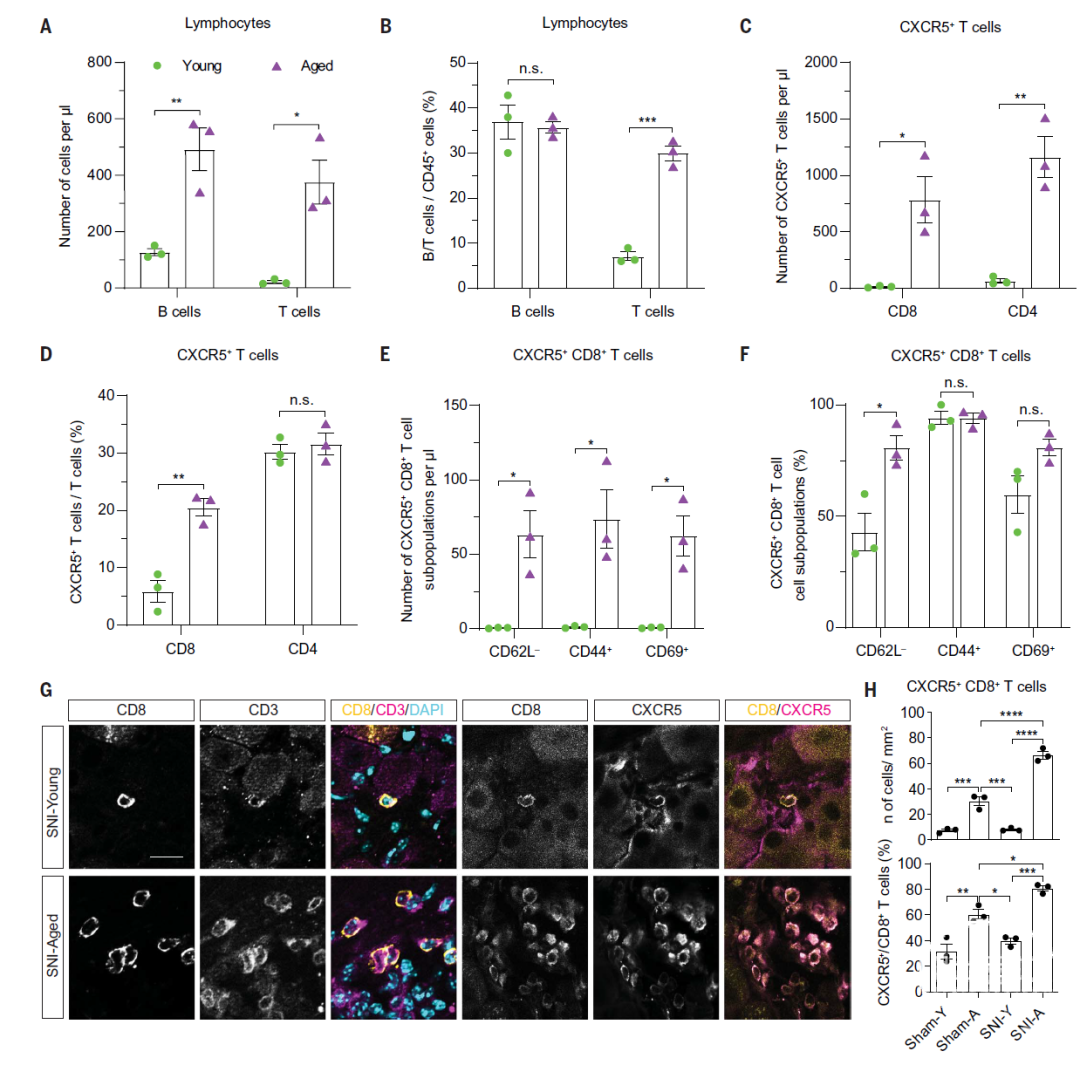
图2. 坐骨神经损伤前后DRG中CXCR5+ CD8+ T细胞特征
接下来,研究者探讨了神经元CXCL13的过表达是否足以将CXCR5+B和T细胞招募至DRG并抑制轴突再生。研究者首先用腺相关病毒感染体外培养的DRG神经元对CXCL13进行过表达,然后收集培养基进行体外脾细胞迁移试验。与对照组相比,高表达CXCL13的培养基显著增加了对CXCR5+B和T细胞的募集。
为了阐明CXCL13的表达是否影响轴突再生,研究者首先通过AAV干预小鼠DRG神经元高表达CXCL13,随后全身给予干扰素γ(IFN-γ)和甘露醇以分别诱导MHC-I提呈和增强血背根神经节屏障通透性;然后立即进行坐骨神经损伤。与对照组相比,在CXCL13过表达的DRG中,CXCR5+B细胞和 CXCR5+CD8+T细胞显著增加(图3A-F),并且,CXCL13过表达后坐骨神经的轴突再生明显减少(图3G-I)。由此可见:DRG神经元内高表达的CXCL13能够招募CXCR5+B和T细胞,并能抑制轴突再生,部分表现出衰老的表型。

图3. 年轻小鼠DRG神经元CXCL13的过表达促进CXCR5+B和T细胞向DRG募集,抑制坐骨神经再生。
下一步,为确定可能参与驱动衰老相关CXCL13表达的转录因子(transcription factor, TF),研究者在其RNA-seq数据中查询了既往文献已报道过的具有促进CXCL13表达的TF是否被衰老诱导产生了变化。在已知的与CXCL13启动子结合的TF(包括Hif1a、 Pou5f1(Oct4)、Rar、Nfkb和Sp1(8,9)中,只有 Nfkb2在老年小鼠DRG中显著上调。因此,选择其进行进一步的研究。
研究者采用经典的NF-κB激活剂(TNF-α或IL-1β)和非经典的NF-κB激活剂(BAFF或 LTα1β2)对体外培养的DRG神经元进行处理,24小时后用RT-PCR检测Cxcl13、 Nfkb1和 Nfkb2的表达。TNF-α和IL-1β能上调Nkb1和/或Nfkb2的表达,但不影响Cxcl13的表达,而BAFF 对Nfkb和Cxcl13的表达均无显著影响。但已知可激活非典型NF-κB2(10)的LTα1β2明显上调了Nfkb2和Cxcl13的表达,该作用可以被IKK抑制剂PS1145选择性抑制NF-κB激酶IKK而减弱。
随着年龄的增长,NF-κB2的表达和磷酸化水平均增加,但PS1145对 NF-κB的磷酸化水平有抑制作用。因此,PS1145可显著降低衰老诱导的 Cxcl13的表达。随后,通过对pNF-κB2进行免疫荧光染色,研究者确定pNF-κB2定位在DRG内;此外,与年轻小鼠相比,老年小鼠DRG内的pNF-κB2水平在坐骨神经损伤前和坐骨神经损伤3天后均显著增加。综上,CXCL13的年龄相关性表达受到NF-κB2的调控;CXCL13在老年小鼠DRG内的表达需要淋巴毒素依赖性的NF-κB磷酸化。
那么,阻碍老年小鼠DRG神经元轴突再生的过程中,是否需要CD8+T细胞、 CD4+T细胞或 B细胞的参与?通过在坐骨神经损伤造模前1周使用CD8α单克隆抗体(moloclonal antibody, mAb)耗竭CD8+T细胞后,研究者观察到老龄小鼠的神经再生得到明显改善(图4A-C),DRG中CD8+T细胞数目明显减少(图4A-C)。相比之下,CD4+T细胞或B细胞的耗竭并不能改善与衰老相关的再生能力下降。这表明,CD8+T细胞参与了老年小鼠坐骨神经损伤后轴突再生障碍的调控。
另外,考虑到RNA-seq发现坐骨神经损伤后MHC-I的表达呈现衰老依赖性富集模式(图1B);以及相对于对照组小鼠,坐骨神经损伤前后MHC-I表达在老年小鼠DRG 神经元内显著上调 (图4D-F)。
研究者探讨了体外培养的表达MHC-I的DRG神经元突起的生长抑制是否需要抗原致敏的CD8+T细胞的参与。IFN-γ可诱导DRG神经元产生MHC-I,但胶质细胞不产生MHC-I。在卵清蛋白多肽OVA257-264存在的情况下,TCR转基因的OT-I CD8+T细胞对表达MHC-I的DRG神经元的突起生长产生了抑制作用,同时增加了caspase3的裂解而未改变细胞凋亡相关特征。研究者采用流式细胞术检测了从OT-I小鼠脾脏分离的CD8+T细胞的纯度。上述结果表明:神经元MHC-I表达和OT-I抗原特异性CD8+T细胞的存在可能是抑制DRG神经元突起生长的必要条件。
那么,老年小鼠的轴突再生能力减退是否需要MHC-I依赖性抗原呈递?研究者利用AAV在老年小鼠DRG中有条件地表达了病毒编码的富含甘氨酸/丙氨酸的GAr肽序列,其能抑制MHC-I抗原呈递,从而逃避CD8+T细胞免疫反应。随后进行坐骨神经损伤造模,3天后处死动物检测MHC-I、caspase3和轴突再生情况。结果表明:与对照组相比,AAV-GAr-rtTA感染后神经元MHC-I和裂解型caspase3的表达明显减少(图4G-H)。感染AAV-GAr-rtTA后,坐骨神经的轴突再生显著增强(图4I-J)。
以上结果共同表明:坐骨神经损伤后衰老依赖性轴突再生能力减退需要CD8+T细胞和神经元 MHC-I。坐骨神经损伤后衰老依赖性再生能力下降需要依赖于CD8+T细胞和神经元 MHC-I的存在。
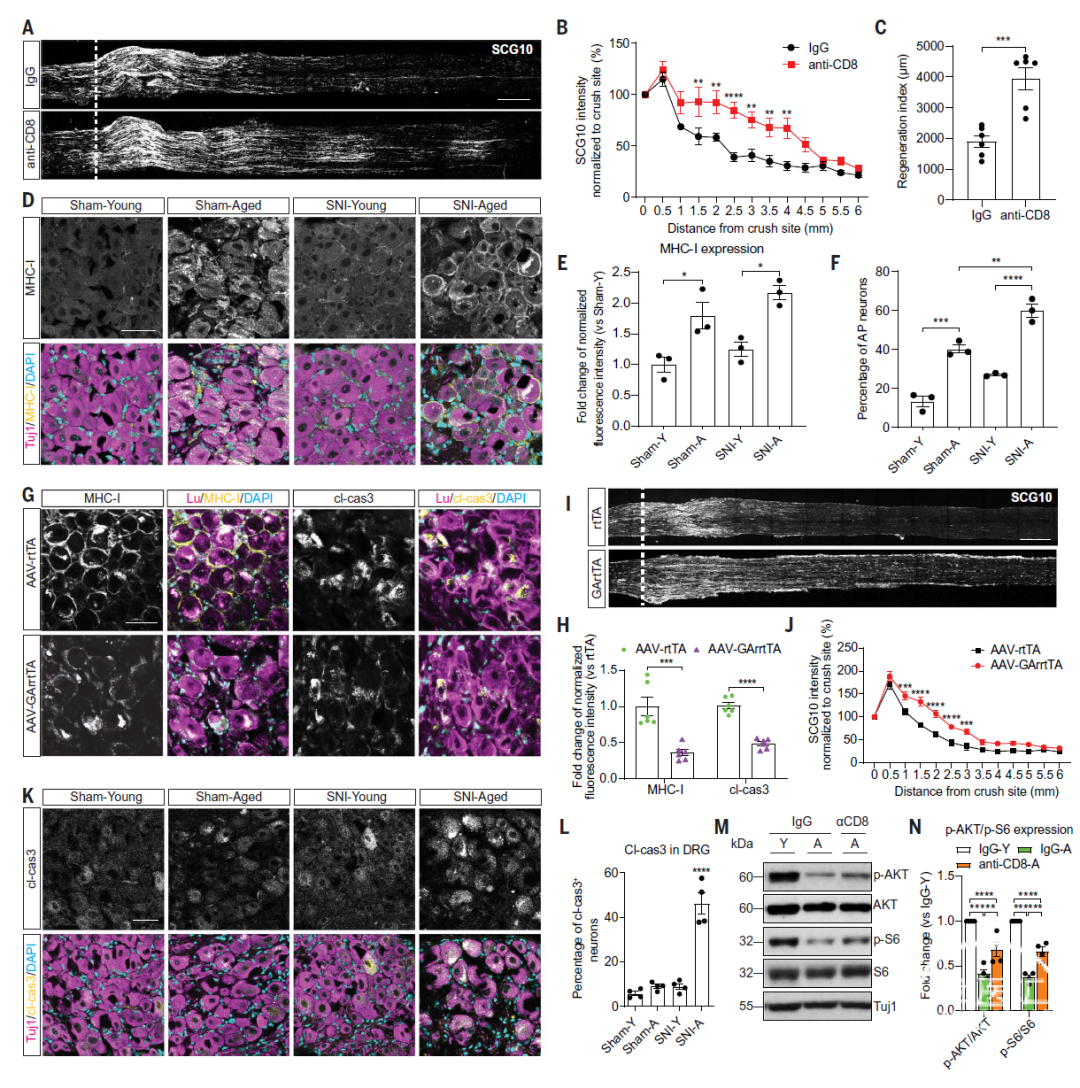
图4. 坐骨神经损伤后年龄依赖性再生能力减退需要CD8+ T细胞和神经元MHC-I的参与,后两者抑制pAKT和pS6
紧随其后,研究者进一步考察了老年动物DRG内CD8+T细胞依赖性神经元再生能力减退的分子信号转导机制。在不存在细胞凋亡相关的DNA片段化的情况下,老年小鼠神经元中裂解的caspase3的表达明显增加(图4K-L)。坐骨神经损伤后,老年小鼠DRG神经元中穿孔素和颗粒酶B的表达显著增加。活化的caspase3可导致AKT截断和AKT磷酸化减少,进而减少S6的磷酸化。pAKT和ps6已被报道与轴突再生相关,并且其表达水平通常随着年龄的增长而减弱。
通过实验研究者发现:坐骨神经损伤3天后,衰老DRG内的AKT和S6的磷酸化水平降低;在耗竭CD8+T细胞后,这种效应被显著逆转(图4M-N)。CD8+T细胞耗竭可显著提升DRG神经元内pAKT和pS6的表达水平,同时降低caspase3、穿孔素和颗粒酶B的表达。最后,通过用Z-DEVD-FMK抑制caspase3可显著提升AKT和S6的磷酸化水平,最终改善坐骨神经的轴突再生。
综上可知:老年小鼠坐骨神经损伤后DRG神经元内AKT和S6的磷酸化水平需要靠CD8+T细胞依赖性的caspase3活化来抑制;并且,抑制caspase3的活化可促进轴突再生。即:CD8+T细胞依赖性的caspase3活化对pAKT和pS6的抑制是衰老相关轴突再生障碍所必需的。
接下来,研究者试图确定CXCR5+CD8+T细胞是否直接导致坐骨神经损伤后轴突再生能力的下降。为达到此目的,研究者使用了构建的缺乏B细胞和T细胞的年轻和老年OT-I Rag2-/-小鼠以及过继性细胞转移等实验方法。
分离CXCR5+CD8+T细胞,过继转移至缺乏B细胞和T细胞的年轻或老年OT-I Rag2-/-小鼠体内。在细胞转移之前,研究者发现:与野生型小鼠相比,存在或不存在CD8+ T细胞缺失的老龄OT-I Rag2-/-小鼠神经再生能力显著增加,而两个OT-I Rag2-/-小鼠组之间没有差别。这说明,内源性 OT-I CD8+T细胞对神经再生没有影响。
将分选的CXCR5+CD8+T细胞注射到年轻或老年OT-I Rag2-/-小鼠体内。过继转染的CXCR5+CD8+T细胞明显浸润老年小鼠的DRG,但对年轻小鼠则无明显影响(图5A-B)。相比之下,在年轻小鼠中,转移的 CXCR5+CD8+T细胞主要在脾脏中积累较多(图5A-B)。CXCR5+CD8+T细胞的这些迁移模式与DRG和脾脏中CXCL13水平的差异相关(图5C)。此外,老年小鼠血液中也发现了较多的转染的CXCR5+CD8+T细胞。最后,CXCR5+CD8+T细胞的过继转移导致老年小鼠坐骨神经损伤后神经再生明显减少(图5D-E)。CXCR5+CD8+T细胞转移导致老年小鼠DRG神经元内穿孔素明显增加,pS6表达下降(图5F-G) ,而年轻小鼠DRG神经元内则无明显变化(图5F-G)。
以上事实说明:CXCR5+CD8+T细胞驱动坐骨神经损伤后老年小鼠DRG内的轴突再生障碍。
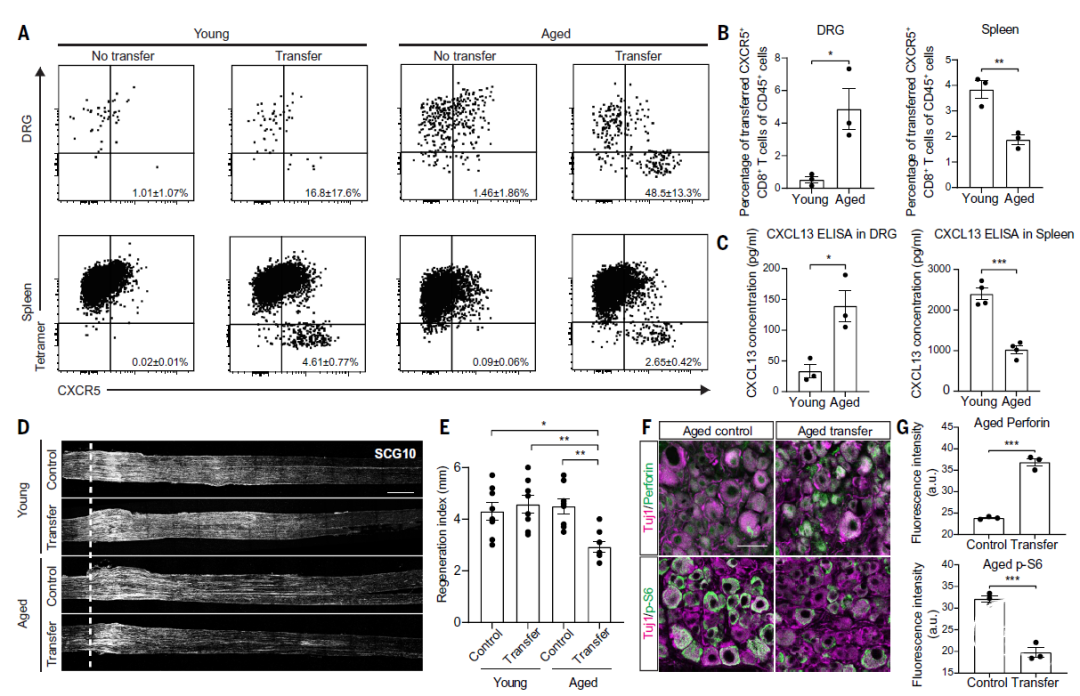
图5. CXCR5+CD8+T细胞引起坐骨神经损伤后衰老依赖性再生能力减退。
以上所有的结果已证明CXCR5+CD8+T细胞的招募引起DRG内神经元轴突再生障碍。那么,CXCR5+CD8+T细胞是如何被招募至DRG内的呢?为解决这一问题,研究者将分选的野生型或Cxcr5-/-CD8+T细胞转移到 OT-I Rag2-/-受体小鼠体内,在坐骨神经损伤前用免疫球蛋白G (IgG) 对照或CXCL13单克隆抗体进行处理。Cxcr5-/-CD8+T细胞向DRG的募集明显低于野生型CD8+T细胞。CXCL13 mAb可以显著降低CXCR5+CD8+T细胞向DRG(图6A-E)和脾脏(图6I-J)的迁移。
过继转移野生型CD8+T细胞后拮抗CXCL13的作用可显著改善坐骨神经再生(图6F-H),而当过继转移Cxcr5-/-CD8+T细胞后拮抗CXCL13的作用后坐骨神经再生未发生明显变化,与野生型CD8+T细胞相比,过继Cxcr5-/-CD8+T细胞组具有更高的再生能力(图6F-H)。
综上可得出结论:作用于受体CXCR5的CXCL13对于CD8 T细胞迁移并限制衰老小鼠DRG神经再生来说是必需的。

图6. CXCR5是老龄小鼠DRG中CD8+ T细胞浸润和衰老后再生能力减退所必需的。
最后,研究者研究了 CXCL13中和是否能促进老年动物轴突再生、表皮神经支配和功能恢复。
通过注射CXCL13单克隆抗体可显著增强体外培养的DRG的神经突生长、减少CXCR5+T和 B细胞的募集、阻断衰老相关的坐骨神经再生障碍以及阻断CD8+T细胞的DRG浸润,但对年轻小鼠则无明显影响(图7A-E)。此外,CXCL13中和并不能改变DRG中CD11b+F4-80+的巨噬细胞的数量。
在另一项单独的实验中,研究者测试了 CXCL13拮抗作用对机体功能恢复情况的影响。老年小鼠的恢复速度明显慢于年轻小鼠,在所研究的所有感觉模式中,CXCL13中和可以显著加快老年小鼠的恢复速度(图7F-I)。CXCL13中和可以促进老年小鼠后爪无毛趾间区域皮肤的神经再支配(图7J-K)。
因此,CXCL13中和可以促进老年动物DRG内神经元轴突再生、皮肤神经再支配和功能恢复。
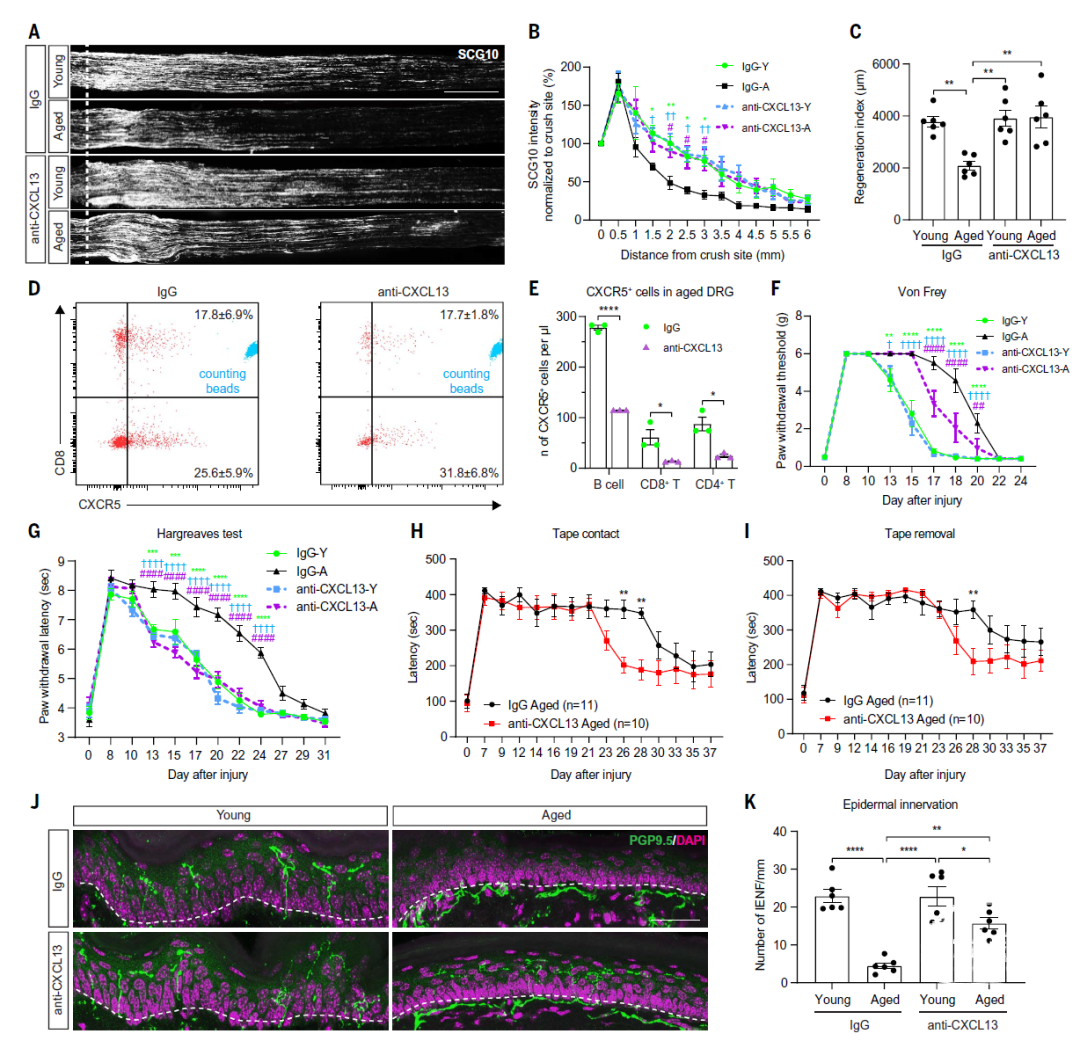
图7. CXCL13中和促进老龄小鼠坐骨神经损伤后的轴突再生、表皮神经再支配和感觉功能恢复。
综合以上所有结果,可知:
衰老主要与小鼠坐骨神经损伤后DRG中T细胞活化和信号传导的显著增加相关;衰老与坐骨神经损伤前后DRG中包括淋巴毒素在内的炎症细胞因子的增加相关。
淋巴毒素β对NF-κB的磷酸化而言是必需的,而NF-κB的磷酸化则可促进DRG感觉神经元中趋化因子CXCL13的表达。
在坐骨神经损伤后,CXCL13在过表达MHC-I的神经元附近招募表达CXCL13受体CXCR5的CD8+T细胞。
CXCR5+CD8+T细胞与表达MHC-I的感觉神经元之间的相互作用激活了caspase3,进一步阻碍pAKT和pS6信号转导,最终导致再生障碍。
通过药理学手段拮抗caspase3的激活可以逆转老年小鼠的再生障碍及恢复AKT和S6的磷酸化水平。
过继性转移实验包括 Cxcl5-/-与野生型细胞之间的比较,直接表明CXCR5+ CD8+T细胞限制老年小鼠坐骨神经损伤后轴突再生。
通过单克隆抗体中和CXCL13阻断CXCR5+CD8+T细胞向DRG的募集可以使老年小鼠坐骨神经感觉神经元轴突的再生能力恢复到与年轻动物相当的水平。拮抗CXCL13能够显著促进皮肤神经再支配和感觉神经功能的恢复。
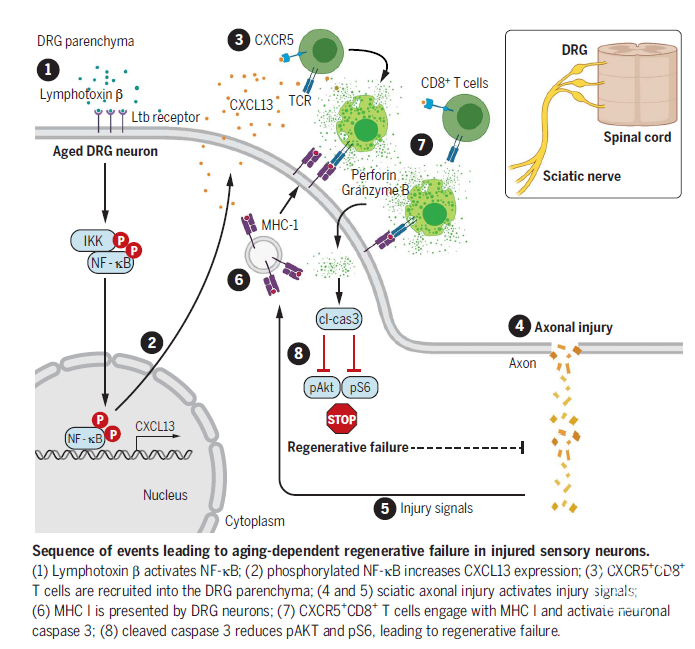
Simone Di Giovanni教授课题组的此项研究的临床意义在于:可以考虑将CXCL13中和用于治疗影响老年人的轴突损伤。更广泛地说,研究者描述了衰老特异性的再生机制,表明在治疗相关疾病时要考虑到受伤或疾病发生时的年龄,需要采取有针对性的干预措施。
Science 同期评述
来自法国图卢兹大学图卢兹传染病和炎症性疾病研究所的Nicolas Gaudenzio教授和Roland S. Liblau对本文进行了评述:


图注:年龄相关的神经损伤反应:在年轻小鼠中,神经损伤通常会触发再生程序,从而产生神经修复。在老年小鼠中,存在密集的CD8+T细胞,损伤引起感觉神经元释放CXCL13,进而招募CXCR5+CD8+T细胞,其与损伤感觉神经元胞体上表达的MHC-1抗原复合物结合,导致轴突再生障碍。
Simone Di Giovanni教授课题组的该项研究揭示了老年小鼠神经系统再生能力下降的一种细胞和分子机制。尽管尚不清楚这种机制是否也发生在人类或是否仅仅局限于脊神经节,但研究者探讨了阻断这一信号通路是否可能为促进坐骨神经损伤后的修复提供治疗机会。结果表明,通过使用单克隆抗体中和CXCL13可阻止 CXCR5+CD8+T细胞在脊神经节内的聚集,进而促进老年小鼠坐骨神经损伤后的轴突再生和功能恢复。在一系列精妙的互补实验中,Simone Di Giovanni教授等人最终证明特异性靶向CXCR5+CD8+T细胞具有与中和CXCL13类似的有益作用。
然而,需要注意的点包括:
(1)CXCR5在许多细胞类型中均有表达,包括B细胞和辅助性CD4+T细胞亚群,作用是引导这些细胞进入淋巴滤泡,在那里它们可以进行富有成效的双向互动。
(2)表达CXCR5的淋巴细胞(包括CD8+T细胞)是对病毒和癌细胞产生适当免疫应答的关键。因此,在未来的临床环境中,全身和/或长期使用CXCL13-CXCR5拮抗剂的患者罹患感染性疾病和(或)肿瘤的风险会增加。因此在未来的实践中需要确定这种治疗的最佳时机和给药途径,这也是未来的研究方向之一。
文献及全文链接:
Gaudenzio, N., & Liblau, R. S. (2022). Immune cells impede repair of old neurons. Science, 376(6594), 694-695
https://www.science.org/doi/10.1126/science.abp9878?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
在招岗位
2022 RECRUIT /
招募编译团队及审稿团队
岗位职责:撰写、审阅神经科学各领域的文献导读、领域速报。
岗位要求:神经科学领域四年级以上的博士生、博士后以及青年科研工作者。
AiBrain作者团队由海内外知名高校博士生、博士后,及已成立实验室的PI们组成;加入AiBrain,可以体验专业的投审稿系统、高效温馨的团队合作、丰富的文章栏目,以及有竞争力的丰厚报酬;能力突出者可以作为领域/栏目负责人,并配有岗位津贴。
欢迎有意者投递简历及个人作品!

微信号:AiBrainzhushou
邮箱:ai_brain@163.com


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享




