作者:蝴蝶 北京大学博士后
神经元可以通过兴奋性和抑制性突触相互影响,产生神经元集群的同步化活动;这种同步化的活动可产生神经振荡,并可以通过局部场电位(local field potential, LFP)进行记录。依据频率大小,神经振荡分为delta振荡(0.5~3 Hz)、theta振荡(4~12 Hz)、beta振荡(12~30 Hz)、gamma振荡(30~100 Hz)和尖波涟漪(sharp-wave ripples)(>100 Hz的纹波叠加在0.01~3 Hz的尖波上)。其中,尖波涟漪是认知活动中重要的生物学标志,大量神经元短时间同步发放,由单个神经元的峰波电位集合成大幅度信号,多出现在动物的清醒静止状态、慢波睡眠和固有的奖赏行为(如进食、交配等)等与环境有较少互动的状态中[1,2]。
海马是参与记忆和认知最重要的脑区之一,海马尖波涟漪节律 (sharp wave-ripples, SPW-Rs)是利用局部场电位(LFP)从哺乳动物脑内记录到同步程度最高的神经振荡形式[3],在记忆巩固方面发挥关键作用,包括在特定的清醒和睡眠状态下,以及记忆引导决策等认知过程中,记忆相关信息的回想[4,5]。尖波表现为由海马CA3区域兴奋性亚群同步活动诱发的树突去极化,而纹波(ripple)振荡是由海马CA1锥体细胞和局部快发放中间神经元之间的微环路相互作用产生的。已有研究表明,SPW-Rs期间的兴奋性活动从海马传导至海马下托(subiculum, SUB)和其他下游脑区。然而,调节海马SPW-Rs和海马外脑区协调SPW-R相关动力学的微环路机制,目前还不清楚。
2022年4月29日,斯坦福大学Gergely G. Szabo课题组在Neuron杂志发表题为“Ripple-selective GABAergic projection cells in the hippocampus”的研究成果,鉴定出了一群具有长程投射和独特的神经活动动力学的海马GABA能神经亚群——TORO cells(theta-OFF/ripple-ON cells)。TORO cells在运动和快速眼动睡眠期间沉默,而在尖波涟漪振荡阶段大量放电。并且TORO cells接收海马CA3谷氨酸能、隔核GABA能和胆碱能输入;投射至海马外多个脑区,协同调节纹波相关神经元动力学。


Gergely G. Szabo
Gergely G. Szabo就职于斯坦福大学神经外科,所在实验室主要研究方向为神经元微环路、神经网络振荡、大麻素信号传导及癫痫的神经环路功能障碍机制。该实验室采用实验与理论技术紧密结合,主要技术包括光遗传学、配对膜片钳记录、在体电生理记录、双光子钙成像、超级计算机大规模计算建模等。
研究人员首先利用细胞旁标记方法(juxtacellular recordings),对头部固定、清醒状态的小鼠,在球形跑步机上运动或休息时,记录其海马CA1非锥体神经元;然后利用监测海马CA1锥体层的LFPs,包括theta振荡和SPW-Rs。先前研究表明,运动状态下,在海马CA1可检测到theta振荡的同时,纹波振荡也被增强的神经元集群(theta-ON/ripple-ON cells),因其为小清蛋白阳性的篮状细胞,又简称PVBC。然而,作者在海马CA1检测到的神经元集群却是theta振荡减弱的同时,纹波振荡细胞放电频率增强(theta-OFF/ripple-ON cells),简称为TORO cells(图1)。PVBC和TORO cells的形态学和神经化学特征差异总结见下表:
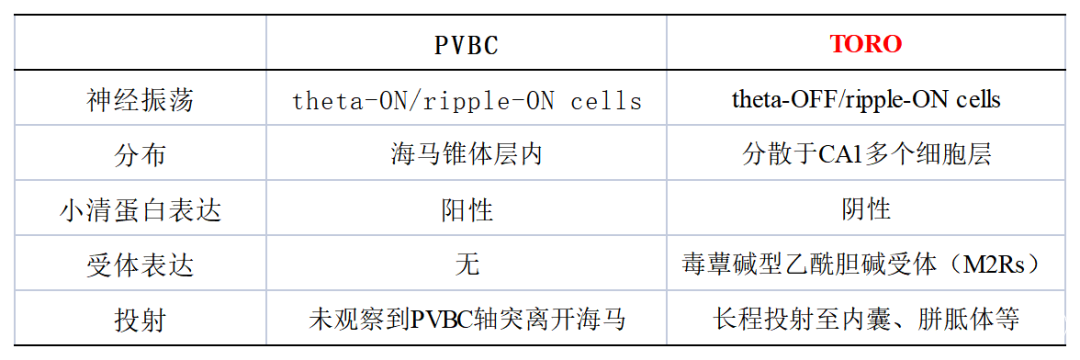
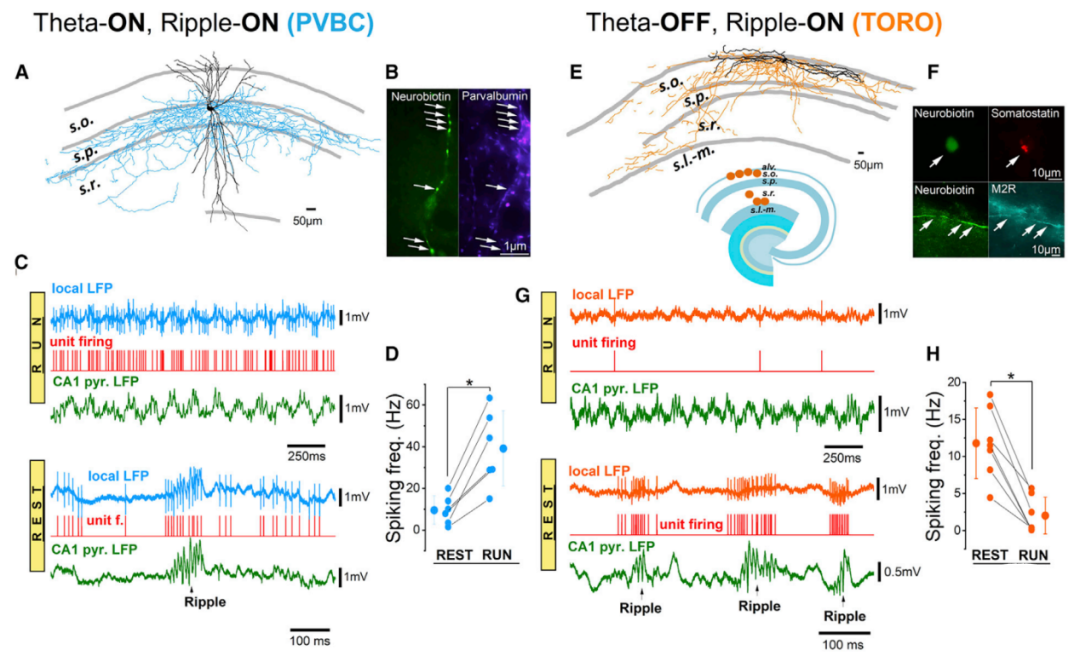
图1 PVBC和TORO cells的分布差异和放电模式图[6]
为了更详细地分析TORO cells的行为依赖活动模式,研究人员利用双光子钙成像技术,发现TORO cells在纹波触发通道中钙信号较强,但在跑步运动触发通道中较弱,并能直观地识别出TORO cells的胞体和树突。并且,作者发现表达M2R的TORO cells是SPW-R期间最活跃的海马CA1神经元之一,TORO cells的钙瞬变信号(calcium transients)大于同一实验中记录的任何其他 GABA 能神经元,表明TORO cells在纹波期间较强的兴奋性。
接下来,作者利用光遗传学进一步研究TORO cells上下游投射,发现TORO cells接收大量海马CA3谷氨酸能的轴突支配,这些兴奋性投射可能有助于其在纹波期间的早期放电。TORO cells还接收内侧隔核(medial septum, MS)的GABA能和胆碱能投射,抑制其在theta振荡期间放电,进而形成TORO cells独特稳定的放电方式。此外,TORO cells可能提供海马GABA能输入至多个脑区,包括海马下托(SUB)、背外侧隔核(dorsal lateral septal nucleus, LSD)、内侧隔核(MS)、外侧和内侧内嗅皮层(entorhinal cortices, ECs)、压后皮层(retrosplenial cortex, RSC)和前扣带回(anterior cingulate cortex, ACC),表明TORO cells在海马至多个脑区的信息传递中发挥关键作用。总之,该研究揭示了TORO cells独特的形态和生理学特征,以指导未来电生理和细胞分辨率功能成像在GABA能投射在在脑内的纹波相关计算。
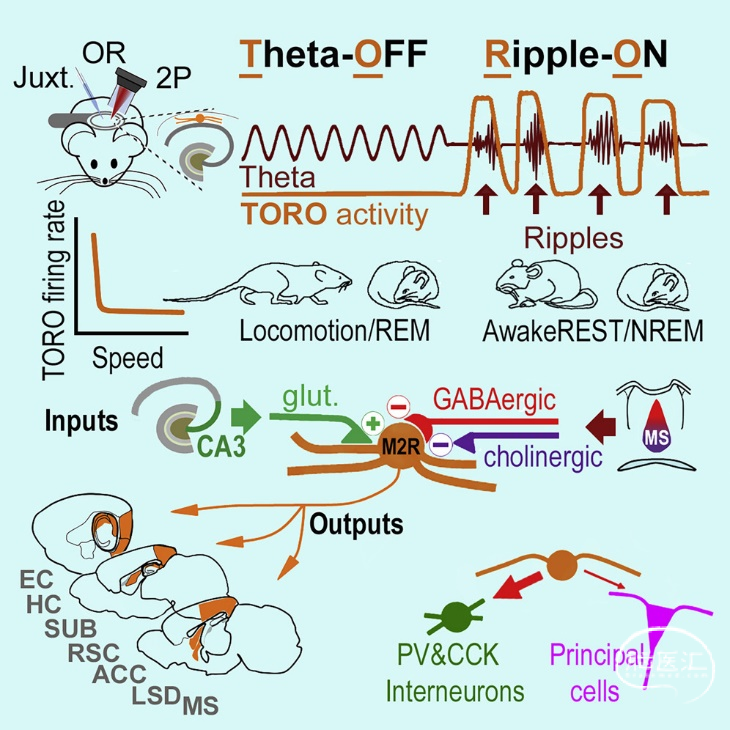
图2 图文摘要示意图[6]
Video1 TORO cells在脑内的三维定位
文章链接:
https://www.sciencedirect.com/science/article/pii/S0896627322003105
参考文献:
1.Colgin, L. L. Rhythms of the hippocampal network. Nat Rev Neurosci 17, 239-249, doi:10.1038/nrn.2016.21 (2016).
2.Buzsaki, G., Horvath, Z., Urioste, R., Hetke, J. & Wise, K. High-frequency network oscillation in the hippocampus. Science (New York, N.Y.) 256, 1025-1027, doi:10.1126/science.1589772 (1992).
3.Csicsvari, J., Hirase, H., Czurkó, A., Mamiya, A. & Buzsáki, G. Oscillatory coupling of hippocampal pyramidal cells and interneurons in the behaving Rat. J Neurosci 19, 274-287, doi:10.1523/jneurosci.19-01-00274.1999 (1999).
4.Diba, K. & Buzsáki, G. Forward and reverse hippocampal place-cell sequences during ripples. Nature neuroscience 10, 1241-1242, doi:10.1038/nn1961 (2007).
5.Ego-Stengel, V. & Wilson, M. A. Disruption of ripple-associated hippocampal activity during rest impairs spatial learning in the rat. Hippocampus 20, 1-10, doi:10.1002/hipo.20707 (2010).
6.Szabo, G. G. et al. Ripple-selective GABAergic projection cells in the hippocampus. Neuron, doi:10.1016/j.neuron.2022.04.002 (2022).


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享




