重组型腺相关病毒(AAVs)是如今神经科学研究中广泛使用的重要工具。4月8日,加州理工学院神经科学和生物工程教授、遗产医学研究所研究员、加州理工学院天桥和 Chrissy Chen神经科学研究所的分子和细胞神经科学中心主任Viviana Gradinaru在Annual Review of Neuroscience上发表了其最新的综述:Adeno-Associated Virus Toolkit to Target Diverse Brain Cells,详尽介绍了AAV的原理及其在大脑研究中的最新进展。

“
重组型腺相关病毒(AAVs)在神经科学研究中作为基因传递载体被广泛的运用。AAV病毒有两种可被设计的特征: 衣壳(蛋白质壳)和载物(封装的基因组)。这两种特征分别可以增强细胞类型或组织的嗜性并控制转基因表达。在现阶段已经发现了一些具有独特嗜性的AAV衣壳,比如可以增强中枢神经系统转导,细胞特异性,以及神经元逆行转运。将这些AAV与基因调控元件,报告因子,传感因子,效应因子相匹配,可以实现高特异性的转基因表达,从而用于大脑细胞和环路的分析研究。在这篇文章中,我们将详细介绍一个AAV工具包,以及其用于在分子层面上对大脑细胞分类进行定义的最新进展。
01
介绍
AAV在神经科学研究和神经系统疾病基因疗法中是首选的基因传递载体。AAV如此适用于转基因传递是因为它们能在人类和动物模型中(小鼠,大鼠已经非人类灵长类动物(NHP))中转导分裂和非分裂型细胞,从而实现长期的基因表达。天然的血清型已被广泛运用于传递报告因子、传感因子和效应因子来分析大脑结构和功能,但是它们的低效率和低精度通常使得给药时产生创伤, 或基因组载物设计需要很复杂。将基因传递到中枢神经系统(CNS)的主要的困难之一在于如何制造靶向精准,创伤微小的载体,同时又可以使转基因载体容量最大化。AAV作为细胞和组织特异性载体,它的成熟化体现在通过运用更具特异性和更有效进入大脑的变体对病毒衣壳的改造;以及通过识别短且特定的基因调控元件来控制转基因表达。这些技术上的进步互利互惠,且非常好的结合起来并建立起AAV工具包,用于将基因有靶向的传递到大脑中。
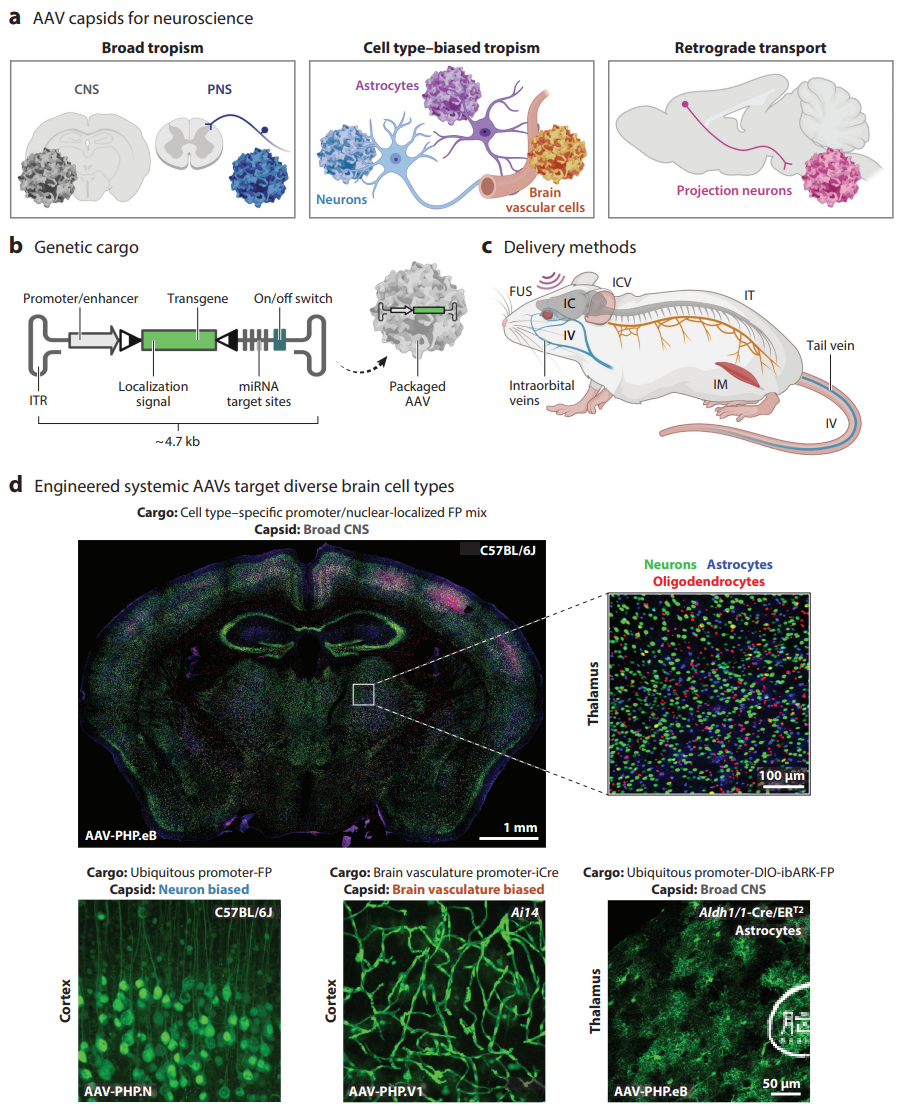
Fig.1 用于将基因靶向递送至大脑的AAV工具包。AAV (a) 衣壳,(b) 载物和 (c) 递送方法确定细胞类型或区域特异性转基因表达。
(a)现在可以使用几种具有独特嗜性的工程衣壳。这些独特性包括可以再中枢和周围神经系统广泛转导,细胞类型特异性或神经元逆行转运的变体。
(b) 遗传载物可以定制从以控制转基因表达。基因调控元件 (启动子和增强子,miRNA 靶位点和重组靶序列,图中用三角形表示)可以促进组织或细胞类型的特异性。基因开关可用于控制表达。AAV的封装容量约为4.7kb。
(c) 病毒递送方法包括聚焦超声(FUS),颅内(IC),脑室内(ICV),肌肉内(IM),鞘内(IT) 和静脉内(IV) 递送。在小鼠中,IV注射通常在侧尾静脉或眶后窦进行。IT 注射在大池或腰椎中进行。
(d) 工程系统性AAV针对不同的脑细胞类型。(上图)单次静脉注射 AAV-PHP.eB 后,向大脑广泛和有针对性的基因递送。核定位荧光报告基因分别使用hSyn1、GFAP或MBP 启动子靶向神经元(绿色),星形胶质细胞(蓝色)或少突胶质细胞(红色)。(左下, 左中图) 有细胞类型偏好的 AAV 衣壳通过普遍存在或细胞类型特异性启动子强制执行独特的嗜性。图中显示了AAV-PHP.N(神经元偏好)和AAV-PHP.V1(脑血管系统偏好)。(右下图) AAV-PHP.eB 将转基因表达限制在星形胶质细胞特异性 Aldh1/1-Cre/ERT2 小鼠中的星形胶质细胞。图d中(底部三图) 使用的启动子包括了普遍存在的 CAG 启动子和脑血管系统特异性 Ple261 启动子。
02
为研究大脑改造AAV
虽然有很多天然存在的AAV血清型, 但它们的嗜性很广泛且常有重叠。许多血清型在脑内注射后可广泛转导神经元和胶质细胞。AAV中被研究最多的AAV9可以穿过血脑屏障(BBB),在静脉注射后转导脑细胞。但这两种方法都有各自的缺点。脑内注射会造成创伤,且药物容易大面积的在脑内扩散,影响到多个细胞和环路。在注射位点向外逐渐扩散还会造成病毒表达浓度在空间上梯度降低。此外,脑内注射还需要高浓度的病毒,且会向外围器官扩散,例如向肝扩散,在浓度高时会导致中毒。脑脊液注射(通过鞘内注射)可以绕过BBB,但是同样会造成创伤且缺乏特异性。人们需要强效的,有针对性的,以及无创伤的载体来实现使用AAV作为研究工具和用于基因疗法。
为了提高和精细化AAV的嗜性,AAV衣壳的突变耐受性已经得到了广泛的研究。人们已发现了一些合理或随机氨基酸(AA)能替换或插入的位点,并开发了血清型改组的嵌合衣壳的构建方法。经过各种方法进行在细胞内和体外的培养和筛选,已经产生了许多可供科学家们研究大脑的AAV衣壳,且这个AAV的行列还在不断扩大中。这些策略目前有4个前景: 1.可以靶向以前无法针对的细胞群;2.可最大化转基因能力(通过缩短基因调控元件);3.可最小化免疫反应(比如通过减少抗原呈递细胞的摄取量);4.可减少病毒注射剂量(通过将非靶向细胞的摄取转入靶向细胞中) 。
2.1
怎么制造可把基因高效, 无创, 且有针对性的传送至小鼠大脑中的AAV
基于Cre重组的靶向进化(CREATE)可以用来筛选AAV衣壳变体,使人们能找到在表达Cre的动物上能够转导特定细胞的AAV衣壳。通过含Lox位点基因组的Cre依赖性聚合酶链式反应扩增可以确定成功的变体。利用CREATE鉴定出了具有增强中枢神经系统(AAV-PHP.B)或周围神经系统(AAV-PHP.S)转导能力的AAV9变体(包含在AA588–589之间随机插入肽7-mer)。AAV-PHP.B 以及其成熟的变体 AAV-PHP.eB,通过改变相邻残基插入增强了中枢神经系统的转导,从而被广泛在中枢神经系统中被运用。这些载体首次实现了对小鼠神经系统进行无创且广泛的基因探索。
然而,CREATE却并没有优化两个重要的AAV的工程目标: 选择细胞类型特异性和机制多样性。一种在CREATE的基础上改进了的方法 - 多路CREATE(M-CREATE),可以在多重组织和细胞中使用下一代测序来记录每一个AAV衣壳变体的生产与性能,同时还考虑到由于实验偏差而导致在选择过程中积累错误的情况。M-CREATE可以囊括最复杂的个体变体,从以找到细胞型特异的AAV,例如用于神经元的AAV-PHP.N和用于血管细胞的AAV-PHP.V1。科学家们还发现了在全身注射后具有增强中枢神经系统的嗜性的不同序列AAV,包括几个AAV-PHP.C 的序列,它们在遗传性多样的小鼠中都保留了增强的中枢神经系统转导。
AAV-PHP.B的不断成熟与进化到更有效的版本AAV-PHP.eB和更具有细胞选择性的版本AAV-PHP.N证实了迭代的AAV衣壳改造的力量。通过重新设计AA588的插入位置或加入新的位点可以进行嗜性的细化。M-CREATE在AAV-PHP.eB中的AA452-458环中的随机替换发现了AAV.CAP-B10,AAV.CAP-B10可在中枢神经系统中转导神经元,大大降低了在小鼠和狨猴中对星形胶质细胞,少突胶质细胞和外周器官的靶向作用。该策略也与血清型改组衣壳兼容,因为AAV-ie是通过将AAV-PHP.eB 9聚体肽环插入AAV-DJ来改造的。但是PHP.B插入环无法改变AAV1和AAV5穿越BBB的能力。
2.2
现代AAV衣壳工程方法
一些其他科学家团队同样也为研究大脑制造了新的AAV衣壳。2016年, Schaffer 和 Karpova科研小组通过在AAV2衣壳基因的AA587-588之间插入一个 10 聚体肽,发现了rAAV2-retro可以增强神经元的逆行转运。2018年,Schaffer小组发表了一个类似于CREATE的技术,通过使用乱序血清型改组库来识别SCH9,从以增强脑室下区的神经干细胞靶向。2019年,Maguire小组发表了iTransduce方法来识别可以通过BBB的AAV,其中突变的AAV在细胞类型特异的启动子的控制下传递 Cre,从而在转基因小鼠中诱导荧光蛋白表达。这个方法使得可以通过细胞分选来恢复功能性衣壳, 并找到AAV-F,其增强中枢神经系统转导的能力保留在了C57BL/6J和BALB/cJ小鼠中。2019年,Bjorklund实验室开发了BRAVE方法,通过对突触具有亲和力的蛋白质合理设计的肽组成了一个DNA条形码衣壳插入库。运用BRAVE,他们发现了在多巴胺神经元中逆行转运增强了的AAV2变体MNM004。2021年, Nonnenmacher开发了TRACER方法来系统性的识别野生型小鼠中可用的AAV。这个方法采用细胞特异性启动子的RNA选择, 控制衣壳变体在野生型小鼠体内的表达,并使用RNAseq来测序回收功能性衣壳。TRACER使用AAV9 AA588-589插入库通过验证,同时证实了M-CREATE的发现,在小鼠中不同衣壳家族都显示了增强的中枢神经系统嗜性。
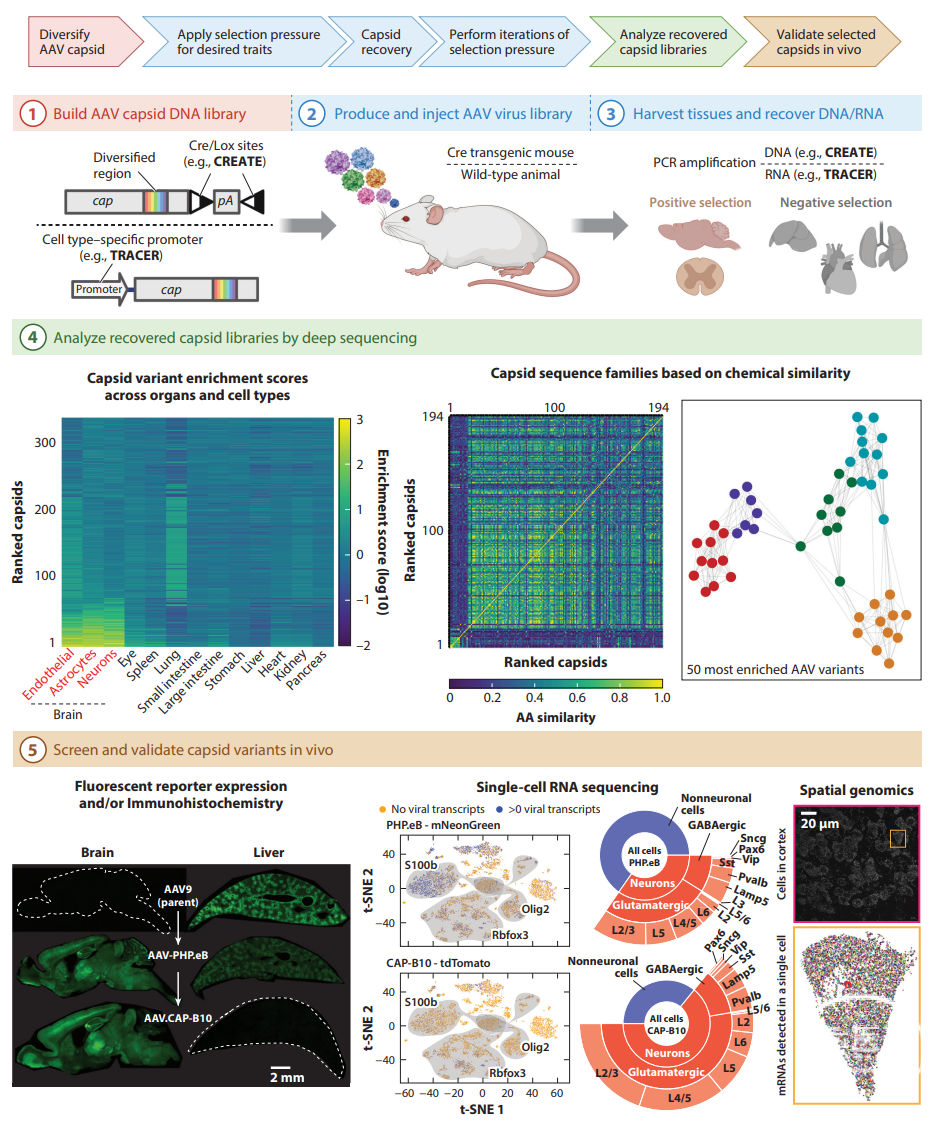
Fig.2 为大脑设计系统性AAV。以下步骤描述了用于发现具有独特嗜性的AAV衣壳的简化流程。
①通过使用PCR使衣壳序列(彩虹)多样化来建立AAV衣壳DNA库。CREATE方法在步骤3中使用Cre/Lox位点进行衣壳回收。
②在HEK293T细胞中产生多样化的 AAV 病毒库。根据衣壳选择方法,在转基因或野生型动物中静脉注射AAV病毒库。CREATE中使用了细胞类型特异性表达Cre的转基因小鼠,TRACER中使用了野生型小鼠。
③2-3周后, 分离取走需要的组织并使用PCR扩增回收DNA(例如CREATE)或 RNA(例如TRACER)。
④通过深度测序分析回收的衣壳文库。(左图) 在大脑中高度富集的库的变体子集显示多种器官和细胞类型的衣壳变体富集的热图。(右图) 衣壳变体插入序列化学相似性热图和簇状图(每个变体是图中的一个点) 显示基于AA属性的多个不同的衣壳序列家族(彩色簇状图)。
⑤在体筛选和验证衣壳变体。(左图) 传统方法使用荧光报告基因表达。(中, 右图) 病毒载体的高通量分析。(中图) 注射AAV-PHP.eB和AAV.CAP-B10的小鼠的scRNA-seq揭示了皮质细胞类型和亚型之间的偏差。t-SNE 图中的阴影区域显示具有高表达Rbfox3(神经元),S100b(星形胶质细胞)或Olig2(少突胶质细胞)的细胞簇(黄色和蓝色圆点)。星爆图显示了AAV-PHP.eB和AAV.CAP-B10的细胞类型分布。(右图) 空间基因组学方法可以检测完整脑组织中的数千个 RNA 转录本。图中显示了在单个脑细胞中检测到的RNA的重建。
2.3
怎么制造可把基因高效, 无创, 且有针对性的传送至小鼠大脑中的AAV
虽然现在有几种具有中枢神经系统特异嗜性的AAV, 但还需要很多工作以实现拥有神经科学研究的完整AAV工具库。现代病毒衣壳选择实验制造了成百上千的AAV变体, 但是其中一大部分没有得到表征, 其原因在于通过免疫组织化学确定AAV嗜性只能低通量的进行,且在不同细胞类型中分辨率低。为了加速对已有的AAV的快速识别和详细表征, 并为在分子层面上定义的细胞类型设计新的AAV衣壳, 需要高通量的分析方法。而条形码载体基因组的测序方法提供了一种潜在的解决方案。2020年, Grimm 实验室将DNA和RNA条形码与下一代测序相结合, 在体监测分析了一些先前发现的AAV变体的性能。这个方法可与任意衣壳和目标细胞兼容,并可以加速发现中枢神经系统转导嗜性的AAV变体。为了从M-CREATE选择中得到丰富的数据集, 可以使用基于单细胞RNA测序的方法来检查用条形码AAV载体转导的脑细胞转录组。该方法揭示了在小鼠中AAV-PHP.eB和AAV.CAP-B10之间的用分子定义的神经元细胞类型的偏差。这些转导特异性的差异突出了仔细分析过去, 现在和未来在选择具有新的分子定义的细胞类型嗜性的工程AAV的重要性。空间基因组学方法为快速和精确的AAV变异表征提供了另一种可能的解决方案。交换反应荧光原位杂交(SABER-FISH)的杂交方法信号的放大可以原位检测AAV基因组,顺序荧光原位杂交(seqFISH+)可以实现在脑组织中多路转录本检测和分子细胞分型。原位变异筛选可以揭示更加精细的区域和细胞型特异性嗜性, 包括神经元亚型和小胶质细胞的特异性, 以及大脑中可能对AAV转导有抵抗力的免疫细胞。
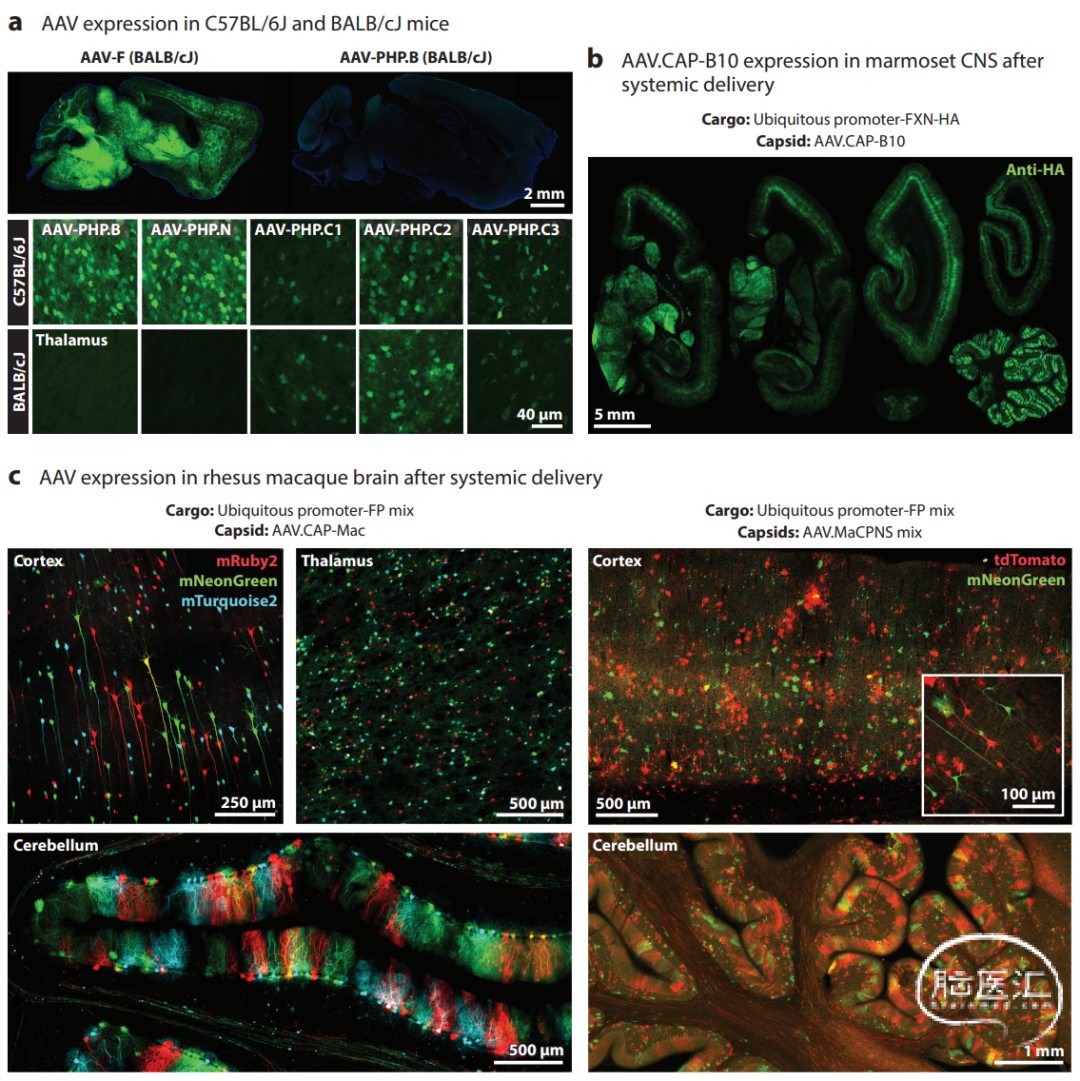
Fig.3 系统工程AAV在不同品系小鼠和非人灵长类动物中的效用。
(a) 自不同序列家族的AAV变体在C57BL/6J和BALB/cJ小鼠中显示出独特的转导特性。
(b) 如这些荧光图像所示,AAV.CAP-B10(在小鼠中鉴定)的增强的中枢神经系统转导在成年狨猴中仍然存在。
(c) 全身给药后普通猕猴大脑中的AAV表达。(左图) 在静脉内给AAV.CAP-Mac后, 优先转导婴儿猕猴大脑中的神经元。(右图) AAV.MaCPNS 衣壳转导婴儿猕猴大脑中的神经元和星形胶质细胞。图b和c中使用的启动子是普遍存在的CAG启动子。
03
适用于多种动物模型的AAV
为了能够更广泛地采用基因传递工具进行研究和投入到治疗,AAV的衣壳和载物必须能够适用于模型生物内部和跨模型生物的遗传多样性背景。包括年龄、性别、品系和物种在内的几个变量都会会影响AAV脑转导。这个部分中我们将会讨论和解决对有关在不同动物模型中使用AAV血清型的问题。
3.1
遗传因素会影响小鼠脑内AAV转导吗
实验室小鼠的遗传背景可以影响大脑中的AAV转导特性。例如,AAV-PHP.B和AAV-PHP.eB增强的CNS转导在一些的小鼠品系中并不存在,包括BALB/cJ小鼠。几个研究小组将这种表型的分子起源确定为鼠限制性蛋白Ly6a中的与品系相关的多态性,AAV-PHP.B和AAV-PHP.eB使用这种蛋白Ly6a作为受体穿过BBB。在低剂量下,这种品系特异性的趋势适用于AAV-PHP.V1和AAV-PHP.N,这两种AAV是新发现的AAV-PHP.B序列家族成员。然而,来自不同家族的AAV血清型在脑转导中没有表现出品系特异性差异。2019年Hanlon等与2020年Ravindra Kumar等分别发现了和AAV-F和AAV-PHP.Cs在BALB/cJ 小鼠中保留增强的脑转导。这些研究表明,来自不同序列家族的衣壳变体具有不同的BBB进入机制。在来自不同遗传背景的小鼠品系中测试AAV血清型(例如,使用免疫组织化学或高通量衣壳分析方法)可能会揭示能否跨越BBB差异的分子机制。
年龄和性别等生物因素也会影响小鼠的AAA转导特性。在全身注射AAV9时, 雌性小鼠的大脑的转导会更高相比于雄性小鼠,而雄性小鼠的肝脏转导率则会低于雌性小鼠。注射病毒时小鼠的年龄也会影响目标脑细胞类型以及是否能进入BBB。关于年龄、性别和其他因素(例如载体的生产方式和疾病状态)AAV血清型转导特性的影响,以及观察到的差异是否在其他动物中也适用(例如非人灵长类)还需要做更多的研究。
3.2
在小鼠身上设计的AAV是否用到灵长类物种中
这个问题的答案取决于病毒载体与递送路线。AAV-PHP.B载体在许多小鼠和大鼠中有很好的作用,但在非人灵长类静脉给药的表现并不优于AAV9。这个结果与灵长类中缺少了Ly6a保持了一致。在猕猴中,与静脉给药相比,鞘内给药(可绕过BBB) 可以使AAV-PHP.B在中枢神经系统的转导更强(且AAV-PHP.eB 在鞘内给药后优于AAV-PHP.B), 但这些载体是否比AAV9更好还需要进行更多的研究。尽管不是所有的AAV-PHP.B载体都能适用于非人灵长类动物, 但其他衣壳变体在灵长类物种中显示出增强的嗜性。例如AAV2-HBKO是一种改良的AAV2载体,具有增强的皮质和纹状体表达,在小鼠和猕猴的颅内注射后显示出神经元偏向转导。从AAV-PHP.eB进化而来的两个系统性变体(AAV.CAP-B10和AAV.CAP-B22, 均在小鼠中发现) 在狨猴中保留了增强的CNS转导和细胞类型偏向,相比于由AAV9转导的神经元分别在数量上增加了四倍和两倍。载体AAV.CAP-B10在狨猴中表现出高度的神经元嗜性和对肝脏的靶向性降低。全身递送的AAV9主要转导猕猴中枢神经的星形胶质细胞, 而AAV9样载体的AAVhu68可在对 非人灵长类动物进行高剂量全身给药后引起肝损伤。AAV.MaCPNS衣壳也同样是在小鼠中发现, 而后应用于非人灵长类中。另一种AAV变体rAAV2-retro(也在小鼠中发现)在猕猴大脑中颅内注射后显示出强大的逆行运输。这些研究表明在啮齿类动物中选择衣壳可在非人灵长类中筛选或验证新型AAV之前先使用。一些基于RNA的选择方式, 比如TRACER(细胞类型特异性启动子驱动野生型小鼠衣壳变体的表达)不需要转基因动物,可用于直接在非人灵长类动物中鉴定AAV衣壳。最近, 运用非人灵长类中多物种的选择方法, 发现了AAV.CAP-Mac, 一种系统AAV变体,用于猴科动物的全脑递送。人类神经外科脑组织或特定区域的脑类器官也是非常值得研究的, 可以在其中识别区域和细胞特定的嗜性以进行临床应用。
04
控制用于大脑的AAV载体
细胞类型特异性也可以通过发现和工程化基因调控元件来实现, 这些元件通过启动子、增强子和microRNA (miRNA) 靶位点来实现转基因特异性。
4.1
启动子和增强子
有几种用于驱动转基因表达的脑细胞类型特异性启动子和增强子已被证明可用于AAV。这些元件大多数都小于3kb(与AAV的有限遗传载荷兼容), 并且可以与很多嗜性衣壳搭配在一起, 以将转录限制在特定的脑细胞和区域。启动子可以驱动AAV在多种脑细胞类型中的表达, 包括神经元, 神经胶质和血管细胞。
神经元细胞类型特异性表达可以通过儿茶酚胺能细胞(catecholaminergic cells), 5-羟色胺能细胞(serotonergic cells), 小脑浦肯野细胞(Purkinje cells) 和整个大脑中表达小清蛋白的GABA能中间神经元(parvalbumin-expressing GABAergic interneurons)的启动子实现。在野生型小鼠中全身注射 AAV 载体后,已经验证了几种启动子的细胞特异性。
增强子(调节转录的短基因组区域)也可以驱动AAV载体的转基因表达。当与最小启动子结合时,增强子能够跨脊椎动物物种进行大脑区域和细胞类型特异性标记。例如,mDlx增强子在斑胸草雀, 啮齿动物, 非人类灵长类和人类细胞中仅限于前脑GABA能中间神经元中表达, 并在使用AAV-PHP.eB对小鼠静脉注射时保持区域和细胞特异性。现代基因组方法(例如开放染色质分析)已被用于寻找新的增强子制造新的病毒。现在已有许多可以使用的亚型和区域特异性增强子, 包括了在小鼠全身或局部注射AAV-PHP.eB载体后以高特异性标记兴奋性和抑制性亚群的调节元件。一些增强子元件同样在灵长类动物中有效。科学家们仍在继续努力识别和验证增强子(尤其是在小鼠眼眶后注射后效率提高的元件), 从而大大扩展AAV工具包。
启动子和增强子的强度和特异性取决于许多因素,包括载体剂量、动物模型、递送方法和衣壳。衣壳-启动子相互作用(其中AAV衣壳影响启动子驱动转基因表达的能力)已在大鼠和非人灵长类的中枢神经系统中被证实, 在在体测试病毒时应予以考虑。一些普遍存在的启动子可以驱动比细胞类型或组织特异性启动子更强的AAV表达。为了在大脑中实现强选择性表达, 可以将一个普遍存在的启动子克隆到floxed转基因的上游,并将其传递给细胞类型特异性的Cre或Flp重组酶表达小鼠。最近新发现的一些针对不同皮质和皮质下细胞群的新驱动谱系就可以使用于此。或者, 可以将表达外源重组酶或转录因子的增强病毒通过静脉内传递给报告因子转基因小鼠进行强标记。更强的最小启动子或多个增强子的复制也可能增加来自增强子AAV的转基因表达。最后, 可以对转基因本身进行工程改造以抵消低表达(例如,由于全身递送后每细胞基因组拷贝数低)。报告因子, 传感因子,和效应因子还可以继续被改进, 以提高表达性, 灵敏度和靶向性。

Fig.4 用于空间,细胞类型和时间特异性的AAV载物。(a, b)具有广泛嗜性的衣壳可以通过将基因调控元件整合到AAV基因组中来提供靶向转基因表达。
(a) 几种细胞亚型和大脑区域特异性增强子已经被发现。这些因子可以通过AAV-PHP.eB 静脉内递送, 以实现区域和细胞类型特异性。
(b)miRNA靶位点可以分别在静脉内或颅内注射后限制表达在不同的细胞类型中(例如, 神经元或星形胶质细胞) 或亚型中(例如, 皮质中间神经元) 。右侧皮质中间神经元图像的比例尺 = 35 μm。
(c) 转基因表达的时间控制可以通过药物诱导剪接开关 (Xon) 来实现。
(d) 转基因表达的空间控制可以通过聚焦超声血脑屏障开放(FUS-BBBO)实现。
4.2
提高特异性和安全性的 miRNA 靶位点
细胞类型特异性也可以间接通过利用内源性表达的miRNA抑制非目标组织和细胞类型中的转基因表达来实现。miRNA很小(约22nt), 非编码RNA分子通过结合3'非翻译区 (UTR) 中的互补的靶序列来抑制 mRNA 表达。将miRNA 靶位点克隆到AAV基因组的3'-UTR中可以减少表达互补miRNA的脱靶细胞中的转基因表达。当与强启动子(与较大且通常较弱的细胞类型特异性启动子相反)配对时,这种方法可以在靶细胞中驱动高水平的转基因表达。比如, 例如,AAV-PHP.eB (一种有广泛嗜性的衣壳) 可以通过将miRNA靶位点整合到其基因组中,将靶向转基因表达传递给神经元或星形胶质细胞。一种类似的方法被用于通过注射AAV9抑制皮质兴奋性细胞的表达,从而限制在皮质中间神经元内特异表达。组织特异性miRNA位点可以包含在转基因盒中, 以降低全身递送到中枢神经系统后在外周器官的表达, 包括的肝脏和心脏miRNA的去靶向策略还可以减少与转基因相关的毒性和免疫反应。例如,在非人灵长类动物中脑脊液内注射后, 背根神经节神经元中特异性表达的miRNA可消除这些细胞中的转基因表达和毒性。在免疫细胞群中表达的miRNA在肌肉内递送后可抑制转基因特异性免疫反应, 并允许对具有不同AAV血清型的相同小鼠进行重新给药。如今已经发现了数百种miRNA, 但是它们在单独或相互组合时对组织和细胞类型特异性的影响还尚未明确。miRNA靶位点还需要更多的验证(例如可以使用高通量AAV表征方法), 来注释目标位点特异性并建立一个能够将转基因表达限制在特定的脑细胞类型和区域的目标位点组合库。
4.3
对转基因表达或功能进行时空控制
AAV基因组中可以使用遗传开关来调节在体的表达水平。小RNA的开关(核糖开关)可以放置在转基因盒的3'-UTR中,以在递送反义寡核苷酸(antisense oligonucleotide)后开启表达。光或化学物质也可以用来改变表达。Xon是一个可调节的药物诱导剪接开关,最近被开发用于控制基因治疗的表达水平。当Xon被打包到AAV-PHP.eB 中时, 它可以实现大脑靶向递送和基因编辑。如果注射AAV后出现并发症, 或者治疗时需要瞬时基因表达, 则关闭开关是一个非常有用的功能。时空控制可以通过光诱导重组酶或化学遗传学来实现。声学靶向化学遗传学将把BBB打开和病毒载体递送的聚焦超声与用于区域, 细胞类型和时间特异性的化学遗传学相结合。对AAV表达控制上更进一步的发展可以达到对转基因(包括治疗基因)进行精确和在特定条件下的调节, 从而提高AAV提供的在基础和转化研究中的治疗安全性和有效性。
05
展望: 基于AAV的治疗和基因组编辑
5.1
基因疗法
AAV作为遗传疾病的治疗传递载体的开发已经进行了几十年。近年来, 这项研究在治疗代谢, 血液和神经肌肉疾病方面取得了明显的成功。美国食品和药物管理局(FDA)批准了Luxturna治疗RPE65相关的视网膜营养不良和Zolgensma治疗脊髓性肌萎缩症, 此举证明了基于AAV的疗法可以在中枢神经系统中有效。从研究新药到新药申请的转化的临床项目的初始成功率要高于其他模式。值得注意的是,神经和眼科适应症的试验结果也同样有效。例如, 基于AAV的光遗传学疗法最近在一位盲人患者中实现了部分视力恢复, 这为采用其他改进的视蛋白进行神经回路疾病治疗的方法铺平道路。
随着临床工具包的进一步开发, 与AAV及其基因载物相关的毒性也值得关注。在大剂量AAV基因治疗临床的试验中出现了严重的并发症和死亡事件。然而, 临床前的工作可以得知该领域相关的安全问题。在非人灵长类动物中, 临床相关的AAV滴度(静脉内或鞘内递送至中枢神经系统)可导致背根神经节产生毒性,而在仔猪中,产生严重的运动失调。在小鼠中, 颅内注射AAV可以消融海马中的神经祖细胞, 并破坏皮质中的树突复杂性和突触传递。了解毒性的潜在机制(例如转基因过表达或AAV基因组的免疫检测), 以及它们在临床上的表现, 将为未来的治疗提供有效的信息。AAV诱导的毒性可在病毒给药后数天至数周发生, 并在啮齿和非人灵长类动物中持续数月。因此, 临床前实验需要更长的时间来预测和减轻患者的可能出现的并发症。在解决与毒性相关的问题的同时, 还需要改进注射靶向性以及载体传播和特异性, 从以推进脑部疾病的临床工具包。
最近在识别和表征新的AAV变体和基因调控元件方面取得的进展将会大大促进基因疗法的临床开发。此处介绍的筛选策略可用于优化临床所需的特征, 例如神经系统某些区域的嗜性进入疾病相关隔室(例如特定细胞类型和组织微环境), 降低安全性和耐受性问题(例如免疫原性和毒性), 以及提高疗效。几项临床前研究证明了AAV(包括了工程系统载体)治疗中枢神经系统疾病的能力。Wegmann等人2021年通过AAV9将基因沉默的锌指蛋白转录因子传递到海马体中, 或者通过AAV-PHP.B传递到全脑, 来抑制阿尔茨海默病小鼠模型中的 tau 表达。Sinnett等人2021年将miRNA调控元件工程化到AAV的病毒基因组中, 包装治疗性转基因, 以防止脑脊液内递送至Rett综合征小鼠模型后过度表达(提高AAV基因转移的安全性而不影响疗效)。对于AAV组件的进一步开发与实施能够控制转基因表达的时间, 空间和数量, 从而提高AAV基因疗法对多种病理的安全性和有效性。
5.2
基因组编辑
结合AAV方法的进步, 用于编辑和操纵基因组的工具为研究疾病中的基因功能和确定潜在的治疗靶点提供了新的可能性。在过去的十年里, CRISPR的衍生工具的数量大幅增长, 使研究人员能够操纵细胞的基因组, 表观基因组和转录组。与高效和有针对性的载体递送相结合, CRISPR工具箱的广泛功能有望改变临床前研究。许多 Cas 蛋白的大体积限制了CRISPR工具与AAV递送的结合。特征明确且广泛使用的如产脓链球菌(Streptococcus pyogenes)的Cas9的长度为4.1kb, 所有调控元件仅剩下几百个碱基对。然而, 较小的Cas 蛋白已被表征, 并且可以与引导RNA (gRNA) 盒一起包装到单个AAV载体中。AAV介导的基于CRISPR的工具的递送也可以通过双载体系统实现: 分别递送gRNA和Cas效应子, 在AAV基因组中递送分裂的Cas蛋白, 从而在转导后重组;或者通过mRNA或蛋白质转拼接。基于CRISPR的工具将在更多科研努力中有更大的发展, 以最大限度地减少和优化启动子, 增强子和调控元件。尽管存在这些困难,但许多研究已经证明了AAV提供的CRISPR工具在用于临床前研究上的广阔前景。Duan等人在2021年使用单个AAV来传递Cas9和 gRNA, 无论是在脑实质内使用AAV9还是在全脑范围递送AAV-PHP.eB , 来编辑家族性阿尔茨海默病小鼠模型中的致病突变,从而改善在分子, 电生理和认知层面疾病进展的标志物的认定。利用分裂内含蛋白反式剪接,Levy等人在2020年研发了胞嘧啶碱基编辑器 (CBE) 和腺嘌呤碱基编辑器, 在多个目标组织中产生定义的单碱基对转换。用带有AAV-PHP.eB的分裂CBE在皮层和小脑中系统性的施用, 产生了强大的C·G 到 T·A, 当用于纠正致病突变时, 此方法使得尼曼匹克症(Niemann-Pick disease)小鼠模型中存活率有适度增加。Matharu等人在2019年使用双载体方法(通过脑实质内注射)传递gRNA和与转录激活因子融合的核酸酶缺陷Cas9, 以通过靶基因的转录激活来挽救小鼠单倍体不足的肥胖症。基于CRISPR的工具也可用于在体大型汇集筛选。Chow等人在2017年使用脑实质内AAV9将gRNA库传递到Cas9报告子小鼠中, 然后对基因组靶位点进行靶向捕获测序, 以识别胶质母细胞瘤驱动基因。由于这些筛选的规模和实用性从根本上受到可分析细胞数量的限制, 因此广泛转导大脑的AAV衣壳可以使用基于CRISPR的工具进行更大规模的合并筛选。
除了制造Cas蛋白以及正确的设计和验证gRNA,AAV衣壳和载物配对的细胞类型特异性靶向,以及完善控制基因的时空表达,可能会减少脱靶效应和免疫反应。自灭活CRISPR载体或抗CRISPR蛋白也可用于在靶向编辑后关闭CRISPR系统。
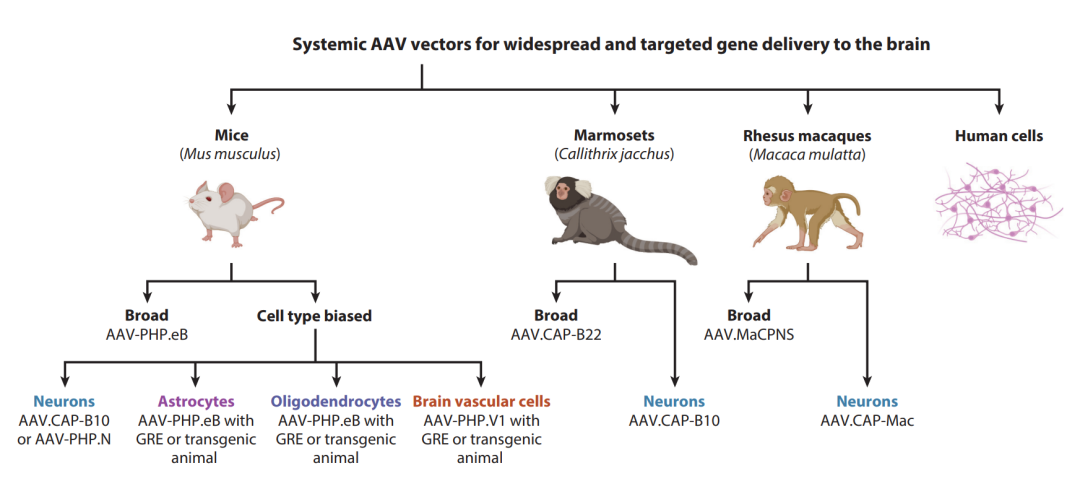
Fig.5 用于将基因广泛和有针对性地传递到大脑系统性的AAV载体。该图总结了用于小鼠, 狨猴和普通猕猴的工程化系统AAV。AAV衣壳的选择取决于许多因素,包括递送方法, 靶细胞群和研究时使用的模型生物。AAV-PHP.B和AAV-PHP.eB可以分别转导人源脑类器官和离体人类新皮质切片。然而, 想要得到可以用于人类的系统性AAV, 还有许多工作要做。包含了人类脑血管系统的细胞类型的发现和分子表征可以促进人类中可跨越 BBB 的AAV的发展。
06
结论
近年来,用于神经科学研究的AAV载体(包括系统AAV)的开发取得了快速进展。AAV衣壳和载物的模块化设计使得采用致动因子,传感因子和基因调控元件的最新进展来针对啮齿和非人灵长类动物中的不同脑细胞类型。越来越多的分子工具现在可以通过Addgene的质粒库(https://www.addgene.org)和其他工具使用,并且定制的载体可以自己在家制作。Addgene的AAV数据中心 (https://datahub.addgene.org/aav/) 等开放平台可以帮助研究人员查找和共享AAV 数据以加速生物医学研究。通过扩展AAV工具包的可用性和实用性,研究人员可以使用工程制造的AAV实现跨物种的微创,细胞类型特异性载物表达。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享




