中国西安空军军医大学唐都医院神经外科的屈延等提出听神经瘤周围膜性结构模型的概念,介绍神经束膜下听神经瘤的分离和切除术的疗效,结果发表在2022年4月的《Frontiers in Oncology》在线。
——摘自文章章节
【Ref: Wu Y, et al. Front Oncol. 2022 Apr 20;12:849109. doi: 10.3389/fonc.2022.849109. eCollection 2022.】
随着显微神经外科技术、手术设备和术中电生理监测的发展,听神经瘤(vestibular schwannomas,VSs)的完整切除和术后面神经功能保留明显进步,保留听力也逐渐成为手术追求。研究表明,对于直径小于1.5cm的听神经瘤,40-70%患者术后能够保留可用听力,面神经功能永久丧失的患者少于10%;肿瘤直径大于2.5cm的患者,可用听力能够保留者不到5%,50%患者有部分性或永久性面瘫。神经外科医生掌握听神经瘤的膜性结构解剖知识,对于手术取得满意效果至关重要。中国西安空军军医大学唐都医院神经外科的屈延等提出听神经瘤周围膜性结构模型的概念,介绍神经束膜下听神经瘤的分离和切除术的疗效,结果发表在2022年4月的《Frontiers in Oncology》在线。
该研究回顾性总结2015年7月至2020年10月在唐都医院收治的124例听神经瘤患者的手术效果和并发症。研究对象纳入标准为病理诊断听神经瘤,排除标准为神经纤维瘤病II型和既往有手术史。术前听神经检查包括纯音听力检查、语言辨别率测定和听觉脑干反应,并根据House–Brackmann面神经分级在术后第一天、1周、3个月、半年和1年评估面神经功能。术前、术后3天、3月、半年和1年行头颅增强MRI检查,根据sammi分级评估肿瘤大小和对小脑及脑干的压迫程度。岩骨薄层CT扫描观察内听道大小,迷路的位置和是否为颈静脉球高位。术中行电生理监测。术前常规放置腰大池引流,并在打开骨瓣后释放60-80ml脑脊液使小脑塌陷,再沿桥脑小脑角池分离出蛛网膜皱襞(图1A和2B)。分开蛛网膜皱襞后可看到肿瘤和表面的囊壁(即第三层蛛网膜和L点前后的神经束膜)。电刺激寻找囊壁表面无面神经附着处,并在神经束膜层下方用显微钩将囊壁从肿瘤表面剥离(图1B和2B)。肿瘤切除顺序依据瘤心、脑干端(图1C和2B)、头端和尾端(图1D和2D)进行。“瘤皮”在不同位置包含不同的膜性结构,而神经束膜一般位于最内层,而且是唯一完整包裹肿瘤的结构(图2)。分离肿瘤和神经束膜界面并在神经束膜下切除肿瘤,即神经束膜下切除技术,对于保留脑干、面听神经功能至关重要(图1E和1F)。桥脑小脑角的肿瘤切除后,个体化磨除内听道外侧壁,持续监测和保护听力结构,直至见到肿瘤最尖端;打开内听道内肿瘤表面的蛛网膜和神经束膜(图2D)。肿瘤减压后,从内听道底到内听道孔切除肿瘤。采用骨蜡和肌肉封堵磨开的内听道外壁并逐层缝合各层结构。肿瘤轻度粘连时,肿瘤能比较容易从神经束膜剥离;中度粘连时则需要显微剥离子分离肿瘤和神经束膜界限;重度粘连时只能锐性分离肿瘤和神经束膜界限。
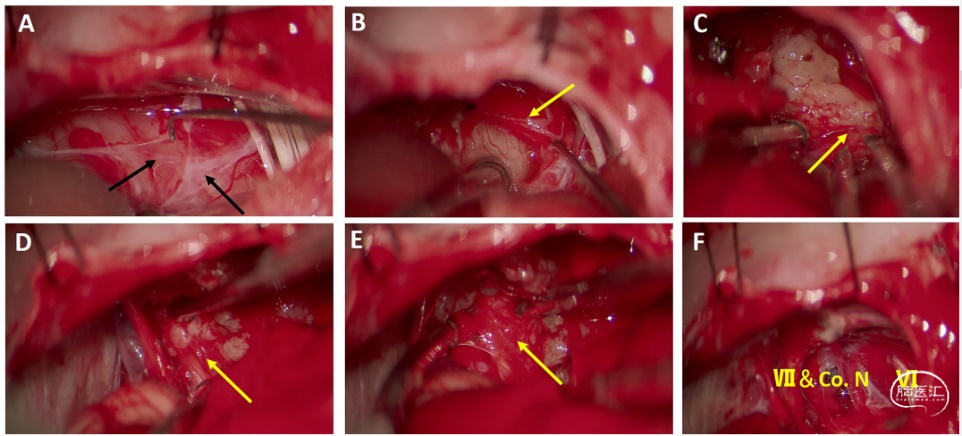
图1. 神经束膜下进行肿瘤分离和切除。A. 肿瘤表面上可见蛛网膜皱襞由二层蛛网膜组成。B. 蛛网膜皱襞下的肿瘤包膜和神经束膜形成清晰的分界。C. 脑干表面剥离肿瘤,并在脑干上保留神经束膜。D. 腹侧面上,神经束膜下方的面神经保留完整,从神经束膜上剥离肿瘤。E. 肿瘤切除后,面听神经、耳蜗神经上的神经束膜保留完整。F. 肿瘤切除后的桥脑小脑角。脑干、面神经、耳蜗神经和展神经在神经束膜下肿瘤切除后保留完整(黑色箭头指示蛛网膜,黄色箭头指示神经束膜)。
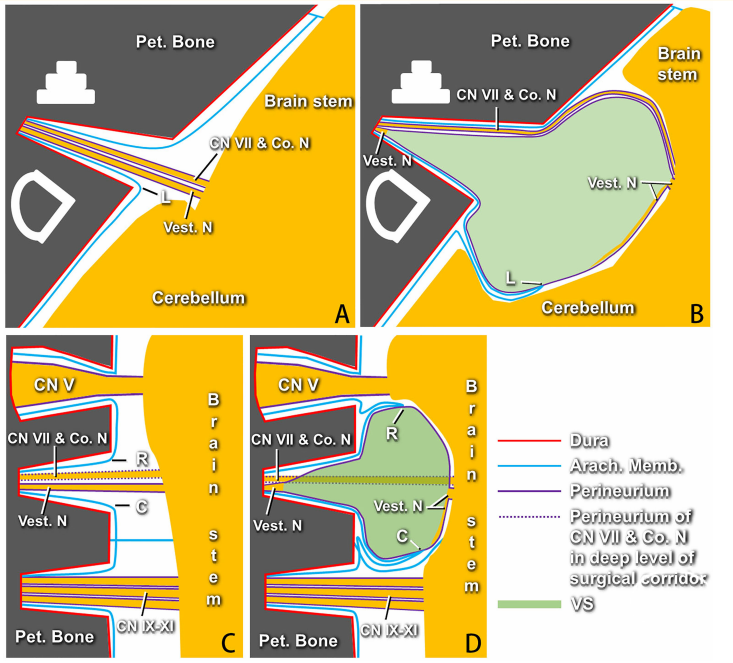
图2. 作者提出的听神经瘤周围膜性结构模型示意图。A. 轴面图显示生理状态下被神经束膜覆盖的面神经、耳蜗神经和前庭神经在蛛网膜下从脑干进入内听道底。点“L”表示内听道孔外侧点的蛛网膜。B. 轴面图显示随着肿瘤进展,“L”点蛛网膜被肿瘤粘连和牵拉至桥脑小脑角,导致神经束膜包裹的肿瘤外侧的三层蛛网膜出现在“L”点前方。“L”点被肿瘤牵拉到桥脑小脑角的程度在每个病例都不相同。有时可以在神经束膜和肿瘤之间识别退变的前庭神经纤维和内听道底。C. 冠状面图显示生理状态面听神经头尾侧膜性结构的形态。点“R”和“C”分别代表内听道孔头尾点的蛛网膜。D. 肿瘤形成后,前庭神经和三叉神经或舌咽迷走副神经之间的膜性结构在“R”和“C”点的不同位置上存在很大差异。可见肿瘤被神经束膜的最内层完整包裹。Pet,岩骨;Co.N,耳蜗神经,Vest.N,前庭神经;Arach,蛛网膜;Memb,膜;VSs,前庭神经鞘瘤。
手术结果,根据头颅MRI所示可将124例听神经瘤分为104例肿瘤完整切除组与20例肿瘤大部切除组(图3)。两组间面听神经功能保留率无明显差异,实性与囊性听神经瘤的切除率也无明显差异(P<0.05)。121例面神经完整保留,3例因肿瘤侵犯或粘连无法保留。术后1周面神经功能按House–Brackmann分级评估,96例患者I-II级(功能完好),25例III-IV级(中度损伤),3例V-VI级(重度受损)。半年后,110例患者I-II级,13例III-IV级,1例V-VI级。35例术前具有有效听力的患者中,17例听力正常,18例听力减退。术后6月复查,17例听力正常患者中,3例听力正常,5例听力减退和9例听力丧失。18例听力减退患者中,7例有有效听力和其余听力丧失。MRI成像显示,与术前内听道底有液体的患者相比无液体的患者听力保留率高。肿瘤直径≤2cm的患者听力保留率高于肿瘤直径>2cm的患者(P=0.14)。20例大部切除者中,13例术后1月接受放射外科治疗。易发生肿瘤粘连并影响肿瘤切除率和面听神经功能保留率的因素,包括年龄(P=0.0046),肿瘤最大直径(P=0.0023),肿瘤质地(P=0.033)和瘤周水肿(P=0.045)。以上四个因素进行多因素回归分析,发现年龄大于60岁(P=0.011),肿瘤直径大于3cm(P=0.004)和囊性肿瘤(P=0.046)是肿瘤粘连的独立风险因素。5例出现小脑或脑干术区出血。其中1例死亡;2例去骨瓣减压术,术后有轻度神经功能障碍;2例保守治疗后好转出院。9例颅内感染,出现术后高热,予以腰大池引流和抗感染治疗后好转。4例脑脊液漏,其中1例耳漏保守治疗后治愈,另外3例为硬脑膜缝合不严的切口漏,修补后漏消失。8例术后小脑共济失调,均在术后3-6个月恢复正常。4例后组颅神经损伤症状(咳嗽反射减弱和吞咽困难),2例外展神经损伤。随访时间为34.6±17.4月(11-70月),2例大部切除后未行放疗的患者由于肿瘤复发再次手术,复发时间分别为术后28个月和41个月。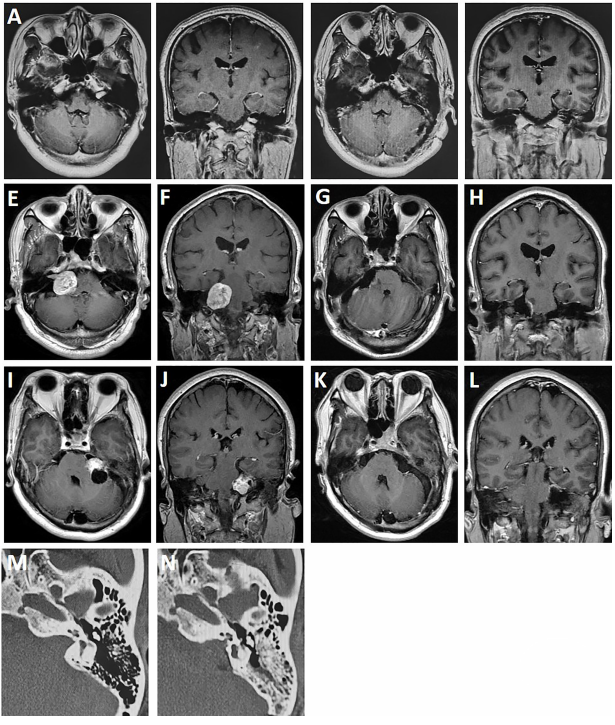
图3. 术前与术后MRI成像。A、B. 1例有效听力保存的患者,术前MRI显示肿瘤长入内听道。C、D. 术后6月MRI成像示肿瘤完整切除并保留听力。E、F. 1例患者术前MRI显示实性前庭神经鞘瘤位于桥脑小脑角。G、H. 术后6月MRI显示肿瘤完整切除而且面神经功能保留(House–Brackmann功能I级)。I、J. 患者听力丧失而且术前MRI显示囊性听神经瘤。K、L. 术后6月MRI显示肿瘤无复发。M、N. 比较术前与术后CT扫描内听道骨窗。
作者认为,前庭神经周围的膜性结构复杂多变,是切除肿瘤的关键界面;电生理辅助下,于神经束膜下分离能够提高肿瘤完整切除率和面-听神经功能保留率。手术时应根据肿瘤粘连程度决定肿瘤的解剖分离方法和切除程度。实施大部切除的患者可辅助放射外科治疗。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。










