中枢神经系统小胶质细胞是脑实质中唯一的一类固有免疫细胞,对其功能的研究有助于理解中枢神经系统稳态的内在维持机制。长期以来对小胶质细胞特异性操控主要是借助Cx3趋化因子受体1(Cx3cr1)作为启动子的Cre小鼠模型来实现,但是CX3CR1在脑膜相关巨噬细胞和外周单核巨噬细胞中表达,不能特异性代表小胶质细胞。
现已任职于哈佛医学院的神经免疫学家Butovsky于2014年首次通过测序和质谱等技术鉴定出小鼠小胶质细胞特异性表达TMEM119(Butovsky O et al., Nat Neurosci, 2014),认为可能能够用于小胶质细胞特异性的操控工具的开发;同时胶质细胞研究先驱Ben A. Barres实验室的Bennett博士于2016年在人和小鼠中进一步验证小胶质细胞特异性表达TMEM119(Bennett ML et al., Proc Natl Acad Sci U S A, 2016);近年来越来越多的研究开始借助Tmem119作为启动子的小鼠开展小胶质细胞功能探究。但是同时有研究发现疾病状态下TMEM119的表达降低(Friedman BA et al., Cell Report, 2018; Masuda T et al., Nat Immunol, 2020);此外在TMEM119在胚胎E17天才开始表达,且发育早期的表达显著低于成年稳态时期(Bennett ML et al., Proc Natl Acad Sci U S A, 2016),因此部分研究者对TMEM119对这一工具是否能够很好的用于小胶质细胞功能的研究提出了质疑。
近日,德国Rostock大学医学中心的Hannes Kaddatz课题组在国际知名期刊《GLIA》上发表“Transmembrane protein 119 is neither a specific nor a reliable marker for microglia”的研究论文。该研究通过对四种中枢神经系统疾病模型(Cuprizone诱导的脱髓鞘模型、实验性自身免疫性脑脊髓炎模型、大脑中动脉栓塞的中风模型、6-羟基多巴胺诱导的帕金森模型)及多发性硬化的临床病人脑组织样本中小胶质细胞的分析,发现此前多个单细胞研究鉴定出的小胶质细胞特异性分子标志TMEM119在几种中枢神经系统疾病的小胶质细胞中均显著降低,同时在外周组织器官如淋巴结树突状细胞中也发现TMEM119的表达,说明TMEM119可能不是可靠的小胶质细胞特异性分子,对使用TMEM119作为启动子的小胶质细胞特异性操控工具进行研究的特异性及可靠性提出了质疑。

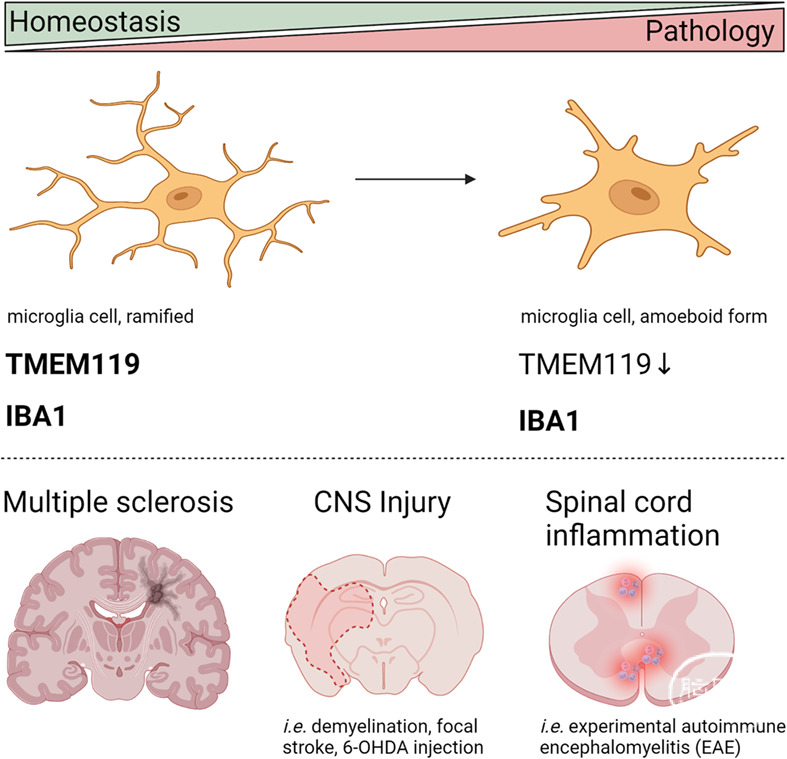
中枢神经系统的固有免疫细胞主要包括脑实质中的小胶质细胞(microglia, MG)和脑边界相关巨噬细胞(Border-associated macrophages, BAMs; BAM包括脑膜、脉络丛和血管周巨噬细胞),MG和BAMs都是发育早期由卵黄囊中的红系髓系祖细胞(Erythromyeloid progenitor, EMP)迁移到中枢神经系统并进行定殖,并通过一系列的转录因子调控最终分化为脑实质中的CD206-小胶质细胞与CD206+中枢神经系统相关巨噬细胞。由于MG和BAMs具有相同的发育谱系来源,因此二者共享具有诸多相同的特征和特异性分子标志,如Cx3趋化因子受体1(CX3CR1),白细胞分化抗原(CD11b)等。长期以来领域内大多数研究都主要是借助Cx3cr1、Cd11b启动子的Cre或者CreER系统对小胶质细胞进行特异性基因操控,但是CX3CR1、CD11b在外周巨噬细胞、BAMs和MG上都表达;因此基于这些工具看到的表型往往混杂的,这些工具都不能很好的进行小胶质细胞特异性操控。
随着对中枢神经系统免疫理解的深入,发现BAMs具有不同于小胶质细胞的功能,因此寻找特异性的小胶质细胞操控工具至关重要。同时借助单细胞测序分析技术的发展,多个研究发现BAMs的转录特征和功能是都显著不同于小胶质细胞,因此选择特异性小胶质细胞操控工具对于准确解析小胶质细胞在中枢神经系统中的功能具有重要意义。
为了寻找区分于外周巨噬细胞和BAMs的特异性小胶质细胞分子标志,多个单细胞测序研究发现一系列只在小胶质细胞上特异性表达的基因,如跨膜蛋白119(Tmem119)、己糖胺酶β亚基(HexB)、P2Y12嘌呤能受体(P2y12r)等;其中Tmem119、HexB和P2y12r作为启动子的特异性Cre或CreER小鼠工具已被不同的实验室构建出(Tobias Kaiser et al., eNeuro, 2019; Takahiro Masuda et al., Nat Immunol, 2019; Jiyun Peng et al., Mol Brain, 2019),并通过一系列实验验证这些分子标志能够标记小胶质细胞,并能很好的区分于外周巨噬细胞和BAMs。其中Tmem119-CreER小鼠逐渐被用于小胶质细胞的特异性操控,但是最近发表在国际知名期刊《GLIA》上的研究认为,TMEM119可能不是小胶质细胞特异性或者可靠的标志。
Cuprizone诱导脱髓鞘模型中TMEM119的表达
作者首先使用Cuprizone来诱导少突胶质细胞损伤的脱髓鞘模型,脱髓鞘会伴随小胶质细胞的活化来清除髓鞘碎片,同时Iba1阳性小胶质细胞的密度会显著升高;但是作者通过免疫组化却发现TMEM119阳性小胶质细胞数量显著降低,同时小胶质细胞中TMEM119的平均荧光强度降低。
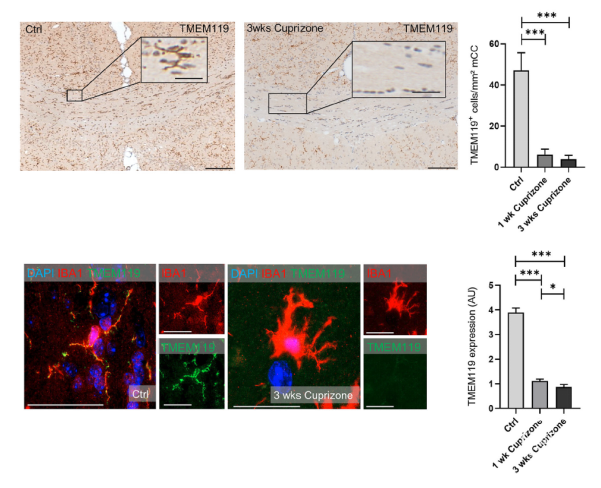
图1. 脱髓鞘模型中TMEM119阳性小胶质细胞的密度及平均荧光强度降低
实验性自身免疫性脑脊髓炎(EAE)及多发性硬化病人脊髓白质区域TMEM119荧光强度降低
EAE模型是模拟多发性硬化疾病的动物模型,该模型除了小胶质细胞的异常活化,常伴随大量免疫细胞的浸润入脑,包括Th1/Th17淋巴细胞和单核细胞等,因此使用TMEM119来区分小胶质细胞变得复杂。通过免疫组化染色,作者发现在EAE模型中,小胶质细胞活化,但是小胶质细胞中TMEM119的表达显著降低;此外在多发性硬化的临床样本中也发现白质区域TMEM119阳性小胶质细胞的密度和表达均显著降低。
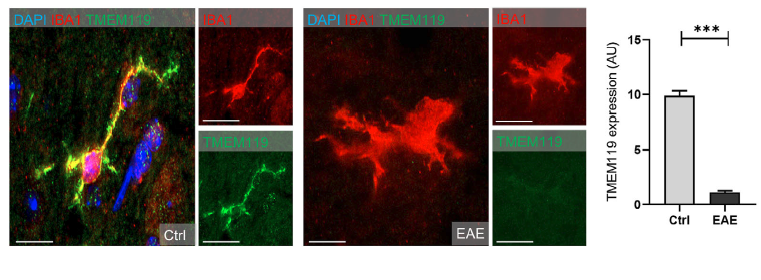
图2. EAE模型中Iba1阳性小胶质细胞TMEM119表达降低
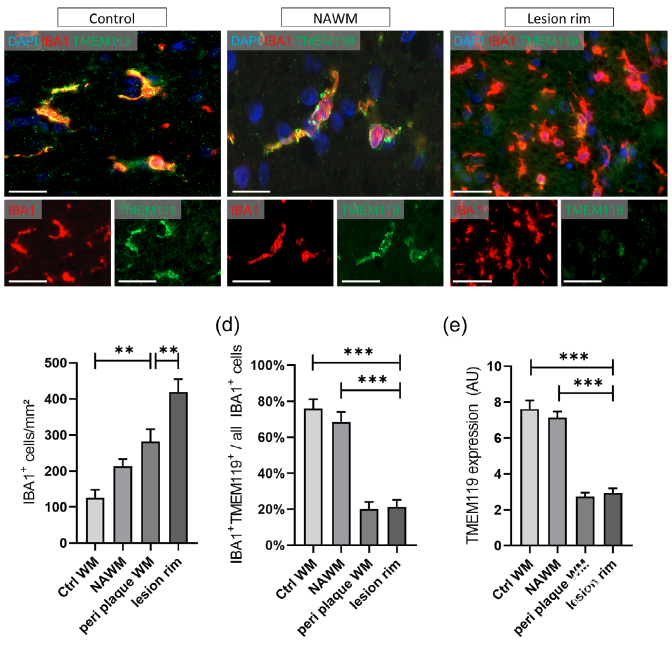
图3. 多发性硬化病人白质区域TMEM119阳性小胶质细胞密度和表达均降低
中风和帕金森模型中TMEM119阳性小胶质细胞密度显著降低
作者进一步在大脑中动脉栓塞的中风模型和6-羟基多巴胺诱导的帕金森模型来分析TMEM119阳性小胶质细胞的变化。中风模型梗死区被周围的半影区所包绕,半影区包含大量活化增殖的小胶质细胞,通过免疫组化分析发现缺血后4小时和3天后,半影区Iba1阳性小胶质细胞密度显著增高,而TMEM119阳性小胶质细胞的密度却显著降低。
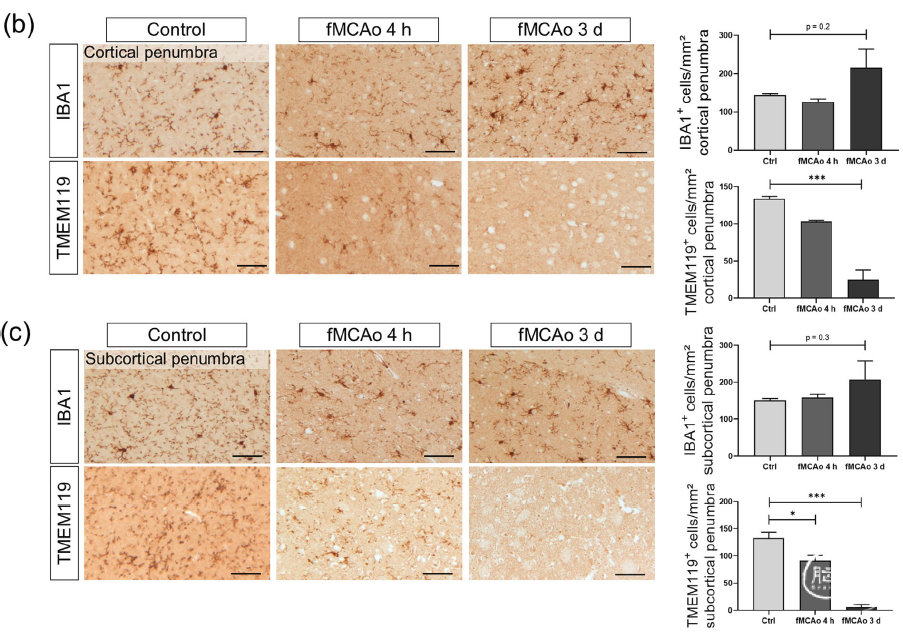
图4. 中风模型皮层、亚皮层半影区TMEM119阳性小胶质细胞密度显著降低
此外,在6-羟基多巴胺诱导的帕金森模型的黑质区域,造模后第一天和第4天通过免疫组化也发现黑质区Iba1阳性小胶质细胞密度显著升高,而TMEM119阳性小胶质细胞密度却显著降低。
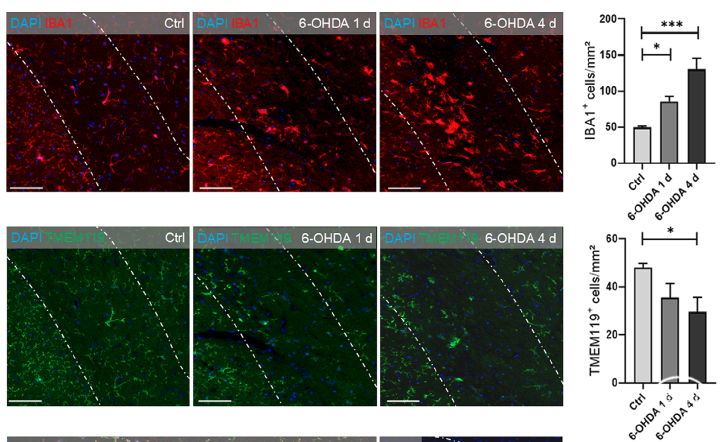
图5. 6-OHDA诱导的帕金森模型黑质区域TMEM119小胶质细胞密度降低
外周组织器官或免疫细胞中表达TMEM119
除了在多种疾病模型中活化小胶质细胞上发现TMEM119表达的降低,作者还进一步发
现外周脾脏和淋巴节中鉴定出TMEM119在树突状细胞中表达,通过免疫组化发现Podoplanin和FDC-M1阳性的树突状细胞中均表达TMEM119,说明TMEM119可能不是小胶质细胞特异性的分子标志。
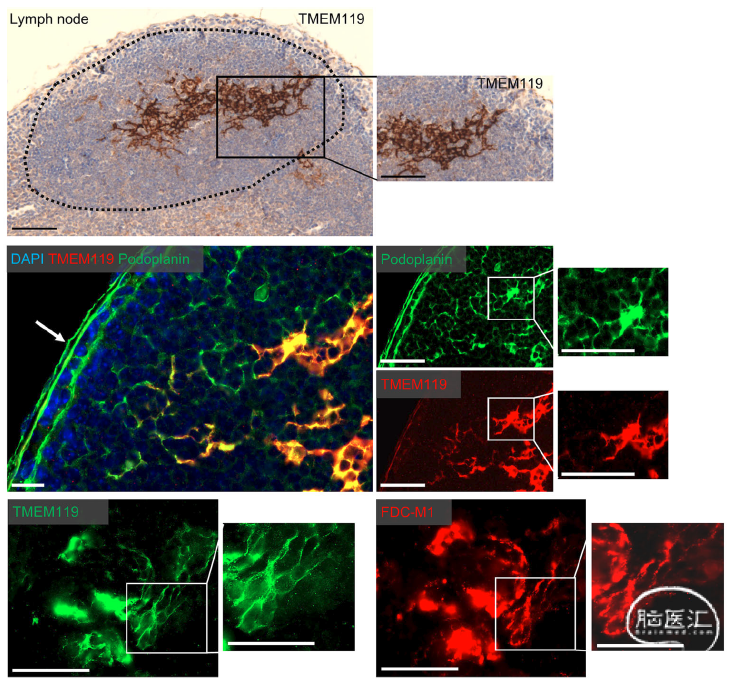
图6. 外周淋巴结中的树突状细胞表达TMEM119
综上所述,在生理状态下,中枢神经系统中TMEM119阳性的可以特异性地代表小胶质细胞,但是在疾病状态活化的小胶质细胞中TMEM119表达下降,同时TMEM119可以在树突状细胞中非特异性表达,因此使用TMEM119作为启动子的小胶质细胞工具小鼠来探究不同状态下小胶质细胞对功能可能会一些干扰。此外有相关的研究发现发育早期小胶质细胞中TMEM119的表达量显著低于成年时期,使用TMEM119作为启动子的小胶质细胞工具小鼠是否可以用于发育时期小胶质细胞功能的探究仍需要更多的深入探究。
参考文献:Vankriekelsvenne E, et al. Glia. 2022. https://doi.org/10.1002/glia.24164.
在招岗位
2022 RECRUIT /
招募编译团队及审稿团队
岗位职责:撰写、审阅神经科学各领域的文献导读、领域速报。
岗位要求:神经科学领域四年级以上的博士生、博士后以及青年科研工作者。
AiBrain作者团队由海内外知名高校博士生、博士后,及已成立实验室的PI们组成;加入AiBrain,可以体验专业的投审稿系统、高效温馨的团队合作、丰富的文章栏目,以及有竞争力的丰厚报酬;能力突出者可以作为领域/栏目负责人,并配有岗位津贴。
欢迎有意者投递简历及个人作品!

微信号:AiBrainzhushou
邮箱:ai_brain@163.com
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享




