黎巴嫩贝鲁特黎巴嫩大学医学科学院神经科学研究中心的Sanaa Nabha等通过文献综述总结NB中生物标记物预测预后的作用以及在靶向治疗中的潜在作用。文章发表在2021年9月《Curr. Treat. Options in Oncol.》在线。
——摘自文章章节
【Ref: Shawraba F, et al. Curr Treat Options Oncol. 2021 Sep 27;22(11):102. doi: 10.1007/s11864-021-00898-1.】
神经母细胞瘤(Neuroblastoma,NB)是儿童交感神经系统的神经内分泌肿瘤,主要影响肾上腺或交感神经节,是儿童最常见的颅外实体瘤,可发生于肾上腺髓质、颈部和脊髓,约占所有儿童肿瘤的10%,中位生存期为3-4年。目前治疗包括手术、化疗、放疗和干细胞移植。早期发现有助于改善疗效。黎巴嫩贝鲁特黎巴嫩大学医学科学院神经科学研究中心的Sanaa Nabha等通过文献综述总结NB中生物标记物预测预后的作用以及在靶向治疗中的潜在作用。文章发表在2021年9月《Curr. Treat. Options in Oncol.》在线。
该文献综述总结NB中的生物标记物如下:
遗传生物标志物
①MYCN基因扩增:MYCN是一种原癌基因,参与细胞增殖、分化和凋亡。小鼠交感肾上腺细胞MYCN基因过度表达导致NB发生。NB患者MYCN基因扩增与侵袭性和预后不良相关。MYCN驱动谷氨酰胺分解,促进活性氧(ROS)产生,进一步促进NB细胞增殖。MYCN基因过表达使抑制NB的miRNA家族let-7失活。MYCN通过抑制clusterin基因与PRC2结合,驱动NB肿瘤发生。因此,MYCN扩增是NB诊断、预后、侵袭和进展的生物标志物(图1)。
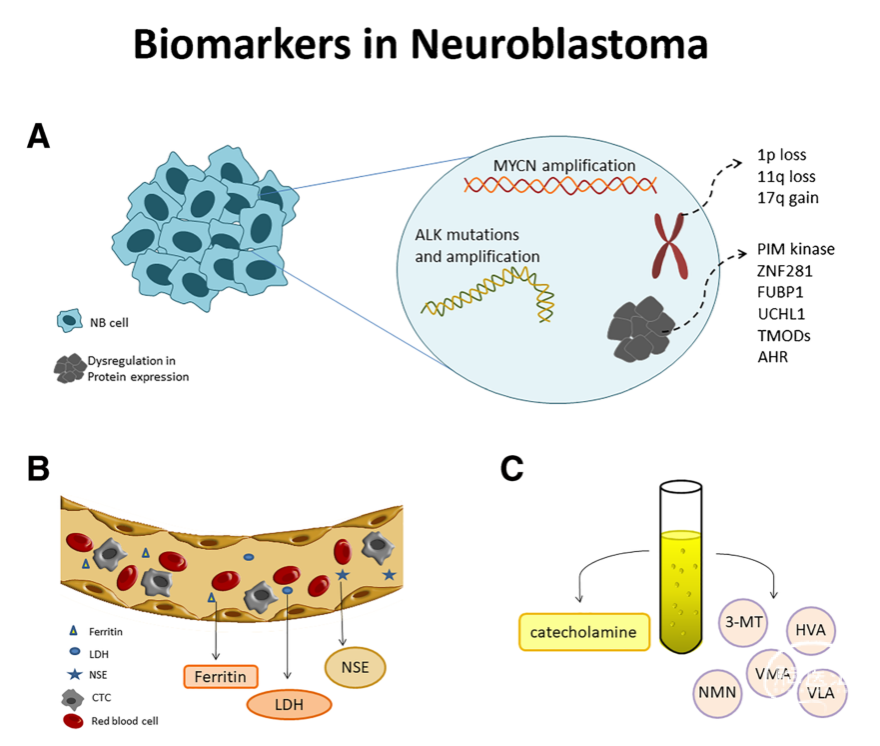
图1. 神经母细胞瘤中的生物标记物。A. 遗传和分子生物标志物:遗传畸变和蛋白失调是NB的重要生物标志物。它们包括MYCN扩增、ALK扩增和突变、染色体片段缺失/增加以及许多蛋白如PIM激酶、FUBP1、UCHL1、TMOD等的失调。B. 血清中神经母细胞瘤的循环生物标志物:包括LDH乳酸脱氢酶、铁蛋白、NSE神经元特异性烯醇化酶和CTC循环肿瘤细胞。C. 尿液中的循环生物标志物:包括儿茶酚胺及其衍生物,如3-MT 3-甲基苯丙胺、HVA高香草酸、VMA香草酸、NMN去甲肾上腺素和VLA香草酸。
②ALK基因扩增与突变:ALK(Anaplastic lymphoma kinase)是一种致癌基因,在NB晚期ALK扩增和突变,参与NB肿瘤发生。ALK突变与生存率低或中高危的NB密切相关。ALK突变增强MYCN活性。ALK突变和MYCN共表达与NB早期发生和预后不良相关。ALK扩增促进ALK激酶组成性激活,而ALK激酶促使NB相关蛋白过度磷酸化。ALK表达抑制导致NB细胞凋亡,故可作为一个治疗靶点。
③Aurora A基因扩增:Aurora A基因编码丝粒相关激酶;可在NB中发现Aurora A基因扩增和过表达。NB细胞系中,Aurora A激酶水平较高。人NB细胞系和组织中过表达Aurora A与NB进展和预后差相关。Aurora A是一个重要的致癌基因和代表NB预后的生物标志物和潜在的治疗靶点。
④ATRX基因突变:ATRX基因位于X染色体上,与表观遗传调控有关。NB患者中ATRX突变导致核中ATRX蛋白缺失。ATRX突变与NB晚期相关,在青少年和年轻成人患者中更常见。它们被认为是一种新的生物标志物,可能有助于识别侵袭性NB。1号染色体短臂缺失(1p)是NB常见的遗传改变,它携带的抑癌基因如CHD5基因表达受损与生存期短和高危NB相关。
11号染色体长臂缺失(11q)是NB另一种遗传改变,与4期NB、转移、复发、预后差和OS低密切相关。染色体11q含有CAMTA1、CADM1、TSLC1和ATM基因,这些基因下调均与NB患者生存期短、预后不良相关。因此,染色体1p和11q缺失是具有预后判断价值的NB遗传标记物。
染色体17q增加是NB患者的预后因素。1岁以上儿童17q增加与NB发生发展相关。17q增加与NB预后不良显著相关,在NB各期均比MYCN扩增和染色体1p缺失更常见。17q含多个基因,如BIRC5基因,该基因编码survivin是一种凋亡抑制剂,该基因高表达是NB晚期的预后因素。
NB另一个重要的预后指标是肿瘤细胞的染色体倍性水平,与年龄、NB分期、患者生存密切相关。NB患者根据核型分为近二倍体、超二倍体、近三倍体和次四倍体。倍性水平可能是一个比年龄、NB分期或MYCN扩增更有影响的预后因素,并与预后不良和生存降低有关,特别是标记染色体1的NB。超二倍体或近三倍体NB患者比近二倍体或次四倍体有更好的预后。表观遗传修饰在驱动恶性肿瘤中发挥关键作用。研究发现,NB中与凋亡、增殖、生长和分化相关的特定基因经常发生于高甲基化。全基因组启动子甲基化显示,在高危NB中至少有70个候选基因表现出表观遗传变化,支持异常DNA甲基化可能与NB发病机制相关的假说。例如,研究表明RB1和TDGF1启动子高甲基化与生存率降低、预后不良相关。这两个基因被认为是NB侵袭和进展的独立预测生物标志物。
PD-L1通过抑制T细胞功能调控机体的抗肿瘤免疫反应。晚期NB患者PD-L1的表达存在差异,值得注意的是PD-L1在NB细胞中低表达与预后良好相关。MYCN与PD-L1表达显著相关,提示MYCN可以调控NB中PD-L1的表达;通过抑制MYCN靶向PD-L1,可恢复对NB的高效抗肿瘤免疫。因此,PD-L1可以作为一种新的预后生物标志物,预测NB患者的临床结局和OS。
PIM激酶在包括NB在内的多种恶性肿瘤中过表达,并与NB患者OS不良显著相关。PIM通过BAD磷酸化抑制细胞凋亡,降低对NB某些抑制剂的敏感性。因此,PIM的表达被认为是NB潜在的预后判断生物标志物和新的治疗靶点。
Zinc finger protein 281(ZNF281)在控制细胞干性和神经元分化中发挥关键作用。MYCN促进ZNF281表达,随后抑制NB细胞向神经元分化。ZNF281的高表达与NB侵袭、预后不良和疾病分期有关。因此,ZNF281可以作为NB的预后相关标志物。
Ubiquitin C-terminal hydrolase L1(UCHL1)是NB细胞分化的关键调节因子。研究UCHL1启动子在NB中的甲基化非常有意义。此外,UCHL1高表达与NB分化相关,临床结果明显较好,OS也较好。因此,UCHL1可能是一个有利的生存标志物,也是一个新的治疗靶点。
①TMOD:Tropomodulin(TMOD)蛋白参与肌动蛋白动力学和神经突起的形成,在包括NB在内的多种癌症中过表达,其高表达与预后良好相关。此外,TMOD过表达诱导NB细胞向神经元分化,阻滞细胞周期,抑制细胞增殖。TMDO可以作为NB独立预后生物标志物。
②FUBP1:Far upstream element-binding protein 1(FUBP1)是包括MYCN和HIF1在内的多个基因的转录调控因子。FUBP1表达水平与NB晚期及OS降低显著相关。FUBP1通过加速糖酵解和ATP产生,诱导NB细胞增殖,抑制凋亡。因此,FUBP1可以作为NB诊断和治疗的一种新的、强有力的生物标志物。
③AHR:Aryl hydrocarbon receptor(AHR)是一种具有肿瘤抑制功能的转录因子。AHR过表达可下调MYCN的表达,从而增强NB分化。它与NB分化和预后良好相关,并抑制NB增殖和转移。AHR可作为NB预后相关生物标志物和治疗靶点。
④β-Catenin和PHOX2B:β-Catenin是一种参与Wnt/β-Catenin信号转导的蛋白,对神经嵴细胞的发育至关重要,与NB晚期、转移、疗效差和高危显著相关。PHOX2B是一种对自主神经系统发育至关重要的转录因子。此外,在家族性NB中也发现PHOX2B错义突变,提示后者可能是一个易感因素。通过对β-catenin和PHOX2B在NB中的表达进行研究,发现β-catenin和PHOX2B的表达与高危患者对治疗的不良反应有关。因此,β-catenin和PHOX2B均可作为NB检测的生物标志物和治疗耐药的预测因子。
⑤Msi1、ID1和PCNA:准确的临床风险评估是预测NB的重要因素。研究人员开发一种3个蛋白预测模型,包括Msi1、ID1和PCNA。ID1低表达、Msi1和PCNA高表达与预后不良和OS低密切相关。这3个蛋白的表达谱构成一个强大而准确的生存预后模型。这是对NB高危组患者进行风险分层的手段。
⑥Trk:Aryl hydrocarbon receptor(Trk)是神经系统发育和维持的重要因子。TrkA高表达与MYCN扩增呈负相关,与生存期长、预后良好相关。TrkB与NB的侵袭性和耐药相关基因过表达以及血管生成因子表达有关。TrkC主要在侵袭性较弱的NB中表达,并与生存期长相关。故Trk可作为NB的一个潜在的诊断和预后标志物。
⑦GD2:GD2是一种由神经元和NB细胞产生的粘附分子,参与NB细胞与各种底物的粘附。NB,尤其是未分化的NB细胞高表达GD2,与临床分期无关。此外,NB患者血浆中检测到GD2,与NB生存期降低、复发、表型未分化有关。NB细胞向循环中释放GD2被认为是检测NB的敏感性指标。故GD2是NB潜在的生物标志物和免疫治疗候选者。
⑧ODC:Ornithine decarboxylase(ODC)是多胺代谢中的限速酶,在许多侵袭性肿瘤中过表达。在没有MYCN扩增的NB患者中,ODC表达与遗传和临床特征相关。ODC过表达可作为非MYCN扩增NB患者的预后生物标志物。
⑨PLK1:Polo-like kinase 1(PLK1)是一种在有丝分裂中表达的细胞周期调节蛋白,在许多人类肿瘤中都有高表达。NB中PLK1可以诱导细胞生长,抑制细胞凋亡。PLK1在NB细胞系中过表达,与NB分期、MYCN扩增、预后不良、生存期短有关。PLK1可作为NB的预后标志物。
⑩GSK-3β:Glycogen synthase kinase(GSK)-3β是一种活跃的丝氨酸/苏氨酸激酶,在癌症相关通路和其它神经系统疾病中发挥着关键作用。虽然GSK-3β是一种抑癌因子,但其作为癌基因的作用已在胶质母细胞瘤和NB中得到研究。抑制GSK-3β显著降低NB细胞增殖和生存能力。循环肿瘤细胞:实体肿瘤通常会将肿瘤细胞释放到循环中,引起肿瘤转移和复发。超过50%的NB患者在初诊时出现转移。NB患者血液样本中循环肿瘤细胞(CTCs)计数增加,表明转移可能增加,OS较差。NB CTCs的缺失与药物反应相关,CTCs的存在与NB的临床复发相关。高NB CTC计数与转移有关。因此,检测NB CTCs在早期诊断转移和评估治疗反应方面具有临床意义。
①游离DNA:包括NB在内很多癌症患者均能检测到脱细胞DNA(cell-free DNA , cfDNA)增高。NB患者外周血中可检测到17q增加,cfDNA中17q随NB分期的增加而增加。在NB患者血清中检测cfDNA中1p、3p、4p、11q和14q染色体片段缺失、MYCN和ALK扩增以及ALK突变。cfDNA检测无需手术,只需少量血清,即可快速评估NB病情。②循环RNA(mRNA、microRNA和外泌体microRNA):NB中检测到tyrosine hydroxylase(TH)mRNA,晚期患者TH mRNA较高,与复发风险增加显著相关。NB相关基因(PHOX2B、CHGA、DCX、DDC、骨髓和血液中的TH基因)是NB进展的预测因子。因此,血液中NB-mRNA为预测NB进展和复发提供新的生物标志物。
循环microRNAs(miRNAs)已成为NB诊断和预后的工具。将特异性肿瘤miRNAs释放到血流中,并在MYCN扩增高危NB患者中鉴定出一组高表达miRNAs (miR-124-3p、miR-9-3p、miR-218-5p、miR-490-5p和miR-1538)。这些miRNA可能成为NB诊治的候选标志物。
外泌体miRNA是肿瘤细胞的标志。NB细胞分泌的致癌外泌体miRNAs在肿瘤进展中发挥作用。此外,外泌体miRNA(外泌体miR-21和miR-155)促进化疗耐药性发展。外泌体miRNA为NB的诊断、监测和治疗提供新方法。
③LDH:Lactate dehydrogenase(LDH)是一种在正常组织中广泛表达的代谢酶,癌症患者血清中LDH会升高,是NB预后的生物标志物。在没有MYCN扩增的NB患者中,LDH升高也与较差的预后及较高的复发风险相关。
NB转移患者尿液中香草扁桃酸(VMA)升高。VMA和HVA(homovanillic acid)水平升高与NB进展相关。此外,高VMA/HVA比值往往预示着较好的生存率和生物学特征。尿儿茶酚胺代谢组分析包括VMA和HVA比单独VMA和HVA具有更高的诊断敏感性。尿儿茶酚胺可为NB诊断和预后提供快速、灵敏的检测手段。
铁蛋白通常在人血清中少量存在;病理状态时由于生物合成增加,血清铁蛋白水平显著升高。NB患者血清NSE水平升高,且与NB分期、生存期和预后有关。NSE是正常神经元和神经内分泌细胞中表达的同工酶,癌症病人血清中可测得。NB患者血清NSE显著升高,与进展性分期、较短的生存及不良预后相关,可作为NB诊疗监测的可靠生物标志物。在一项I期临床试验中,ALK抑制剂crizotinib在患有ALK畸变的NB患者中显示出抗肿瘤作用。因此,ALK抑制可能是一种针对NB的有效策略。
在一项I期临床试验显示,Aurora A激酶抑制剂alisertib与化疗药物伊立替康和替莫唑胺联合使用改善患者整体疗效,延长患者生存期。然而,Aurora A激酶抑制剂MLN8237的I期临床试验显示,该药物有许多不良反应,包括骨髓抑制、情绪改变、粘膜炎和手足皮肤综合征。因此,Aurora A抑制剂是治疗NB特别是MYCN扩增的NB的一种新药物。
NB患者通常接受强化多模式治疗后再进行免疫治疗。抗GD2单克隆抗体通过抗体依赖细胞介导的毒性促进自然杀伤细胞激活,有效触发对NB表达GD2抗原的免疫应答。还与高危NB患者的预后和生存期改善相关。此外,抗GD2抗体联合GM-CSF治疗对化疗耐药NB具有高度活性。然而,这种治疗通常与毒性相关,如疼痛、高血压、荨麻疹和补体衰竭。
此外,靶向多胺生物合成是NB的首选治疗策略。接受ODC抑制剂DFMO治疗的患者OS改善,且无NB复发和副作用。这些数据表明,抑制ODC活性结合常规治疗可提高NB患者治疗成功率。
生物标志物的临床应用
NB诊断:一些生物标志物在临床实践中可用于NB的诊断:检测患者尿液中儿茶酚胺及其代谢物是临床诊断NB的关键。预后和风险评估也依赖于生物标志物,包括MYCN基因扩增、1p和11q缺失、17q增加和倍性水平。此外,血清铁蛋白和乳酸脱氢酶水平升高可能提示预后不良。
NB治疗:临床上高危NB患者主要采用两种FDA批准的抗GD2单克隆抗体dinutuximab和naxitamab联合细胞因子进行免疫治疗。此外,抑制ALK突变的药物crizotinib和抑制Aurora A激酶的药物LY3295668的临床试验正在进行中。对于其它类型的NB,靶向治疗不是首选,标准治疗仍是手术、化疗和放疗。
最后作者者认为,NB早期发现有助于改善预后;生物标志物在肿瘤分类、分期、治疗靶点确定、疗效判断和预后分析等方面具有非常重要的价值。由于NB的异质性以及高危患者预后不良,故需要开发NB生物标志物以提供更加精准的治疗。将生物标志物与临床实践相结合,有助于NB的早期诊断和个性化治疗。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。









