转载自︱小柯生命
随着医学进步与人均寿命不断增加,人类罹患与衰老相关的疾病,如帕金森疾病(Parkinson's Disease, PD)等神经退行性疾病的人数不断升高。通过建立帕金森疾病的动物与细胞模型,进行致病机理与药物靶点的研发,近年来一直是基础与临床医学研究以及药物研发领域的热门话题之一。
美国加州大学洛杉矶分校(UCLA)神经内科与分子药理学系和加州纳米系统研究所郭明教授带领的团队,于2006年发现帕金森致病基因PINK1和parkin缺失造成的线粒体损伤是导致患病的关键分子通路(Nature, 2006)[1],2008年发现PINK1和parkin调控线粒体形态(PNAS, 2008)[2],2014-2018年相继发现MUL1, VCP, Atg1基因能够有效抑制PINK1和parkin缺失造成的线粒体损伤,从而为防治帕金森症提供了多个潜力药物靶点(eLife, 2014)[3, 4, 5]。
2022年3月24日,该团队在Nature Communications期刊发表最新论文。此项研究发现人类基因CLUH及其果蝇同源基因clueless能够通过调控负责线粒体分裂的核心因子Drp1,来有效抑制PINK1和parkin缺失造成的线粒体和组织损伤。因此,CLUH同样有很大潜力成为防治帕金森症的新药物靶点。

线粒体作为人体细胞的“发电机”,除了为细胞提供能量,也在调控代谢和程序性细胞死亡过程中发挥关键作用。所以,维持线粒体的健康与正常的形态功能,对维持细胞内稳态、防治疾病发生、延缓衰老至关重要。线粒体的形态由两股相反的拉力共同调控:线粒体分裂(fission, 一个线粒体一分为二)与线粒体融合(fusion, 两个线粒体合二为一)。其中任何一股拉力出现问题,都会使线粒体的形态与功能失去平衡。失去平衡而受损的线粒体在细胞中积累,则会进一步引起细胞代谢失调、神经和肌肉等细胞的损伤甚至凋亡,从而造成帕金森症等神经退行性疾病的发生。PINK1和Parkin即是通过促进Mitofusin(Mfn,调控线粒体融合的核心蛋白)的降解、促进受损线粒体经由细胞自噬通路清除的过程(mitophagy)来发挥其调控线粒体形态、维持线粒体健康、抑制帕金森疾病的功能。
Drp1是调控线粒体分裂的核心蛋白,也是一种GTP水解酶。Drp1主要分布在细胞质中,而一旦响应细胞中促进线粒体分裂的信号,Drp1则由其位于线粒体上的受体蛋白招募到线粒体表面,并聚合成环状结构,利用GTP水解的能量将线粒体一分为二。然而, Drp1这一核心蛋白受到哪些信号通路和其他关键因子的调控,领域内还并不清楚,有很大的探索空间。郭明教授团队发表的最新研究成果表明,人类CLUH基因及其果蝇同源基因clueless在人类细胞系和果蝇模型中发挥着相同的作用,都能促进Drp1被受体招募到线粒体表面,从而促进线粒体分裂。在人类和果蝇细胞中,CLUH/clueless的缺失均造成线粒体明显增大(由于线粒体分裂减少,天平向线粒体融合一端倾斜),而CLUH/clueless的过表达均造成线粒体形态明显减小(由于线粒体分裂增加,天平向线粒体分裂一端倾斜)。重要的是,过表达CLUH/clueless形成的这股促进线粒体分裂的拉力,恰恰能够平衡并修复因PINK1和parkin缺失造成的Mfn积累、线粒体形态的过分增大和线粒体损伤的积累,从而有效抑制PINK1和parkin缺失造成的线粒体和组织损伤。
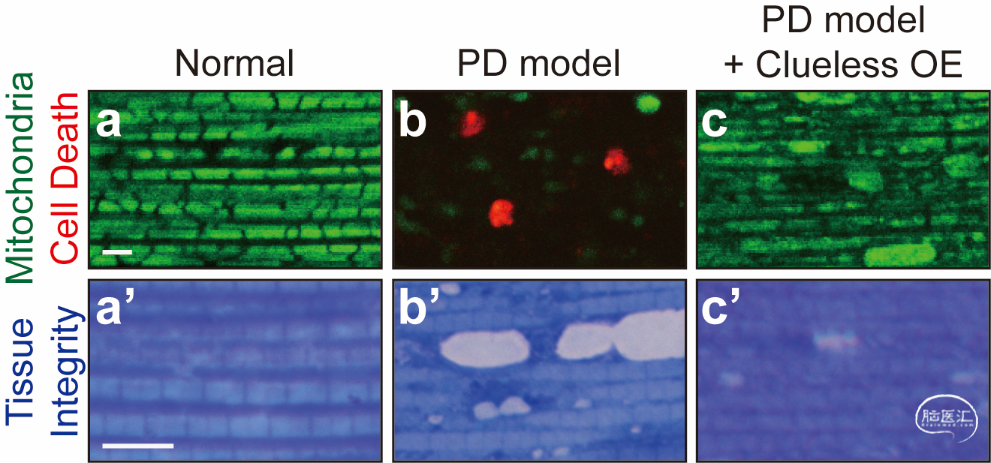
图1:Modified from Nat Commun, 2022 [6]
此外特别值得注意的是,由于CLUH/clueless本身是一个具有进化保守性、调节多项基础生命过程的重要基因,所以在果蝇模型中,clueless的缺失导致果蝇最多只能存活6天,而野生型果蝇的寿命可以超过3个月。当在有clueless缺失突变的果蝇中过表达Drp1时,则可以将果蝇的寿命延长4倍之多(最长可达25天以上)。此项研究中这一项惊人的遗传互作数据表明,CLUH/clueless对线粒体的调控功能,有很重要的一部分是通过Drp1作为下游因子而实现的。
综上所述,此项研究不仅发现CLUH/Clueless是调控Drp1和线粒体分裂的关键上游因子,也表明人类CLUH基因是防治帕金森症的潜在新型药物靶点。
郭明教授的团队主要聚焦于神经退行性疾病以及其他与衰老相关疾病的病理研究与药物研发。在郭明教授的研究领域之外,Drp1也一直是整个基础与临床研究领域的热点。Drp1的基因突变与线粒体分裂过程的异常会造成癌症、糖尿病、心脏病和儿童发育疾病,甚至会造成新生儿夭折。郭明教授表示,此项研究不仅为探寻生命现象基本原理的基础研究提供了新的发现,也为帕金森疾病和其他疾病的防治与药物研发,为促进人类健康的医学研究提供了新的思路。
在进一步深入探寻CLUH调控Drp1的具体分子机制的过程中,郭明教授的团队发现,CLUH之所以能够促进Drp1被其受体招募到线粒体的表面,是因为CLUH作为一种RNA结合蛋白,能够直接结合Drp1受体(Mff和MiD49)的信使RNA,并促进其蛋白质合成。细胞中合成更多的受体蛋白,则意味着更多的Drp1能够被招募到线粒体上。
郭明教授表示,这一项深入分子机制的研究意义在于,Drp1是一个在细胞中发挥着多项重要作用的关键蛋白,如果直接以Drp1作为药物靶点来治疗一种疾病,可能会因为扰乱细胞中的其他信号通路而造成药物副作用,从而很难实现精准治疗。而通过CLUH作为上游因子对Drp1的受体实现精细调控,则有希望使专门针对帕金森症的精准治疗成为可能。
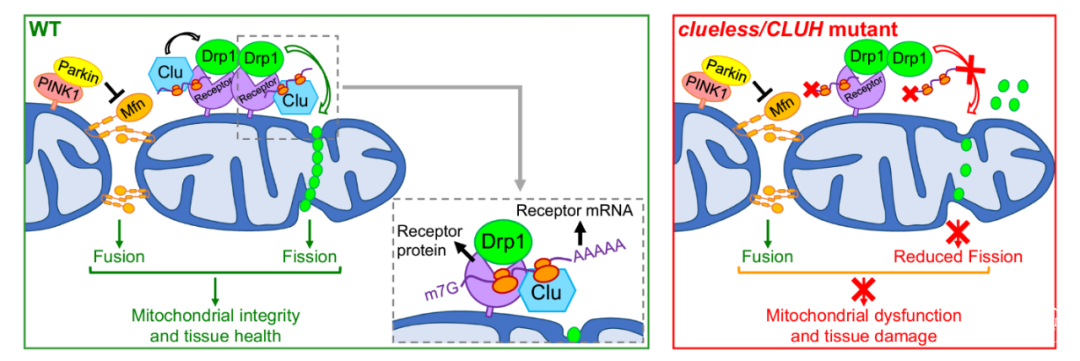
图2:CLUH-Drp1与PINK1-Parkin-Mfn的互作模型
(Nat Commun, 2022 [6])
CLUH/clueless的同源基因可追溯到最简单、最古老的真核生物,如酵母、变形虫等,同源基因均保持着结构和功能上的保守性。郭明教授团队通过人类细胞模型和果蝇模型证明CLUH/clueless基因在调节Drp1和线粒体功能上的进化保守性,也更加强调了CLUH/clueless这一项功能对细胞和机体健康的重要作用。今后,团队将进一步深入探寻CLUH对线粒体功能的调控机理,并研究如何通过调节CLUH的功能促进细胞和机体的健康。
UCLA郭明教授团队的博士后杨欢博士为文章的第一作者,其他合作作者包括Jina Yun博士(前UCLA郭明教授团队博士后),Caroline Sibilla博士(前美国国立卫生院博士生),加州理工学院的Raymond Liu博士、Bruce Hay教授和David Chan教授,哈佛大学医学院的Craig Blackstone教授,澳大利亚University of Sunshine Coast的Robert Harvey教授。
/
相关论文信息:
https://doi.org/10.1038/s41467-022-29071-4
参考文献:
在招岗位
2022 RECRUIT /
招募编译团队及审稿团队
岗位职责:撰写、审阅神经科学各领域的文献导读、领域速报。
岗位要求:神经科学领域四年级以上的博士生、博士后以及青年科研工作者。
AiBrain作者团队由海内外知名高校博士生、博士后,及已成立实验室的PI们组成;加入AiBrain,可以体验专业的投审稿系统、高效温馨的团队合作、丰富的文章栏目,以及有竞争力的丰厚报酬;能力突出者可以作为领域/栏目负责人,并配有岗位津贴。
欢迎有意者投递简历及个人作品!

微信号:AiBrainzhushou
邮箱:ai_brain@163.com
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享



