本部分主要对自发性脑出血的预防展开叙述,主要包括二级预防及有脑出血高危影像学特征人群的一级预防两部分内容。包含了16条推荐意见,其中1条强推荐意见,7条中等推荐意见,7条弱推荐意见,以及1条强不推荐意见。
1.自发性脑出血患者远期风险预测,主要考量以下因素:初次出血中的脑叶位置;高龄;MRI上是否存在微出血,其数量及脑叶位置;MRI上存在弥漫性皮质浅表铁质沉着;高血压控制不佳;亚裔或非裔;载脂蛋白E ε2或ε4等位基因的存在等。但该指南主要是针对白人人种进行的研究,关于国人的脑出血远期风险预测,还需要国内各大中心展开相关研究。
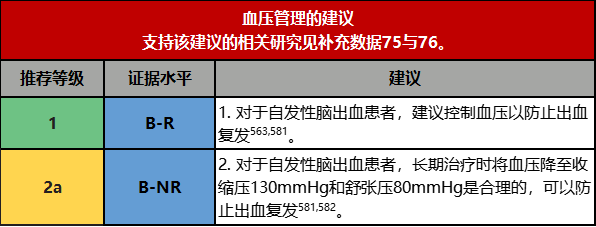
2.高血压与脑出血患者的预后密切相关,多个研究均表明,当收缩压和/或舒张压较高时,个体的脑出血风险增加。有关脑出血的相关证据表明2017年高血压临床实践指南中推荐的控制血压≤130/80mmHg是合理的。
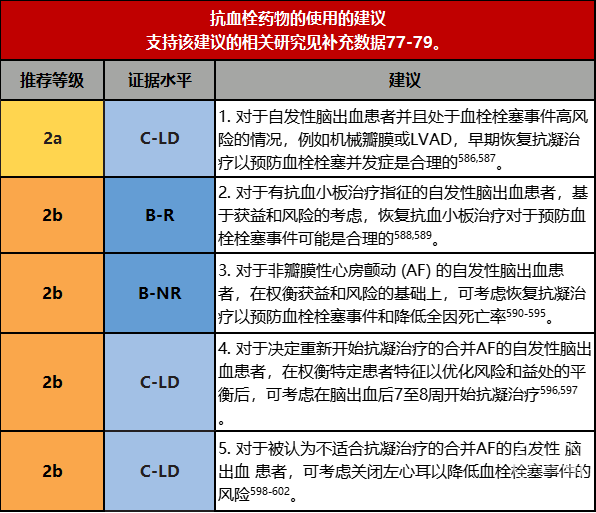
3.既往使用抗血栓药物的患者在发生脑出血之后,恢复抗血栓药物使用的时机如何把握仍是困扰众多临床医生的难点。该指南对于自发性脑出血患者并且处于血栓栓塞事件高风险的情况,例如机械瓣膜或左心辅助装置,早期恢复抗凝治疗以预防血栓栓塞并发症持中等推荐态度。具体如何确定恢复抗血栓药物的时间,临床医生可以结合再发脑出血的相关危险因素,个体化的制定用药方案。
4.他汀类药物与脑出血的关系尚不明确,还需要进一步的研究以明确。非甾体类药物可能会增加脑出血的风险,因此不建议在脑出血后长期使用相关药物。
5.改变生活方式不仅是二级预防的一部分,也是脑出血一级预防的一部分。脑出血后积极改变不良生活习惯有利于提高患者的生活质量。该指南强调了看护者对脑出血患者进一步恢复及生活质量提高所起的积极作用,建议对看护者进行相关知识技能培训及社会心理学培训。
6.MRI提示脑微出血征象的患者,其可能存在较高的脑出血风险,建议将这部分个体进行脑出血一级预防。
张波
香港中文大学(深圳)医学院
神经外科学系教授
南方科技大学/暨南大学/大连医科大学
博士生导师
9.1.1.远期脑出血风险预测
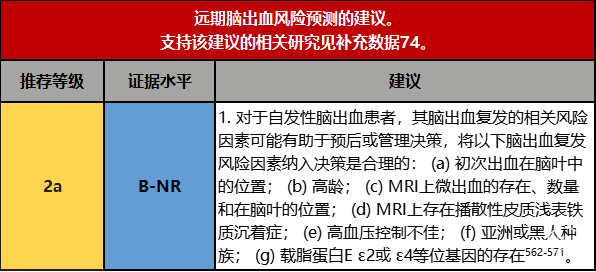
脑出血的幸存者存在出血复发的风险。在未分类的脑出血患者中,估计的复发风险范围为1.2%/y至3%/y,在出血事件后的第一年再出血的发生率最高[562,565-571]。然而,个体复发风险可能因潜在发病机制(与脑血管淀粉样病变相关的脑出血的复发率高于小动脉硬化)、人口统计学和整体临床情况的不同而有很大差异。对325名被诊断为脑血管淀粉样病变的脑出血个体的汇总分析发现复发风险为7.4%/y(95% CI,3.2%/y–12.6%/y),远高于981名非脑血管淀粉样病变,相关脑出血的复发率1.1%/y[95% CI,0.5%/y–1.7%/y])[564]。临床评估和实验室检测,包括MRI,有助于脑出血复发风险的分层和总体血管相关事件的管理优化。可能需要仔细评估个体复发风险,因为脑出血患者也有发生缺血性卒中和其他主要血管事件的风险[571]。在这种情况下,通常会考虑使用抗血栓药物,并且必须权衡出血的风险和缺血性血管闭塞性疾病的风险(纳入这一信息的复杂决策过程在第9.1.3节,抗血栓药物的管理中阐述)。提示潜在的淀粉样血管病变的放射学特征与脑出血复发的最高风险相关。其中包括先前的脑叶出血(HR=4.8)[572],微量出血的存在(特别是严格意义上的脑叶微出血)[27,573,574],脑叶微出血的数量(1处微出血,HR=1.88;2-4处微出血,HR=2.93;大于4处微出血,HR=4.12)[572],以及存在弥漫性皮质铁质沉着症(HR=4.69)[576,577]。与载脂蛋白E基因型携带相关联的血管淀粉样病患者其脑出血再次发生率与更常见的ε3/ε3基因型患者相比类似且再发风险均较高,具有ε2或ε4等位基因的患者脑出血复发的HR分别为3.3和2.5578。门诊血压测量值[563]和高龄[570,579](年龄>65岁,HR=2.8),脑出血复发风险也会增加;非裔(HR=1.22)或亚裔(HR=1.29)的复发风险高于白人(住院期间的自称、临床医生或管理人员定义的种族)[568],脑出血复发与西班牙裔种族的关系一直不明确[568,580]。
- 没有足够的证据来评估个体患者的脑出血复发风险。推导和验证包含临床、放射学和基因型生物标志物的预测规则,并确定对这些因素进行分类的最意义的阈值,将有助于估计复发风险。
- 种族与脑出血复发相关的机制,包括健康的社会决定因素可能的关键作用,尚不清楚。需要对这种关联进行更多研究。
- 提示小血管疾病的MRI结果可能反映脑出血复发的风险增加。需要对与T2高信号、血管周围空间扩大、微血管病变、脑内出血以及大叶与非大叶微出血相关的复发风险进行更多研究。
9.1.2.血压管理
高血压与脑出血有很强的因果关系,是所有卒中亚型中重要的可改变的风险因素。未得到控制的高血压占全球脑出血人群归因风险的73.6%[93]。尽管如此,很大一部分脑出血幸存者的血压仍然控制不佳[563,583]。此外,脑出血患者也有未来发生缺血性中风和心血管疾病的风险。脑出血后治疗高血压是降低远期脑出血风险和减少各种血管疾病事件的安全有效方法[581]。因此,测量和识别脑出血后未控制的高血压并积极管理血压以防止脑出血复发显得至关重要。
1.在一项包含1145名原发性脑出血患者且中位随访时间为36.8个月的大型前瞻性队列研究中,血压控制不佳与脑叶出血(HR,3.53 [95% CI,1.65-7 .54])和非脑叶(HR,4.23 [95% CI,1.02-17 .52])脑出血复发风险增加相关[563]。在PROGRESS(培哚普利保护复发性卒中研究)中,使用培哚普利和吲哒帕胺治疗后,脑出血患者的平均血压降低了10.8/4.4毫米汞柱,主要血管事件的相对风险降低了42%(95%CI,14-60),5年内为预防脑出血复发所需治疗的患者数量为18581。脑出血后降压的最佳时机尚不清楚,在急性期开始降压治疗的决定应符合第5.1节“急性降压”中讨论的建议。
2.在PROFESS试验(有效避免二次卒中的预防方案)中,收缩压≥160mmHg的患者在随访期间脑出血的风险高于收缩压为130~139mmHg的患者(HR,2.07[95%CI,1.22-3.51]),而收缩压<130mmHg的患者发生脑出血的风险没有明显下降的趋势。同样地,舒张压≥100mHg的患者与舒张压80-89mmHg的患者相比,其脑出血风险增高(HR,2.58[95%CI,1.50-4.45])[582]。在一项对1145例原发性脑出血患者进行的大型前瞻性队列研究中,收缩压<120mmHg和舒张压≥80mmHg的患者脑出血复发的风险显著高于收缩压<120mmHg和舒张压<80mmHg的患者[581,584]。收缩压和脑出血复发之间的关系是连续性的,复发性脑叶和非脑叶脑出血的HR分别为1.33和1.54(收缩压每增加10mmHg)。尽管二者之间的连续关系允许血压目标具有一定的灵活性,但脑出血证据支持2017年高血压临床实践指南中推荐的≤130/80mmHg[585]。
- 预防脑出血复发的理想目标血压尚不清楚。需要更多的研究来确定更积极地将收缩压控制≤120mmHg是否有益。
- 启动血压控制治疗的时间和实现控制的最佳药物类别尚不确定。此外,新出现的研究表明,家庭血压测量可能是一种更准确的控制措施。治疗的时机、降压药物的最佳选择以及门诊血压监测的最佳方法需要进一步研究。
- 重要的是要确定个人、系统和社会层面上阻碍血压控制的主要因素,并制定克服这些障碍的策略。
9.1.3.抗血栓药物的使用
抗血栓治疗是缺血性心脑血管疾病或有血栓栓塞事件史的患者的主要治疗方法。鉴于缺乏针对特定患者群体的前瞻性RCT,一旦这些患者发生脑出血,有关使用抗血栓药物的临床决策仍然具有挑战性。在已发表的复发事件率文献的背景下,个体患者的决定仍然基于对抗血栓治疗的风险和益处的评估。此外,关于恢复抗血栓治疗的最佳时机的文献仍然很少。在第9.1.1节“远期脑出血风险的预测”中给出了对复发性脑出血风险因素的进一步讨论,这些风险可能有助于临床医生选择患者的个体化治疗方案。
1.在脑出血合并左心辅助装置或机械瓣膜的患者中,恢复抗凝治疗时血栓相关风险与出血复发风险的平衡是存在极大挑战性的。关于装置血栓形成与出血恶化之间风险与时机的数据很少,且部分仍处于研究阶段。一项研究发现,在左心辅助装置患者中,与单独恢复抗血小板治疗相比,在脑出血后中位数14天时恢复华法林抗凝治疗,致死性和非致死性血栓事件发生均较少,且脑出血复发率无显著差异[586]。在一项对22名伴有脑出血的左心辅助装置患者的观察性研究中,在停止抗凝治疗长达13天后,没有人出现左心辅助装置血栓形成的证据[182]。既往有1项研究报道,在机械瓣膜患者中尽管在第14天前恢复抗凝治疗的并发症显著增加,但综合出血和血栓风险考虑,机械瓣膜患者最早可以在脑出血后的第6天开始考虑抗凝[587]。因此,对于左心辅助装置或机械瓣患者,重新开始抗凝的决定是合理和安全的(例如,对于左心辅助装置患者在脑出血后14天,对于机械瓣膜和相对较小脑出血的患者可能更早),但需要对风险进行个体化评估。2.考虑到对脑出血复发风险的担忧,对有缺血性血管事件病史且曾发生脑出血的患者继续进行抗血小板治疗的决定具有挑战性。一个开放标签的RCT研究解决了这个问题[589],537例患者中,在脑出血发病后中位数76天随机分组,随访时间中位数为2年,该研究表明抗血小板药物治疗没有增加脑出血的风险,并且降低了非致死性心肌梗死、非致死性卒中(包括脑出血和缺血性卒中)和血管原因导致的死亡的复合终点。在长达7年的随访中,研究发现抗血小板治疗对复发的脑出血或所有其他主要血管事件的影响没有统计学意义[603]。这些结果与一项1916例脑出血患者的大型荟萃分析一致,该分析报告称,随着抗血小板治疗的恢复,脑出血复发的风险没有显着增加,血栓栓塞症和缺血事件的风险降低[588]。重要的注意事项包括缺乏关于脑出血位置或原因风险差异的数据,以及基于临床医生风险评估的患者登记中的选择偏差。临床医生需要评估患者复发脑出血的风险和抗血小板治疗的益处,根据现有的数据在适当的患者中恢复抗血小板治疗是合理的,但恢复抗血小板治疗的最佳时机尚未系统研究。3.许多回顾性分析试图探讨抗凝治疗对合并非瓣膜性房颤的脑出血患者的风险和益处[179,590,591,593-595,604]。这些研究因设计而异,包括登记、回顾和前瞻性队列;具有不同的纳入和排除标准以及开始抗凝的时间;一般研究维生素K拮抗剂治疗;以及包括一些研究中的队列重复。这些局限性包括抗凝和非抗凝个体之间的系统性差异,这些差异可归因于临床医生感知的风险效益曲线对治疗选择的干扰。已发表的文献表明,使用抗凝可减少缺血事件的复发和死亡率。通过风险和收益的评估,可以考虑在选定的患者中进行抗凝治疗,并应优先登记正在进行的前瞻性随机对照试验,以解决这一临床难题。在卒中预防试验和实践中,与维生素K拮抗剂相比,直接口服抗凝剂合并脑出血的风险较低,如果有脑出血病史的患者有抗凝治疗指征,则直接口服抗凝剂方案可能更受青睐。
4.对于房颤和脑出血患者,恢复或开始抗凝治疗的时机仍然存在争议。一项研究表明,在脑出血后7-8周时开始抗凝,卒中风险降低且出血风险最小化[597]。在4-8周之前,出血风险明显增加[596,597]。这些研究表明,开始抗凝的最佳时间是脑出血后约8周。然而,这些研究受到适应症以及临床医生和患者偏好的限制。因此,应根据具体情况对血栓栓塞、复发性脑出血和晚期脑出血扩大进行风险评估。
5.对于有长期口服抗凝药禁忌症的房颤和脑出血患者,左心耳封堵是一种替代方法。PROTECT-AF试验(WATCHMAN左心耳系统对心房颤动患者的栓塞保护)和PREVAIL试验(WATCHMAN左心耳 [LAA] 闭合装置在心房颤动患者中与长期华法林治疗的比较)报告了随机接受左心耳封堵术或华法林治疗的患者的结果[598,599]。与华法林相比,左心耳关闭的缺血性卒中的发生率并不低,但出血性卒中和出血的发生率更低,两个治疗组的主要卒中终点、全身血栓和心血管死亡相似[598,599]。在有脑出血和房颤病史的患者中,一个小型、非随机、回顾性队列的数据显示,与标准药物治疗相比,左心耳封堵术降低了心血管事件死亡率、全因死亡率、出血性卒中风险和大出血事件[601]。其他一些小型回顾研究报告称,在确诊为脑血管淀粉样病变的患者中,在左心耳关闭后30天内,没有脑出血且没有缺血性中风或脑出血的患者的相关事件发生率很低[602]。由于患者选择的潜在偏倚、报告的患者数量有限、左心耳闭合的时间间隔、抗血小板或抗凝剂的类型以及封堵前后治疗持续时间缺乏标准化,这些结论在个体脑出血患者中的是否适用仍不清楚。
- 除了房颤和脑出血患者抗凝治疗风险和益处的不确定性外,对于将重新开始抗凝治疗的患者,个体化选择恢复抗凝治疗的最佳时机的证据有限。基于脑出血位置、机制和复发风险因素进行分层的正在进行的试验和未来研究可能会提供更多的有效信息以供决策。
- 大多数评估适当抗血栓治疗对脑出血患者作用的分析都集中在复发事件上。除了临床事件之外,未来的研究还包括残疾或生活质量等结果,可能会提供更以患者为中心的信息。还需要对恢复抗血小板治疗的时间以及不同适应症和性别、种族和民族群体的不同药物之间的益处和风险差异进行更多研究。
- 缺乏关于脑出血患者左心耳封堵术的安全性和有效性的前瞻性数据,尤其是在脑出血后6个月内进行封堵术。这一点很重要,因为大多数考虑进行装置植入的患者都在根据未经治疗的房颤血栓栓塞风险进行时间敏感的风险-收益分析。未来的研究可能需要探索植入前后抗血小板治疗或抗凝治疗的更早时机及更好的标准化治疗方案和治疗持续时间。未来左心耳封堵设备类型的变化可能会影响患者的预后。
9.1.4.其他药物的使用

包括选择性5-羟色胺再摄取抑制剂、他汀类药物和非甾体抗炎药在内的几类药物,有可能增加脑出血复发的风险,从而增加了服用这些药物且发生脑出血的患者的药物管理临床困境。在SPARCL试验(通过积极降低胆固醇水平预防卒中)中,脑出血患者的他汀类药物治疗与脑出血复发风险增加有关[606,612]。然而,在其他观察性、非随机研究的高胆固醇血症患者中并未发现这种关联,且风险可能取决于患者本身存在的脑出血复发风险和使用的他汀类药物类型[607,609,613-618]。对于这两类药物,必须权衡个体患者的适应症和风险收益概况。使用非甾体抗炎药会增加出血风险[610,611];因此,脑出血患者应尽可能避免定期长期使用(选择性5-羟色胺再摄取抑制剂的使用在第8.2节中讨论)。
1.在脑出血患者中,他汀类药物的使用与急性预后和减少复发血管事件之间的关系尚不确定。SPARC的研究发现,在设定的极低密度脂蛋白水平时,使用大剂量阿托伐他汀会增加脑出血的风险[612]。事后分析确定以脑出血作为卒中亚型进入试验,表明随后发生脑出血的风险最高,但未发现脑出血与最近的脑出血前低密度脂蛋白值之间存在关联[606]。其他非随机观察性研究未发现脑出血患者使用他汀类药物的相关性[607,609,613,616,618]。这种风险可能是通过脑出血复发的遗传风险、血脂水平和脑出血部位之间的复杂交互作用所介导的[614,617]。此外,与亲水性他汀类药物相比,亲脂性他汀类药物可能与更高的脑出血发生率相关[615]。另一些回顾分析表明,使用他汀类药物可改善脑出血后的预后[605,619,620],并且使用他汀类药物可降低短期和长期死亡率[608,618,621-627]。然而,在这些非随机化研究中,由于选择偏差和适应症混淆,对结果的解释应该谨慎。鉴于这种不确定性,在脑出血患者中是否使用他汀类药物取决于对缺血性心脑血管事件与复发脑出血的风险评估。鼓励参与正在进行的可解决这个问题的随机临床试验。到目前为止,降低血脂的PCSK9i(前蛋白转化酶枯草杆菌蛋白酶/kexin 9型抑制剂)的临床试验尚未表明首次脑出血的风险增加,但未调查既往脑出血患者的复发风险[628-630]。
2.非甾体抗炎药的使用与出血风险增加有关。在普通人群中,脑出血的总体发生率很低,但一项对观察性研究的大型荟萃分析发现,双氯芬酸和美洛昔康的使用增加了出血性中风的风险[611]。随后的一项大型荟萃分析发现,使用任何非甾体类抗炎药都会增加脑出血的风险[610]。一项针对短期结局的脑出血患者的小型研究发现,使用非甾体类抗炎药与复发性脑出血无关,但随访仅限于90天[631]。考虑到使用非甾体类抗炎药会增加出血的风险,脑出血患者比普通人群有更高的脑出血复发风险,而且在大多数情况下存在非类固醇抗炎药的更安全的替代品,如对乙酰氨基酚。尽管缺乏随机数据和来自脑出血患者的数据,不建议在脑出血后规律(例如每天)使用非类固醇抗炎药。
- 他汀类药物对脑出血患者远期发生的缺血和出血事件的影响尚不确定,他汀类药物对脑出血后短期预后的影响也不确定。需要进一步研究以确定哪些患者可能从短期和长期使用他汀类药物中受益,或从替代降脂剂如依折麦布或PCSK9i中受益。
- 进一步研究可进一步细化复发风险的放射学和生物标志物,例如脑小血管疾病的MRI标志物、遗传风险、血压和药物相互作用,将有助于对需要使用这些药物的患者进行风险分层。
- 有越来越多但仍不确定的证据表明,抗血栓药物以外的一些常用药物可能会增加脑出血的风险。
9.1.5.生活方式调整以及患者和护理人员教育
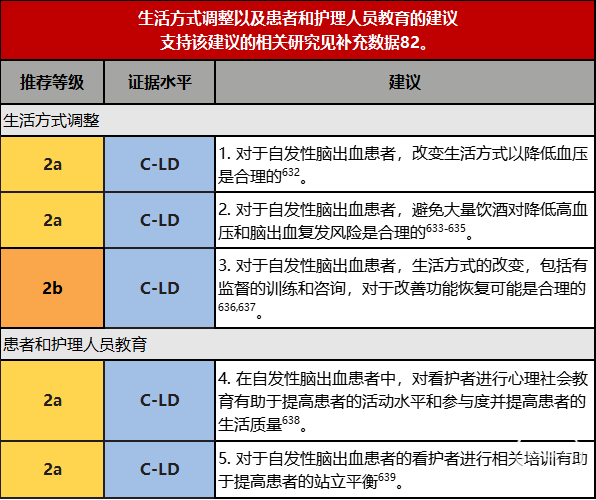
生活方式的改变不仅是一级预防的一部分,也是二级预防的一部分,这是中风后管理的重要自我保健组成部分。这包括增加身体活动、戒烟、减少饮酒和健康饮食,对整体健康有益[632,637]。这些建议对许多与个人生活方式相关的所谓非传染性疾病有益。急性住院和康复期结束后,家属往往在脑出血患者回家后承担起看护者的角色。为了优化康复,看护者需要参与其中并且需要具备相关专业知识。因此,有必要向看护者提供有关疾病的信息,并且让他们清楚应该做什么和应该抱有怎样的期待。看护者的需要帮助患者活动和日常生活,或与患者一起进行锻炼。这就需要对看护者进行相关培训,使他们熟悉辅助设施的使用方式及相关知识。
1.多模式二级卒中预防有积极作用。二级预防包括增加体力活动、戒烟戒毒、减少饮酒和健康饮食[632,640]。健康的饮食包括增加富含长链omega-3脂肪酸的鱼类、蔬菜和水果以及全谷物产品的摄入,以及降低红肉、盐和糖的摄入水平,并用多不饱和脂肪或单不饱和脂肪取代饱和脂肪[641]。一项meta分析显示,较低的血压对短暂性脑缺血发作和卒中的患者有积极的影响,并且血脂与拟人化测量有正向相关趋势[632]。但是许多研究规模小且质量参差不齐,且没有一项是针对脑出血患者的研究。
2.大量饮酒会导致血压间歇性升高,这在有脑出血病史的人中尤其不健康[633,634]。对于大量饮酒的人来说,饮酒量减半对血压的影响最大[635]。在既往的观察性研究中,尽管难以排除其他生活因素的影响,酒精摄入与脑出血风险相关[633,93]。3.生活方式的改变,特别是增加体力活动,可能有降低血压的效果[637,640]。虽然其作用机制尚未完全明确,但有监督的训练和咨询似乎对增加体力活动有着重要影响。增加体力活动,如减少坐着的时间和每天散步均会产生影响,尤其是从久坐状态到特定的活动水平。这些活动对许多中风患者是可行的[636]。
4.在卒中患者中,对看护者进行社会心理教育有利于提高患者的活动水平和参与度并提高患者的生活质量[642]。心理社会干预不仅减少了中风后患者的抑郁症状,也减少了他们的看护人员的抑郁症状,并可减少焦虑,改善生活质量和应对能力[638,635]。这种类型的干预看护者们可以接受,并可以以小组的形式一对一地进行[643]。与康复中的常见情况一样,时间问题需要根据个人需求进行调整。支持使用对一般卒中患者而不是专门针对脑出血患者研究的社会心理学数据。
5.对看护者的实践训练(如怎样与患者一起安全行走)和培训(如怎样行某些锻炼)是合理的,这可以使在家进行一些康复锻炼成为可能。尽管不如与专业人员一起锻炼有效,但可以改善患者的站立平衡[639]。与常规康复治疗相比,这是否具有成本效益尚不清楚,但护理人员的负担似乎没有增加。护理人员主导的日常锻炼很有希望成为一种治疗形式,可以添加到日常护理中[639]。然而,有几个因素限制了对这些研究的解释。这些数据来自于对一般卒中患者的研究,而不是针对脑出血患者的研究,与站立平衡的正相关关系来自次要结果分析,而非主要结果分析。
- 生活方式的改变有积极的影响。然而,目前尚不清楚如何针对改变生活方式制定可以使正向影响持续的策略。目前假设个体户定制的干预措施优于标准化的干预措施,但还需要进一步的研究。改变生活方式中哪一组成部分影响最大以及门诊随访的最佳频率与随访内容也缺乏进一步认识。
- 患者和护理者教育已被证明是有积极作用的;然而,目前还不清楚如何实现这一点。
- 患者以及护理人员教育中另一个尚未被研究的部分是如何使用更为先进的指标来决定在脑出血复发或发生其他重大事件情况下的首要选择。

概要
神经影像学检查不作为初次原发性脑出血风险分层的一部分进行常规检查。然而,MRI偶尔可用于某些个体,并可能揭示可能与远期脑出血风险相关的标志。来自广泛人群的关于神经影像标志和首次自发性脑出血风险的数据很少。尽管临床医生在制定进一步的预防性治疗(如抗血栓治疗或血压管理)时可能会考虑这些数据(参见2017年高血压临床实践指南)[585],但指导具体实践的数据有限。重要的是,原发性脑出血的绝对风险比继发性(复发性)脑出血的风险低许多数量级,即使在具有这些标志的个体中,也低于原发性缺血性卒中的风险[644]。
针对指南中推荐意见的具体支持文献
在以白种人为主的欧洲健康人群中进行的一项基于人群的研究表明,脑微出血和出血的脑叶位置与远期脑出血风险增加有关[644]。在选定的医院人群中的观察数据也表明脑微出血或皮质表面铁质沉着症与相关风险增加相关。在一项对诊断为疑似脑淀粉样血管病的患者进行的单中心回顾性分析中,这些患者因脑出血以外的临床症状(如认知症状或短暂的局灶性神经发作)而接受了MRI检查,皮质浅表铁质沉着症(检测为皮质表面的曲线状低密度,与血管不同)的存在和进展预示着远期的症状性脑出血[564,645]。在对既往有短暂性脑缺血发作或中风的患者进行的多中心荟萃分析中,发现脑微出血与脑出血风险增加有关,并且可以纳入预测脑出血的风险评分。在一项针对既往缺血性卒中合并房颤的患者接受抗凝治疗的多中心观察性研究中,脑微出血的存在增加了脑出血的风险[25]。关于抗血栓药物的暴露,一些病例对照分析表明,有脑微出血的患者在接受华法林治疗时更有可能发生脑出血[646,647]。综上所述,目前的证据表明,脑微出血特别是出血在脑叶部位,以及多灶性和播散性皮质浅表铁质沉着症可能预示远期脑出血风险的增加。
未来研究方向
使用神经影像学和其他标志物进行基于人群的风险评估需要进一步研究和验证。
需要进一步研究以了解心血管疾病预防策略(例如,抗血栓使用或血压目标)与脑出血高危神经影像学标志之间的相互作用。
不同的人群应包括具有不同种族和民族背景、遗传特征和既往合并症的人群。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。


















