近期,美国华盛顿大学医学院的David H. Gutmann等在NF1患者中筛选得NF1错义突变,随后采用人诱导多能干细胞和NF1小鼠模型,通过脊髓解剖、视神经测定和神经元钙成像等方法,研究神经元活动对肿瘤发生发展的机制,结果发表于2022年5月的《Nature Communications》在线。
——摘自文章章节
【Ref: Anastasaki C, et al. Nat Commun. 2022 May 19;13(1):2785. doi: 10.1038/s41467-022-30466-6.】
神经元兴奋性(Neuronal activity)是中枢神经系统(CNS)和外周神经系统(PNS)肿瘤发生的重要驱动因素之一。神经纤维瘤病1型(Neurofibromatosis-1,NF1)患者在NF1抑癌基因中具有种系突变,多种实体肿瘤易患性增高,其中包括中枢和周围神经系统肿瘤。然而,神经元兴奋性参与神经系统肿瘤发生发展的机制尚不明确。近期,美国华盛顿大学医学院的David H. Gutmann等在NF1患者中筛选得NF1错义突变(c.5425C >;T p. Arg1809Cys),随后采用人诱导多能干细胞(hiPSC)和NF1小鼠模型,通过脊髓解剖、视神经测定和神经元钙成像等方法,研究神经元活动对肿瘤发生发展的机制,结果发表于2022年5月的《Nature Communications》在线。
研究发现,在CNS中,与不发生视神经胶质瘤(OPG)的NF1错义突变小鼠和野生型(WT)小鼠相比,NF1突变小鼠均患有OPG,而且表现出更高的Ki67、小胶质细胞含量、T细胞含量和GFAP免疫反应性。进一步分析其作用机制发现,一方面,NF1突变以及光刺激显著增加了视网膜神经节细胞(RGC)的兴奋性,进而提高s-Nlgn3/Nlgn3水平,促进OPG的发生;另一方面,NF1突变激活RGC进而抑制超极化激活环核苷酸门控通道(HCN),靶向midkine/T细胞/Ccl4/小胶质细胞/Ccl5轴,参与OPG进展。此外,作者还验证河豚毒素(TTX)对神经元活性的抑制、HCN通道的特异性及其活性受拉莫三嗪调节等关键步骤(图1-3)。
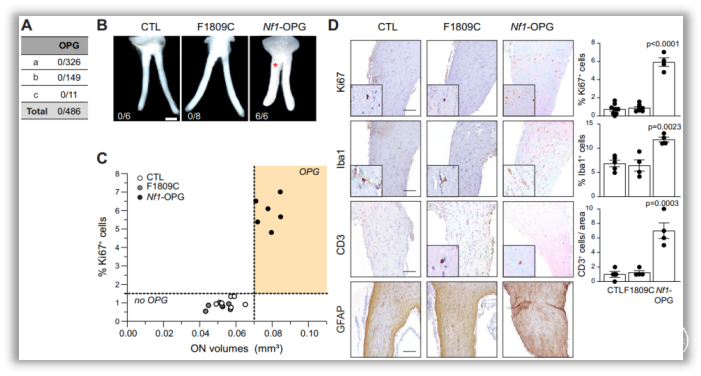
图1. NF1错义突变小鼠在体细胞NF1失活后不发生视神经胶质瘤。
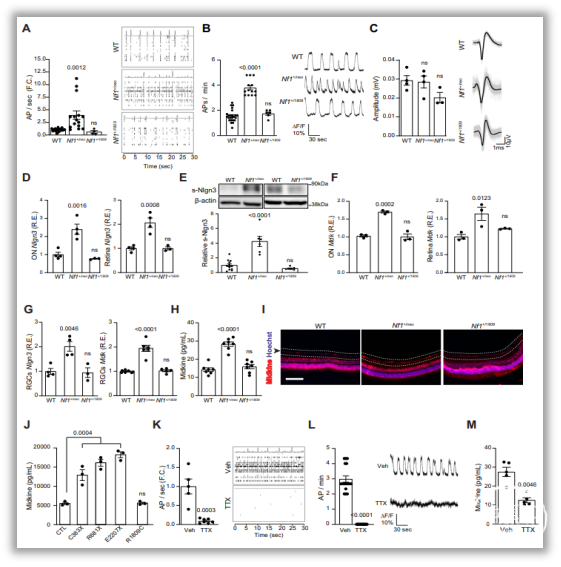
图2. OPG相关的NF1突变增加神经元活性并产生OPG促进因子。
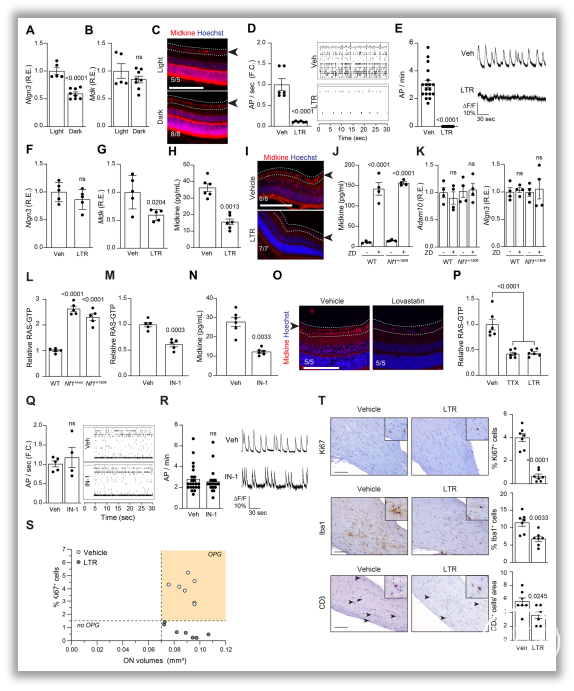
图3. 与OPG相关的NF1突变神经元兴奋性依赖于HCN通道。
在外周神经系统中,与伴有丛状神经纤维瘤(pNF)的NF1突变小鼠和WT小鼠相比,NF1错义突变小鼠均未患pNF,而且感觉神经元和背根神经节细胞(DRGs)中包含的细胞总数和SOX10+的前体施旺细胞更少。NF1突变抑制HCN通道激活感觉神经元释放COL1A2,从而促进NF1-/-施旺细胞增殖和pNF进展(图4-6)。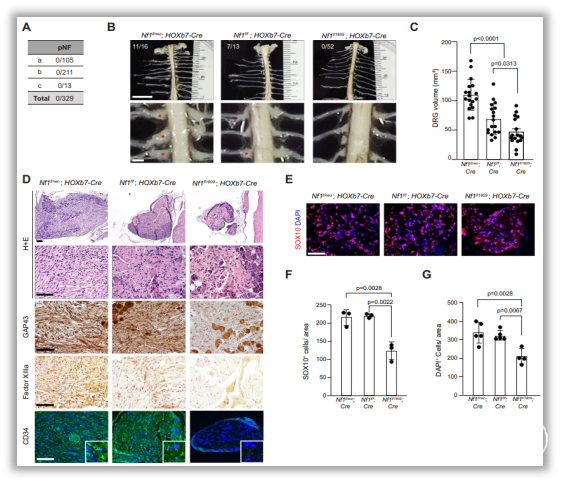
图4. NF1错义突变小鼠在体细胞NF1失活后不发生丛状神经纤维瘤。
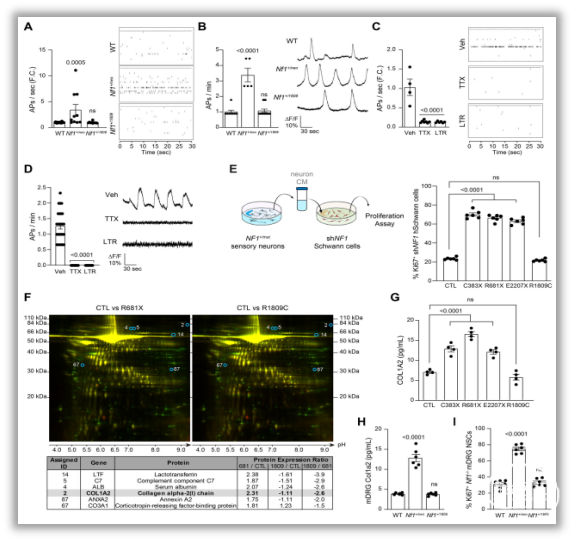
图5. pNF相关的NF1突变神经元活性增加并促进COL1A2依赖性NF1-/-施旺细胞生长。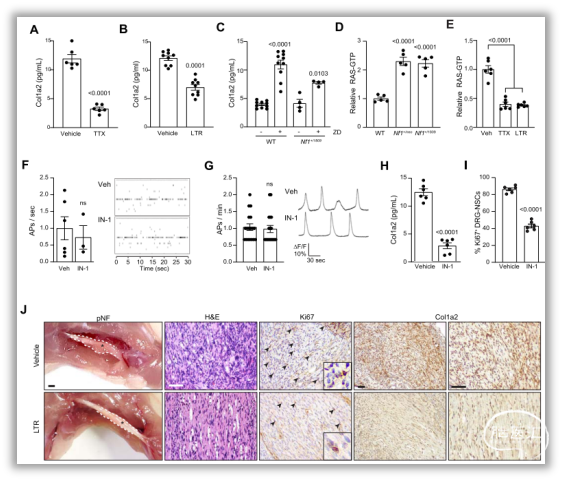
图6. 感觉神经元靶向HCN通道调节COL1A2的分泌。
综上所述,该研究结果明确CNS和PNS的神经元依赖性肿瘤发生的相关机制:神经元兴奋性增高能够靶向特定的门控通道、引起相关的级联反应、受特异调节剂调控,从而促进小鼠OPG和pNF的发生发展,为治疗NF1相关的神经系统肿瘤提供理论基础,也为肿瘤发生发展机制研究、肿瘤靶向治疗、老药新用等方面提供新思路。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。












