美国德克萨斯大学西南医学中心神经外科的William H. Hicks等通过文献复习撰写介绍胶质瘤大型动物模型的研究现状的综述。文章发表于2021年11月《Anticancer Research》杂志。
——摘自文章章节
【Ref: Hicks WH, et al. Anticancer Res. 2021 Nov;41(11):5343-5353. doi: 10.21873/anticanres.15347.】
脑胶质瘤临床试验成本高、持续时间长,但成功率低。大型动物模型可以弥补基础研究与临床试验之间的转化差距。大型动物的解剖和生理与人类较相似,可用于胶质瘤手术和辅助治疗等试验。美国德克萨斯大学西南医学中心神经外科的William H. Hicks等通过文献复习撰写介绍胶质瘤大型动物模型的研究现状的综述。文章发表于2021年11月《Anticancer Research》杂志。
小鼠一直是癌症建模的主要生物,但有一定的局限性。大型动物模型克服在啮齿类动物中模拟人类疾病的许多解剖学和生理学局限性,虽然大型动物模型并不能取代啮齿类动物研究,但它们可以作为治疗开发的过渡步骤,可更好地复制人体生理,从而提高临床试验的成功率(图1)。
图1. 胶质瘤啮齿类动物模型、大型动物模型与人类胶质瘤临床试验转化研究的工作流程
人和小鼠之间存在明显的解剖和生理差异,其中最明显的是体型;人的体型比小鼠大3000倍;人脑的重量大100倍以上,表面积和神经元数量大1000倍以上。视神经胶质瘤小鼠模型的研究揭示,视神经小于一粒大米,从而限制成像和手术技术的使用。而且小鼠大脑缺乏脑回,缺乏人类和其它大型动物的皮质发育特征。也缺失某些神经网络,因此,造成癫痫发作或认知功能障碍的建模困难。人类的寿命是小鼠的30-50倍,要经历105次以上的细胞分裂,因此相对于小鼠,肿瘤转化的风险增加。小鼠寿命进一步限制与杂合性缺失突变相关的癌症或外显率高的癌症的发生。小鼠的代谢率显著高于人类,对药效学和药代动力学研究提出挑战。在人类中,血脑屏障(BBB)是药物递送至中枢神经系统的主要障碍。人和小鼠之间新皮质星形胶质细胞比例增加、周细胞异质性和血管解剖结构差异对临床前建模造成额外的困难。胶质瘤小鼠模型的建立在很大程度上是通过化学诱导、自体移植、人脑胶质瘤异种移植和基因工程模型等完成。对动物癌症模型的要求很高。大型动物癌症模型具有显著的解剖学、生理学和遗传学优势。猪是用于做胶质瘤模型数量最多、用途最广的大动物。猪脑具有脑回,能反映人脑皮质、皮质结构内的肿瘤浸润、药物递送和药物扩散(图2)。猪脑大小在大脑高分辨率成像中具有显著优势。猪的繁殖能力也相对较强,每年有20只后代。此外,猪比犬或非灵长类动物在伦理方面的问题更少。非人灵长类动物(NHP)胶质母细胞瘤可自发形成,在无外源性操作因素的情况下可提供研究胶质瘤的独特材质。NHP模型在系统发育上更接近人类,在脑解剖和胶质瘤发生的分子驱动因素方面有高度的相似性。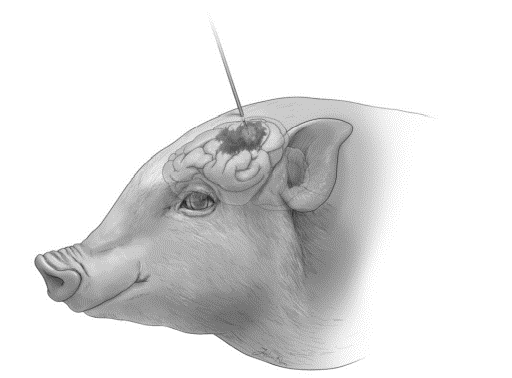
图2. 猪脑解剖结构与人脑具有更大的相似性,可施行先进的治疗方法,如手术及对流增强输送等手段
长期以来,家养或农业猪品种多、价格低廉,已广泛应用于人类疾病的建模。2012年的研究完成家猪Sus scrofa的基因组测序,从而扩大其在生物医学和癌症研究中的适用性;猪与人类基因组的比较分析,揭示表观遗传调控和基因转录谱具相似性,目前已成功开发亨廷顿病、黑色素瘤、1型神经纤维瘤病、肝细胞癌和腺瘤性息肉病的猪模型。迄今也有几种可用的胶质瘤研究的猪模型,但尚无猪自发性胶质瘤形成的证据。
Selek等采用3月龄白猪,首次开发胶质瘤大型动物模型。对21只动物脑内种植U87或胶质瘤干细胞,并口服环孢素达到免疫抑制。15只猪中,14只30天内出现胶质瘤肿瘤和神经系统症状,MRI成像上展示T1等信号、T2高信号病灶。Khoshnevis等通过U87细胞在尤卡坦小型猪脑内成功形成胶质母细胞瘤。两个实验室的猪胶质瘤形成表明,未来胶质瘤异种移植可复制。Tora等通过慢病毒诱导高级别脊髓胶质瘤的形成,开发第一个基因工程猪胶质瘤模型。给Göttingen小型猪注射表达血小板源性生长因子PDGF-β、活性HRAS和shRNA-p53的慢病毒载体,成功诱导脊髓肿瘤,MRI和组织病理学证实为高级别胶质瘤。基因工程模型的一个关键优势是使用免疫活性生物体,供肿瘤免疫研究。
自20世纪60年代以来,犬模型用于癌症研究。犬可自发产生许多癌症,包括骨肉瘤、淋巴瘤、黑色素瘤和胶质瘤。胶质瘤是犬最常见的原发性恶性脑肿瘤,短头品种犬的胶质瘤形成的遗传倾向较高;犬胶质母细胞瘤与人的相似(图3)。Amin等对犬和人脑胶质瘤进行基因组谱比较,发现犬胶质瘤与人类儿童胶质瘤驱动突变、突变时间和表观遗传模式等相似。患有胶质瘤的犬未经治疗的生存期为1-2个月,手术切除和辅助治疗能提高生存期。Dickinson等采用9只自发性胶质瘤(2级或3级)犬评价伊立替康脂质体和钆显像剂增强给药的疗效,结果经MRI检测显示88%肿瘤体积减小。自发性犬脑肿瘤的主要特点是为自然生长的肿瘤,同时表现异质性。而远交犬可复制人类的遗传多样性,近交犬缺乏遗传多样性。
但目前可应用于研究的犬模型样本量少,美国每年仅有12000只犬发生可检测脑肿瘤,而且兽医神经科医生往往会早期施行人道处死。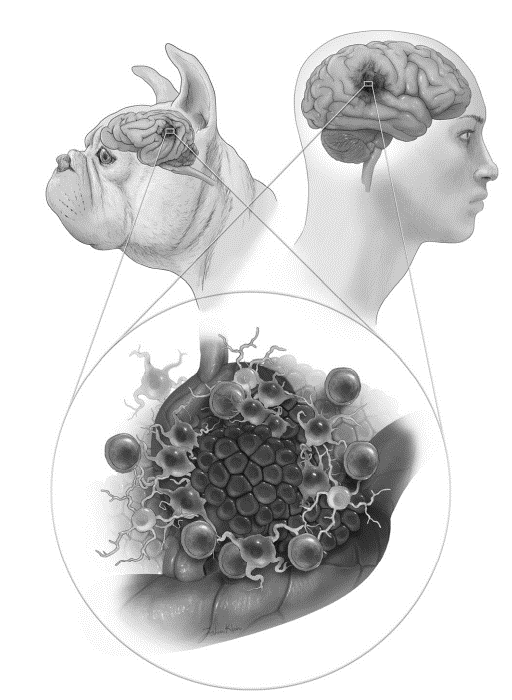
图3. 新生犬和人胶质瘤之间病理和免疫微环境的相似性提供免疫学研究的可能。
NHP是研究人类疾病的最具吸引力的模型,NHP生理学、解剖学和遗传学上与人类最相似,基因组之间存在接近1:1的同源性。Lonser等发现分次全脑放疗(2周内3500cGy)后,大多数猕猴(恒河猴)在2.9~8.3年间发生胶质母细胞瘤;该模型有助于研究化疗药物的药代动力学和药效学。肿瘤发生的潜伏期很长,与人类相似。
此外,在树鼩(tupaia belangeri,一种野生动物)中通过慢病毒介导表达H-Ras和沉默TP53可诱导胶质母细胞瘤,其特征为间充质亚型胶质母细胞瘤。慢病毒注射后1个月,胶质母细胞瘤诱导成功率为100%。虽树鼩系统发育分类存在争议,因此建立NHP胶质瘤模型有伦理方面的争议,致使美国和欧盟建立的胶质瘤NHP模型减少。随着基因组编辑技术的进步和推广,人们对胶质母细胞瘤NHP模型的兴趣可能再次上升。
通过文献综述表明,由于胶质瘤有效治疗方法仍然非常缺乏,因此临床前动物模型越来越得到重视。猪已成为开发胶质瘤的大型动物模型理想动物,犬可形成自发性胶质母细胞瘤。NHP模型在基因型和表型上与人类相似,但受到伦理的限制。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。









