万丁源
四川大学华西临床医学院

摘要
轻型创伤性脑损伤(mTBI)是TBI中最为常见的一种类型(80%-90%),其特征包括意识丧失(LOC)<30min,创伤后失忆(PTA)<24h以及格拉斯哥昏迷评分(GCS)13-15。鉴于mTBI在神经影像学上无明显变化,想要准确诊断这一疾病并非易事,而这又恰恰万分重要,因为mTBI可能导致部分患者出现脑震荡后综合征(PCS)、认知功能(如注意力、记忆力)以及信息处理速度损伤。学界已试图通过多种方法提高mTBI的诊断与严重程度分级的准确性。本综述聚焦于各类生物标志物在诊断mTBI中的重要作用,内容共包括5个版块:1)外周与中枢神经系统(CNS)的蛋白标志物;2)基因生物标志物;3)影像生物标志物;4)神经生理标志物;以及5)mTBI相关的基础研究与临床试验。
关键词:生物标志物、遗传学、轻型创伤性脑损伤、神经影像学、神经生理学、蛋白质组学
TBI是一种由交通事故、神经损伤、运动冲撞等所造成的外界暴力所导致的急性脑部损伤。全球范围内每年TBI新发病例数可达 69,000,000。2014年,全美境内报道了约2,870,000例TBI,其中837,000是儿童患者。TBI可依照临床表现以及GCS评分被分为三类:轻型、中型以及重型,其中,轻型患者最为常见,并且在文献中常被描述为“脑震荡”。mTBI被定义为影响正常功能和脑部生理,并伴有1)LOC<30min,2=PTA<24h以及3=13≤GCS≤15的脑部创伤。mTBI患者占所有TBI患者中的80-90%,这即意味着全人群中有近10-25%的人要遭受mTBI,具体的计算数值随着不同研究变化而变化。mTBI的症状可包括头痛、颈痛、恶心、头晕、呕吐以及失忆;这些症状可能与脑损伤有关并需要进一步检查。大多数mTBI患者CT平扫上无可见的损伤,症状最多持续3个月;少部分患者CT上可见损伤并且合并了其他健康问题;5-10%的mTBI患者会进展为PCS,并且将表现出生理、认知以及行为上的症状,这些症状可持续数月、数年甚至伴随一生。在更为严重的mTBI患者大脑中可检出诸如炎症、细胞损伤以及细胞应激等变化,这些改变可能导致进一步脑损伤。影像学研究显示PCS可在白质与灰质中造成可见损伤以及代谢改变。儿童与青少年患有mTBI后更可能进展为PCS。不同研究间的mTBI诊断标准可能略有不同,但主要都基于以下各类检查:GCS评分、LOC、PTA、如CT、MRI、SPECT、PET的影像学检查,磁共振波谱分析(MRS)能提供非常有用的分析。考虑到mTBI不仅是PCS、认知功能(如注意力、记忆力)以及信息处理速度损伤的危险因素,同时其与诸如慢性损伤性脑病、痴呆、帕金森病以及肌萎缩性侧索硬化症的关系尚不明朗,准确地诊断mTBI已成为健康社区的主要关注点。图1显示了不同严重分级TBI的症状以及每一分级所占的比例:轻型患者(13≤GCS≤15)80%,中型患者(9≤GCS≤12)10%,重型患者(GCS≤8)10%。图1还总结了对应每一TBI分级的诊断(病史、评分、影像学表现)、预后(生物标志物)以及治疗(静养、药物、靶向途径)。恰当的诊断以及有效的治疗方式仍是一个挑战。中到重型患者的特征包括:口齿不清、严重混淆、癫痫、持续性头痛以及间断性昏迷。
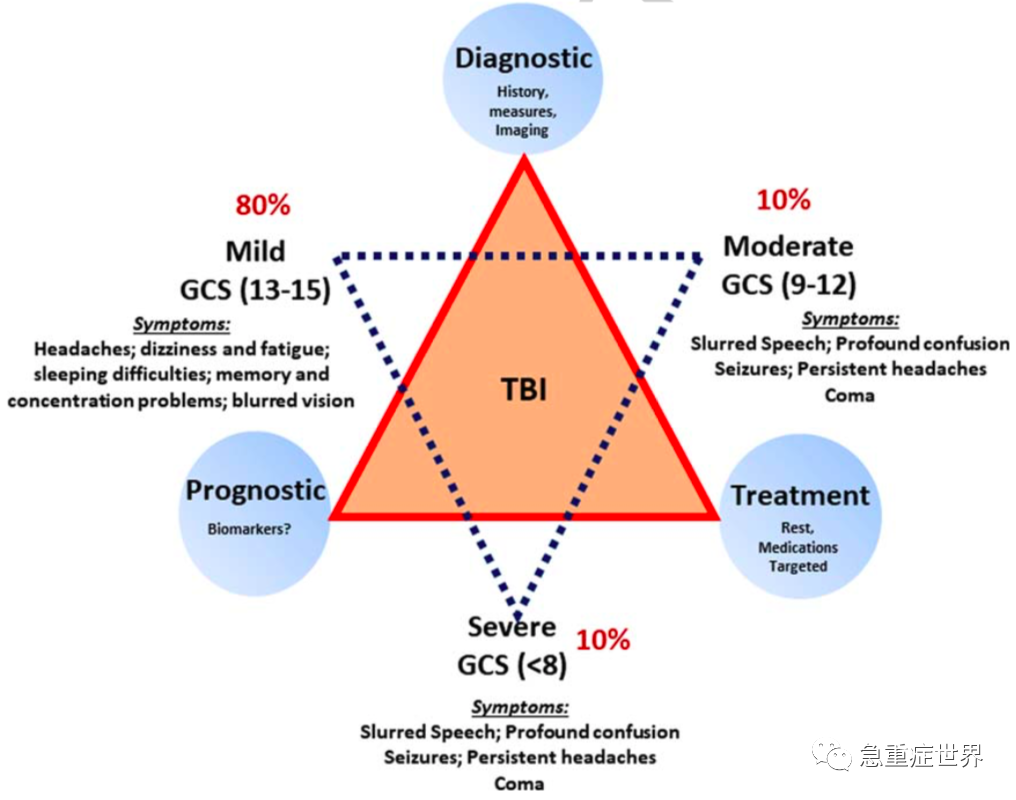
图1. 根据症状进行TBI分类——轻度(80%),格拉斯哥量表评分(GCS)在13-15之间;中等(10%)GCS评分9-12分;重度(10%)GCS<8。根据TBI的阶段列出轻度到重度的症状;根据TBI的阶段对治疗(休息、药物、可能的靶向治疗)进行诊断(病史、测量、影像学)和预后(生物标志物)。
轻、中、重型患者的分类依据包括:1)影像学:轻型基本正常,中、重型可有明显变化;2)LOC:轻型<30min,中型≥30min,但≤24h,重型>24h;3=GCS:轻型13-15;中型9-12;重型3-8(参见表1)。已有文献指出,利用生物标志物(如血清、血浆、脑脊液(CSF)、毛囊、唾液、尿液中所含蛋白质、miRNA、以及脂质)来诊断mTBI颇具前景。值得一提的是,外泌体中包含的miRNA在调节mTBI疾病过程中的基因表达以及蛋白合成中发挥着重要作用。目前学界普遍认为联合生物标志物筛查以及影像学检查将能够提高mTBI诊断的准确性。而mTBI的研究与了解潜在的病理生理学高度相关,通过开发一套生物标志物,可以建立诊断和预后的临床工具,从而使mTBI的诊断更加一致。因此,本综述将mTBI相关的生物标志物分为了生物、影像以及神经生理标志物三类。


基于外周与CNS的mTBI生物标志物
在某疾病的特定状态下,生物标志物可以按照生理、生物以及功能状态进行粗浅的分类;其也可被分为诊断性的、预后性的以及治疗性的以了解脑损伤的状态。在本节中、我们将讨论在mTBI中特异性表达的外周/CNS的蛋白标志物。表2总结了基于文献研究的mTBI候选蛋白生物标志物,包括mTBI特有的损伤类型、方法类型、研究结果和样本来源。


星型细胞损伤
S100β
S100β是S100蛋白家族的一员。这种蛋白需要结合成为二聚体才能够发挥作用。S100β是一种EF类的钙调节蛋白,参与到调节细胞内的钙稳态。其主要参与到神经胶质增生。S100β已经被发现是多种TBI的生物标志物,并且其主要作用在于钙稳态、细胞存活以及分化。最近的一些研究表明成人和儿童mTBI患者血清中的S100β水平会发生变化,因此可作为一种诊断mTBI的生物标志物。不同的课题组发现血浆和尿液中的S100β都可作为样本来源。在成人mTBI患者中,血清S100β水平要高于控制组。此外,Vos等人的研究证明了mTBI患者血清中的S100β水平有所升高。
胶质纤维酸性蛋白(GFAP)
GFAP是一种星型细胞的蛋白标志物并且仅在神经胶质细胞中表达。目前有研究支持GFAP释放是mTBI的反应机制的假设。研究者发现成人与儿童mTBI患者血清中的GFAP水平有所上升。GFAP是鉴定与诊断mTBI很好的备选标志物,但究竟能否实际应用还需要大样本研究支持。
髓鞘碱性蛋白(MBP)
MBP是髓鞘的重要组成成分并且仅在少突胶质细胞或施万细胞等有髓鞘的细胞中表达。MBP作为神经损伤的标志物的可行性已被检验。在儿童TBI患者的CSF样本中,MBP的水平有所升高。此外mTBI患者血清中的MBP水平也有升高。一系列研究已经表明MBP在诊断不同类型的TBI中颇具前景。
细胞因子与炎性蛋白
CSF中的炎性蛋白(如IL-6,IL-8以及IL-10)会在损伤后升高,但这一促炎反应是否与mTBI患者较差预后相关尚不清晰。一项针对16名儿童mTBI患者的预实验表明IL-6以及MMP9作为mTBI的诊断实验的敏感度与特异度可分别达81%和94%。血脑屏障通透性的升高可能提高了这些蛋白水平。这类损伤同样导致了marinobufagenin(MBG)的升高。MBG是肾动脉狭窄时人体释放的一种类固醇强心剂,其能够启动并且维持炎症,因此,循环中的MBG应当也有作为mTBI标志物的潜力。尿MBG水平在脑震荡患者中同样有所升高,通常在损伤2到5天后达到峰值,并且与神经认知症状相关,但仍然需要更多的研究支持要理解这类炎症反应分子,开发mTBI的蛋白标志物。
Tau蛋白
Tau蛋白是一类微管相关蛋白(MAPs),其主要作用在于促进轴突生长过程中的微管聚合。最近的研究表明在发生不同类型的神经损伤时,CSF与血清中的tau蛋白都会升高。一些涉及神经损伤(如mTBI)的研究发现不论是在动物模型还是人类患者中,tau蛋白水平升高都会作为损伤反应机制的一部分出现。基于这些证据,tau蛋白可能作为mTBI等神经损伤的生物标志物。
泛素羧基端酯酶L1(UCHL1)
UCHL1是一种含有76个氨基酸残基的小分子羧端水解酶,其能够移除羧基酯以及泛素化的残基产生游离的泛素单体。UCHL1仅在神经元胞浆、睾丸以及卵巢中表达,是一种在神经元损伤时释放到血浆中的蛋白质,尤其是在mTBI中。此外,研究已经证明mTBI患者血中的UCHL1水平较正常人高。不过Puvenna等人的研究却发现神经损伤并没有导致UCHL1水平发生变化,这进一步说明还需要审慎对待UCHL1作为生物标志物的价值。
神经丝(NFLs)
NFLs是细胞骨架以及中间丝的组成成分,根据分子量的大小其可被进一步分为3类:神经丝重链(NFL-H)、神经丝中链(NSF-M)、神经丝轻链(NSF-L)。许多研究都证实在发生轴索损伤时NFLs会被释放入CSF以及血清中。依据样本来源组织以及实验目的的不同,NFLs可以作为轴索/神经元损伤、以及其他很多疾病的生物标志物。现有证据显示在发生mTBI等神经损伤时,三类NFLs水平均会升高。某一实验表明mTBI患者中的血清NFL-L水平要高于对照组,其他实验发现mTBI患者的CSF以及血清中的NFL-M以及磷酸化的NFL-H水平均有升高。
烯醇酶2(NSE)
NSE是一种磷酸苷酸水合酶神经元特异性酶,参与到糖分解的进程中。鉴于神经损伤会导致NSE被释放入血,其能否作为mTBI的诊断标志物是近来讨论的一个话题。Stalnacke的研究显示mTBI患者血清中的NSE水平有所升高。但另一研究则指出NSE水平没有任何具有统计学意义的改变,甚至可能就根本没有改变,因此有人争论道NSE可能不能够作为mTBI的诊断标志物,至少仅凭借它本身不能实现。不过若是将NSE与其他mTBI诊断标志物联合进行mTBI诊断,NSE或许能够提高诊断的精确度。目前研究NSE诊断价值的研究较少,相关结论还有待后续进一步证实。
中性粒细胞明胶酶相关脂质运载蛋白(NGAL)
NGAL,也即脂质运载蛋白2(LNC2),是一个分子量仅为25kDa的明胶相关的脂质运载蛋白。NGAL能够与细菌产生的亲脂性物质结合从而参与到炎症系统反应。在发生重型TBI等脑部损伤时,作为创伤反应机制的一部分,mRNA与蛋白质水平的NGAL都将升高,不过这一现象同样会在肾损伤时出现,因此NGAL异常水平的解读需要结合实际情况。文献内容显示,NGAL的水平与神经损伤的严重程度正相关,因此其可作为特定脑损伤的生物标志物。总体而言,NGAL可被用于确定mTBI的类型以及严重程度。
溶于血浆的细胞朊病毒(PrPC)
PrPC是血浆中具有糖化膜并且可溶的蛋白质。根据针对啮齿类以及人类的研究,不同种类的脑损伤会导致血清样本中PrPC显著地增多。证据表明PrPC在诊断TBI上颇具前景。近日Pham开展的研究表明PrPC在脑震荡确诊病例中升高,因此有作为mTBI标志物的可能,但以此作为mTBI诊断标志物的研究数量太少。如蛋白质大小的代谢物和氨基酸标记物等一组经过验证和可靠的诊断性TBI生物标志物可以减少成像过程的辐射伤害。Hajiaghamemar2020年出版的一项研究使用了稳健的标志物组和多元logistic回归分析,对血清甘氨酸、牛磺酸和鸟氨酸等多个氨基酸亚群进行了高敏感性和准确预测率的研究。完整的mTBI蛋白生物标志物列表见表1。
mTBI的基因生物标志物
少量研究对部分基因标志物作为mTBI的可用性进行了鉴定。影响病理生理生物标志物的潜在基因变异可能会导致个体对损伤的易感性,并可能引起后遗症,如PCS和CTE。载脂蛋白E (APOE)和脑源性神经营养因子(BDNF)是mTBI的重要候选标志物。BDNFVal66Met等位基因与mTBI后出现记忆缺陷的较高风险有关。SNP rs1157659也可能是mTBI后患神经退行性疾病的高危因素。APOE基因的epsilon 4等位基因是神经退行性疾病如阿尔茨海默病发展的最大危险因素之一。研究发现具有APOE4基因型的mTBI军队患者表现出了记忆衰退以及处理能力下降等认知功能损害,而APOE4本身在以军队人群为基础的研究中未显示任何不良现象。在其他研究中,APOE4基因型的mTBI患者显示出语言记忆障碍,并增加了阿尔茨海默病等神经退行性疾病的发病率。
microRNA是一种新兴的生物标志物,在mTBI的临床应用中具有广阔的前景。Johnson等人2018年的研究表明唾液microRNAs可有效作为儿童PCS的预测标志物,使得临床医生能够为患者提供更可靠的治疗选择。这些潜在的标志物相关实验的效应量与样本量都相当小,我们需要更大样本量的实验来验证和重复这些结果。然而,测序成本的下降和深度测序方法的日益普及使基因生物标志物成为在未来研究中颇具吸引力的候选者。Di Pietro等人指出mTBI和颅外损伤患者中两种miRNAs水平的降低,使得这类患者能够与重型TBI患者相区分。此外,LaRocca等人(2019)发现,血清和唾液中的某些miRNAs水平与脑外伤后的认知和平衡结果有关,这具有进一步研究和临床应用的潜力。
mTBI的影像生物标志物
mTBI可能由多种原因引起,如机动车事故(MVAs)、跌倒、暴力等。尽管为减少MVAs引起的TBI付出了不少努力,TBI仍然是急诊(ED)的常见主诉,特别是由于老年人跌倒相关TBI发生率的上升。Lagerstedt等人2018年发表的一项研究旨在利用CT阳性和CT阴性共133名mTBI患者从广泛炎症生物标志物中发现一种新的mTBI诊断生物标志物,结果显示IL-10在区分CT阳性和CT阴性mTBI患者上具有100%的敏感性。
头部CT
mTBI患者进行头部CT平扫是为了筛选需要紧急医疗处理或手术干预、或是可能有后续后遗症的患者。头部CT平扫同时具有评估短期和长期预后的作用。最近的研究表明,对疑似TBI患者同时进行面部和头部CT扫描具有一定价值,因为TBI患者面部骨折的频率更高。而这些骨折可能需要手术治疗却可能被常规的头部CT检查忽略。Lagerstedt等人(2018)进行的一项研究表明,一种抗炎蛋白——IL-10的水平可以帮助预测mTBI患者的头部CT是否会有阳性发现。
MRI
脑部MRI通常不用于mTBI,但对于头部CT正常、不明原因神经功能无好转或持续恶化的患者而言,MRI是一可用的选择。研究表明,在疑似mTBI但CT正常的患者中偶尔会发现脑MRI异常,这些异常被描述为“与轴索损伤一致”。最近的研究试图通过调查TBI病例中弥漫性轴索损伤(DAI)的位置如何影响预后来提高这些研究的敏感性和特异性。Mittl等(1994)的一项研究认为:脑干、黑质和中脑被盖的DAI表现与较差的神经认知预后相关。此外,在脑MRI和CT扫描中发现的皮质挫伤数量可能是中型TBI患者预后的预测因素。Abu等人(2017)进一步证实了这一点,他们发现黑质和中脑脚盖病变数量的增加与DAI患者长期预后不良相关。目前部分实验探究了发生mTBI后脑白质发生的变化。最近的一项研究发现,在104名mTBI受试者中,通过MRI发现27%的人有与年龄无关的白质改变,并且其中的26例与急性创伤无关。MRI上的皮质厚度是一个潜在的有用的生物标志物,因为有研究表明mTBI患者的右顶叶上区和左颞中区皮层有所增厚。而不同的治疗组中患者的皮质则在变薄,这可在mTBI患者皮质中被跟踪监测。
动态对比增强磁共振成像(DCE-MRI)
mTBI对血脑屏障(BBB)的损伤是一种激发的分子机制。这种破坏会改变组织间液微环境的调节,从而导致功能失常。在开发缓解和治疗损伤的疗法过程中,确定创伤后BBB的破损程度是一个关键步骤。DCE-MRI是一种在造影剂通过期间提供序列图像的神经成像工具,其已被用于测定脑卒中幸存者和动物模型的BBB功能障碍。目前,还没有检测脑损伤后BBB损伤的方法。确定mTBI后BBB的基线水平和任何异常将有助于更准确地诊断mTBI以及开发新的治疗方法。Winter等人(2015)的一项研究检验了DCE-MRI和SPECT在TBI患者中的应用,其结果表明,这两种神经成像工具中的任何一种都可作为确定BBB改变的工具。
磁化率加权图像(SWI)/定量磁化率图(QSM)
为有效地分类创伤性脑损伤的严重程度,并评估神经认知结果,目前已有许多研究尝试了其他类型的方法,其中一个是测量侧脑室上方的脑静脉容量。与对照组相比,mTBI患者侧脑室上方的脑静脉容量显著增加[124]。其他研究表明,SWI可以提供关于潜在的脑部微出血的信息,有助于确定损伤的严重程度和治疗进展,并因此应当在诊断步骤中被实施。
扩散峰度成像(DKI)
DKI也被认为是一种可能的评估TBI的诊断工具。据推测,TBI可导致大脑微结构的改变,一项研究发现,急性TBI患者和损伤后3个月的脑白质发生了显著变化。DKI的检测价值需要更多的证据来确定这些变化。Karslen等人(2019)进行的一项研究表明,TBI患者微观结构的改变可能与发展为脑震荡后综合征的风险有关,而DKI可以检测到这些变化。Grossman等人的研究使用DKI确定了mTBI患者的这些结构改变。总体而言,研究表明DKI可以作为一种工具来识别和监测mTBI导致的生理变化。
弥散张量成像(DTI)
DTI是一种更敏感的神经成像工具,可以检测mTBI的微结构轴索损伤。新技术已经允许分析脑损伤影响的特定脑区。在普通的神经影像学检查通常不会发现任何可见的损伤时,高敏感的DTI可以显示白质微观结构的改变,从而提示mTBI引起的损伤。Aoki等人(2012)的一篇系统回顾和meta分析评估了DTI是否能检测mTBI患者的白质损伤。一共28项DTI研究被纳入了这项分析,但只有13项mTBI患者的DTI研究符合数据分析的标准。随机效应模型显示胼胝体各向异性分数显著降低以及平均扩散率显著增加。此外,该研究还显示,胼胝体后部比前部更容易受到mTBI的伤害,这表明DTI在检测mTBI患者胼胝体白质损伤方面可能是有效的。Madaan等人(2021)的另一项研究是关于6-16岁mTBI患儿的神经认知结果及其DTI结果相关性的研究。一项包括74例mTBI患儿的前瞻性分析发现17%的轻度创伤性脑损伤儿童有内化行为问题,而对照组只有4%。右弓状束平均弥散度与血管性认知障碍呈正相关。
外伤性脑血管反应性损伤(TCVI)
TBI可导致影响日常活动的功能缺陷和残疾。TCVI是被认为与TBI有关的机制之一。由于脑内的脉管系统重要性,TCVI一直是创伤性脑损伤治疗开发的重点。Amyot等人(2018)的一项研究利用MRI检测了TBI患者TCVI的空间分布,并确定了脑血流和脑血管反应性(CVR)可作为TCVI的生物标志物。他们的结果表明,CVR与TBI症状的相关性更好,因此有可能成为TCVI的生物标志物[133]。Kenney等人(2016)的另一项研究表明,测量TBI后的脑血管功能障碍不仅能够拓展我们对TCVI病理生理的认识,而且可为开发更具体的TBI治疗方法提供更多的见解[134]。总而言之,TCVI已被证明与TBI导致的认知行为受损有关。尽管这些研究关注的是其他TBI的严重程度,但它关注的是一个潜在的、可被用于诊断和治疗mTBI的生物标志物。
神经生理学生物标志物
神经系统中的电生物信号具有作为mTBI诊断和治疗的神经生理生物标志物的潜力。目前存在几种测量生物电信号的方法,其中两种包括脑电图(EEG)和脑磁图(MEG)。EEG测量两个电极之间的电流,而MEG测量大脑中电流产生的磁场。
EEG
EEG显示出作为TBI临床生物标志物的潜力。在对刺激的反应中,大脑产生事件相关电位(ERPs),其可以分为事件相关同步和事件相关去同步(ERD)。脑振荡的变化可以用EEG来测量。Arakaki等人(2019)进行的研究检查了13名有mTBI病史的患者的工作记忆加工过程。与7名有轻度外周创伤病史的对照组患者相比,定量EEG(qEEG)显示mTBI患者在完成低工作量任务过程中,具有较大的αERD(qEEG测量在损伤后5天内进行)。研究还发现与对照组相比,mTBI患者的诱发αERD并没有恢复到基线水平。此外,研究还发现,在发生损伤2周后,与轻度外周创伤患者相比,mTBI患者顶叶的诱发α ERD/事件相关同步性更强。
另一项研究对71名有mTBI病史和持续PCS的服役人员的脑电图异常进行了调查。EEG显示大约39%的参与者的基线减慢。在美国11个急诊室进行的一项观察性、前瞻性验证试验,对720名有TBI病史、格拉斯哥昏迷评分(GSC)为12-15的患者进行了调查。该研究旨在评估使用名为AHEAD 300的定量脑电活动算法判断患者是否接受了CT检查的有效性。所有的脑电活动测量都是在受伤72小时内进行的。该研究发现,AHEAD 300算法在辨别TBI患者时敏感性为92.3% (95% [CI] = 87.8%-95.5%),特异性为51.6%(95% [CI] = 48.1%-55.1%),具有潜在的应用前景,可作为一种基于脑电图的TBI生物标志物。
MEG
MEG也被证明具有作为临床TBI生物标志物的可能性。一项纳入了26例mTBI患者的研究发现,其中7例患者的脑磁图中θ带活动异常。作者还发现,一些参与者只有在mTBI后6-26天的初始记录中才发现MEG活动异常。这提示有症状的mTBI患者损伤后进一步利用MEG进行评估的必要。另一项研究纳入了30名有mTBI病史的患者,分析了不同频段振荡之间的相互作用,也称为交叉频率耦合。该研究将mTBI患者与50名对照组进行比较,发现对照组的神经网络功能整合更好。此外,与对照组相比,mTBI患者的相位锁定值,即大脑中相位相互作用的复杂度量,有所减少。一项纳入了9名有mTBI病史和PCS的患者的研究发现,主要是δ带的相位锁定值减少,但是α与β相位锁定值也有下降。此外,相位锁定值的降低主要发生在顶叶和枕叶。
在犹他大学和阿尔伯克基VAMC的MEG项目中,对30名mTBI患者进行了一项回顾性研究,发现尽管没有人报告有临床癫痫发作,但五分之一的患者在MEG上表现出间歇性癫痫发作。在30名患者中,只有19人偶极慢波活动异常。此外,有10例MRI、SPECT发现均正常,但EEG异常的患者。
生物标记物的临床意义和临床试验
基础科学研究已经发现了大量mTBI的生物标志物,它们被用于诊断、预测临床结局、检测康复状况和指导治疗。鉴于mTBI的高发病率和疾病负担,生物标志物研究的临床应用发展将对公共卫生产生重大影响。生物标志物在TBI治疗中的应用正在扩大,包括最近FDA批准的一项利用血液中GFAP和UHCL1帮助排除mTBI患者中头部和脑成像需求的检测。(https://www.fda.gov/news-events/press-announcements/fda-authorizes-marketing-first-blood-test-aid-evaluation-concussion-adults).
除了发现生物标志物外,无论是通过假设驱动还是无偏倚的方法,还必须进一步地验证这些生物标志物,并评估它们在mTBI中的临床应用。mTBI研究的目的是确定是否可以通过在头部外伤患者转院期间提取的血液生物标志物排除颅内病变来减少广泛检查的需要(NCT02867137)。
对于mTBI,CSF采集的相对不切实际导致了对血液、唾液和尿液作为治疗和预后的生物标志物的研究。目前的临床试验正在研究基于mTBI的预后和诊断性生物标志物的治疗干预的效果。一项正在进行的研究是观察脉冲电磁场对TBI的影响(NCT03654014)。另一项研究是观察重复经颅磁刺激对记忆任务表现的影响,以及其与TBI患者大脑区域间功能连接生物标记物之间的关系(NCT03050801)。随着生物标志物的发现以及它们与mTBI病理生理学的关系被进一步阐明,研究人员将更好地确定干预疗法的靶点。
发现和理解mTBI生物标志物的临床意义的努力积极而广泛。这些丰富的发现需要收集和组织,以供临床医生在日常实践中使用。TRACK-TBI项目正为所有类型的生物标志物开发目录以完善TBI患者的诊断和治疗指南(NCT02119182)。对将mTBI生物标志物的形态、动力学以及对治疗反应这三个特性间的相关联的临床试验的持续投资将促进这一努力,并促成崭新临床工具的开发。与mTBI研究相关的临床试验和参考编号摘自
http://www.clinicaltrials.gov。结论以及展望
在美国,据估计每年有数百万人受累于TBI,其中绝大多数是mTBI。根据文献,mTBI患者的症状最长可达3个月,然而,大多数患者没有可见的脑损伤。据估计,5-10%的mTBI患者存在可检测到的脑损伤,其可导致PCS的病理生理变化,并有发生神经退行性疾病等健康问题的风险。
许多科学家研究了mTBI的后果,他们发现,由于受伤会有分子释放到血清中。使用这些分子作为生物标志物可能有助于mTBI的诊断,并能够阐明损伤的严重程度。虽然一些生物标志物对诊断TBI很有用,但它们通常不能用于mTBI患者。例如,CSF对mTBI诊断并不有效,因为CSF/血清白蛋白比值不能为该病提供任何重要的信息。相比之下,神经胶质源性生物标志物如S100β、MBP和GFAP作为mTBI的生物标志物已被广泛研究。根据文献,这三种生物标志物都有强有力的证据证明它们在诊断mTBI患者方面是有用的。
此外,另一种观点认为,一组蛋白质的释放是神经元损伤/伤害的结果。进一步讲,这些蛋白在神经元中表达,因此任何对神经元的损伤都会导致这些蛋白被释放到血清中。根据文献,有一些特定的蛋白被认为与mTBIs有关,如tau蛋白,但尚无足够的证据支持其能用于mTBIs的诊断。UHCL1和NSE两种蛋白质的相互矛盾的数据也使得其很难被用于生物标志物。另一项研究表明朊病毒中,PrPC非常有前途,但目前缺乏足够的证据表明它可以作为生物标志物,特别是mTBI。在许多蛋白质已被纳入考虑范围但没有获得完全的数据支持时,有两个蛋白质基因已可作为诊断mTBI的生物标志物、APOE和BDNF。虽然这些可能是有用的诊断生物标志物,它们同时也用于诊断神经退行性变,这或许有助于开发一种预测mTBI诱发的神经退行性变的技术。生物标志物的检测可以通过使用不同的取样来源来完成,如血清、血浆或脑脊液。2018年,FDA首次允许使用基于GFAP和UCHL1水平的血液检测来诊断mTBI患者。获得检查结果仅需要3-4小时,并且可以帮助确定患者是否具有颅内病变,以及是否需要进行头部CT扫描。
即时医疗(POC)设备是一种很好的工具,它极大地改善了糖尿病和心脏病等疾病的健康问题。鉴于其使得人们能够以低廉的价格获得可拯救生命的诊断工具,相关设备的开发至关重要。POC设备被定义为:使患者在检测时能够快速获得结果,而不需要额外医务人员的诊断设备。尽管这些设备非常有用,但针对特定疾病的POCs尚显不足。然而,针对其他疾病的新设备的开发正在进行中。考虑到这一点,开发一种有助于mTBI诊断的POC仪器将是开创性的,特别是在体育和军事这些快速诊断将非常有益的领域。确定mTBI的特异生物标志物将有助于开发特定的、用于在受伤后检测这些生物标记物异常情况的POC设备。这种形式的诊断工具可帮助患者决定是否需要进一步的医疗服务。然而需要指出的是,目前mTBI的生物标志物还不是具体的,并且需要更多的研究,相关POC设备还有待开发。
总的来说,很多文献都把重点放在使用生物标记物作为mTBI的诊断技术上。然而,许多生物标志物都还没有强有力的证据来证明其可用于mTBI的诊断。我们认为需要更多的数据来准确地使用这些生物标志物。也有人假设,检测生物标记物的组合可能比检测单个的标志物结果更准确。最后,在早期阶段准确诊断mTBI并鉴定可能的不可逆损害及其对个人健康的影响,可能使人们有机会治疗和/或努力预防疾病,并提高生活质量。
来源:Journal of Alzheimer’s Disease
DOI 10.3233/JAD-215158
本文章转载于公众号:急重症世界
END




