《Lancet,Diabetes & Endocrinology》杂志2021年12月9日刊载[(12):847-875.]美国、法国、荷兰、巴西、德国、西班牙、意大利、英国、澳大利亚、加拿大、以色列、日本、希腊、奥地利等国的Maria Fleseriu, Richard Auchus ,Irina Bancos,等46位学者代表垂体学会(The Pituitary Society)联合撰写的《库欣病诊断和管理共识:指南更新。Consensus on diagnosis and management of Cushing's disease: a guideline update》(doi:10.1016/S2213-8587(21)00235-7.)。

【摘要】
库欣氏病需要准确诊断,仔细选择治疗,和长期管理,以优化患者的结果。垂体学会(The Pituitary Society)召开了一个由50多名学术研究人员和临床专家组成的共识研讨会,讨论最近的循证证据在临床实践中的应用。在虚拟会议前,所有参与者回顾了录像讲座中对从2015年至今的关于库欣病筛查和诊断的;外科、内科和放疗的;与疾病相关和与治疗相关的并发症的数据的总结。在会议期间,提交录像讲座的简要概要,然后进行分小组讨论。将各组的共识意见整理成文件草案,并由所有参与者进行审查和批准。提出关于实验室检测,影像,和治疗方案,以及库欣综合征诊断和库欣病管理流程的推荐。而被认为是在未来的研究中最重要的主题也得到确定。
介绍
库欣病是内源性库欣综合征最常见的病因,由分泌促肾上腺皮质激素(ACTH)的垂体肿瘤引起。患者得到最佳的预后,需要准确的诊断、仔细的治疗选择和对疾病及其相关并发症的管理,以优化患者预后。值得注意的是,与肾上腺所致库欣综合征患者相比,库欣病患者的长期生活质量较差。自2003年、2008年、和2015年临床指南发布以来,已经确定了新的筛查和诊断模式,并批准使用新的治疗方法。这些新进展突出了需要更新这一挑战性障碍的临床指南。
垂体学会于2020年10月召开了为期2天的虚拟共识研讨会,讨论库欣病的治疗,批判性地回顾当前文献,并提供筛查和诊断建议;手术、药物治疗和放射治疗的最佳使用和监测结果;以及识别和管理与疾病相关和与治疗相关的并发症。重点是垂体,而不是肾上腺或异位库欣综合征,最近在其他共识声明或综述中涉及的重叠主题没有包括在内。
本指南更新回顾了最近的临床实践证据和建议,对证据的质量和共识建议的强度进行了分级。表中列出了使用不同实验室测试和药物疗法的主要考虑因素。专家小组对库欣综合征的诊断和监测、库欣病并发症的处理和库欣病的药物治疗的使用提出了共识建议。在附录(p3)中给出了证据质量的分级模式和强烈或酌情推荐。也给出了诊断库欣综合征的流程(图1)和处理库欣病的流程。
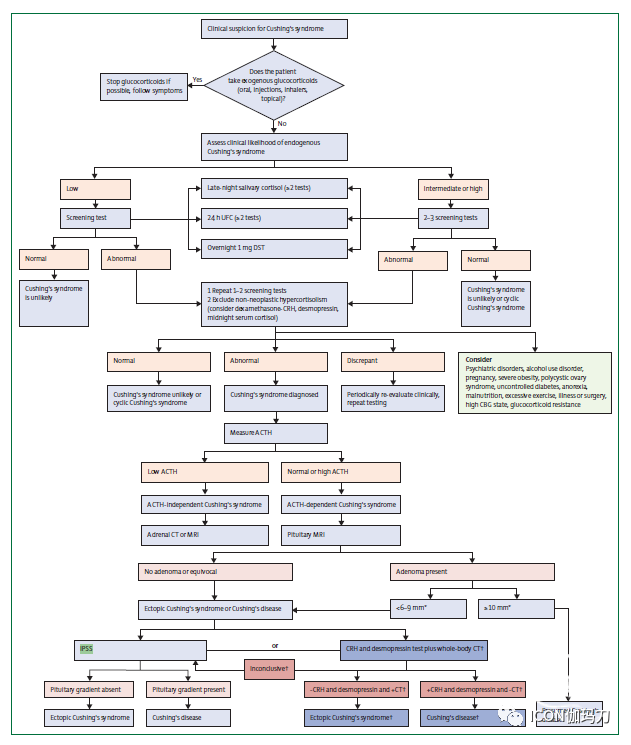
图1:库欣综合征诊断流程。ACTH=促肾上腺皮质激素。CBG=皮质醇结合球蛋白;CRH=促肾上腺皮质激素释放激素。DST=地塞米松抑制试验。IPSS=岩下窦采血。UFC=尿游离皮质醇。*共识认为,所有患者的直径小于6mm的病变都应该行IPSS,而10mm的病变不需要IPSS,但对于直径为6-9mm的病变,专家意见不一。对这个替代方案没有明确的共识,需要进一步的研究,这方面由黑框表示的。绿框表示所考虑的要点;较深的颜色表示验证较少的检测途径。
对提出于成人库欣病的建议用于临床实践,但应该考虑与患者特定和疾病特定因素的个体化医疗。关于儿科库欣病的独特考虑的简要介绍也包括在内。
方法
研讨会共同主席和指导委员会成员确定了28个与库欣病诊断、并发症和治疗相关的专题。在附录中描述文献批判性回顾、工作坊前讲座和工作坊讨论的方法。
库欣综合征的诊断:筛查、确认和定位方式
实验室检测
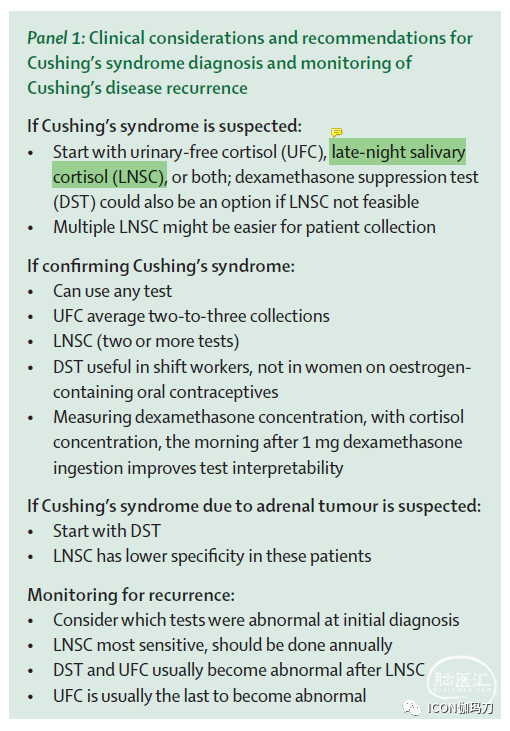
库欣综合征的诊断常常延迟数年,部分原因是缺乏对其隐伏的、进行性的疾病过程和检测的复杂性的认识。库欣综合征的筛查和诊断是检测评估皮质醇分泌状态:昼夜节律异常伴午夜唾液皮质醇(LNSC),糖皮质激素反馈受损伴夜间1mg地塞米松抑制试验(DST)或小剂量2天地塞米松试验(LDDT),伴皮质醇和24小时尿游离皮质醇生物效应增加(UFC;Panel1)。在此背景下,所有测试的敏感性均高于90%;DST和LNSC的敏感性最高,UFC的敏感性最低。特异性略低于敏感性,LNSC的特异性最高,DST和UFC的特异性最低。
表1:库欣综合征诊断和库欣病复发监测的实验室检测。
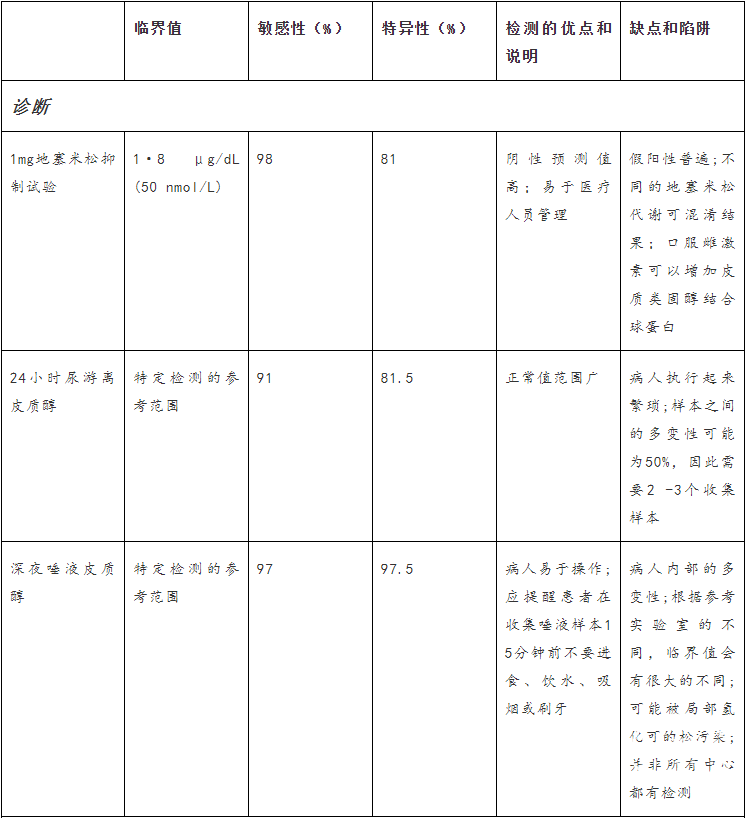
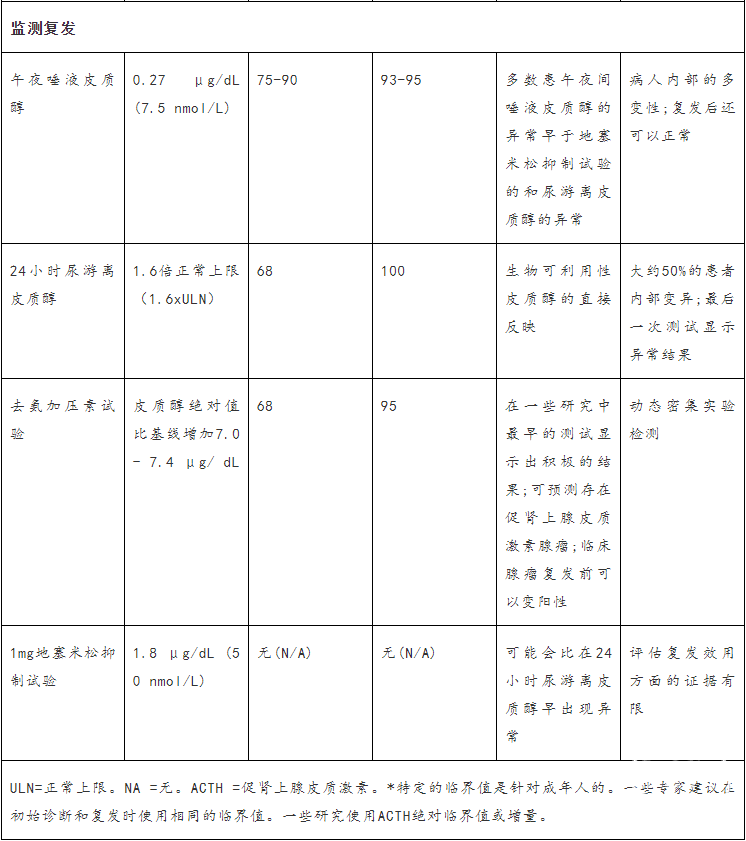
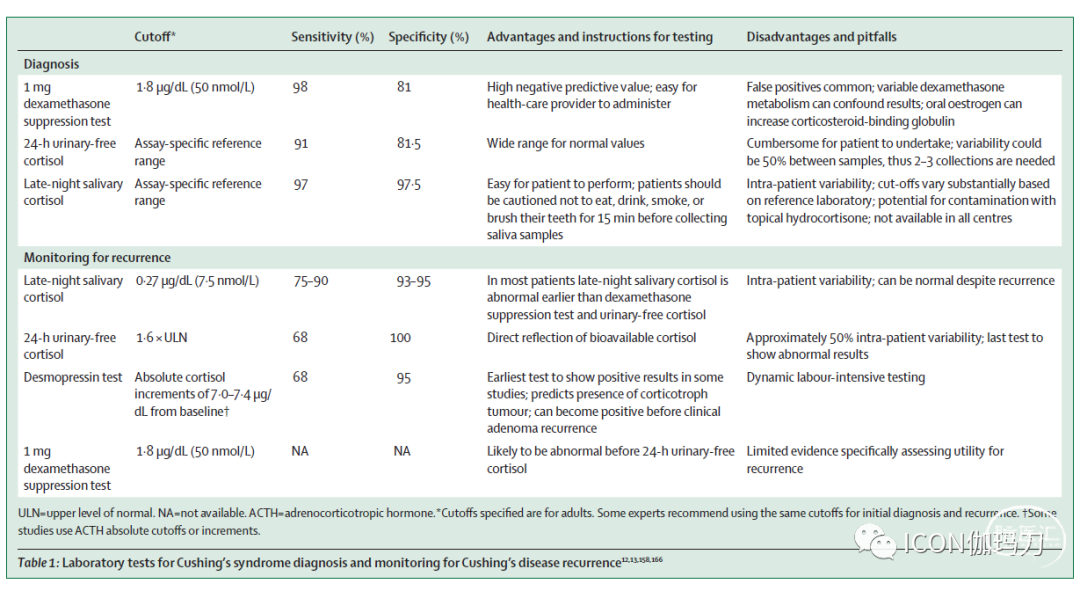
午夜唾液皮质醇(LNSC)
LNSC的诊断效用是建立在假设库欣综合征患者失去正常的皮质醇分泌昼夜节律谷值的基础上的,建议至少进行2-3次LNSC检查。轻度库欣综合征患者的LNSC可能恰好高于正常上限(ULN)。在正常的就寝时间而不是在午夜行唾液采样可以减少假阳性结果,因为皮质醇谷值紧跟着进入睡眠状态(cortisol nadir is tightly entrained to sleep onset)。液相色谱串联质谱法可以检测皮质醇和可的松,从而确定污染的通常不包含可的松的局部氢化可的松制剂。因此,应用质谱分析法诊断库欣综合征具有较高的特异性,而免疫分析法对库欣综合征具有较高的敏感性。周期性库欣综合征患者表现出数周至数月的皮质醇分泌正常,并伴有发作性皮质醇超量,多次、定期、连续的LNSC检测对于鉴别周期性库欣综合征(cyclic Cushing s syndrome)患者所需的纵向监测特别有用。相比之下,LNSC不应在正常昼夜周期被打乱的患者中进行,如夜班工人(night-shift workers)
夜间1毫克地塞米松抑制试验(Overnight 1-mg DST)
在健康个体中,超生理的地塞米松剂量可抑制血管加压素和ACTH的分泌,从而降低皮质醇浓度。因此,在晚上11点至午夜给药1毫克地塞米松后,在早上8点血清皮质醇浓度低于1.8μg/dL(50nmol/L)被认为是正常反应。阴性结果强烈预测不存在库欣综合征。在较高的临界点(如5μg/dL[138nmol/L]),DST敏感性降低。皮质醇浓度小于1.8μg/dL,排除了肾上腺意外瘤引起的皮质醇失控制(dysregulayed);在这种情况下,皮质醇分泌异常值高于5μg/dL的患者通常是由带有明显库欣综合征的意外瘤引起的皮质醇分泌失控制。由于肠道运转时间(gut transit time)增加、慢性腹泻或乳糜泻(coeliac disease)引起的地塞米松的快速吸收或吸收不良可出现假阳性结果;与CYP3A4诱导剂(如苯巴比妥、卡马西平、圣约翰草[治疗抑郁的草药St John s wort])联合治疗;以及口服雌激素、妊娠或慢性活动性肝炎引起的皮质类固醇结合球蛋白(CBG)浓度增加,这些都会增加皮质醇的总浓度。同时测量地塞米松和皮质醇,使用特定的实验室期望值范围,可以降低假阳性结果的风险。假阴性结果不太常见,通常是由氟西汀、西咪替丁或地尔硫卓(fluoxetine,cimetidine, or diltiazem)等伴随药物抑制地塞米松代谢所致,从而导致较高的生物学可用剂量。在并发肾病综合征的患者中,可以注意到皮质类固醇结合球蛋白(CBG)和白蛋白浓度的降低,这也可能产生一个错误的低值。
尿游离皮质醇(UFC)
建议至少收集两到三个24小时的尿液来测量UFC,以考虑到患者内部的多变差异。与DST相比,UFC的一个优势是,总体皮质醇的产生与CBG变化、地塞米松代谢或依从性无关。然而,尽管计算几个集合的平均值有助于正确的解释,但随机变异性可能高达50%。与LNSC一样,UFC依赖于患者的准确采集。
性别、身体质量指数(BMI)、年龄、很高或很低的尿量和钠摄入量都可以影响UFC浓度,在解释时应予以考虑。因为尿量和尿滤过率能很好地预测UFC,其他筛选试验如LNSC可能更适合有肾功能损害(肌酐清除率<60mL/min)或有临床意义的多尿(>5L/24h)的患者。
非肿瘤性高皮质醇症(假性库欣综合征)的检测
精神障碍、酗酒、多囊卵巢综合征和肥胖可激活下丘脑-垂体-肾上腺(HPA)轴。这类患者也可能伴有一般人群常见的库欣综合征特征(如体重增加),从而需要进行生化筛查。DST、LNSC和UFC在这些非肿瘤性临床高皮质醇血症(或所谓的假性库欣综合征)患者中均可显示阳性(异常)结果。此外,伴随用药可能导致类固醇交叉反应或在其他方面干扰实验室检测结果。然而,这些异常结果倾向于轻度升高;UFC几乎总是在正常浓度的3倍以内。LDDT-促肾上腺皮质激素释放激素(CRH;Dex-CRH)试验、LDDT或去加压素试验可能能够区分ACTH依赖性库欣综合征和假性库欣综合征。在此背景下,Dex-CRH试验的应用是基于这样一个假设,即只有ACTH依赖性Cushing综合征患者在地塞米松抑制后才会对CRH表现出皮质醇反应。然而,由于不同的方案、使用不同剂量绵羊的或人的CRH、皮质醇和ACTH检测的特征,以及患者特征(如高皮质醇血症的程度、肾上腺与垂体库欣综合征和并存疾病),检测的可靠性可能会各相径庭。使用去氨加压素试验是基于一项发现,即分泌ACTH腺瘤表达血管加压素V1b受体(也称为血管加压素3受体),在注射去氨加压素后,血浆ACTH浓度增加去氨压血素试验对库欣病具有较高的特异性,而且与Dex-CRH试验相比,去氨压血素试验的复杂性和费用较低,但在某些研究中,这两种试验在区分库欣综合征和假性库欣综合征方面均表现出良好的诊断性能;完成两项测试后,结果非常一致。
对实验室检测的临床考虑和建议
对于库欣综合征还没有单一的首选诊断方法(专题1),尽管人们试图开发一个易于诊断的评分,尚无关于如何决定是否和何时进行检查的共识。对库欣综合征的临床判断和怀疑指数很重要,并强调需要根据临床情况对诊断检测的时机和选择作出个体化的决定(高质量证据,强烈推荐)。
如果怀疑是库欣综合症,任何一种诊断试验都可能有用。我们建议从UFC、LNSC、DST或其组合开始(高质量、强烈推荐),而这取决于当地的可获得性;多次LNSCs可能更容易让病人完成(高质量,强烈推荐)。如果怀疑有肾上腺肿瘤,我们建议从DST开始(中等质量,强烈推荐),如果可的松浓度也有报告,只使用LNSC(中等质量,强烈推荐)(专题1,panel1)。
DST可能是夜班工人和因睡眠时间表不均衡而昼夜节律紊乱的患者的首选测试,但在口服雌激素治疗的女性中可能不可靠(高质量,强烈推荐)。如果由于临床情况怀疑DST呈假阳性,测量地塞米松水平是有用的(中等质量,强烈推荐)。如果使用UFC,应该获得两到三个集合来评估可变性(高质量,强烈推荐)。如果使用LNSC,我们建议至少进行两到三次测试(高质量,强烈推荐)。尽管最初有人担心LNSC会增加SARS-CoV-2感染的风险,在适当预防的情况下,它对实验室人员仍然是安全的。双侧下岩窦采血(IPSS)不应用于诊断高皮质醇血症,因为健康对照组和假性库欣综合征患者的中枢到外周ACTH梯度与库欣病患者观察到的梯度重叠(高质量,强烈推荐)。在典型的周期性库欣病或皮质醇浓度波动不可预测的患者中,动态测试和定位测试(包括IPSS)应在进行确认性LNSC或UFC之前进行,以证明患者处于活动期(专题1,panel)。

目前,在检测皮质醇水平,以诊断并确保不将轻度高皮质醇血症患者排除在外过程中,质谱分析法并不优于免疫分析。然而,需要采用现代分析方法的规范数据。
非肿瘤性高皮质醇血症
非肿瘤性高皮质醇血症或假性库欣综合征仍然是最具挑战性的诊断之一。由于引起假性库欣综合征的原因各不相同,因此没有单一的方法可以将其排除。我们建议考虑患者的临床病史,特别是症状持续时间,并反复检测,以避免在不存有库欣综合征时实施不适当的治疗(低质量,酌情推荐)。在大多数情况下患者有轻度高皮质醇血症,可监测3-6个月,观察症状是否缓解;对潜在疾病(如抑郁症)的治疗可以恢复正常的HPA轴功能和皮质醇浓度(低质量,酌情推荐)。标准诊断检测在这一人群中是不可靠的。随时间推移,LDDT或连续的LNSC试验与临床表现相关(低质量,酌情推荐)。去氨加压素易于使用,易于在门诊给药。在这种情况下,Dex-CRH可能有价值,但已发表的诊断准确性结果各不相同;建议如同和严重肥胖患者的皮质醇截临界值调整一样,在专业中心与地塞米松浓度测量一起使用(中等质量,强烈推荐)。CRH目前还没有在美国、加拿大、巴西、阿根廷、墨西哥和其他一些国家使用。
影像和肿瘤定位
MRI是检测垂体分泌ACTH腺瘤的首选影像学方法。然而,部分原因是大多数病变非常小,使用标准的1.5T MRI只有大约50%的微腺瘤会得到清楚地描述。
技术上的改进,包括扰相梯度回波(SPGR)采集回波,1mm薄层间隔,液体衰减反转恢复,和稳定状态下的相关干扰(spoiled gradientrecalled (SPGR) acquisition echo with 1mm slice intervals,fluid attenuation inversion recovery,56 and constructive interference in the steady state),可能会增强检测,T1加权turbo自旋回波序列的变异,以及使用超高场强3T和7T磁铁可以改善微腺瘤的定位。然而,大约三分之一的库欣病患者的扫描仍然是阴性的,使用3T或7T磁铁有较高的分辨率可以增加发现可能与该疾病无关的意外偶发瘤的风险。
肿瘤大小与库欣病高皮质醇血症的程度不一定相关。事实上,较大腺瘤的患者可表现有较轻的高皮质醇血症。
PET已经被探索作为一种替代方法,或与MRI结合,以定位促肾上腺皮质激素腺瘤。在一个系列中检测垂体病变方面,18F(氟)-fluoro-deoxy-glucose(氟脱氧葡萄糖)(18F-FDG)PET/CT在很大程度上是可比得上标准快速自旋回波磁共振,另一项研究发现,标准自旋回波磁共振成像和高分辨率18F-FDG PET都不如SPGR MRI。之前的CRH刺激可以提高18F-FDG摄取,从而增加检测。PET与容积MRI (PET/磁共振配准)结合了功能和解剖成像,11C-蛋氨酸可以更精确地定位放射性示踪剂的摄取部位。在一个系列研究中,这项技术正确地定位了初发疾病和初次手术后持续或复发的高皮质醇血症患者的促肾上腺皮质激素腺瘤,其中大多数患者的标准自旋回波MRI为阴性或不确定。然而,该方法在大多数国家尚不可行或未获批准。最近也有人提出了替代策略(如靶向促肾上腺皮质激素肿瘤上的CRH-1受体),但还需要进一步研究。
对影像学和肿瘤定位的临床考虑和建议
对于分泌ACTH的垂体腺瘤,MRI仍然是首选的成像方式(高质量,强烈推荐)。如果可以,我们建议用3T磁共振代替1.5t磁共振(质量低,酌情推荐)。7T MRI还没有广泛被应用,如果1.5 T或3T MRI没有发现肿瘤,目前也没有理由用7T MRI进行再次成像。
功能性成像很可能最终被证明是一种比单独MRI更好的方法。然而,需要更多的数据来定义在不同的临床背景下不同的配体的使用。虽然先进的成像技术在一些卓越的中心是可获得的,对在3T MRI后转诊所有患者进一步成像的获益仍然是未知的。
库欣病与异位ACTH依赖性库欣综合征的鉴别
在库欣病患者中,在存在高剂量地塞米松情况下,糖皮质激素受体通常保留抑制ACTH分泌的能力,血管加压素V2和V1b(V3)受体,以及CRH受体,均过表达。相比之下,大多数(但不是全部)异位分泌促肾上腺皮质激素(ACTH)肿瘤不表达这些受体。因此,去氨加压素和CRH刺激试验被证明在鉴别垂体和异位肿瘤方面是有用的。CRH或去氨加压素给药后血浆ACTH和皮质醇浓度升高,通常提示库欣病。使用多个动态试验可能进一步提高临床的准确性。然而,分化良好的神经内分泌肿瘤也可以表达任何或所有这些受体,可能导致假阳性结果。虽然总体准确度较低,但高剂量(8毫克)DST(地塞米松抑制试验),仍在一些国家使用。所有的诊断测试都没有100%的特异性,结果可能在多达1/3的患者中不一致;异位肿瘤类型的差异,以及患者的年龄、性别和高皮质醇血症的严重程度都可能影响结果。
IPSS(岩下窦采血)测量垂体与外周静脉引流中的ACTH,长期以来一直是可靠排除异位ACTH产生的金标准,因为有潜在的患者风险,最好在专门的中心进行。兴奋前中枢-外周ACTH梯度小于2或兴奋后小于3,提示异位肿瘤;然而,假阴性和假阳性均有报道。测量泌乳素可能提高诊断的准确性,患者在IPSS时有高皮质醇血症,测量泌乳素是必要的。
在一个研究系列中,使用三或四种检查的结合,尤其是CRH和去氨加压素兴奋加上MRI,的非侵袭性的方法,如果诊断不明确,再行全身CT,大约一半的患者库欣病得到正确诊断,可能排除行IPSS。CT扫描阳性,CRH和去加压素兴奋阴性,MRI阴性,对库欣病的阴性预测值为100%。目前,这种结合了实验室和影像学检查的非侵袭性方法来鉴别垂体和异位分泌ACTH肿瘤可能仅限于专门的中心。
68Ga-DOTATE是与放射性68Ga同位素相结合的与1,4,7,10--四氮杂环十二烷(tetraazacyclododecane)-1,4,7,10-四乙酸(tetraacetic acid)(DOTA)共价键连接的修饰的(酪氨酸3Tyr3)-奥曲肽分子。这种放射性药物的半衰期约为1小时,与生长抑素受体具有类似奥曲肽的亲和力,可作为异位分泌ACTH的神经内分泌肿瘤PET显像的示踪剂。68Ga-DOTATATE定位了大约65%的这些肿瘤,包括在横断面成像中没有看到或没有明确识别的肿瘤,图像比单光子111In(铟)-DTPA-喷曲肽(pentateotide)更清晰,对小肿瘤更为敏感。因为有慢性炎症,可能发生假阳性,阳性扫描不能明确证明神经内分泌肿瘤是ACTH的来源,但68Ga-DOTATATE成像在指导临床治疗中是有用的。
68Ga(镓)同位素通常来自于衰变的68Ge(锗),而全球的68Ge(锗)供应正在耗尽。如果Ga同位素可以通过回旋加速器在当地生成,或64Cu(铜),其半衰期较长,可以集中生产,可作为DOTATATE、DOTATOC或DOTANOC偶联物的替代。
对鉴别库欣病和异位ACTH依赖性库欣综合征的临床考虑和建议
任何单一的实验室检测或联合检测都不能绝对区分垂体的和异位的分泌促肾上腺皮质激素肿瘤(高质量,强烈推荐)。我们建议同时使用临床证据和检测结果来指导治疗管理(高质量、强列推荐)。如果对异位ACTH综合征有很大怀疑,如UFC非常高的男性患者,严重低钾血症,或两者均有,则行颈部至骨盆薄层CT扫描是有用的(低质量,酌情推荐)。
如果MRI检测到直径大于或等于10毫米的垂体瘤,且动态检测结果符合库欣病,则无需行IPSS诊断(中等质量,强烈推荐)。由于MRI检测到的垂体病变可能是偶然发生的无功能腺瘤或其他鞍区肿块,且ACTH来源是异位的,因此应始终考虑临床表现。一些研究表明,对于大于6毫米的病灶,这是正确的,但并不是所有的专家中心都使用这个较低的临界值。对所有病变小于6mm的患者都应该行IPSS,病变大于或等于10mm的患者不需要行IPSS(中等质量,强烈推荐)。专家对肿瘤6-9mm有不同的意见,但大多数人建议行IPSS来确认这种情况下的诊断(中等质量,酌情选择)。值得注意的是,中心和国家之间的一些差异是基于介入放射影像学的可获得性。泌乳素测量可用于排除假阴性IPSS(中等质量,酌情推荐)。虽然IPSS在垂体定位方面具有较高的诊断准确性,但对于肿瘤向右侧或左侧转移,IPSS的可靠性还不够(质量中等,强烈推荐)。
使用大剂量DST和CRH兴奋试验的非侵袭性替代方法,如果两项试验均为阳性,则可预测库欣病。然而,如果检测结果不一致,行IPSS是必要的(低质量、酌情推荐)。新出现的数据表明,如果由经验丰富的多学科团队进行评估,行CRH和去氨加压素检测伴垂体MRI后,行全身CT扫描可能是可靠的替代选择(非常低的质量,酌情推荐)。
库欣病的并发症
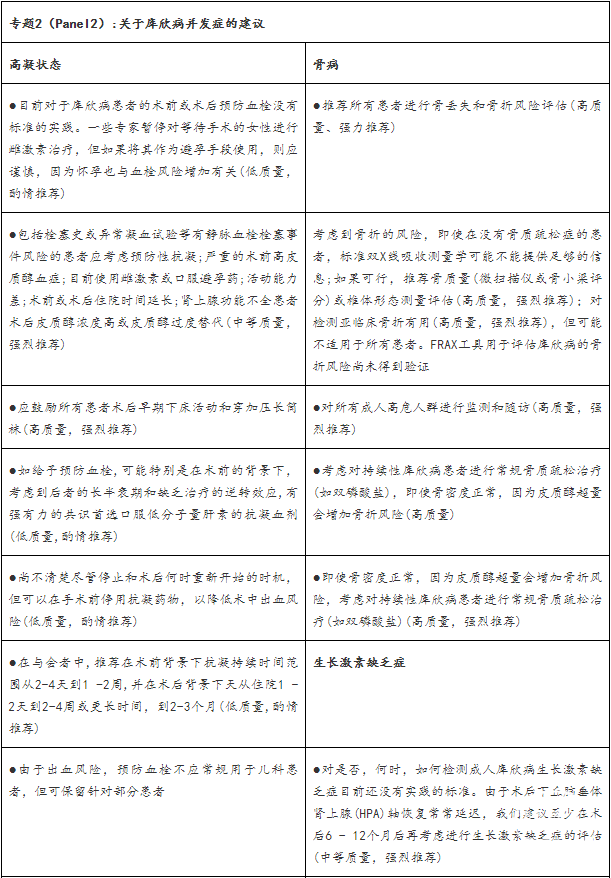
库欣病的管理策略应该考虑可能会损害患者的健康和生活质量的与库欣病相关的并存疾病和并发症。为了恢复正常的皮质醇水平,在库欣病特异性治疗之前,许多情况下,并存病应该被解决。关于库欣病并发症的临床考虑和建议在专题(panel)2中总结。

高凝状态
库欣综合征的高凝状态(Hypercoagulability)会导致血栓栓塞事件的风险增加,与皮肤萎缩和毛细血管脆弱导致的出血倾向增加相矛盾。大多数患者表现出活化的凝血级联反应,包括活化的部分凝血活酶时间缩短,纤维蛋白原、血管性血友病因子和因子VIII增加,以及升高的纤溶酶原激活物抑制剂-1和抗纤溶酶蛋白浓度介导的纤溶功能受损。凝血酶、血栓素A2和血小板的增加,以及抗凝因子(如维生素K依赖蛋白C和维生素K依赖蛋白S)的代偿性增加,也与高凝性有关。
与健康人群相比,内源性库欣综合征患者的静脉血栓栓塞事件(VTE)发生率比无功能垂体腺瘤手术患者的高10倍以上,优势比(OR)为17.82(95%CI 15.24-20.85)。VTE风险持续存在于库欣病手术后的头几个月,这表明高凝状态不能随着皮质醇的正常化而立即逆转。在肾上腺切除术后30天,VTE风险为3.4-4.75%,在一项长期研究中,双侧肾上腺切除术后血栓栓塞事件的OR为3.74(95%CI 1.69-8.27).在一研究系列的17例患者中,短期药物治疗(帕瑞肽、卡麦角林和酮康唑的各种组合)后的生化缓解似乎也没有逆转风险或诱导前-抗凝因子的改变(changes in pro-anticoagulation factors);2例UFC明显降低的患者发生肺栓塞。
回顾性研究的数据表明预防血栓,特别是延长到30天,可以降低术后静脉血栓栓塞的发生率。调查表明,增加了对预防血栓的必要性的认识,增加了临床实践中使用抗凝,但确定最可能受益的患者的策略仍在发展中。
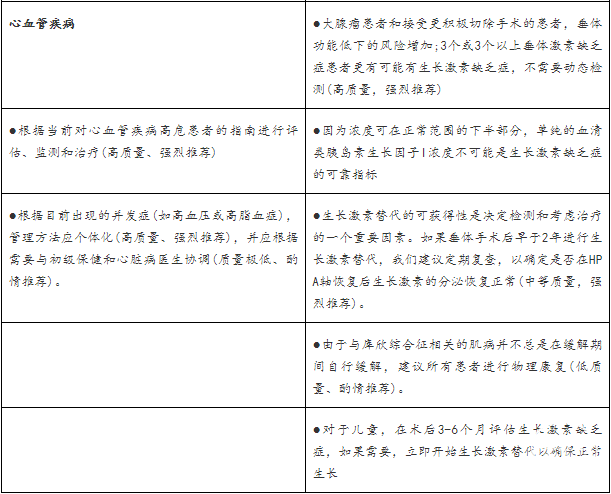
心血管病
库欣病患者表现出不良的心血管疾病风险,即使在治疗成功后也可能持续存在。尽管大多数患者仍然超重或肥胖,但缓解后内脏脂肪、皮下脂肪和总脂肪可减少。高达30%的患者存在2型糖尿病和血脂异常,16-64%的确诊患者报告有低HDL、高LDL和高甘油三酯。在许多患者中,但不是所有患者,缓解后2型糖尿病就会消失。包括左心室肥厚、向心性重构、扩张性心肌病、内膜中间层增厚、动脉粥样硬化斑块形成增加等心血管结构性改变,以及包括高血压、心脏衰竭等临床表现,改善。尽管高皮质醇血症有所缓解,但可能不会完全缓解(Structural cardiovascular changes improve, including left ventricular hypertrophy, concentric remodeling, dilated cardiomyopathy, increased intima media thickness, and increased formation of atherosclerotic plaques, as well as their clinical manifestations, including hypertension and heart failure, but might not fully resolve despite remission of hypercortisolism.)。
心肌梗死、卒中、和其他血管事件是活动性或持续性库欣病患者标准化死亡率(4.1-16.0)升高的主要原因。大多数研究表明,这些比率并没有完全正常化,,但在缓解后降低,在一项研究中,在一次垂体手术后缓解的患者在10年时有一个正常的标准化死亡率。因此,术前和术后对心血管危险因素进行筛查和风险评估是非常必要的。
骨病
骨骼脆弱(Skeletal fragility)是高皮质醇血症的常见和早期并发症,骨折可能是该疾病的第一个临床表现。30-50%的患者发生椎体骨折,主要与高皮质醇血症严重程度相关。对生长激素-胰岛素样生长因子I(GH-IGF-I)和下丘脑-垂体-性腺轴的抑制,以及甲状旁腺素脉动性的改变,导致成骨细胞数量和功能的减少,这可以从骨钙素和碱性磷酸酶等骨形成标志物血清浓度的降低中得到证明。腰椎双X线骨密度测定法可能显示骨密度(BMD)低,但即使骨密度在正常或骨质缺乏范围内的患者也可能发生骨折。尽管有报道称高皮质醇血症缓解后骨密度增加,但一些患者表现出持续的高骨折风险,男性高于女性。传统的骨质疏松治疗,如双磷酸盐,以及维生素D和钙的支持治疗,可以比单独的皮质醇正常化更快速地改善骨密度,并且对术后持续的高皮质醇血症患者有用,以防止进一步的骨丢失。关于在库欣病治疗后缓解的骨质疏松患者特殊骨治疗作用的数据是稀缺的。
生长激素缺乏症
在库欣综合征患者中,内源性和外源性糖皮质激素抑制生长激素的分泌,从而降低肝脏分泌IGF-I。尽管在成功的治疗和HPA轴恢复后,大多数患者甚至在缓解数年后,可以完全恢复产生生长激素,持续的生长激素缺乏可能会加重高皮质醇血症并发症,如骨的丢失、肌病和记忆减退。使用胰岛素耐受性或胰高血糖素刺激试验,成人生长激素缺乏症的患病率随诊断时间的不同而不同,在手术后2年内检测的患病率为50-60%,而在手术后2年以上检测的患病率为8-13%。在术后3年的中位缓解时间后,行GHRH-精氨酸试验,观察到65%的患病率,而36%的患者在放疗后得到缓解后99个月时被诊断有生长激素缺乏症。尚不清楚macimorelin兴奋试验的患病率。值得注意的是,IGF-I是诊断成人生长激素缺乏症的不敏感的筛查试验。
与其他生长激素缺乏症的病因相比,生长激素缺乏症在女性和青年患者中更为常见;一般来说,这些患者2型糖尿病、高血压、低骨量、骨折的患病率较高,生活质量较差。缓解期患者肌病可能部分与生长激素缺乏症有关。尽管术前IGF-I浓度在活动性库欣综合征中不能预测长期肌病的风险,但术后6个月低的IGF-I浓度强烈预示库欣综合征缓解后更严重的长期肌肉萎缩和无力。
生长激素替代可以改善与代谢综合征和心脑血管疾病风险相关的几种并发症。研究表明降低体重,腰围,总胆固醇和低密度脂蛋白胆固醇,以及生活质量和BMD会得到改善。相反,对于已经存在葡萄糖不耐受的患者,替代会使葡萄糖代谢恶化。生长激素替代尚未在对反向代谢综合(reverse metabolic syndrome)征和心脑血管并发症的随机、前瞻性试验中得到证实。
其他并发症
可以发现库欣病患者的感染、如中枢性甲减等一个或多个垂体轴功能障碍、性腺功能障碍、不孕症和其他并发症的风险增加。甚至在一些患者得到成功治疗后,身体和心理疾病通常影响生活质量。包括情感障碍、认知功能障碍和负面的疾病认知(affective disorders, cognitive dysfunction,and negative illness perception),等与先前高皮质醇血症相关的几个特征的持续存在,可对患者的健康产生持续影响。近端肌病(Proximal myo pathy)是库欣综合征的特征,尽管生化缓解,但可能持续存在。病状是多因素的,包括通过叉头基因盒O3通路(forkhead box O3 pathway)的蛋白降解,以及肌内脂肪的积累和无活动相关的肌肉萎缩(accumu lation of intramuscular fat and inactivity-associated muscle atrophy.)。此外,高皮质醇血症的缓解可诱发原有自身免疫系统疾病的加重。
由于这些并发症是最近的指南和综述的主题,因此在研讨会上没有具体讨论它们。
库欣病的初始治疗及监测复发
垂体手术
经蝶手术被推荐为库欣病的一线治疗方法。缓解,通常定义为术后血清皮质醇浓度低于55nmol/L(<2μg/dL),如果手术由有经验的外科医生进行,大约80%的微腺瘤患者和60%的大腺瘤患者可见缓解。缓解的患者需要糖皮质激素替代,直到HPA轴恢复。由于缓解可能延迟,监测到术后皮质醇谷值通常可以识别此类患者。偶尔,轻度皮质醇增多症、循环库欣病或术前经药物治疗的患者可达到缓解,术后无明显的低皮质醇血症。由经验丰富的外科医生在高病员量中心进行治疗,以及(如MRI检测、无侵袭行、小于10mm等)肿瘤特征似乎与缓解率的增加相关;尚不清楚大腺瘤的内镜治疗是否有潜在的增量获益。总的来说,并发症的发生率很低,经验丰富的外科医生比经验不足的外科医生的发生率更低。新发垂体功能低下(约10%的患者),以及永久性尿崩症、脑脊液漏和静脉血栓栓塞(VTE)(<5%的患者)是最常见的并发症;围手术期死亡率<1%。
仍不清楚如何衡量库欣病的外科专业技能。与其他医院相比,那些限定神经外科医生进行经蝶手术台数,从而增加外科医生经验的医院,效果更好,并发症更少,而且术后住院时间更短,费用更低。在开展经蝶手术的神经外科医生中,调查数据显示,那些做过超过200例经蝶手术的神经外科医生的并发症发生率最低。由4到5名专家组成的区域性神经外科团队,每250万居民可以获得最佳结果,降低成本,提高整体医疗质量。
对垂体手术的临床考虑和建议
我们建议库欣病患者在任何可能的垂体肿瘤专科卓越中心接受手术(高质量,强烈推荐),手术应由有经验的垂体神经外科医生进行,并由包括垂体内分泌科医生在内的多学科团队随访(高质量,强烈推荐)。应报告并公开垂体手术的结果和成本-效益(低质量,酌情推荐)。
监测复发
成功进行垂体手术后复发的特点是在最初缓解后再次出现高皮质醇血症的临床和生化特征。定义缓解的标准是术后即刻皮质醇浓度低或检测不到,但并不一定预示没有复发;一些患者在早期缓解后,术后皮质醇浓度很低(<2-5μg/dL),但可能在之后复发。已公布的复发率在5%-35%之间,一半的复发出现在术后5年内,一半出现在10年或10年以上。
需要终生监测复发情况(专题1)。在术前对去氨加压素有反应的患者中,术后早期对去氨加压素无反应(包括或不包括地塞米松或CRH[促肾上腺皮质激素释放激素])可预测复发风险,但大多数专家并不一致使用或不推荐使用。
与用于库欣综合征的初始诊断相比,LNSC、1-mg DST、UFC和去氨加压素试验对复发的敏感性较低,但特异性较高(表1)。LNSC可以在1-mg DST之前检测到术后皮质醇浓度升高,UFC通常是复发患者出现异常的最后一项检测。因此,LNSC可以允许开展早期干预,但由于结果的差异很大,建议进行系列试验。
在HPA轴恢复后应开始复发情况评估,如果临床有怀疑,应每年或更早地进行评估。然而,在实践中,临床表现和生物标志物可能是不一致的。此外,早期复发的诊断对何时及如何敢于治疗提出了额外的挑战。
对监测复发的临床考虑和建议
我们建议终生监测库欣病的复发(中等质量,强烈推荐)。术后动态检测可以潜在地预测复发(低质量,可自由选择的建议),但其在临床实践中的应用仍有待确定,因为一些预测复发的可能性低的患者可能在多年后复发。
在现有的检测中,LNSC对检测复发最敏感,应在术后HPA轴恢复后每年进行(质量中等,强烈推荐)。LNSC通常在DST和UFC前显示异常结果,尽管对复发的监测也应考虑到个别患者在初始诊断时哪些特定检查显示异常结果(中等质量,强烈推荐)。如果只有轻微的生化异常,没有高皮质醇血症的临床特征,可以考虑通过重复检测密切监测并治疗并存疾病,而不是治疗潜在的疾病(低质量,酌情推荐)。
重复垂体手术
有生化证据表明库欣病复发且MRI上可见肿瘤的患者可以考虑再次经蝶手术。在某些专家中心,尽管MRI没有发现腺瘤,但有成功再次手术的报告,通常病理上为ACTH染色腺瘤,或在初次手术时IPSS上可见中枢性ACTH梯度。
肿瘤因素,包括大小和存在鞍外延伸,应考虑是否适合再次手术,神经外科医生的经验可能在取得良好结果中发挥作用。文献中再次手术后的缓解率差异很大,从37%到88%不等,至少部分原因是缓解标准和随访时间不同。尽管一些研究报告重复手术的手术(如脑脊液漏、脑膜炎)和内分泌并发症(如尿崩症和垂体功能低下)的发生率明显高于首次手术,但在有经验的患者中严重的并发症发生率较低。
对重复垂体手术的临床考虑和建议
如果没有手术禁忌证,我们建议对有生化证据证明库欣病复发的患者,如果MRI显示肿瘤明显,则再次进行经蝶手术。特别是如果第一次手术不是在优秀的垂体肿瘤中心(低质量,酌情推荐)。如果MRI没有显示肿瘤存在,如果在高病员量中心有经验的外科医生认为可行,并有积极的病理或在初次手术前,可见IPSS的中枢性梯度(低质量,酌情建议)。
库欣病的药物治疗
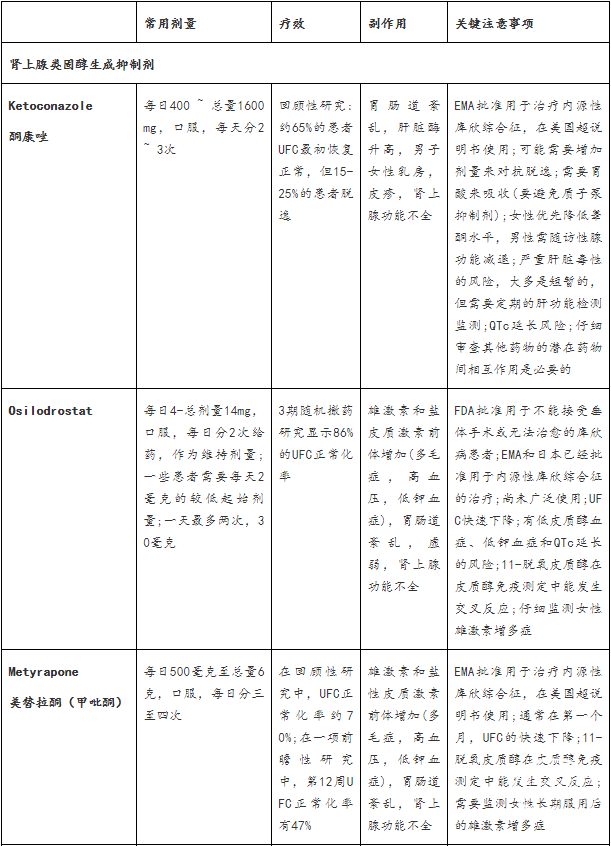
治疗库欣病的药物主要针对肾上腺类固醇生成、垂体的生长抑素受体和多巴胺受体以及糖皮质激素受体。药物可用于治疗持续或复发的库欣病患者和那些不适合或拒绝手术的患者的皮质醇增多症,以及控制接受放疗的患者的皮质醇浓度。已报告的3期临床试验结果的可用药物和研究药物见表2。
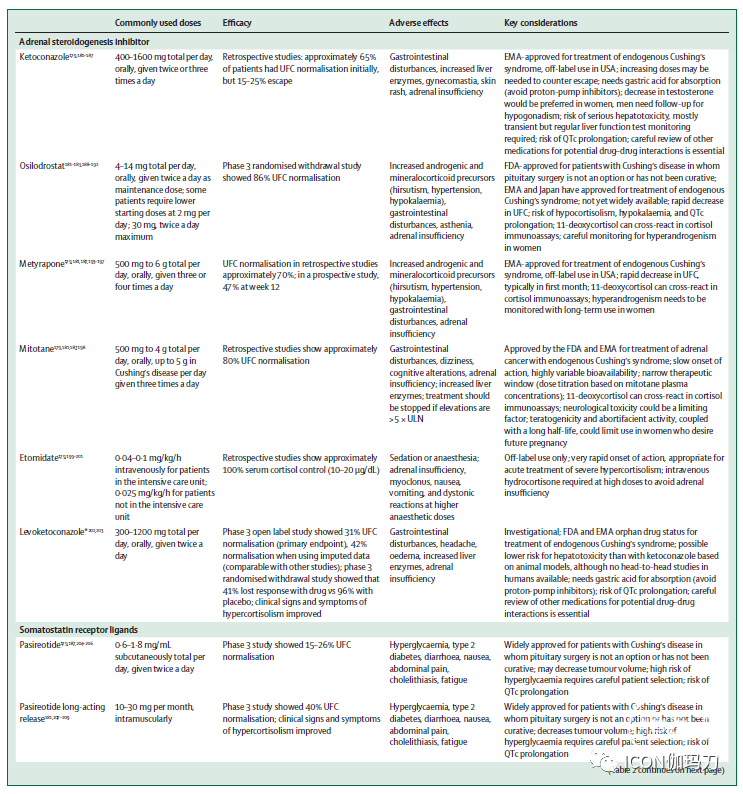
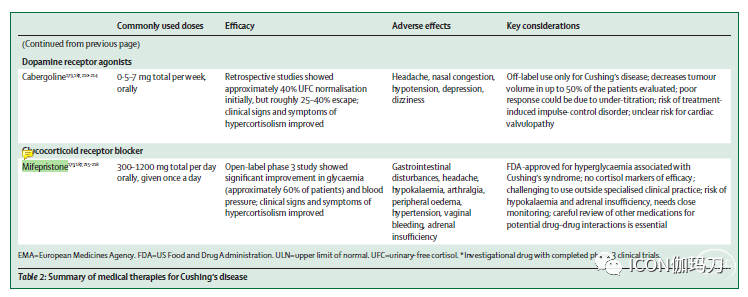
表2:库欣病的药物治疗总结
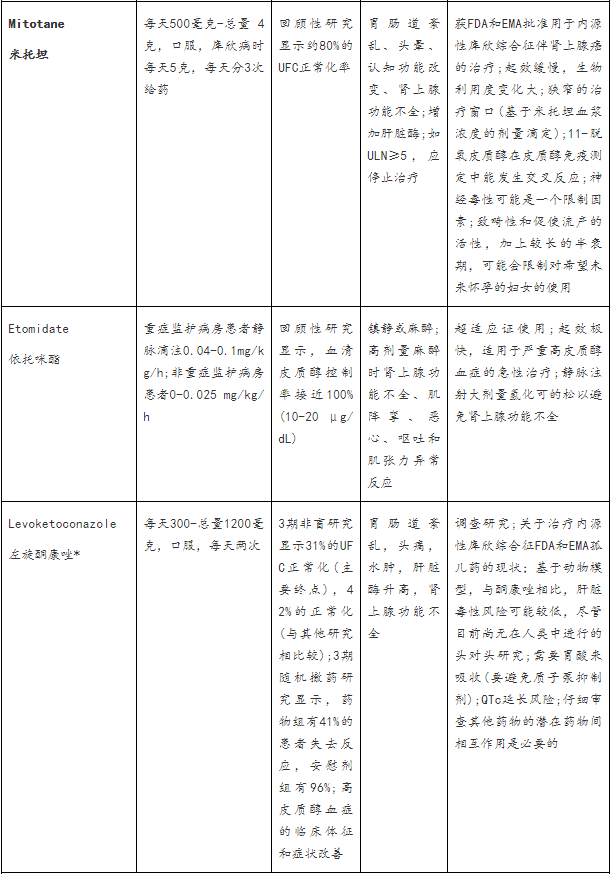
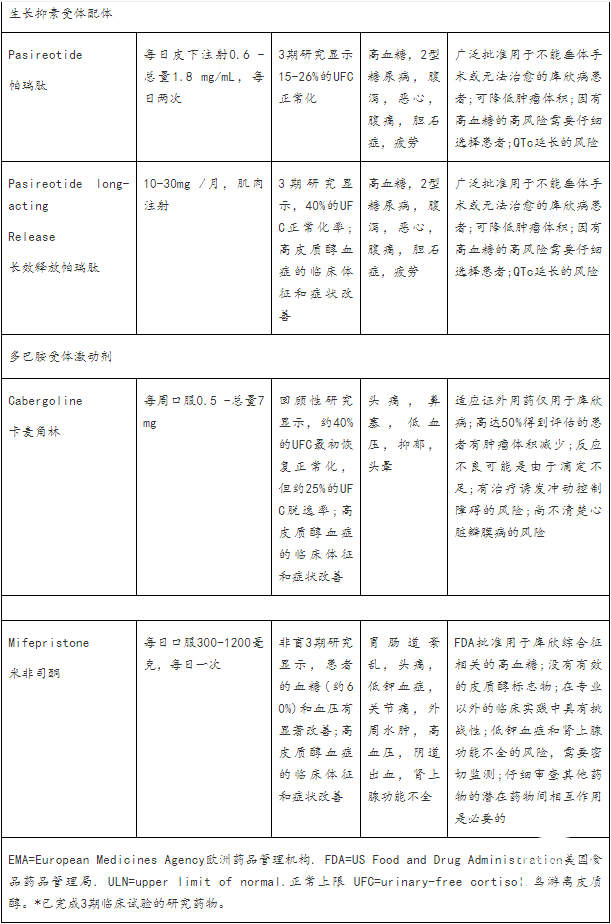
针对肾上腺类固醇生成
已经使用多年的肾上腺类固醇生成抑制剂,包括酮康唑、媒体辣条、米托坦和依托咪酯,以及最近批准的osilodrostat,可以阻断一种或多种肾上腺酶,减少产生和分泌糖皮质激素的合成或肾上腺雄激素,或同时减少两者。它们能有效控制皮质醇过量,但不能直接针对垂体分泌ACTH的腺瘤,也不能恢复HPA轴的昼夜节律。
当治疗是按剂量滴定(dose-titrated)以达到皮质醇正常化,而过度治疗有肾上腺机能不全的风险。另外,对于从一开始就使用高剂量肾上腺类固醇生成抑制剂阻断内源性皮质醇分泌和外源性糖皮质激素替代以避免肾上腺功能不全的患者(即阻断-替代方案),如果阻断不完全,就会有糖皮质激素过度替代的风险.一些与库欣病患者ACTH增加的不良事件和肾上腺激素在靠近阻断区盐皮质激素或雄激素活性的部位积聚有关。与潜在药物-药物相互作用相关的不良事件是治疗选择和应用的一个关键因素。
酮康唑
酮康唑可阻断多种肾上腺酶,包括早期参与类固醇生物合成途径的肾上腺酶。这种方法避免了雄激素和盐皮质激素前体的过度循环,但它也可以减少性腺类固醇的合成;男性可能会经历性腺功能减退和男性乳房发育(hypogonadism and gynecomastia),这限制了长期治疗。回顾五项研究310例库欣综合征采用平均剂量673.9毫克/天酮康唑治疗,平均随访12·6个月,64.3%的患者显示UFC正常化(中位50%,44.7-92.9%),但多达23%的最初有反应的患者失去生化控制。同样,从200例使用酮康唑的库欣病患者的最大回顾性研究中获得的数据表明,51例患者中有33例(64.7%)接受了超过24个月平均剂量600mg每日正常UFC浓度的治疗,但有15.4%的患者脱逸(escaped)。还观察到有库欣综合征临床特征的改善,包括体重和血压降低,糖代谢改善,肌肉无力减轻。
肝毒性(10-20%的患者)大多无症状,伴有轻度或中度肝酶升高(≤5ULN),通常出现在治疗的前6个月内;这些增加似乎不是剂量依赖的,并在2-12周内逆转剂量减少或停药。然而,由于在没有明显危险因素的患者中有严重肝毒性的报道,美国食品和药物管理局(FDA)引入黑盒子警告并建议用酮康唑治疗的真菌感染患者每周测试肝功能监测。值得注意的是,酮康唑用于库欣综合征在美国是标示外的。5%-20%的患者可见常见的胃肠道紊乱和肾上腺功能不全,患者可见皮疹。有几种药物与酮康唑相互作用;仔细审查病人的药物清单,以发现潜在的未确定的相互作用是必要的。
美替拉酮
11β-羟化酶抑制剂美替拉酮治疗120例库欣综合征(5项研究;平均剂量2127.5mg/d,平均随访8.7个月)显示71%的UFC恢复正常(中位75.5%;范围45.4-100%),初始反应后逃逸率高达18%随后的一项对164名库欣综合征患者的多中心回顾性研究报告称,在平均8个月的单药治疗下,平均起始剂量为每天1040mg,逐渐增加到每天1425mg,43%的患者通过UFC实现了生化控制。一项对31名库欣综合征患者(包括20名库欣病患者)的观察性研究显示,在治疗第一个月后,每天1000mg的中位剂量连续9个月诱导UFC(-67%)和LNSC(-57%)从基线水平快速下降。在最后一次就诊的患者中,70%的UFC患者和37%的LNSC患者持续恢复正常,1943例患者在9个月时失控,6个月时UFC浓度正常,2例患者LNSC正常。值得注意的是,11-脱氧皮质醇在血液和尿液免疫检测中可能与皮质醇产生临床相关的交叉反应。一项对50名库欣综合征患者的多中心前瞻性研究显示,23名(47%)患者在12周时UFC恢复正常(12周时,最终中位美替拉酮剂量为1500mg[250;有6例(12%)患者报告肾上腺功能不全接受美替拉酮治疗的患者。
库欣综合征的临床特征(在前瞻性研究中占66%)一般有改善,如血压、葡萄糖代谢、精神障碍和肌肉无力。
多毛、头晕、关节痛、疲劳、低钾血症和恶心是美替拉酮最常见的不良反应;肾上腺功能不全、腹痛和特异反应性皮炎(atopic dermatitis)少见报道继发于高雄激素血症的不良事件可限制长期治疗,尤其是女性患者。
Osilodrostat
概念验证(Proof-of-concept)和2期前瞻性研究表明,作为11β-羟化酶和醛固酮合成酶抑制剂,Osilodrostat可有效降低皮质醇,且耐受性良好。在一项3期、前瞻性、多中心、双盲、随机停药研究中,对137例库欣病患者进行了进一步评估。经过12周的非盲剂量滴定治疗和另外12周的非盲剂量优化治疗后,72例(53%)患者保持了正常的UFC,并符合随机化的条件。到第34周,在随机治疗期结束时,36例随机分配给osilodrostat的患者中有31例(86%)保持正常UFC,而35例随机分配到安慰剂的患者中有10例(29%)保持了正常UFC(OR 13.7,95% CI 3.7-53.4;p<0.0001)。
使用osilodrostat治疗也产生了临床改善。到48周时,患者的体重、血压、总胆固醇和低密度脂蛋白胆固醇较基线下降,空腹血糖和糖化血红蛋白浓度下降。生活质量和抑郁得分也有所提高。
8-11%的患者报告有恶心、贫血和头痛,约一半的患者报告有与低皮质醇血症相关的不良事件,主要发生在非盲剂量滴定期间。这些不良事件通常可以通过减少剂量或中断来控制,尽管在70名有一项或多项低皮质激素相关不良事件的患者中,有25名(36%)患者需要糖皮质激素替代治疗。此外,在3期研究中,137例接受治疗的患者中,有58例(42%)显示了肾上腺类固醇前体水平升高的影响,包括低钾血症和高血压;106名妇女中有12人(11%)报告多毛症。在另一项前瞻性3期研究中,44例患者中,接受osilodrostat治疗12周后,平均UFC低于或等于ULN的患者比例(77%)显著高于安慰剂(8%),临床特征、心血管疾病标志物和生活质量均有改善。在27%的患者中发生与低皮质醇相关的不良事件。
米托坦
米托坦可抑制多种类固醇生成酶,并在分泌类固醇的肾上腺皮质细胞中具有持久的肾上腺素溶解作用。在80%的患者中,它抑制高皮质醇血症,但起效缓慢,生物利用度变化很大。当需要治疗肾上腺功能不全时,CYP3A4介导的皮质醇快速失活诱导需要糖皮质激素替代剂量增加2-3倍,或采用阻断-替代策略。它很少用于库欣病。大多数研讨参与者认为,使用米托坦应限于肾上腺癌患者。
依托咪酯
最初是作为麻醉剂开发的,依托咪酯被证明能迅速使皮质醇浓度正常化,导致在重症监护环境中治疗的患者急性控制严重的高皮质醇症低剂量依托咪酯(0.4 -0.05mg/kg/h)可产生部分封锁;高剂量(0.5-1mg/kg/h)可完全阻断,并静脉注射氢化可的松避免依托咪酯引起的肾上腺功能不全。重症监护室外住院治疗的患者可使用极低剂量(0.025mg/kg/h),201,尽管这可能取决于当地的做法。
与脂质制剂相比,依托咪酯丙二醇制剂(the propylene glycol preparation of etomidate)较常与血栓性静脉炎和注射疼痛有关,同时也伴有额外的不良事件,如溶血、肾小管损伤,以及高剂量下的乳酸性酸中毒。
靶向垂体生长抑素和多巴胺受体
多巴胺激动剂卡麦角林(cabergoline)和生长抑素受体配体帕瑞肽(pasireotide)均用于有持续或复发性皮质醇增多症的库欣病患者,尽管只有帕瑞肽被监管机构批准用于该人群。对于有巨大残留肿瘤的患者和有促肾上腺皮质激素肿瘤进展,或Nelson综合征的患者,有可见的肿瘤控制(缩小和预防生长),,在临床上是重要的。
帕瑞肽(Pasireotide)
在一项对162名库欣病患者行皮下帕瑞肽进行治疗的3期研究中,15-26%剂量未增加的患者在6个月时UFC恢复正常。在UFC基线低于5倍ULN(正常值上限)的患者中,UFC正常化率较高,并且在大多数患者中有显著的临床改善。
另一项3期研究用10mg或30mg帕瑞肽长效缓释剂(LAR)治疗150例库欣病患者。在第7个月,两组患者中都有62例(40%)显示UFC正常化,无论剂量滴定如何,UFC基线低于2倍ULN的患者的反应最高。在第12个月,UFC正常化患者的血压改善比未UFC正常化的患者更大;无论UFC控制与否,BMI、体重、腰围和生活质量均有改善。长期扩展研究表明,在选择的继续研究的患者中,生化和临床改善可以维持长达5年。值得注意的是,在现实生活中,很少有关于长期治疗依从性的数据,而且几项研究表明治疗停药率很高。帕瑞肽LAR治疗也使在10mg剂量下,中位肿瘤体积减少了17.8%,在30mg剂量下,减少了16.3%。15例(43%)接受10mg剂量的患者和18例(47%)接受30mg剂量的患者中位肿瘤体积至少减少了20%。
对5例双侧肾上腺切除术后库欣病伴Nelson综合征患者的纵向研究表明帕瑞肽LAR能迅速抑制ACTH浓度,并在24周内持续降低。
三分之一到三分之二的库欣病肿瘤中含有USP8的突变,这些突变的肿瘤比野生型肿瘤表现出更高的SST5表达。因为帕瑞肽对该受体有很高的亲和力,USP8突变状态可能被证明是预测治疗反应的有用标记。
帕瑞肽的高血糖风险较高。在两项3期研究中,大约70%的患者报告与高血糖相关的不良事件,大约一半的患者需要使用新的抗糖尿病药物或调整剂量。高血糖的发生率被认为是由于胰岛素和肠促胰岛素分泌受到抑制,同时又受到较低程度的胰高血糖素抑制。因此,使用GLP-1受体激动剂或DDP-4抑制剂治疗被认为是有用的。
卡麦角林
卡麦角林用于库欣病的现有数据主要来自小型回顾性研究,表明有25-40%的患者出现生化正常化,有20-40%的患者在最初恢复正常的情况下失去控制。
一项对53名患者进行的回顾性多中心队列研究显示,中位卡麦角林剂量为每周2.3mg(范围为0.5-6.0),第一年有40%的患者UFC正常,但中位随访32.5个月后,只有23%的患者UFC持续恢复正常。控制率低可能是由于滴定不足,一项针对20名患者的小型研究显示,在24个月时,8名患者(40%)的UFC正常。25%-40%有完全应答者的体重、血糖控制和高血压得到改善,有50%的患者肿瘤缩小。Nelson综合征患者对卡麦角林也有反应,ACTH恢复正常和肿瘤收缩都有报道。尽管在此背景下,卡麦角林未获批准,但已被用于患有泌乳素瘤和其他垂体腺瘤(包括库欣病)的孕妇。
卡麦角林诱发的冲动控制障碍可能报道不足,表现为性欲亢进、病态赌博、过度饮酒、暴饮暴食和不受控制的购物。这种行为可能发生在卡麦角林治疗开始后的几个月内,或可能在随后出现,并在停止治疗后改善或解决。
用于帕金森病患者的高累积剂量麦角胺衍生多巴胺激动剂与心脏瓣膜返流风险相关。尽管一项关于泌乳素瘤的研究发现,剂量越大,轻度三尖瓣反流越频繁,但一项大型多中心研究发现,卡麦角林累积剂量与年龄校正后任何瓣膜异常患病率之间没有相关性。此外,一项荟萃分析显示,这种超声心动图检查结果是否具有临床意义仍是一个悬而未决的问题。
靶向外周组织糖皮质激素受体
米非司酮
糖皮质激素受体阻滞剂米非司酮对控制高皮质醇症的某些影响是有效的,无论其原因是什么。
一项对50名内源性库欣综合征患者(包括43名库欣病患者)进行的非盲研究表明,经过24周的治疗后,在同时诊断为2型糖尿病或糖耐量受损的25例患者中,有15例(60%)在口服糖耐量试验中,葡萄糖曲线下面积较基线至少显著降低了25%。21例高血压患者中有8例(38%)舒张压显著降低至少5mm Hg。胰岛素抵抗、体重、腰围和生活质量也有所改善。
12名患者血压升高,包括9名低钾血症患者,他们需要安替舒通(spironolactone),这与盐皮质激素受体激活相一致。子宫内膜肥大(Endo metrial hypertrophy)和不规则月经出血也被报道,这与米非司酮的抗孕激素活性一致。对7名有肾上腺功能不全体征和症状的患者使用地塞米松,强调需要仔细监测尽管使用米非司酮治疗。即使使用米非司酮,皮质醇浓度仍然很高,低皮质醇通常用于确认由于过度使用其他药物治疗而导致的肾上腺功能不全,但不能使用米非司酮。相反,只能利用临床特征。
在一项长期扩展研究中,对27例库欣病患者进行米非司酮持续治疗,结果显示ACTH浓度持续增加至少2倍,但3例大腺瘤患者从基线到25个月有肿瘤体积进展,与ACTH增加无关。应密切监测甲状腺功能,并根据需要调整甲状腺激素替代考虑到与米非司酮的药物相互作用的可能性,应仔细审查所有伴随的药物。
对药物治疗的临床考虑和建议
我们建议根据临床情况,包括皮质醇增多症的严重程度,对所有库欣病患者进行个体化药物治疗。监管批准、治疗可得性和药物成本因国家而异,往往会影响治疗选择。然而,在可能的情况下,重要的是考虑平衡治疗费用与无效或治疗不足的费用和不良后果。对于严重疾病的患者,主要目标是积极治疗以使皮质醇浓度正常化(或使用米非司酮时皮质醇的作用)。UFC和LNSC的多个系列测试用于监测治疗结果。专题(Panel)3和图2简要总结了关于如何最好地结合每种不同处理方案的研讨讨论。
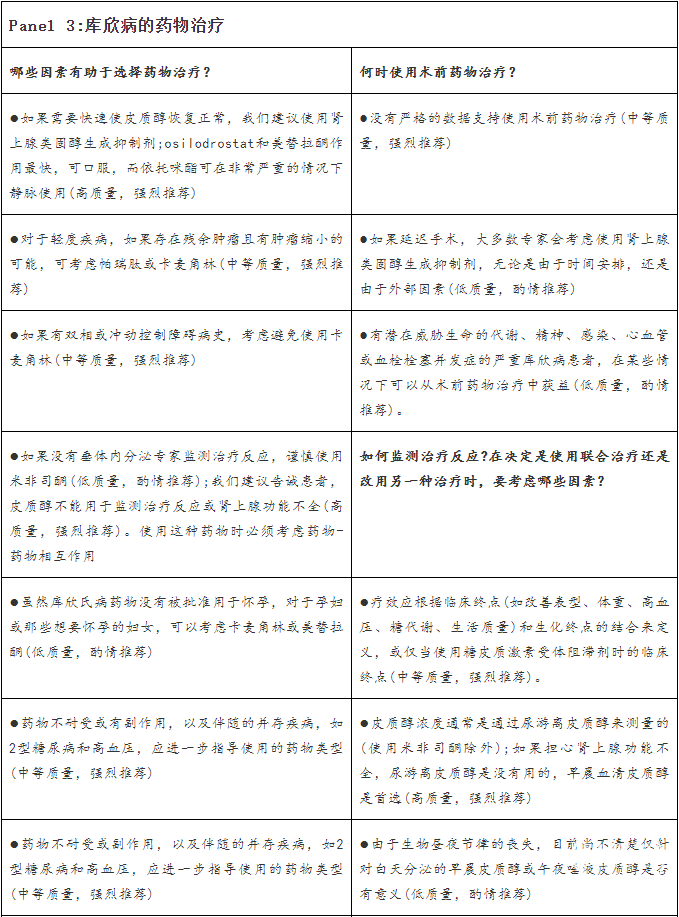
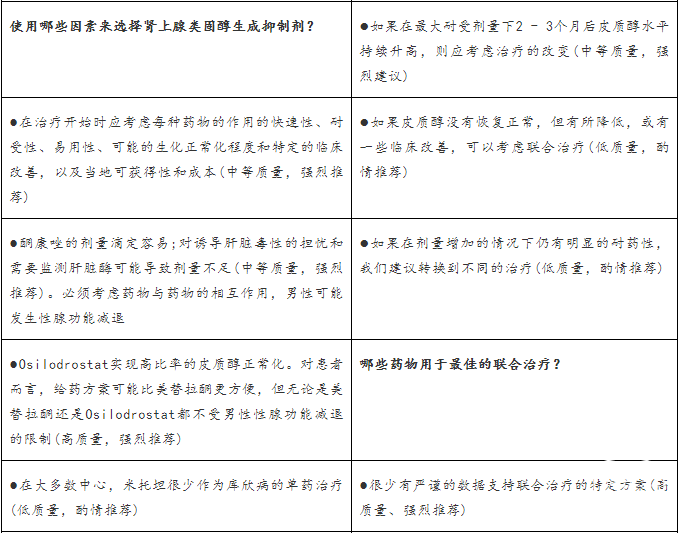
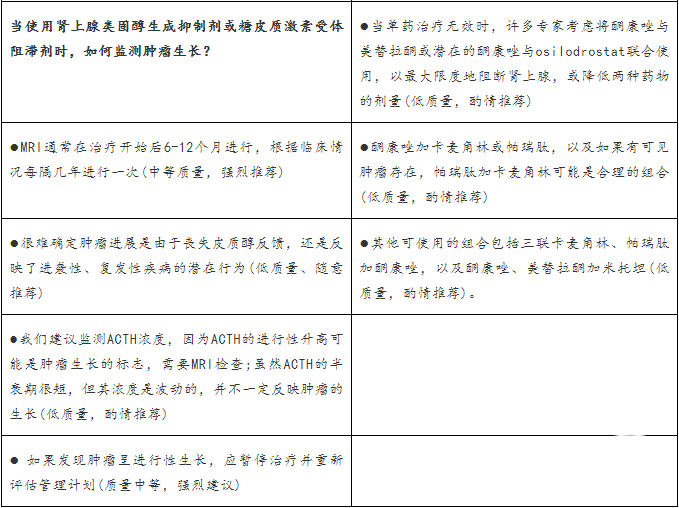

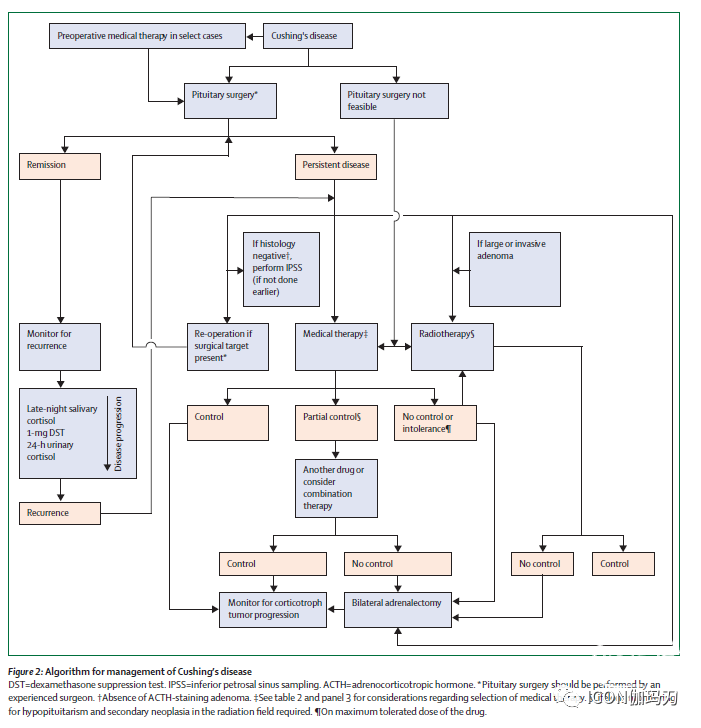
图2:库欣病管理流程
DST=地塞米松抑制试验。IPSS=岩下窦取样。ACTH=促肾上腺皮质激素。*垂体手术应由有经验的外科医生进行。†未见ACTH染色腺瘤。‡关于选择药物治疗的考虑见表2和图3。﹩在放疗野内终身监测垂体功能低下和继发性肿瘤。『药物的最大耐受剂量。
药物治疗的初步治疗选择
因为其可靠的有效性,通常首先使用肾上腺类固醇生成抑制剂。对于病情轻且MRI未见肿瘤的患者,通常首选酮康唑、osilodrostat,或美替拉酮。卡麦角林也可用于轻度库欣病;它的疗效较差,起效较慢,但需要的剂量较之前描述的药物的少。,因为肿瘤有缩小的可能性,对于轻到中度疾病和一些残留肿瘤的患者,可能会优先使用卡麦角林或帕瑞肽。然而,帕瑞肽高血糖的高发率将使对患者的选择至关重要。
对于重症患者来说,皮质醇的快速恢复是最重要的目标。使用osilodrostat和美替拉酮,通常在数小时内见效,而使用酮康唑则在数天内见效。静脉注射依托咪酯也能迅速起作用,如果病人不能口服药物,也可以使用。对于严重的皮质醇增多症患者,与类固醇生成抑制剂的联合治疗可能是必要的。然而,如果皮质醇增多症很严重,并且对优化的药物治疗无效,包括联合治疗,应考虑双侧肾上腺切除术,以避免恶化的结果。
其他病人的因素对最初的治疗选择可能很重要。例如,卡麦角林不应用于有躁郁症或冲动控制障碍病史的患者,但可能首选用于渴望怀孕的年轻女性。虽然这些药物都没有被特别批准用于怀孕,但对于选定的怀孕妇女,可以考虑采取预防措施。在这种情况下,考虑到怀孕期间正常的皮质醇水平较高,使用更高的皮质醇临界目标(如1.5倍ULN)。
米非司酮改善与皮质醇增多症相关的关键临床特征,特别是高血糖和体重增加。然而,在标准的临床实践中使用它可能是具有挑战性的,并经常恶化低钾血症。由于没有可靠的生化指标来监测皮质醇浓度,过度治疗增加了肾上腺功能不全的风险,而米非司酮及其代谢物的半衰期较长,如果出现肾上腺功能不全,需要几天的应激剂量糖皮质激素替代,最好使用地塞米松。由于皮质醇测量对剂量或安全性监测没有帮助,米非司酮只能由在库欣病方面有丰富经验的临床医生使用;同样重要的是,要告诉患者,特别是对于肾上腺功能不全的患者,监测皮质醇浓度是不可靠的。
很少有严格的数据支持联合治疗的特定方案,但已经描述过几个。当单药治疗无效时,许多专家考虑将酮康唑与美替拉酮联合使用,以最大限度地阻断肾上腺素,或允许两种药物的剂量都降低,尽管类固醇生成抑制剂加肿瘤靶向剂,如酮康唑加卡麦角林,特别是当存在可见肿瘤时,也是一个合理的组合。其他可以使用的组合包括卡麦角林、帕瑞肽和酮康唑三联;加上美替拉酮,酮康唑和米托坦。也应考虑到联合治疗加重不良反应的风险,如QTc延长。
监测药物治疗的反应
对所有患者,需要常规监测治疗疗效,包括测量皮质醇(米非司酮除外)、患者症状和并存疾病病,特别是体重、血糖和血压。此外,生活质量是重要的考虑因素,最好是通过患者报告的结果。皮质醇浓度通常用UFC来测量;值得注意的是,该检查对肾上腺功能不全的诊断没有帮助。早晨皮质醇、LNSC或两者均检查,都可以作为一种替代方法,但由于昼夜节律的丧失,目前尚不清楚只针对昼夜分泌是否有意义。然而,早晨皮质醇的值对于那些晚上服药剂量比早晨高的病人可能特别相关。使用帕瑞肽LAR使UFC和LNSC均得到正常化的患者比UFC单独正常化的患者有更好的临床结果,每日两次的较高的睡前治疗剂量可能有助于恢复昼夜节律模式,但没有严格的证据支持后一种方法。
由于设计、药物上调方案、比较组、纳入和排除标准、主要终点甚至在前瞻性研究中也存在差异,因此无论是对疗效还是不良反应,很难直接比较治疗结果。此外,一些药物尚未对库欣综合征进行前瞻性研究。当以UFC正常化为目标时,基于几个前瞻性临床试验的数据,osilodrostat的疗效最高,其次是美替拉酮(回顾性和前瞻性数据)、酮康唑(回顾性数据)、帕瑞肽(前瞻性数据)和卡麦角林(回顾性和前瞻性数据)。由于库欣综合征和糖尿病临床特征的改善被用作米非司酮疗效的标志物,该药物不能直接与其他可用治疗方法进行生化疗效的比较。
如果皮质醇浓度在用最大耐受剂量治疗2-3个月后持续升高,应考虑改变治疗。如果皮质醇没有正常化,但其有降低或有一些临床改善,可以考虑联合治疗。如果对治疗有明显的耐药性,我们建议转换到另一种治疗。然而,重要的是要确保剂量不足导致的疾病控制不足不会被误解为对治疗的耐药性。
对于肾上腺素靶向药物,由于ACTH-皮质醇反馈中断,可能会引起对肿瘤生长的担忧。然而,很难确定这种肿瘤进展是由于丧失这种反馈,还是反映了潜在的疾病进袭性(aggressive)、复发性的行为。我们建议监测促肾上腺皮质激素的浓度,因为大量的增加可能预示着新的肿瘤生长,且需要行MRI,但需要说明的是促肾上腺皮质激素的半衰期较短,浓度波动,因此它们可能不一定反映肿瘤的生长。如果发现肿瘤大小进行性增加,应暂停治疗,应重新评估管理。MRI通常在治疗开始的6-12个月后进行,每隔几年重复一次,视临床情况而定。
在联合治疗中,监测潜在的重叠毒性也很重要,特别是QTc延长,以及药物与药物的相互作用。
新生库欣病的初始主要的和术前药物治疗
当由于定位不良、临床有显著的侵袭性、或MRI上不可见(lack ofvisualisation)而无法成功切除腺瘤时,应采用初始主要的(primary)药物治疗。评估几种新型药物疗效的双盲、随机3期研究包括一小部分新生库欣病患者,范围从0%到28%。需要进一步的研究来证明不同的药物疗法在这种情况下的效用,无论是单药治疗还是联合疗法,同时也要考虑到这种治疗对腺瘤大小的潜在影响。
发表的关于库欣病患者术前药物治疗的证据很少,虽然存在区域差异,但它没有用于大多数患者。一项荟萃分析显示,在术前和术后辅助治疗中接受降低皮质醇药物的受试者之间,皮质醇正常化率没有差异。对于有手术禁忌证的重症患者或等待手术时间较长的患者,术前药物治疗可能是一种选择,或对需要快速控制皮质醇的皮质醇增多症有危及生命的并发症的患者医生调查显示,高达20%的库欣病患者术前使用酮康唑或美替拉酮进行治疗,特别是那些有较严重临床特征或不可见腺瘤的患者。
回顾性研究表明,术前平均4个月的使用类固醇生成抑制剂治疗可使皮质醇正常化率达到50-72%,尽管在只有三分之一的患者中观察到主观症状改善。从理论上讲,术前药物治疗导致的术后低肾上腺素发生率可以防止促炎性和促凝性状态的发生,但无论是否使用上述药物,包括静脉血栓栓塞(VTE)的术后并发症,,都是相似的。如果术前HPA轴恢复,术后可能不会出现肾上腺功能不全,因此很难判断是否缓解。
术前卡麦角林的价值可能有限,因为在前瞻性治疗6周的队列中,只有四分之一的患者皮质醇显著下降。
对新生库欣病初始主要的和术前药物治疗的临床考虑和建议
放射治疗主要用于经蝶手术后持续或复发疾病的患者或进袭性肿瘤生长的辅助治疗。约三分之二的患者在接受常规外放射放疗(通常以小于2Gy的剂量给予45- 50Gy)或立体定向放疗(以单次剂量或约20Gy的几次分割照射),治疗后数年内达到生化缓解。然而,最近的一系列立体定向放射外科,包括全鞍区放疗,显示较高的生化缓解率。在一项伽玛刀立体定向放射外科多中心研究中,278名参与者平均随访5.6年,其中193人(80%)实现了生化控制,158人(57%)维持了持久的高皮质醇症控制。248肿瘤控制率通常较高,在接受立体定向放射治疗的患者中,大约95%的患者的MRI上可观察到肿瘤体积减小或稳定。一项小型单中心质子束放射治疗研究显示,库欣病或Nelson病所致的持续性皮质激素腺瘤患者完全缓解(皮质醇或ACTH恢复正常),中位随访62个月,并发症发生率较低。
立体定向放射外科治疗也可作为手术风险高或拒绝手术的患者的主要治疗手段。在这个背景下,21例库欣病患者中17例(81%)在5年随访时内分泌缓解。放疗后,报道有复发和肿瘤生长,所以需要长期随访。
考虑到放疗后缓解之前的潜伏期,需要辅助药物治疗来控制高皮质醇血症;定期停药(periodic withdrawal)可评估皮质醇分泌,以评估治疗效果。虽然关于立体定向放射外科时酮康唑或卡麦角林治疗是否会限制疗效的数据存在差异,但它们在放射治疗时往往被暂时保留。
垂体功能减退是常规放疗和立体定向放射外科治疗最常见的副作用,在25-50%的患者中可见,通常随着时间的推移而增加。立体定向放射外科治疗继发性恶性肿瘤、颅神经损伤和卒中的风险较低。在接受立体定向放射外科的患者中,建议肿瘤与视交叉之间至少保持3-5mm的距离,且视交叉受照剂量小于8Gy,以限制治疗性损伤。与常规放疗相比,长期数据将有助于研究使用不同的立体定向放射外科模式(如伽玛刀[GammaKnife]、直线加速器、质子束),是否能降低卒中和垂体功能低下的发生率。
对放射治疗的临床考虑和建议
放疗最常用于促肾上腺皮质激素细胞腺瘤不完全切除术后持续高糖血症的患者,特别是如果肿瘤具有进袭性或侵袭性或被认为不可切除的(高质量,强烈推荐)。立体定向放射外科可能更方便,因为很少需要多疗程治疗,但避免视交叉暴露是关键(高质量,强烈推荐)。所有接受放疗的患者都需要终身监测垂体激素缺乏和复发(高质量,强烈推荐)。也应考虑放射野内继发性肿瘤的成像(高质量,强烈推荐)。
肾上腺切除术
对皮质醇过度持续或复发性库欣病患者对药物治疗不敏感,双侧肾上腺切除术提供直接控制,但这只考虑针对由于必然发生的肾上腺机能不全,需要终身糖皮质激素和盐皮质激素替代治疗的部分患者。腹腔镜双侧肾上腺切除术采用经腹膜或后腹膜入路,最大的研究系列显示并发症发生率为10-18%,死亡率小于1%。由于高ACTH肾上腺休眠兴奋(adrenal rest stimulation by high ACTH)引起的高皮质醇症长期临床旧病复发是罕见的(<10%),而超过80%的患者报告有BMI、2型糖尿病、高血压和肌肉无力的临床改善。
术后5-10年,25-40%的患者的双侧肾上腺切除术后促肾上腺皮质激素细胞先瘤的进展是一个长期受关注的问题。大多数患者可以用手术、放疗或药物治疗来治疗。然而,一部分进袭性肿瘤将继续增长,需要长期监测。2021年发表了一项欧洲共识,聚焦于这些患者的治疗。
双侧肾上腺切除术后促肾上腺皮质激素细胞腺瘤的进展似乎不受怀孕的影响,这可能使双侧肾上腺切除术成为有立即怀孕计划的女性患者首选的选择。然而,在大多数情况下,在初次垂体手术失败后,很少行双侧肾上腺切除术作为一线治疗,而且在肾上腺手术前的病程通常为3-4年或更长,这是否以及如何影响长期治疗结果仍是未知的。
对肾上腺切除术的临床考虑和建议
在库欣病患者中,双侧肾上腺切除术通常被认为是所有其他治疗方案失败后的最后手段(中等质量,强烈推荐)。然而,对于需要对皮质醇产生快速、明确的作用的有严重高皮质醇血症的患者,可以更早进行双侧肾上腺切除术,以避免不可控疾病的长期的全身系统性影响(中等质量,强烈推荐)。许多专家中心建议希望怀孕的库欣病女性患者在病程早期行双侧肾上腺切除术(中等质量,强烈推荐)。
双侧肾上腺切除术后,血浆ACTH和连续垂体显像被用于监测,间隔时间由临床情况决定,通常在术后6个月开始(高质量,强烈推荐)。如果临床怀疑促肾上腺皮质激素肿瘤进展,可能需要更频繁的评估(高质量,强烈推荐)。
额外的注意事项
库欣病的遗传学研究
促肾上腺皮质激素腺瘤的起源主要是散发的,是基于单个突变细胞的单克隆扩增。这些腺瘤大量表达EGFR,这是诱导ACTH产生的信号。36-60%的促肾上腺皮质激素细胞腺瘤存在USP8的体细胞激活驱动基因突变。这些突变导致EGFR持续过表达,从而使ACTH的超合成持续存在。很少见的是,会出现糖皮质激素受体NR3C1、BRAF致癌基因、去泛素化酶USP48和TP53的突变。具有家族性肿瘤综合征的患者,如MEN1、FIPA和DICER1,很少发展为促肾上腺皮质激素细胞腺瘤。据提出,促肾上腺皮质激素细胞肿瘤可以根据USP8驱动基因突变和临床行为进行分类。由于USP8突变状态可能预测经蝶手术后的复发,这样的基因组分类可能为未来更有针对性、个性化的治疗模式开辟新的途径。
儿童库欣综合征的诊断与管理
在18岁之前,内源性库欣综合征非常罕见。MEN1、RET、AIP、PRKAR1A、CDKN1B、DICER1、CABLES1和SDH相关基因的种系突变均可使儿童易患库欣病,尽管筛查通常只针对有家族病史或其他提示遗传综合征的征象的患者。
儿童库欣综合征最常见的症状是体重增加以及缺乏身高增加,这使得该疾病比在青春期后的青少年或成年人中的更容易被发现。使用胰岛素耐受性或胰高血糖素刺激试验,估计严重生长激素缺乏症(<9mU/L)的患病率为31%,部分生长激素缺乏症(<30mU/L)的患病率为54%。
24小时UFC(尿游离皮质醇)、LNSC(午夜唾液皮质醇)或夜间1mg DST(地塞米松抑制试验)记录到的高皮质醇血症均用于确诊。据最近广泛综述,诊断方法和检查表现与成人稍有不同。Dex-CRH测试对儿童无效。在6岁以上的儿童中,库欣病是引起库欣综合征的最常见的原因,而肾上腺原因在较小的儿童中更为常见。有一些测试流程可以区分ACTH依赖性和ACTH非依赖性库欣综合征。值得注意的是,IPSS(岩下窦采血)在儿童中的作用比在成人中的作用更为有限。
与成人相同,手术切除分泌促肾上腺皮质激素的肿瘤是儿童中的一线治疗。然而,与成人不同的是,由于出血风险,不应常规使用预防血栓,而应保留针对选定的儿科患者。如果治疗成功,肾上腺功能通常在12个月内恢复生长激素缺乏的评估。应在术后3-6个月进行,如果需要,立即给予生长激素替代以确保正常生长;生长激素替代能保证最终有足够的身高,但肥胖不能完全被逆转。对于需要药物治疗的儿科患者,酮康唑或美替拉酮通常与早晨皮质醇一起使用,以监测反应。不推荐使用帕瑞肽,在儿童中的Osilodrostat临床试验正在进行中。也可考虑用美替拉酮阻断-替代方案。
早期诊断和专家管理是至关重要的,因为长期的高皮质醇血症和经蝶窦手术或放疗相关的并发症发生率可能导致长期的不良健康结果。库欣综合征患儿应转诊到卓越的多学科中心,由儿科内分泌专家管理垂体疾病,协同专门的神经外科科室。如果存在潜在的遗传综合症,则有必要对儿童和家庭成员进行遗传咨询,并对与该综合征有关的其他疾病进行检查。
结论






