![]()
病例概述
![]()
2021年1月接诊一例来自宁夏的16岁男性患儿(身高:179cm,体重:83kg),主诉偶然发现颅内占位20个月余,进行性增大。患儿于20个月前偶然发现颅内占位,当地医生建议手术,由于患儿无症状,家长顾虑手术风险,拒绝手术,随访期间,发现肿瘤进行性增大,遂来我院要求手术治疗。门诊查体示:神清语利,自主体位,无明显神经系统阳性体征。头颅CT显示:小脑蚓部占位,稍高密度团块影,含颗粒钙化,四脑室受压变形;头颅MRI显示:小脑蚓部占位,大小约37.5×19.69×16.95mm,等T1稍长T2混杂信号影,不均匀强化。初步诊断:1髓母细胞瘤;2胶质瘤。(见图1和图2)

图1 患儿偶然发现颅内占位,随访20个月,肿瘤体积进行性增大,遂来京要求手术治疗。

图2 术前影像,CT显示:小脑蚓部占位,稍高密度团块样影,含颗粒钙化,四脑室受压变形;MRI显示:小脑蚓部占位,大小约37.5×19.69×16.95mm,等T1稍长T2混杂信号影,不均匀强化。初步诊断:1髓母细胞瘤;2胶质瘤。

鉴于肿瘤体积进行性增大,手术指征明确,完善术前检查,于2021年1月11日行“后正中开颅肿瘤切除术”。术中见肿瘤位于小脑蚓部,色灰黄、质软、血供不丰富、边界欠清晰,瘤体腹侧未突破四室顶壁侵犯脑干,手术顺利,肿瘤镜下全切,脑干背侧保护完好。术中冰冻回报:胶质瘤。术中出血约100ml,未输血,术毕安返ICU监护。

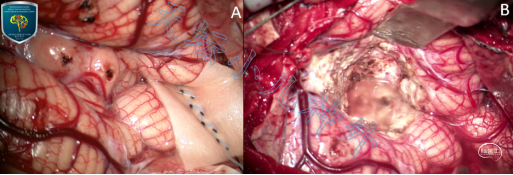
图3. A.肿瘤位于小脑蚓部,色黄质软、血供中等,术中冰冻提示胶质瘤;B.肿瘤全切,未突破第四脑室,脑干保护完好。
![]()
![]()
![]()
![]()
术后患儿状态好,复查头颅CT/MRI显示肿瘤切除满意。病理回报示:混合性神经元胶质肿瘤(WHO 1级);免疫组化:Olig-2(+),NeuN(颗粒细胞+),Syn(+),Ki-67(约1-3%,局灶8%),P53(-),IDH1(-),CD34(血管+),BRAFV600E(±);基因检测:BRAF基因突变。患儿恢复好,无新增神经系统阳性体征,未出现小脑缄默综合征,术后一周顺利出院,定期随访中。
![]()

图4. 术后当晚CT及术后一周MRI显示肿瘤切除满意。
![]()
治疗体会
![]()
本例我院影像报告提示髓母细胞瘤可能性大,但结合病史,肿瘤进展缓慢,位于小脑蚓部,对四室轻度压迫、对脑干无侵犯,应属低度恶性,最终证实为混合性神经元胶质肿瘤,而非髓母细胞瘤。反思影像科判断髓母细胞瘤,主要依据是本例肿瘤CT呈稍高密度伴点状钙化,是髓母细胞瘤常见影像特征。但若脱离病史,显然容易出现误诊漏诊,如前述病例提及,髓母细胞瘤CT影像可以呈现为罕见的低密度[1];而如本例,胶质瘤在CT影像上也可以呈现为少见的稍高密度。在此,进一步思考,人工智能(AI)在影像学上的发展方兴未艾,但若脱离临床第一手资料,单纯从影像学上分析,极易误诊。期望人工智能完全代替经验丰富的影像学专家,还有漫长的道路需要探索。
后颅窝手术易合并小脑缄默综合征(Cerebellar mutism Syndrome,CMS)。近40年来,描述CMS术语混乱,Thomale/Driever总结常用语包括:小脑性缄默症(Cerebellar mutism ,CM)、小脑缄默综合征(CMS)、后窝综合征(Posterior fossa syndrome,PFS)、短暂性小脑性缄默症(Transient Cerebellar mutism,TCM)、运动性缄默症(AM)和伴随构音障碍的缄默症等等[2]。由于术语不统一,国际报道儿童后颅窝肿瘤术后CMS发生率8%-32%不等[3-5]。
在此,对两个临床易混淆概念简单梳理一下:1、后颅窝综合征(Posterior fossa syndrome,PFS)又称小脑缄默综合征(cerebellar mutism syndrome,CMS),儿童髓母细胞瘤术后常见[5-7],通常表现为短暂性语言障碍[8],同时伴有共济失调、易怒、情绪不稳定等[5-7, 9, 10]。2、中枢性球麻痹(central bulbar paralysis),则是后组颅神经受损表现。后颅窝手术,若造成舌咽、迷走神经及共同起始核团受损,患儿术后表现为声音嘶哑、吞咽困难、饮水呛咳、咽反射消失等,我们称之为真性球麻痹;舌咽、迷走神经的运动核受双侧皮质脑干束支配,当一侧损害时不出现球麻痹症状,咽反射存在,称为假性球麻痹。简言之,真性球麻痹是舌咽/迷走等周围神经受损的表现,而假性球麻痹是舌咽/迷走中枢核团受损的表现。

对于CMS的成因,普遍认为是齿状核-丘脑-皮层通路(DTC pathway)受损[11]。DTC通路是小脑皮质回路的上升部分,起源于齿状核,由穿过同侧小脑上脚的轴突、交叉于中脑被盖的轴突和对侧丘脑腹外侧核的突触组成[12]。该传导通路通过运动前区、运动区、前额叶和额叶皮质的二级神经元终止,因此,除了参与运动外,与儿童认知行为关系密切[13]。CMS相关的风险因素包括:肿瘤是否侵犯脑干、齿状核、小脑中脚;肿瘤类型(髓母多见、SHH型少见[14])、肿瘤体积(直径>5cm)[15] 等,年龄方面尚存在争议[16],笔者体会,年龄偏大的学龄后儿童更易发生术后CMS。大量研究证实脑干受侵与CMS密切相关[17, 18],具体机制可能是:(1)术中操作及牵拉造成脑干及小脑脚的水肿;(2)术前肿瘤压迫引起脑干白质传导束受压弯曲,术后减压空腔形成,进一步导致传导束弯曲,引起白质传导束轴突受损,术后CMS发生。Doxey等回顾了20例CMS,脑干受累的病人术后CMS发生率100%[19],而小脑蚓部的切开及脑积水是否导致CMS目前尚存争议。
本例患儿,起源于小脑蚓部的肿瘤切除,并未造成术后缄默。笔者认为,后颅窝手术造成缄默的影响因素,依次排序为::1、肿瘤对脑干的侵犯;2、来源于PICA的供血动脉的损伤;3、瘤体巨大、瘤周水肿明显,切除肿瘤时对齿状核的损伤;4、小脑上蚓部的损伤。本例肿瘤起源于下蚓部,与脑干无关,行根治性切除,不会造成术后缄默。需要指出,部分学者,过分强调术中小脑蚓部的保护,仅通过小脑延髓裂切除后颅窝巨大肿瘤,既不利于肿瘤的全切,也说明该学者不了解儿童术后缄默产生的机制。特别是髓母细胞瘤等起源于小脑蚓部的肿瘤,对瘤体及下蚓部进行根治性切除是必要的。
CMS患儿多数经过1-3个月的康复性训练,可自行恢复语言功能;当患儿术后即出现认知及运动功能障碍,语言功能恢复的时间会延长。术后出现CMS,可能是齿状核损伤所致;而术后2-3天延期出现的CMS,则可能是来源于PICA的供血动脉电凝切断,术后血流再分配,齿状核局部缺血、水肿引起[20]。前者恢复慢,CMS持续时间长;后者恢复快,CMS持续时间短。
-END-




