文章来源:中国脑血管病杂志, 2021, 18(9):607-614.
作者:康军 苟芸 叶琦 梁晓珊 石琳然 王萌 李可 张绪梅
基金项目: 国家自然科学基金 (81373003、81874262)
通信作者: 张绪梅, Email: zhangxumei@tmu. edu.cn
摘要:目的 探讨同型半胱氨酸(Hcy)干预通过DNA 甲基化途径对于局灶性脑缺血大鼠大脑皮质区神经干细胞(NSCs)增殖分化的影响。方法 将36 只健康雄性成年清洁级Sprague Dawley(SD)大鼠完全随机分为假手术组、大脑中动脉闭塞(MCAO)模型组(MCAO 组)、Hcy + MCAO 组,每组12 只。在MCAO建模手术之前的7 d内,假手术组与MCAO组腹腔注射等渗盐水[5 ml/ (kg·d)],Hcy + MCAO 组注射2% Hcy 溶液[5 ml/ (kg·d)]。采用改良Longa 法构建MCAO 模型。在MCAO模型建立后第5 天开始,连续3 d 注射5-溴-2-脱氧尿嘧啶[BrdU,50 mg/ (kg·d)]标记新生成的神经细胞。MCAO 手术后7 d,苏木素-伊红染色观察大脑皮质区的病理变化。分别在手术后7 d 和14 d采用免疫荧光双标双皮质素(DCX)/ BrdU、神经元核蛋白(NeuN)/ BrdU 检测内源性NSCs 的增殖和分化情况,采用免疫荧光双标DCX/5-甲基胞嘧啶(5mC)和NeuN/5mC 检测大脑皮质DNA 甲基化水平。结果 3 组大鼠大脑皮质区正常神经细胞数量差异有统计学意义(F=49.55,P<0.01),MCAO 组正常神经细胞数量[(54 ± 10)个/视野]明显少于假手术组[(99 ± 13)个/视野],Hcy +MCAO 组正常神经细胞数量[(32 ± 8)个/视野]明显少于MCAO 组,差异均有统计学意义(均P<0.05)。MCAO 组皮质区DCX+/BrdU+ 、NeuN+/BrdU+ 、DCX+ /5mC+ 和NeuN+ /5mC+ 数量[分别为(7.8±1.1)、(9.3 ±0.9)、(8.3 ±0.5)和(9.7 ±1.8)个/ mm2]较假手术组均增多[分别为(0.5 ±0.5)、(0.5 ±0.5)、(1.8 ±0.7)、(2.2 ± 0.7)个/ mm2;均P<0.05],Hcy+ MCAO 组上述阳性细胞数量[分别为(3.7 ±0.8)、(2.8 ±0.7)、(2.5 ±0.5)和(2.5 ±1.0)个/ mm2 ]均较MCAO 组少(均P<0.05)。结论 Hcy 水平升高可能降低MCAO 大鼠大脑皮质区DNA 甲基化水平并抑制其神经发生。
缺血性卒中是全球可预防死亡的第二大原因,约占所有卒中的80% [1-2]。神经干细胞(neural stemcells,NSCs)是一种多能干细胞,具有自我更新和分化成多种细胞谱系的潜力,如分化为神经细胞、星形胶质细胞和少突胶质细胞[3]。神经发生是NSCs 增殖分化以替代丢失或受损神经细胞的过程,是卒中后恢复的重要机制[4]。
DNA 甲基化是甲基转移酶将甲基转移到胞嘧啶的C5 位置形成5-甲基胞嘧啶(5-methylcytosine,5mC)的过程[5]。同型半胱氨酸(homocysteine,Hcy)是非必需氨基酸,为甲基化过程中的中间体[6-7]。Hcy 浓度升高可能会增加S-腺苷同型半胱氨酸浓度,降低S-腺苷-L-蛋氨酸与S-腺苷同型半胱氨酸比值从而降低DNA 甲基化[8]。DNA 甲基化在NSCs的增殖分化的调控中也起关键作用[9-11]。
高同型半胱氨酸血症是心脑血管疾病的危险因素[6,12]。Hcy 对NSCs 有毒性作用[13],但相关研究较少且Hcy 在卒中情况下损伤NSCs 的机制尚未完全清楚。本研究利用大鼠大脑中动脉闭塞(middlecerebral artery occlusion,MCAO)模型,采用免疫荧光标记双皮质素(doublecortin,DCX;神经发生的标志物)和5-溴-2-脱氧尿嘧啶(bromodeoxyuridine,BrdU;标记新生成的神经细胞)研究NSCs 的增殖情况,标记神经元核蛋白(neuronal nuclear protein,NeuN;神经细胞分化的标记)和BrdU 研究NSCs 的分化情况[14-15],标记DCX/5mC、NeuN/5mC 检测梗死皮质区的DNA 甲基化水平[5],探讨Hcy 对皮质区NSCs增殖分化的影响及相关机制。
1 材料与方法
1.1 实验动物与分组
健康雄性清洁级Sprague Dawley(SD)大鼠,6 ~8 周龄,体质量为200~220 g,购于维通利华实验动物技术有限公司[中国,北京;许可证号:SCXK(京)2014-0008]。在标准环境下适应性喂养7 d 后,将36 只大鼠按数字表法随机分为3 组:假手术组、MCAO 模型组(MCAO 组)、Hcy + MCAO 组,每组12 只。天津医科大学动物伦理委员会批准了本研究中的实验方案(伦理号:TMUaMEC、2012016)。
1.2 药品与试剂
Hcy 标准品(Sigma 公司,美国),BrdU 粉末(Sigma 公司,美国),小鼠抗大鼠BrdU 单克隆抗体(1∶ 50;Sigma 公司,美国),兔抗大鼠DCX 多克隆抗体(1∶ 200;Abcam 公司,英国),NeuN 单克隆抗体(1∶ 100;Abcam 公司,英国),小鼠抗5mC 单克隆抗体(1∶ 200;Epigentek 公司,美国),四乙基异硫氨酸罗丹明(tetramethylrhodamine,TRITC)标记荧光山羊抗兔二抗(1∶ 100;北京中杉金桥科技有限公司),异硫氨酸荧光素(fluorescein isothiocyanate,FITC)标记荧光山羊抗小鼠二抗(1∶ 100;北京中杉金桥科技有限公司),柠檬酸钠-乙二胺四乙酸二钠抗原修复液(碧云天生物技术研究所,中国),山羊血清(博士德生物技术有限公司,中国),其他常用试剂均为国产分析纯。
1.3 药物干预
MCAO 手术前7 d 对实验动物进行干预,假手术组与MCAO 组大鼠腹腔注射等渗盐水[5 ml/(kg·d)],Hcy + MCAO 组腹腔注射2% D,L-Hcy溶液[5 ml/ (kg·d)][16-17]。
1.4 建立MCAO 模型
采用Longa 改良法[18]对大鼠进行MCAO 手术:腹腔注射10%水合氯醛(3 ml/ kg)麻醉大鼠,将大鼠仰卧固定在手术台上,刮去大鼠颈部毛发,在颈部中央切开2.0 ~2.5 cm 的切口,分离左侧颈总动脉、颈外动脉、颈内动脉,结扎颈总动脉和颈外动脉及其分支,在颈总动脉分叉处插入线栓直至感觉到轻微阻力(约插入20 mm),随后用手术缝线固定栓线和颈内动脉,并缝合切口。假手术组大鼠不在颈总动脉分叉处插入线栓,其他操作同模型组。大鼠清醒后,采用四分制评分法进行神经功能评分[18]:0 分,无神经系统症状;1 分,无法完全伸展对侧前爪;2 分,爬行时旋转,向对侧坠落;3 分,无法独立行走;4 分,昏迷(未恢复)。1~3 分为成功模型,纳入研究。大鼠发生神经功能障碍时也可表示MCAO 模型建立成功[19-20],主要表现为左侧Horner 征(瞳孔缩小、上眼睑下垂、眼球内陷)[20],且右前肢瘫痪,提尾悬空时右侧前肢内收、屈曲,自主运动时身体向右侧倾倒或转圈[20]。
在尽量少使用实验动物的原则下,为保证后续实验正常进行,实验开始时大鼠用量共45 只(每组15 只),当每组造模成功的大鼠数量为12 只时,其他大鼠不再进行后续造模和干预实验。
1.5 腹腔注射BrdU
BrdU 标记为研究神经发生最常用的技术[21]。在模型建立后第5 天开始,各组大鼠每日腹腔注射1 次BrdU[50 mg/(kg·d)],连续3 d,用以标记大鼠脑组织内新增殖的神经细胞。
1.6 脑组织石蜡切片制作
分别在MCAO 手术后7 d 和14 d 时,每组取6 只大鼠的脑组织用于制作石蜡切片。腹腔注射10%水合氯醛(3 ml/ kg)麻醉大鼠,心脏灌注120 ml 等渗盐水,然后用100 ml 4%多聚甲醛缓慢固定。麻醉后颈椎脱臼处死大鼠,取出大鼠全脑组织,于4%多聚甲醛中固定过夜。经过脱水处理后进行石蜡包埋,蜡块冷却后用切片机切片,切片厚度为6 μm,将患侧大脑组织沿着冠状面方向切开。
1.7 苏木素-伊红染色
取上述MCAO 手术后7 d 时的大鼠脑组织制作的切片脱蜡、水化,用磷酸盐缓冲液洗3 次,每次浸泡5 min。用1 ×苏木素染色液对切片进行染色,每张切片滴加50 μl 染色液,室温孵育10 min 后用自来水冲洗反蓝,再用磷酸盐缓冲液洗3 次。用醇溶性伊红染液进行染色,每张切片滴加50 μl 染色液,于常温放置1 min 后用自来水冲洗。切片过梯度酒精脱水,每次5 min,晾干后过2 次二甲苯,每次10 min。自然晾干后中性树胶封片。在显微镜下观察拍照。依据文献[22-23]中的方法对图像中正常神经细胞进行计数。
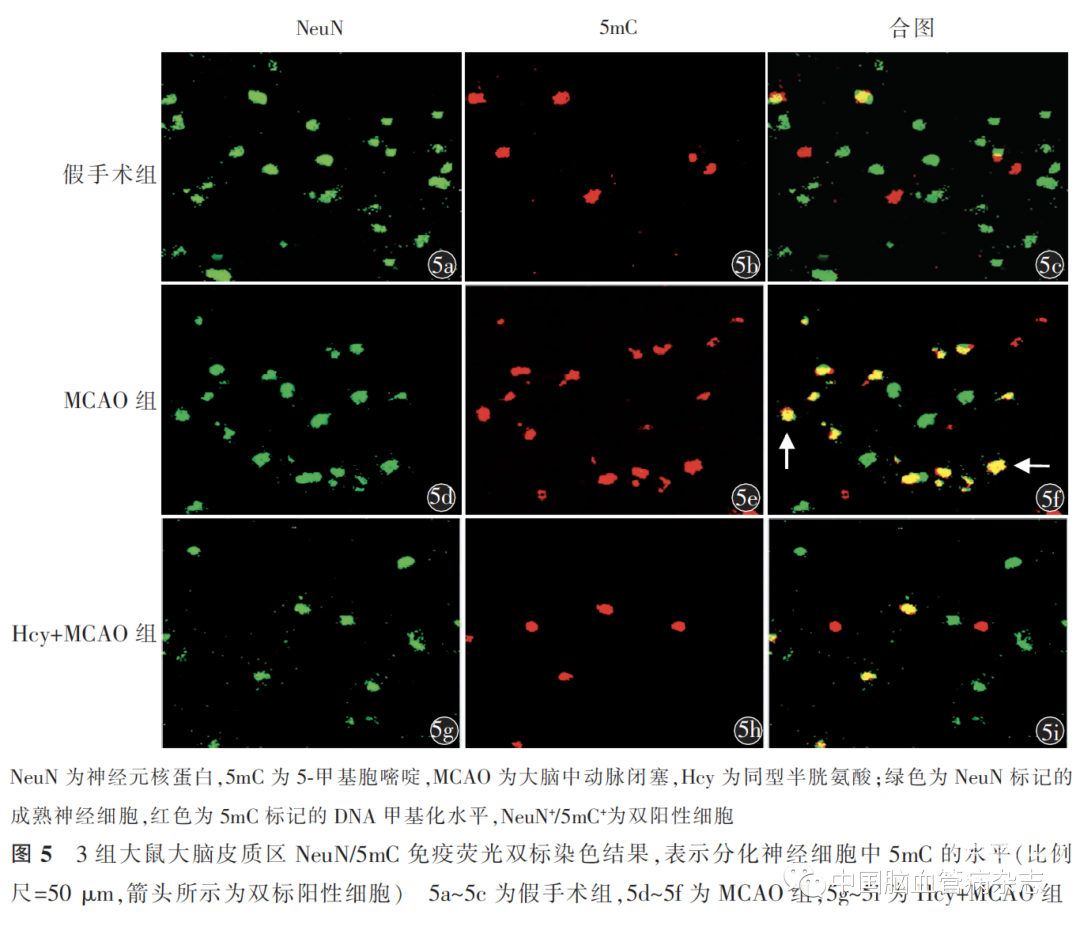
1.8大鼠大脑皮质区免疫荧光双标记监测
取上述MCAO 手术后7 d 和14 d 时的大鼠脑组织制作的切片脱蜡、水化。于2 mol/ L 盐酸中浸泡30 min,37 ℃,0.1 mol/ L 硼酸洗2 次,3%过氧化氢孵育10 min。进行抗原修复,自然冷却后滴加10%山羊血清封闭1 h,加入一抗混合液后4 ℃过夜。次日磷酸盐缓冲液洗3 次,加入相应二抗混合液,室温避光孵育1 h,再用磷酸盐缓冲液洗3 次,滴加抗荧光淬灭剂后封片。在荧光显微镜(IX81,Olympus,日本)下观察拍照,每张切片取皮质区的6 个不同视野,结果以每个视野下的BRDU+/BrdU+ 、NeuN+ /BrdU+、BRDU+ /5mC+和NeuN+ /5mC+双阳性细胞的平均数表示。
MCAO 手术后7 d 时观察内源性NSCs 增殖迁移情况,手术后14 d 时检测内源性NSCs 分化情况,及对应时间点的增殖迁移神经干细胞和分化神经细胞中的5mC 水平。
1.9 统计学分析
应用SPSS 20.0 软件对数据进行统计学分析。采用Kolmogorov-Smirnov 检验对计量资料进行正态性分析。正态分布的计量资料以x- ± s 表示,多组间比较采用单因素方差分析,若组间差异有统计学意义,则采用SNK-q 法进行组间两两比较。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠大脑皮质区神经细胞组织形态及数量的变化
结果显示,假手术组大脑皮质区神经细胞胞体未见异常,细胞排列有序,形态规则,细胞核正常,细胞染色均匀。MCAO 组梗死灶皮质神经细胞与假手术组相比排列紊乱,细胞核变形,核固缩,细胞染色加深。Hcy + MCAO 组皮质神经细胞有变性坏死、肿胀的现象,核固缩更为严重,正常细胞数量较少。见图1。
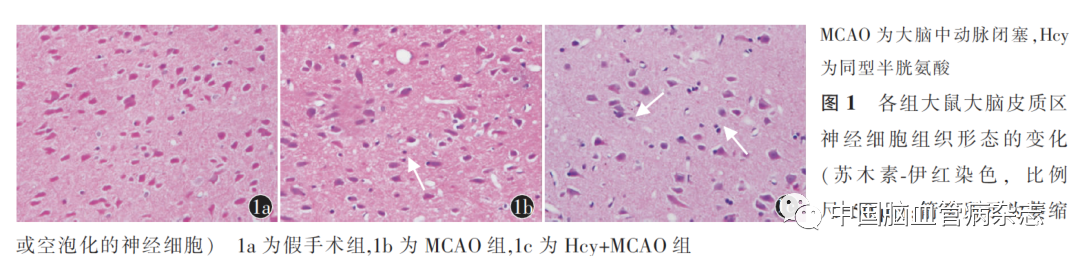
3 组正常神经细胞数量差异有统计学意义(F =49.55,P<0.01),MCAO组正常神经细胞数量[(54 ±10)个/视野]明显少于假手术组[(99 ± 13)个/视野],Hcy + MCAO组正常神经细胞数量[(32 ± 8)个/视野]明显少于MCAO 组,差异均有统计学意义(均P<0.05)。
2.2 Hcy 对大鼠大脑皮质区NSCs 增殖的影响
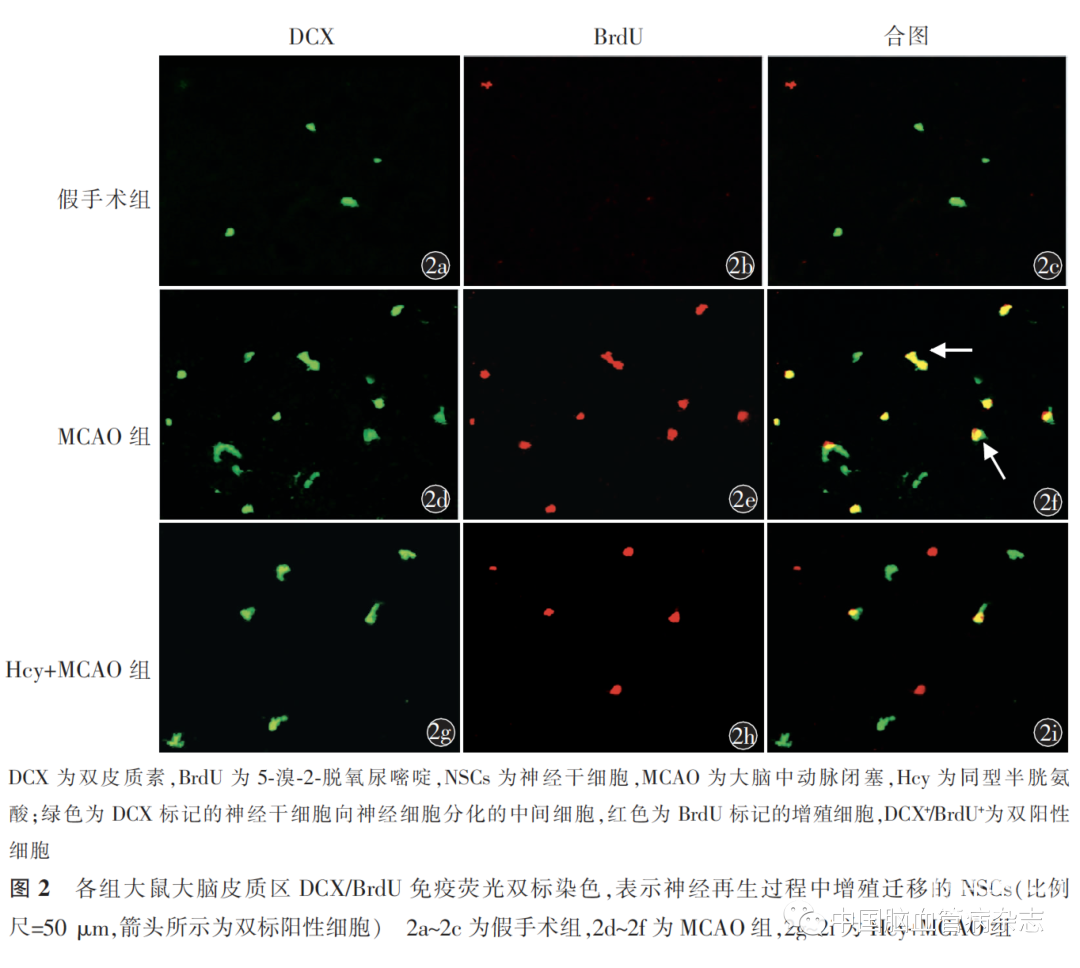
MCAO 手术7 d 后脑组织切片DCX/BrdU 免疫荧光双标结果可见,与假手术组[(0.5 ±0.5)个/ mm2]比较,MCAO组的/ BrdU+数量[(7.8 ±1.1)个/mm2]增多(P<0.05);Hcy+ MCAO 组的BRDU+ /BrdU+的数量[(3.7 ±0.8)个/ mm2]少于MCAO 组,差异有统计学意义(P<0.05)。3 组BRDU+/BrdU+数量差异有统计学意义(F=104.4,P<0.01)。见图2。
2.3 Hcy 对大鼠大脑皮质区NSCs 分化的影响
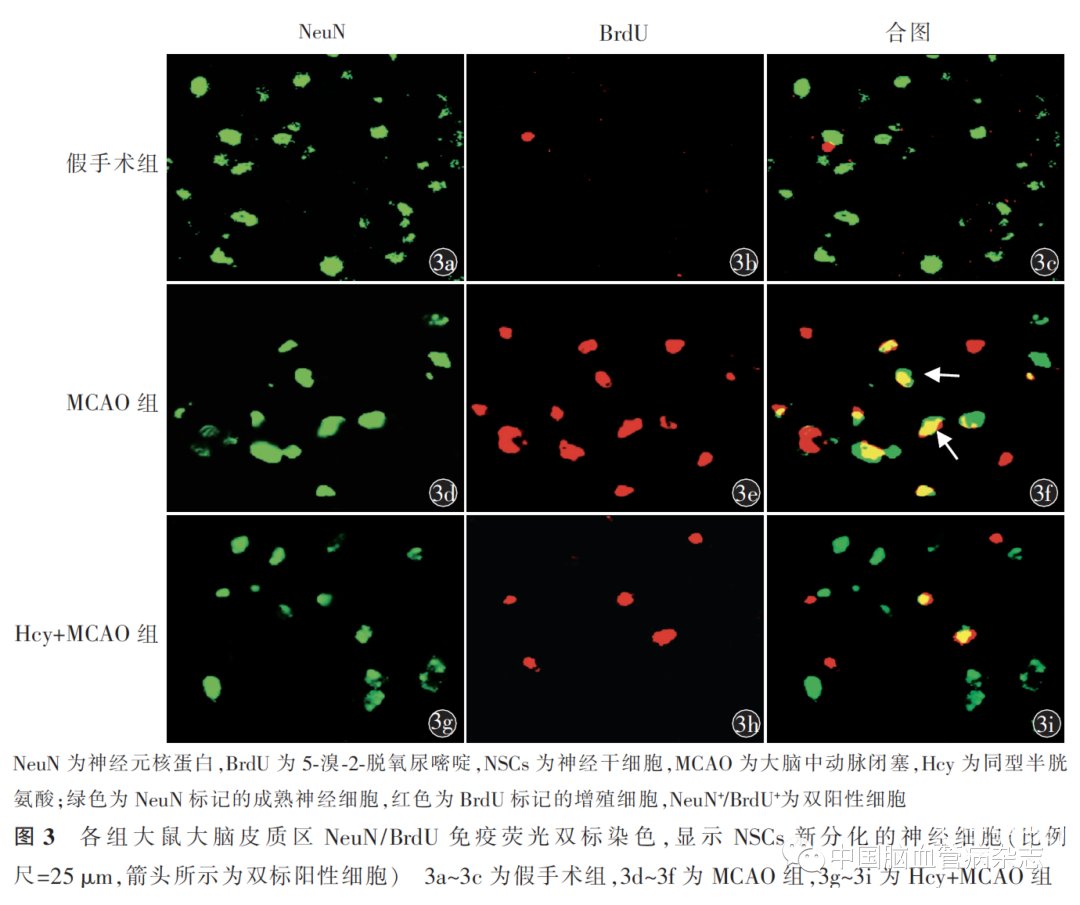
MCAO 手术14 d 后脑组织切片NeuN/ BrdU 免疫荧光双标的结果显示,MCAO 组的NeuN+/BrdU+的数量比假手术组多[(9.3±0.9)个/ mm2 比(0.5 ±0.5)个/ mm2;P<0.05];与MCAO组比较,Hcy+ MCAO组的NeuN+/BrdU+的数量[(2.8 ±0.7)个/ mm2]显著减少,差异有统计学意义(P<0.05)。3 组NeuN+ /BrdU+ 数量差异有统计学意义(F=195.1,P<0.01)。见图3。
2.4 Hcy 对大鼠大脑皮质区 BRDU +/ 5mC+ 数量的影响
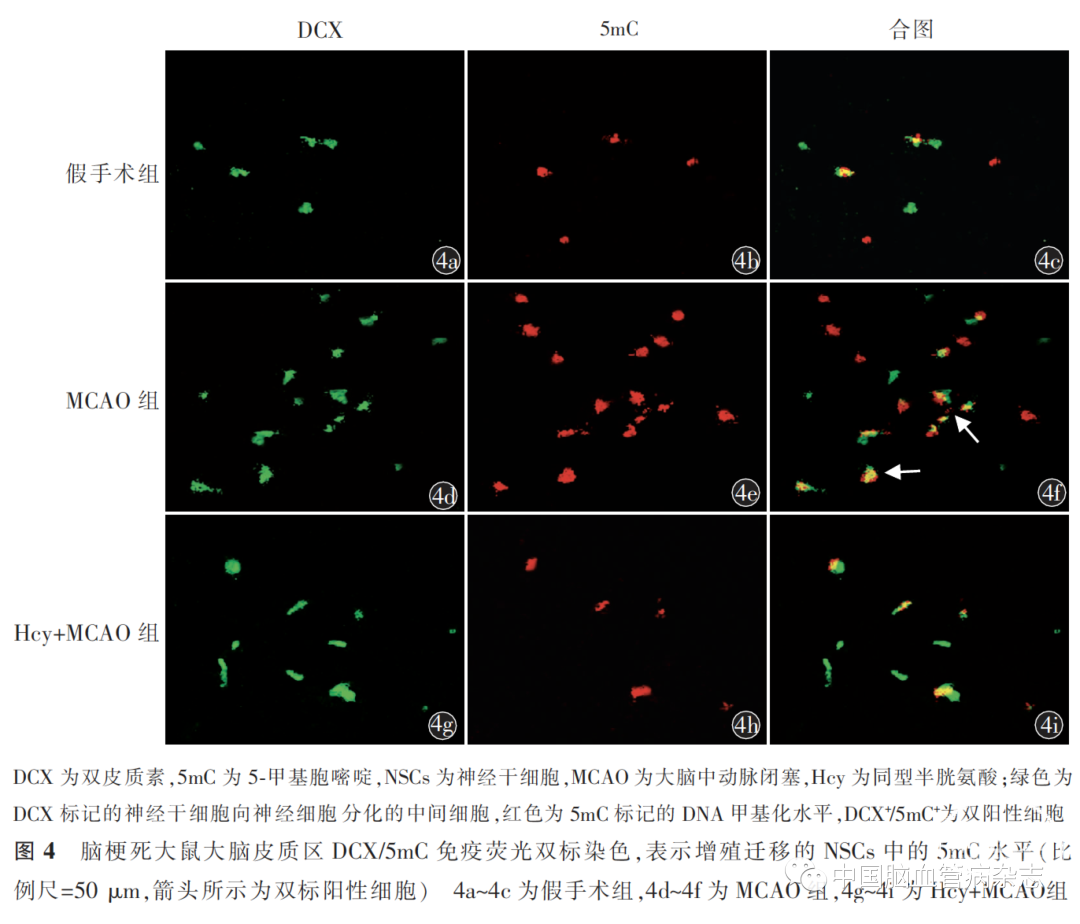
MCAO 手术7 d 后脑组织切片DCX/5mC 免疫荧光双标染色的结果可见,与假手术组相比,MCAO组的BRDU+ /5mC+的数量更多[(8.3 ± 0.5)个/ mm2比(1.8 ± 0.7)个/ mm2;P<0.05];Hcy + MCAO 组的BRDU+ /5mC+ 的数量[(2.5 ± 0.5)个/ mm2 ]比MCAO 组少,差异有统计学意义(P<0.05)。3 组BRDU+ /5mC+数量差异有统计学意义(F=203.1,P<0.01)。见图4。
2.5 Hcy 对大鼠大脑皮质区 NeuN+ / 5mC+ 数量的影响
MCAO 手术14 d 后脑组织切片NeuN/5mC 免疫荧光双标染色结果可见,与假手术组相比,MCAO 组的BRDU+ /5mC+的数量更多[(9.7 ±1.8)个/ mm2 比(2.2 ± 0.7)个/ mm2;P<0.05];Hcy + MCAO 组的BRDU+ /5mC+ 的数量[(2.5 ± 1.0 )个/ mm2 ]比MCAO 组少,差异有统计学意义(P<0.05)。3 组NeuN+ /5mC+数量差异有统计学意义(F=58.4,P<0.01)。见图5。
3 讨论
NSCs 在缺血性卒中后维持大脑稳态起关键作用,在神经血管损伤后表现出潜在的治疗作用[24]。NSCs 增殖分化的活力与其周围的微环境相关,脑梗死后由于血-脑屏障受损、兴奋性毒性和神经炎性反性,受损的大脑细胞微环境被明显破坏,不利于NSCs 的生存[25]。保护NSCs 的增殖和分化可以作为缺血性卒中治疗的一个思路。
血浆中Hcy 浓度升高被认为是神经退行性疾病的独立危险因素[26-27]。Hcy 本身可引起氧化还原电位紊乱,从而促进钙内流、淀粉样蛋白和tau 蛋白的积累、细胞凋亡和神经细胞死亡[28]。Deep 等[28]的研究结果表明,Hcy 可对神经细胞产生毒性,并诱导神经细胞死亡,这与N-甲基-D-天冬氨酸受体介导的钙离子持续流入有关[29]。有研究表明,Hcy 的神经毒性抑制NSCs 的生长,这可能是由于能量代谢的变化和线粒体功能障碍所致[30]。可见Hcy 除了导致神经细胞的死亡外,还会影响NSCs 的生长。本研究结果显示,在MCAO 后,大鼠大脑皮质区的BRDU+ /BrdU+ 、NeuN+/BrdU+ 细胞较多,表明此时NSCs 开始迁移和分化,脑组织开始自我修复,但Hcy 抑制了NSCs 的增殖分化过程。对于血浆中的Hcy 浓度,既往研究表明,大鼠脑缺血后血浆Hcy 水平有轻微上升,但假手术组与MCAO 组之间的差异无统计学意义,而Hcy+ MCAO 组大鼠血浆Hcy 水平较MCAO组显著上升[31]。结合本实验,说明Hcy 干预可导致大鼠脑梗死后血浆Hcy 水平上升,抑制了大脑神经发生,从而影响脑梗死后的恢复。
表观遗传学对于细胞生长和正常发育至关重要,并且可能是基因、环境和疾病之间重要的桥梁。表观遗传修饰,特别是DNA 甲基化,受环境因素的影响并且是可遗传的修饰[32]。DNA 甲基化确保了NSCs 增殖分化的每个步骤中适当的基因激活[33-35]。研究结果表明,异常DNA 甲基化涉及许多神经退行性疾病,包括帕金森病和阿尔茨海默病[36]。Hcy 是DNA 甲基化的代谢物之一,Hcy 水平升高也会破坏DNA 甲基化循环,导致DNA 损伤和细胞死亡。在动物模型和细胞培养模型中发现,高水平Hcy 通过影响特定基因的甲基化来改变基因表达;高Hcy 动物模型通常具有更低的整体DNA 甲基化;人群相关研究表明,Hcy 水平高的人群整体DNA 水平较低[8,37]。本研究结果显示,MCAO 术后脑组织开始自我修复时,DNA 甲基化水平升高,而Hcy 干预组的脑梗死大鼠脑组织DNA 甲基化水平升高明显被抑制。在哺乳动物体内,Hcy产生的唯一途径是由膳食中衍生的蛋氨酸通过转甲基作用合成[33]。Hcy 参与一碳代谢且与DNA 甲基循环过程之间有着紧密联系。Hcy 水平升高可增加S-腺苷同型半胱氨酸浓度[8]。S-腺苷-L-蛋氨酸和S-腺苷同型半胱氨酸水平是细胞甲基化状态的重要代谢指标[6]。因此,Hcy 水平升高可能会破环甲基循环,影响DNA 甲基化水平,进而抑制脑梗死后NSCs 的增殖分化。
总之,本研究结果表明,血浆Hcy 水平升高可能通过降低MCAO 大鼠大脑皮质区DNA 甲基化水平从而抑制NSCs 增殖分化的神经发生过程。本研究为Hcy 在脑梗死中的作用机制探讨提供参考。有研究表明,在体外实验和胱硫醚β-合成酶基因杂合敲除小鼠模型中,补充B 族维生素可以降低Hcy 水平,改善DNA 甲基化的抑制,对Hcy 引起的神经毒性起到保护作用[3840]。降低血浆中Hcy 浓度或许可以恢复DNA 甲基化水平,但在MCAO 模型中降低血浆中Hcy 水平的作用和机制尚不清楚,需进一步深入研究。
参考文献 请见原文





