病史简介
患者,女性,27岁,因“脑积水分流术后22年,发热5天”入院。患者五岁时(1999年)因“先天性脑积水”在当地医院首次行右侧V-P分流术,随后4年内因“分流管排异反应及分流管梗阻”在当地医院共行V-P分流及分流管调整手术四次(具体不详)。
2004年患者因“反复低热伴V-P分流管腹腔侧外露”初次来浙大二院就诊,诊断为:脑积水、V-P分流术后、腹腔感染、分流管外露,行原V-P分流管拔除术+腹腔脓肿穿刺引流术,术中见原分流管腹腔端脓性物附着。术后第2天患者出现意识水平下降,查头颅CT提示脑积水,行脑室外引流术;10天后患者病情稳定,拔除侧脑室外引流管,并行左侧脑室心房(V-A)分流术,术后患者病情缓解出院。
2006年患者因“头痛5天”第二次来浙大二院就诊,检查发现左侧分流阀按压不通畅,考虑为:脑积水V-A分流术后,分流管梗阻;再次手术治疗,术中见分流管脑室端无脑脊液流出,拔除时有阻力,拔出后见末端有结缔组织样物质长入,予更换脑室端分流管,病情缓解。
2012年患者因“分流管外露”第三次来浙大二院行创口清创缝合术。
2015年患者因“双眼上视不能1周”第四次来院就诊,检查发现按压分流泵难以弹起,考虑脑室端再次梗阻,行左侧脑室端原分流管结扎、右侧新分流管脑室端置入术,术后患者病情改善出院。
2019年患者因“头部外伤”损伤头皮,再次出现分流管外露,到当地医院就诊,予清创缝合处理。5天前患者无明显诱因下出现间歇性发热,最高体温39℃,头痛,伴左额部头皮水疱形成,局部偶有清亮液体渗出,为进一步治疗再次急诊来院。查头颅CT提示:脑积水分流术后,幕上脑积水,拟“1 .发热待查;2. 脑积水分流术后”收住入院。自起病以来,神志尚清,精神软,胃纳睡眠一般,无大小便失禁,体重无明显减轻。既往史:2021年2月患者因不明原因发热在当地医院治疗,诊断存在肺栓塞情况,予口服华法林长期抗凝治疗后,肺栓塞缓解。无高血压、糖尿病、心脏病等其他基础疾病。
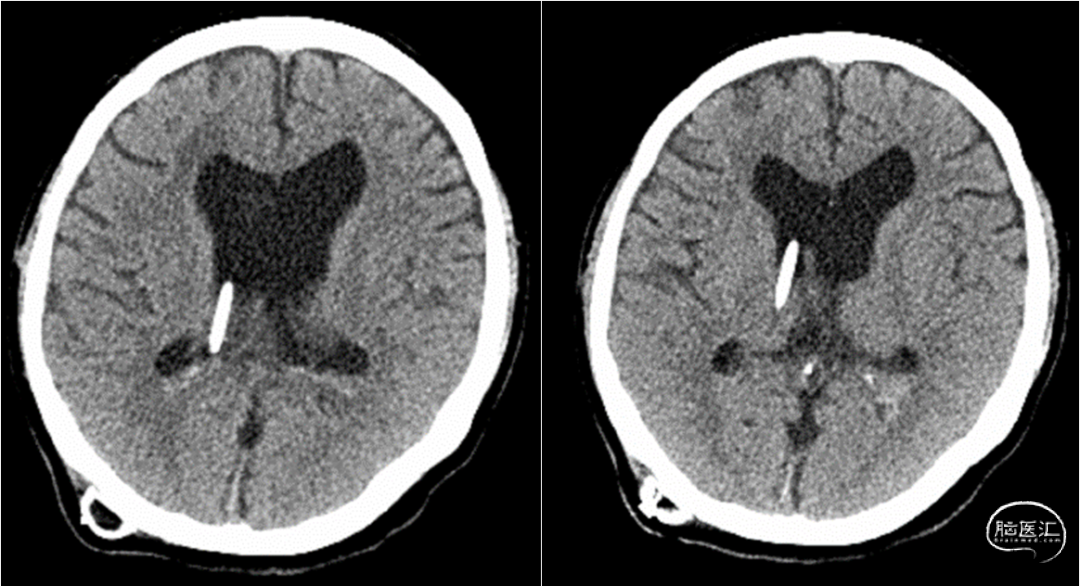
入院查体:体温:37.8℃,呼吸:18次/分,脉搏:95次/分,血压108/81mmHg。神清,对答切题,GCS评分:E4V5M6=15分,双侧瞳孔等大等圆,直径3mm,对光反射灵敏,左额部头皮可见一大小约2.5*1.0cm的水疱样隆起,未见明显液体渗出(图1),颈软,双肺呼吸音清,未闻及干、湿啰音,心律齐,未及额外心音和病理性杂音,腹部可见陈旧性手术疤痕,腹软,无压痛及反跳痛,肝脾肋下未及。四肢肌力V级,肌张力无增减,浅、深感觉无明显异常,双侧巴氏征阴性。实验室检查:白细胞8.0×109/L(中性粒细胞百分比76.5%,淋巴细胞百分比16.8%);C 反应蛋白 35 mg/L。凝血谱提示:凝血功能异常,INR 4.52;脑脊液常规提示有核细胞数增加;脑脊液生化提示糖和氯化物降低,蛋白含量升高(图2)。辅助检查:浙大二院胸部CT提示:双肺少许慢性炎症,肺动脉增宽;心脏彩超提示:三尖瓣少量反流,肺动脉收缩压中度升高,EF 70.3%;心电图提示:窦性心律;颈部血管彩超提示:未见明显异常;头颅CT(图3)提示:脑积水分流术后,幕上脑积水。头颅MRI平扫(图3-右)提示:中脑导水管狭窄,小脑扁桃体疝,脑积水分流术后改变,侧脑室及第三脑室扩张。
图1. 左额部头皮可见一大小约2.5*1.0cm水疱样隆起。
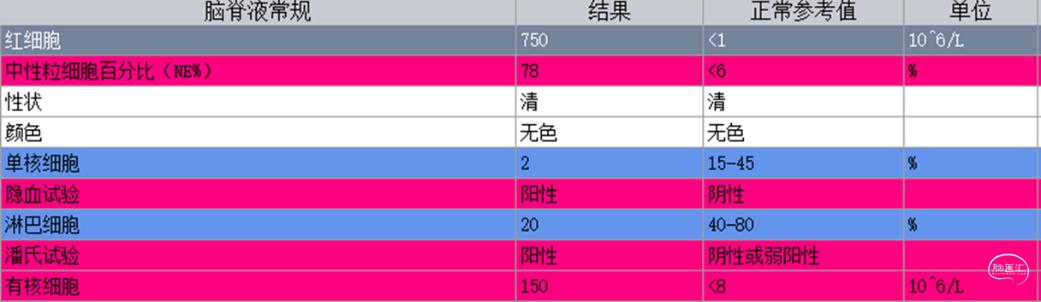
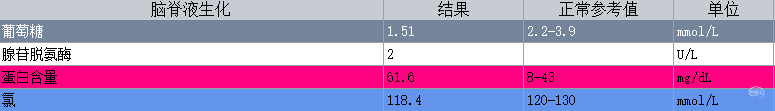
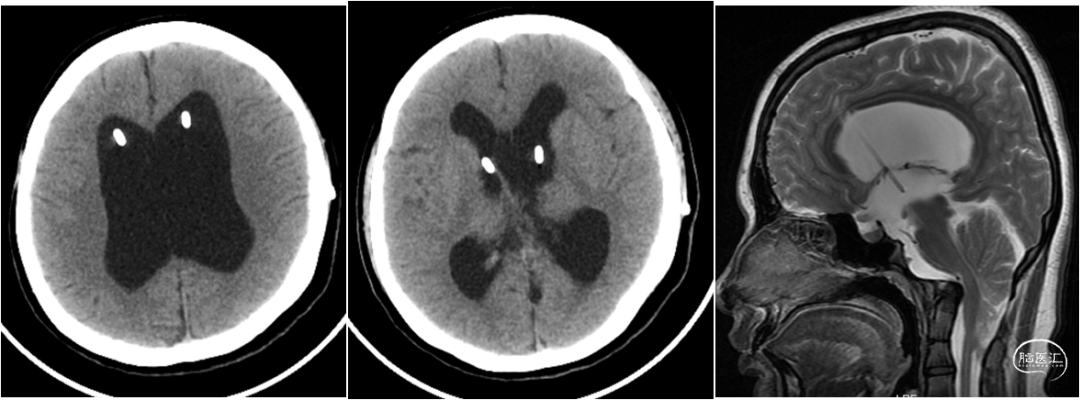
图3. 头颅CT提示脑积水分流术后,幕上脑积水。头颅MRI平扫提示:中脑导水管狭窄,小脑扁桃体疝,脑积水分流术后改变,侧脑室及第三脑室扩张。
根据患者病史、临床症状及影像学表现,诊断为:1. 梗阻性脑积水、V-A分流术后、V-P分流术后;2. 发热待查:颅内感染;3. 凝血功能异常;4. 小脑扁桃体下疝。停用华法林,予美罗培南经验性抗感染、小剂量甘露醇脱水降颅压,患者发热及头痛情况有所缓解,凝血功能恢复逐渐正常。患者脑脊液培养提示表皮葡萄球菌阳性(图4),根据药敏结果,改用利奈唑胺600mg q12h抗感染治疗,于2021年6月7日行脑室分流管拔除+脑室外引流术。术后第一天复查头颅CT提示:分流管拔除+脑室外引流术后改变,余未见明显异常(图5)。术后第二天,患者右侧脑室外引流管引流欠通畅,并有少许暗血性液体引出,查头颅CT提示:穿刺道少量出血,双侧侧脑室内少量积血(图6)。予调整引流管高度、抽吸通管、尿激酶冲管处理后,引流管通畅程度较前改善。患者脑积水持续存在,外引流管抬高引流量减少时,患者头痛明显,甚至出现意识减退;经延长引流时限,多次尝试后,脑室外引流管仍无法拔除,遂于2021年6月24日行脑室镜下第三脑室底造瘘+脑室外引流术,术中予充分扩大三脑室底造瘘口,见脑脊液经漏口引流通畅;附见脑室壁有菌斑(图7)。患者行三脑室造瘘后予逐步抬高外引流管,仍出现头痛加重表现,考虑因颅内感染导致造瘘口闭塞可能;或因患者长期分流致脑组织顺应性减低,造瘘口流量无法满足引流需求所致。遂持续脑室外引流下,继续抗炎治疗。术后多次复查脑脊液化验,常规及生化指标明显改善,细菌培养均阴性。因患者既往多次行脑室腹腔分流术后出现腹腔感染、分流管腹腔端外露;且患者存在中脑导水管狭窄,小脑扁桃体下疝,不宜行脑室或腰大池腹腔分流术。与患者及家属充分沟通病情,最终科室讨论后决定于2021年7月12日再次行“右侧V-A分流术”。术后复查头颅CT示分流管在位(图8),患者头痛症状缓解,可独立行走。患者病情稳定于2021年7月20日出院,术后随访无发热、头痛等明显不适。
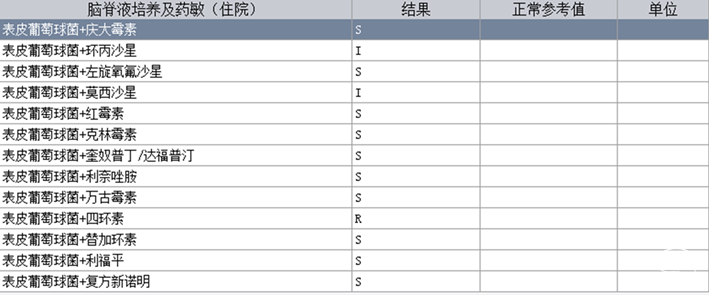
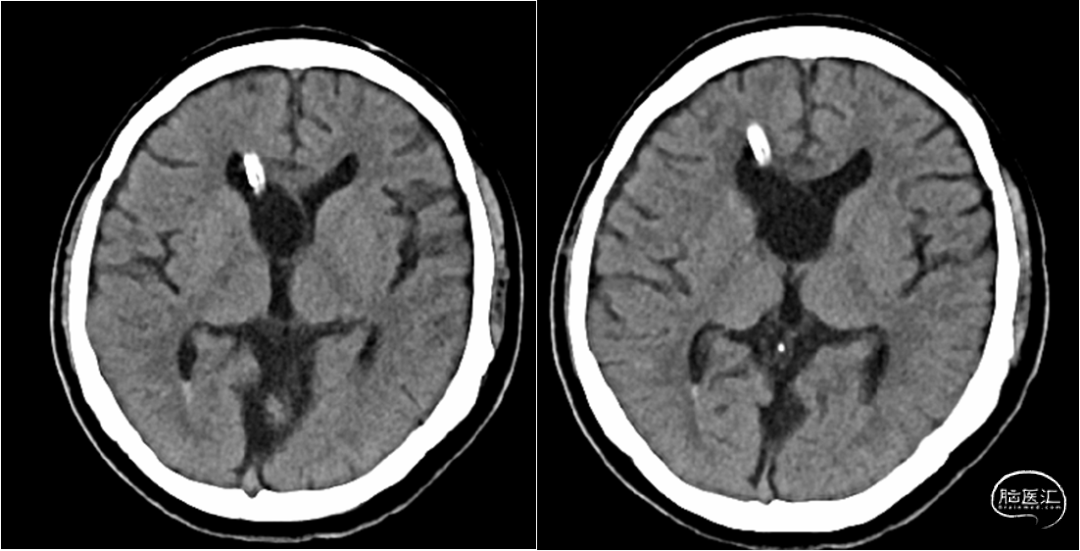
图5. 脑室分流管拔除+脑室外引流术后第一天复查。
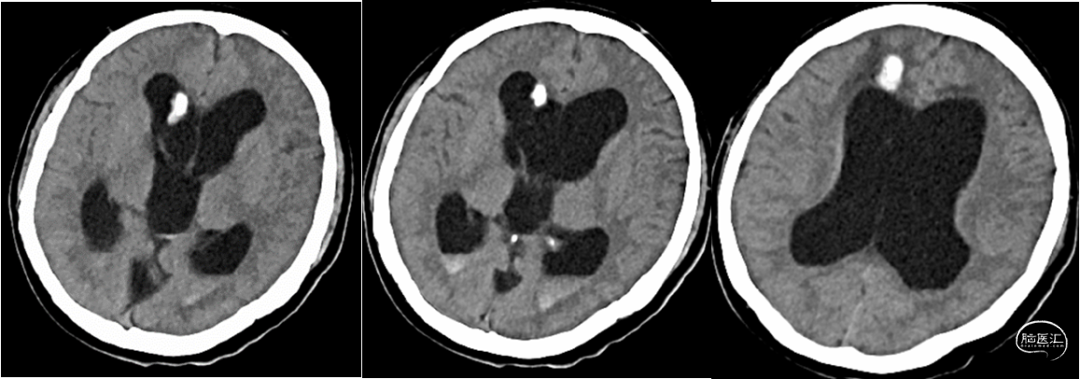
图6. 脑室分流管拔除+脑室外引流术后第二天复查:穿刺道少量出血,两侧侧脑室内少量积血。
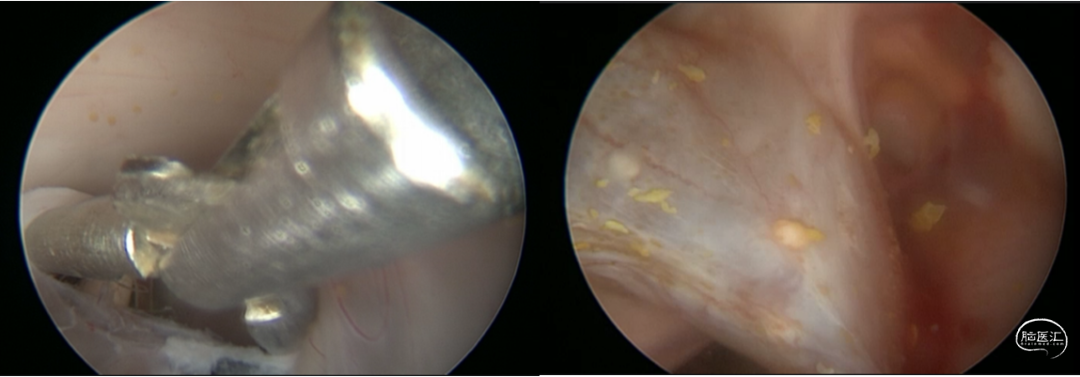
图7. 脑室镜下行三脑室底造瘘,充分扩大瘘口,术中见瘘口处脑脊液引流通畅,脑室壁较多菌斑附着。
讨论
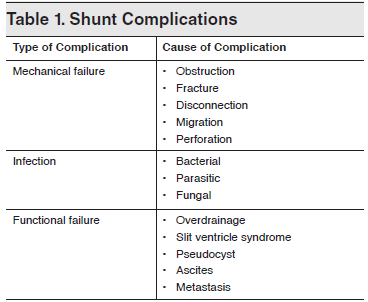
脑积水是临床最常见的神经系统疾病之一,严重危害着人类的健康。虽然脑积水分流手术操作简便,疗效确切,但其并发症很常见,主要包括机械性、感染及功能相关性并发症[1](表1)。一旦出现诸如上述并发症,脑积水分流手术往往面临失效风险,相应分流装置常常需要拔除与更换。因此,充分认识脑积水分流手术及其相关的并发症,及时准确地评估该类患者出现并发症时的临床表现及影像学特点,将有利于对该类患者进行及时有效的处置,以最终改善患者的预后[2,3]。
表1. V-P分流术后常见的并发症
对于典型病例,当脑积水分流术后再次出现颅高压或感染等相关症状时,影像学上表现为脑积水进展的影像学特征或检查发现分流装置功能障碍时,诊断分流手术相关并发症并不困难[4]。在本病例中,患者发生了多种分流手术相关并发症,包括分流管排斥反应、分流管外露、分流管梗阻、分流管相关性腹腔感染和颅内感染、穿刺通道出血以及可能与分流管相关的肺栓塞事件(表2),给患者带来了巨大的影响。
为了减少或避免脑积水分流手术后并发症的发生,术者常需考虑以下几方面事宜:在本病例中,患者脑积水分流术后20余年,先后多次行V-P分流术,术后出现分流管腹腔侧外露和腹腔感染情况,导致分流手术失败,需改行其他术式,如V-A分流术、腰大池腹腔分流术或第三脑室造瘘术。但患者存在中脑导水管狭窄和小脑扁桃体下疝,行腰大池腹腔分流效果不佳且存在加重小脑扁桃体下疝可能;同样,患者行第三脑室造瘘术后脑积水仍持续存在,故本次住院选择再次行V-A分流术。患者第一次V-A分流术后17年,出现肺栓塞情况,心脏彩超检查虽未见分流管心房侧有血栓形成,但仍不能完全排除肺栓塞发生与V-A分流手术无关,需密切随访。
表2. 本病例脑积水分流术后并发症发生的时间、事件以及处理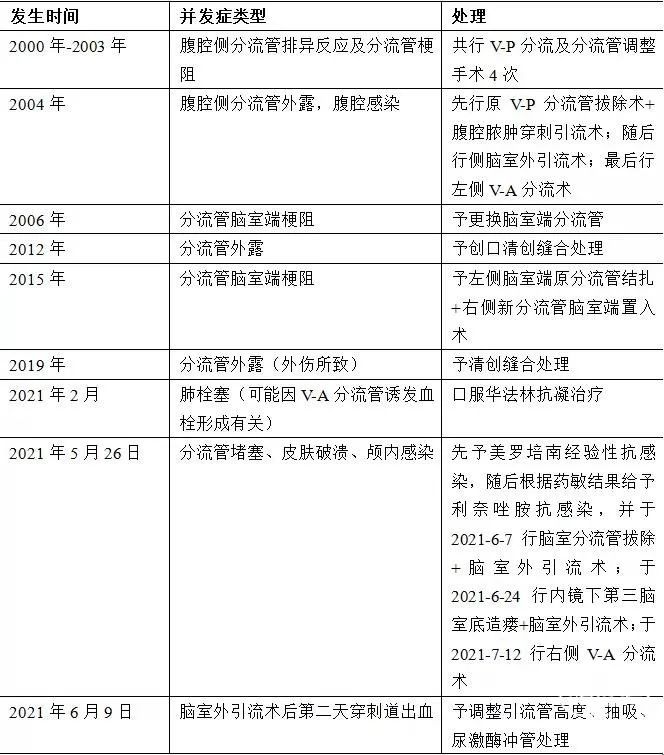
分流管排异反应是脑积水分流术后较为少见的并发症[5,6]。脑积水分流术后患者对分流管装置的排斥反应可最终造成分流手术失败[7]。在本病例中,患者在无皮肤损伤情况下多次出现分流管外露状况,提示其可能存在对分流管排斥反应。因此,再次行分流手术时,应更加谨慎,选择材质耐受性更佳的分流装置,注意皮下隧道的深度,严格无菌及精细操作减少皮下创伤,以期尽量减少排异反应的发生。目前,由于技术和材料的不断改进,单纯排异反应极少见,但临床工作中仍需注意,特别对无明显诱因下出现皮下局部疼痛且分流管反复外露的患者,应考虑到该并发症,尽早处理以减轻不良预后。脑积水分流术后发生颅内感染并不少见[8]。而颅内感染可引起脑血管炎性病变,造成血管炎、血栓形成、栓塞甚至动脉瘤形成等,最终导致颅内出血的风险增加[9,10]。在本病例中,患者脑室分流管拔除+脑室外引流术后第一天头颅CT复查未见明显颅内出血征象;而在术后第二天,患者右侧脑室外引流管引流欠通畅,并有少许暗血性液体,复查头颅CT发现穿刺道少量出血,两侧侧脑室内少量积血。上述表现提示颅内感染后患者脑血管壁发生结构改变可能,容易发生出血事件,在临床工作中值得注意,特别是针对于需行颅脑手术的患者而言。综上,对于脑积水行分流手术的患者,应进行密切的随访评估,当出现头痛、发热、意识水平下降、分流管外露等状况时,应及时评估颅内情况及分流系统引流状况,以作出合理的临床决策和处理。针对病例个体特点选择合适的手术方式、优化手术操作细节、密切随访并及时恰当的处理并发症,有助于改善患者长期预后。
1. Bober J, Rochlin J, Marneni S. Ventriculoperitoneal Shunt Complications In Children: An Evidence-Based Approach To Emergency Department Management. Pediatr Emerg Med Pract 2016; 13:1–22; quiz 22–23.2. Goeser CD, McLeary MS, Young LW. Diagnostic imaging of ventriculoperitoneal shunt malfunctions and complications. Radiographics 1998; 18:635–651.3. Sivaganesan A, Krishnamurthy R, Sahni D, Viswanathan C. Neuroimaging of ventriculoperitoneal shunt complications in children. Pediatr Radiol 2012; 42:1029–1046.4. Bates P, Rajderkar D. Common and Uncommon Causes of Ventriculoperitoneal Shunt Malfunction Diagnosed on Plain Radiographs. Curr Probl Diagn Radiol 2018; 47:317–323.5. Hussain NS, Wang PP, James C, Carson BS, Avellino AM. Distal ventriculoperitoneal shunt failure caused by silicone allergy. Case report. J Neurosurg 2005; 102:536–539.6. Leer M, Simms HN. Silicone allergy mimicking shunt infection. Br J Neurosurg 2020:1–2.7. Snow RB, Kossovsky N. Hypersensitivity reaction associated with sterile ventriculoperitoneal shunt malfunction. Surg Neurol 1989; 31:209–214.8. González S, Carbonaro M, Fedullo AG, et al. Cerebrospinal fluid shunt-associated infections in pediatrics: Analysis of the epidemiology and mortality risk factors. Arch Argent Pediatr 2018; 116:198–203.9. Radwan W, Sawaya R. Intracranial haemorrhage associated with cerebral infections: a review. Scand J Infect Dis 2011; 43:675–682.10. Connor MD, Lammie GA, Bell JE, Warlow CP, Simmonds P, Brettle RD. Cerebral infarction in adult AIDS patients: observations from the Edinburgh HIV Autopsy Cohort. Stroke 2000; 31:2117–2126.(本文由浙二神外周刊原创,浙江大学医学院附属第二医院神经外科吴海建、沈智伟主治医师整理,闫伟副主任医师、赵学群主任医师审校,张建民主任终审)
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
















