文章来源:中国脑血管病杂志, 2021, 18(7):492-504.
作者:中国医师协会神经介入专业委员会 中国颅内动脉瘤计划研究组
基金项目:国家重点研发计划重大慢性非传染性疾病防控研究重点专项资助项目(2016YFC1300800)
通信作者:张鸿祺,100053 北京,首都医科大学宣武医院神经外科,Email:xwzhanghq@163.com;卢洁,100053 北京,首都医科大学宣武医院放射与核医学科,Email:imaginglu@hotmail. com;杨新健,100070 北京,首都医科大学附属北京天坛医院神经介入科,Email:yangxinjian@ voiceoftiantan.org
摘要: 颅内动脉瘤是一种患病率较高,一旦破裂会导致较高致残、致死率的疾病,通过合适的影像学方式检出颅内动脉瘤、进行风险的评估,并精确指导治疗尤为重要。但是,目前尚无颅内动脉瘤影像学判读规范,因此,专家组结合文献、研究和临床经验共同撰写了本共识,旨在为动脉瘤的影像学判读规范化提供参考。
颅内动脉瘤在普通人群中的患病率较高,一项来自83个普通人群中的68项流行病学研究结果表明,颅内动脉瘤的总体患病率为3.2%[1]。一项基于我国上海地区单社区横断面研究显示,35~75岁普通人群中通过MR血管成像(MRA)诊断颅内动脉瘤的患病率达7%[2]。颅内动脉瘤一旦破裂,其致残、致死率可高达25%~50% [3-4]。但有研究表明,颅内动脉瘤的年破裂风险仅为0.25%~2.00%[5-6],即大多数颅内动脉瘤终生未发生破裂。因此,通过合适的影像学方式检出颅内动脉瘤,并对其进行破裂风险的预测,从而指导治疗显得尤为重要。目前,针对颅内动脉瘤患者,具体影像学检查方式的选择、颅内动脉瘤形态学参数的测量、血流动力学参数的计算等均缺乏循证医学证据支持的规范。因此,中国医师协会神经介入专业委员会成员及国家重点研发计划重大慢性非传染性疾病防控研究重点专项中“颅内动脉瘤破裂出血早期规范治疗和未破裂动脉瘤出血风险的研究”课题专家组共同撰写了本共识,以规范颅内动脉瘤影像学检查方式的选择、影像学检查的质量控制、形态学参数测量及血流动力学计算等,旨在为颅内动脉瘤影像学判读提供参考。
因DSA具有较高的时空分辨率,目前仍是公认的颅内动脉瘤临床诊断的“金标准”。DSA的成像原理是将对比剂快速注入动脉,在X线照射下使血管腔显影,依次记录和观察含有对比剂的血液流动顺序、血管充盈情况等,同时可以利用计算机处理数字化影像信息,并消除骨骼和软组织的影响,从而达到减影效果。DSA的对比度和分辨率均较高,而三维DSA可以较好地呈现颅内动脉瘤的形态,多投射角度和选择性动脉造影可以更加清晰地显现颅内动脉瘤及其周围血管的情况,且三维DSA还可对血流的动态图像进行实时观察。相比CT血管成像(CTA)等影像学检查,DSA尤其是三维DSA 对最大径<3 mm 的微小动脉瘤及其周围小血管的显影有更高的敏感度[7-8]。DSA 也是对蛛网膜下腔出血(SAH)进行病因诊断的“金标准”[9]。对于高度怀疑为动脉瘤性SAH 的患者,在有治疗条件的前提下,推荐直接进行DSA检查。同时,必要且有条件时可在复合手术室进行DSA,以便明确诊断后直接进行治疗,从而争取宝贵的抢救时间。
DSA检查也存在一定的缺点。首先,DSA作为一种有创性且需注射对比剂的检查,可能引起穿刺部位的血肿和(或)假性动脉瘤和(或)动脉夹层和(或)动静脉瘘,可能引起对比剂肾病,甚至肾功能衰竭,还可能引起造影管途经处的动脉夹层以及神经功能障碍等并发症[10]。其次,DSA检查需要患者接受一定剂量的X线辐射,其辐射剂量相当于CTA检查的4~5倍[11]。最后,DSA检查需要患者住院,且费用较高,而CTA、MRA相对更方便、快捷且费用较低,同时CTA和MRA还具有较好的图像分辨率和对比度,随着影像学技术的发展,CTA和MRA诊断颅内动脉瘤的准确性正在不断接近DSA[12]。
CTA是通过在周围静脉快速注入水溶性碘对比剂,对比剂在靶血管充盈的高峰期,用多层螺旋CT对靶血管进行快速断层数据采集,并利用后处理软件对血管影像进行重建和立体呈现的一种微创性血管造影术,对于血管形态、血管性疾病以及病变与血管间关系的显示有重要价值。目前,CTA已广泛用于颅内动脉瘤的检出和随访,虽然接受X线的辐射剂量与对比剂使用量均少于DSA,但与MRA相比,仍有一定的辐射。另外,骨质、金属伪影均对CTA成像效果存在一定的影响[13]。64层及以上的多排CT 通常可获得较好的脑血管成像效果。2011年的一项荟萃分析纳入了45项研究,共3643例颅内动脉瘤患者,结果显示,CTA 检测颅内动脉瘤的敏感度为97.2%,特异度为97.9%[14]。随着CT技术的不断发展,有研究报道显示,CTA对颅内动脉瘤诊断的敏感度可达96.3%,特异度可达100.0%,但对于最大径<3mm的微小动脉瘤,CTA仍存在漏诊的情况,其敏感度仅为81.8%[15]。另一项荟萃分析显示,CTA检测颅内破裂动脉瘤的综合敏感度为98% ,综合特异度高达100% [16]。然而,对于已有意识障碍或高度怀疑颅内动脉瘤破裂所致SAH的患者,仍首选DSA 作为检查手段,且CTA 为阴性的SAH 患者仍应完善DSA 检查,以明确诊断。
在颅内动脉瘤大小测量值方面,CTA与DSA间的差异无统计学意义(P>0.05),但在瘤颈测量方面,CTA的测量值往往较DSA的测量值大[17]。对于巨大动脉瘤(最大径≥25mm),在动脉瘤大小测量值方面,CTA与时间飞跃法(time-of-flight,TOF)MRA、增强MRA的差异均无统计学意义(均P>0.05),但CTA对于瘤腔的呈现效果明显优于后二者,且其对于腔内血栓、瘤壁钙化也可较好地呈现[18]。
MRA的常见类型包括TOF-MRA、增强MRA等,其中TOF-MRA常用于颅内动脉瘤的检出。TOF-MRA的成像原理是通过捕获血液流动信号,并将其转化为MR信号后进行成像,但只有相对规则的血流才会被捕获并转化为稳定的MR信号。血管不规则狭窄和(或)扩张处的血流易产生涡流及湍流,因局部血流不规则可致信号丢失,同时在颅内动脉瘤伴血栓形成时,易造成成像缺失。TOF-MRA的突出优势在于,无需注射对比剂以及不接受X线辐射,所以在无MR检查相关禁忌证的前提下,推荐使用TOF-MRA作为未治疗颅内动脉瘤患者定期影像学随访的方式,同时CTA可作为备选的检查方式,在2015年《北美卒中协会未破裂动脉瘤指南》中对此进行了相关的意见推荐[5]。1.5T及以上的MR仪可获得较好的TOF-MRA成像效果,但相关序列参数需在工程师的协助下,根据场地环境进行校准与调试。
MRA对颅内动脉瘤诊断的敏感度可达95%(95%CI:89%~98%),特异度可达89%(95%CI:80%~95%)[19]。有研究报道,对于最大径>3mm的颅内动脉瘤,有经验医师判读的敏感度可达89%[20];而对于最大径<3mm的颅内动脉瘤,MRA诊断的敏感度仅为74.1%,提示MRA检出颅内动脉瘤的敏感度与颅内动脉瘤大小相关[21]。另有研究表明,有经验医师通过容积重建技术对最大径≤5mm的颅内动脉瘤进行判读,相比DSA,MRA对其诊断的准确度可达96.4%~97.3%[22]。对于位于大脑中动脉(MCA)以及颅底的动脉瘤,MRA易出现假阴性或假阳性结果,使用3.0TMR对该部位颅内动脉瘤进行检查,同时医师进行手工三维重建,可提高颅内动脉瘤诊断的准确度[19]。相比3.0TMR,虽然7.0TMR在颅内动脉瘤诊断效能方面有一定提升,但仍需进一步研究验证,且与其在临床的广泛实际应用仍存在一定的距离[23]。相比增强MRA,虽然TOF-MRA在颅内动脉瘤测量方面有较大的误差,且对于动脉瘤瘤颈以及从动脉瘤上发出的分支血管显影较差,但两种检查方式均与DSA成像效果有良好的一致性(组内相关系数>0.95)[24-25]。在诊断效能方面,MRA与CTA的差异无统计学意义(P>0.05)[26]。
HR-MRI是通过抑制血管内血流信号以及脑脊液信号,获取血管壁等静态组织信号,以保证颅内动脉血管壁的高水平信噪比,具有扫描快速、准确、分辨率高、无电离辐射损害等优点,显示了管壁、管腔及血液情况,在脑动脉粥样硬化性狭窄的鉴别诊断、斑块成分检测等方面均有较高的应用价值。研究表明,颅内破裂动脉瘤血管壁强化率高于未破裂动脉瘤,血管壁强化机制可能与炎性反应相关,内皮细胞与血管平滑肌细胞的凋亡促进了动脉瘤壁发生炎性反应及白细胞浸润,使颅内动脉瘤持续增长,乃至破裂[27-28]。正常状态下,HR-MRI检查使用的对比剂无法透过血管内皮,因而不出现强化效应。血管内皮一旦发生炎性反应,动脉壁内皮遭到破坏,对比剂可直接通过裂隙进入管壁,则可因此出现血管壁的强化效应。HR-MRI显示强化越明显,提示动脉瘤壁的炎性反应越强烈,颅内动脉瘤的破裂风险则越高[27-28]。此外,对于夹层动脉瘤的诊断,HR-MRI可以显示血管夹层的内膜瓣、双腔和壁间血肿等内部结构,且可对颅内动脉瘤的外壁结构及其占位效应进行评估,为颅内动脉瘤的诊断和评估提供了较全面的信息,帮助临床医师获取更多影像学征象,有利于为患者制定更为科学、有效的临床治疗方案[29]。
4D Flow MRI 是基于时间分辨的三维相位对比MRI技术,可同时对3个相互垂直的维度进行相位编码,从而采集多维度信息,包括3个空间维度信息、3 个速度方向信息和心动周期内的时间信息[30-32]。除获取形态学信息外,4DFlowMRI还可对颅内动脉瘤的血流动力学参数进行计算,如血流速度、能量损耗、壁面剪应力(wall shear stress,WSS)等[32-33]。目前,4D Flow MRI作为一种诊断和风险评估工具已应用于临床工作中,能够通过最小流速流线来识别颅内动脉瘤中的涡核,在对有子囊的颅内动脉瘤进行检查时,其发现了更为复杂的血流模式[34],而较大的颅内动脉瘤具有更多的非均质流动[35]。与梭形动脉瘤相比,囊状动脉瘤中WSS、涡度和峰值速度更大[35]。有研究报道,偏心流与更大的长宽比相关,偏心流与WSS峰值均为颅内动脉瘤进展的独立危险因素[32]。HR-MRI结合4D Flow MRI分析发现,低WSS和低流速是动脉瘤瘤壁信号增强的独立危险因素[36]。但是,通过4D Flow MRI得到的WSS和流速值均显著低于计算流体力学获得的结果,少数情况下,甚至不足计算流体力学结果的四分之一,该差异可能是由于4D Flow MRI与计算流体力学的空间分辨率不同所致[37-38]。
四维CTA 是通过实时图像数据处理及定量分析,观察颅内动脉瘤壁在心动周期不同时相中的形态学变化,计算颅内动脉瘤壁的力学特点和分布,并对颅内动脉瘤破裂风险的预测提供帮助[39-41]。四维CTA可在低浓度对比剂和低辐射剂量的条件下,观察颅内动脉瘤的静态特征(包括大小、部位、形态等)。通过四维CTA可对瘤壁的运动情况进行评估,有效识别颅内动脉瘤的不规则搏动,从而对未破裂动脉瘤的破裂风险进行评估。有研究通过四维CTA在41.0%(48/117)的未破裂颅内动脉瘤中观察到了异常搏动,表明具有异常搏动动脉瘤的破裂风险是无异常搏动动脉瘤的6倍[39]。
常见的重组方式主要包括最大密度投影(maximalintensity projection,MIP)重建、多平面重建(multiple planereconstruction,MPR)与容积重建。
MIP的主要原理为从各方向分别对血管的断层影像进行投影重建,图像中保留该投影方向中密度最大的像素,从而得到各方向上的血管造影图像。即使较小的密度变化也能在MIP重建图像上显示,其可较好地显示血管的狭窄、扩张、充盈缺损以及区分血管壁钙化与血管腔内的对比剂。但该重建方式局限于二维,难以得到颅内动脉瘤全方位的呈现。另外,若角度选取不佳,获取的相关信息量则会更加局限,甚至可能造成颅内动脉瘤的漏诊。
MPR的主要原理是先将扫描范围内所有轴面图像进行叠加,再对标线标定的重建线所指定的组织进行冠状、矢状面及任意角度斜面图像进行重建,其优点在于能任意产生新的断层图像,而无需重复扫描。曲面重建可以在一幅图像里展开显示弯曲物体,其缺点在于难以表现复杂的空间结构,易造成假阳性结果。
容积重建的主要原理为将原有断层图像进行分割,并将原来二维平面的像素转化为三维立体体素,每个体素都视为接受或发出光线的粒子,并设计光照模型。根据每个体素的空间位置与介质属性,编码为一定的光强和透明度,重建成为三维立体投影图像。容积重建图像可以从全方位对颅内动脉瘤进行呈现,能较好地显示颅内动脉瘤的形态、大小以及其与周围血管的毗邻关系。但在该重建方式下的测量值可能存在误差,很大程度上受到阈值的影响。
基于TOF-MRA的研究结果表明,容积重建方式在颅内动脉瘤诊断准确性、敏感度以及颅内动脉瘤形态呈现方面均优于MIP重建[42]。就颅内动脉瘤测量而言,基于增强MRA通过MIP重建与容积重建的颅内动脉瘤径线测量值存在差异,相关差异甚至高达24.7%,仅30.0%的颅内动脉瘤通过两种不同方式重建后其测量值误差小于10.0%,但测量值与真实值的误差仍有待进一步探究[43]。使用容积重建方式进行测量时,因阈值问题有时会出现较大误差,而在MIP重建、MPR以及直接在原始断层图像上进行测量则误差较小[44]。
影像质量是对颅内动脉瘤精准评估的基础,其优劣直接影响诊断的准确性和治疗方案的正确性。影响颅内动脉瘤影像质量的因素较多,主要包括成像设备、扫描方式、对比剂、扫描全程头部运动以及颅内金属等异物。
DSA 成像质量最高,主要影响因素为对比剂的用量、浓度、注射流率以及医患配合度等。CTA成像质量其次,主要影响因素包括扫描方法与对比剂增强方案,头部运动、金属置入物和血管钙化也会对其质量产生影响。MRA技术发展最为迅速,MR设备的场强、不同扫描方式、头部运动和金属物干扰对影像质量影响较大;传统TOF序列影像质量受慢血流的血流饱和效应影响较大,同时因成像时间较长和噪音过大,患者可能无法耐受而产生运动伪影;新的扫描方式,如零回波时间动脉自旋标记可减少上述干扰,提高影像质量[45]。
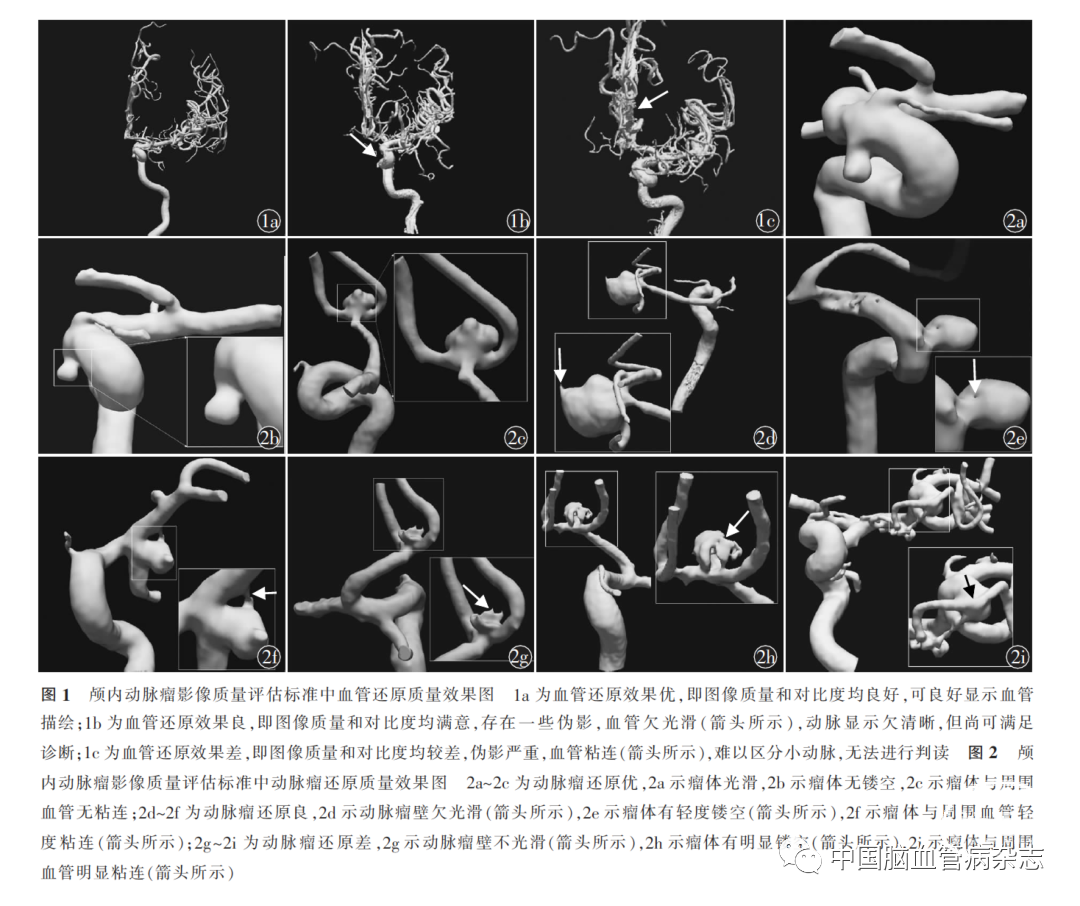
目前,临床实践中对颅内动脉瘤影像质量的评估仍以主观评价为主,通常以载瘤动脉、动脉瘤显示情况以及动脉瘤与载瘤动脉关系等方面对图像质量进行分级,其主要依据为是否存在明显运动伪影、血管表面及动脉瘤壁是否光滑、是否充分显示载瘤动脉及动脉瘤形态、是否存在血管镂空或动脉瘤镂空、是否与周围血管粘连。在已有的相关报道中,颅内动脉瘤影像质量的评估主要包括血管还原质量和动脉瘤还原质量两方面,均采用人工评价,由两名资深专家分别评审,若出现判读结果不一致,则由第3名专家评审,并形成统一意见[46-47]。有研究从血管还原角度提出了颅内动脉瘤影像中血管还原质量评估标准,该评估标准将血管还原质量分为优、良、差3个等级,其中优为好的图像质量和对比度,良好的血管呈现,无伪影,易于诊断(图1a);良为满意的图像质量和对比度,可存在一些伪影,血管壁欠光滑,动脉显示虽欠清晰但尚可满足诊断所需(图1b);差为图像质量和对比度均较差,伪影严重,血管粘连,难以区分小动脉,无法进行诊断(图1c)[46]。另有研究从动脉瘤还原角度提出了颅内动脉瘤影像中动脉瘤还原质量评估标准,该评估标准将动脉瘤影像质量分为优、良、差3个等级[47]。(1)优(图2a~2c):能较好地还原出颅内大血管[大脑前动脉(ACA)、MCA、颈内动脉(ICA)];血管表面光滑,血管无粘连;动脉瘤壁光滑,无伪影,瘤体无镂空,与周围血管无粘连。(2)良(图2d~2f):基本还原出颅内大血管(ACA、MCA、ICA),但效果略差;血管表面欠光滑,血管粘连少;动脉瘤壁欠光滑,瘤体有少许镂空,与周围血管轻微粘连。(3)差(图2g~2i):未还原出颅内大血管(ACA、MCA、ICA);血管表面不光滑,血管粘连多;动脉瘤壁欠光滑,瘤体有明显镂空,与周围血管严重粘连。
推荐意见:
(1)DSA是动脉瘤诊断的“金标准”,DSA、MRA及CTA均可作为颅内动脉瘤有效的影像学检查方式,相关研究已证实,CTA、MRA 的特异度与敏感度与DSA间的差异无统计学意义。
(2)对于最大径<3mm的动脉瘤,CTA、MRA检出的敏感度、特异度均有所下降,对该类动脉瘤必要时需进一步完善DSA检查。
(3)相比CTA、增强MRA及DSA,TOF-MRA无需接受对比剂注射以及X线辐射,对于未治疗的颅内动脉瘤患者,推荐使用TOF-MRA作为筛查及定期影像学随访的方式,同时CTA可作为备选的检查方式。
(4)颅内动脉瘤壁在HR-MRI呈现的强化信号被证实为动脉瘤破裂的相关危险因素,相关征象可为颅内动脉瘤的治疗决策提供一定的参考,该结论仍需更多的研究进一步验证。
(5)在获取颅内动脉瘤影像时,推荐由有经验的医师拷贝原始DICOM数据,通过容积重建方式对动脉瘤进行影像学判读,若怀疑存在动脉瘤,需结合原始断层图像进行诊断;MIP重建+MPR方式有助于发现小动脉瘤,也可准确测量瘤体及瘤颈大小,必要时可查看原始断层图像进行测量。
(6)为保证颅内动脉瘤具有基本的影像质量,以用于诊断及治疗评估,对影像扫描的基本要求是层厚<1mm,对三维DSA数据的要求是三维断层DICOM,对CTA采集的基本要求是使用64层及以上的CT仪,对MRA采集的要求是1.5T及以上MR仪。
(7)为保证诊断与治疗评估的准确性,影像质量要达到一定标准,血管还原质量及动脉瘤影像质量需达良或优。
2. 1. 1 定义:颅内动脉瘤是由于颅内动脉先天发育异常和(或)后天损伤等因素所致的局部血管壁损害,在血流动力学负荷和其他因素作用下,血管壁逐渐扩张形成异常膨出[48-49]。国际未破裂颅内动脉瘤研究(international study ofunruptured intracranial aneurysms,ISUIA)[6]、国际蛛网膜下腔出血动脉瘤试验(international subarachnoid aneurysm trial,ISAT)[50]、未破裂脑动脉瘤研究(unruptured cerebral aneu-rysm study,UCAS)[51]3 项动脉瘤研究中,均未对囊性动脉瘤进行明确的定义或提出诊断标准,但MRA、CTA和DSA均可作为颅内动脉瘤的诊断工具,同时DSA 是诊断颅内动脉瘤的“金标准”。但对膨出的程度、形态等达到何标准可做为动脉瘤的定义,现尚无定论。
2. 1. 2 分类:依据是否破裂,可将颅内动脉瘤分为未破裂及破裂动脉瘤;依据病因,可将其分为感染性、外伤性动脉瘤等。基于动脉瘤影像学特征的判读,本共识主要就动脉瘤大小及形态进行推荐。
根据形态学特征,可将颅内动脉瘤大致分为囊性与非囊性动脉瘤。囊性动脉瘤是指动脉侧壁发出的异常类圆形膨出,通常具有瘤颈小于瘤体的特征。非囊性动脉瘤主要包括梭形动脉瘤、蛇形动脉瘤等,其中梭形动脉瘤较为常见,主要表现为节段性血管壁向各方向的异常膨出;蛇形动脉瘤较为少见,主要表现为长节段的迂曲扩张,并常伴有瘤内血栓形成。临床常用的标准是依据动脉瘤最大径,将其分为小型动脉瘤(最大径<5mm)、中型动脉瘤(5mm≤最大径<15mm)、大型动脉瘤(15mm≤最大径<25mm)以及巨大型动脉瘤(最大径≥25mm),动脉瘤大小通常被认为与其破裂风险存在相关性[52-53]。ISUIA一期研究表明,对于最大径<10mm且不伴SAH病史的动脉瘤患者,其年破裂率为0.05%;对于最大径≥10mm且伴有SAH病史的动脉瘤患者,其年破裂率为1.00%,后者的破裂风险是前者的20倍[6]。ISUIA二期研究结果显示,无SAH病史且位于ICA、前交通动脉、ACA或MCA的未破裂动脉瘤,最大径分别为<7、7~12、13~24、≥25mm患者的5年累积破裂率分别为0、2.6%、14.5%和40.0%;而最大径相同,但位于后循环、后交通动脉的未破裂动脉瘤患者,其5年累积破裂率分别为2.5%、14.5%、18.5%和50.0%[54]。UCAS研究结果表明,与最大径为3~4mm的未破裂动脉瘤相比,最大径为5~6、7~9、10~24和≥25mm未破裂动脉瘤的破裂风险分别增至1.13倍(95%CI:0.58~2.22)、3.35倍(95%CI:1.87~6.00)、9.09倍(95%CI:5.25~15.74)和76.26倍(95%CI:32.76~177.54)[51]。此外,有研究结果表明,对于最大径<3mm的微小动脉瘤,不治疗而进行定期的影像学随访是获益最大的处理方式[55]。
2. 1. 1 定义:颅内动脉瘤是由于颅内动脉先天发育异常和(或)后天损伤等因素所致的局部血管壁损害,在血流动力学负荷和其他因素作用下,血管壁逐渐扩张形成异常膨出[48-49]。国际未破裂颅内动脉瘤研究(international study ofunruptured intracranial aneurysms,ISUIA)[6]、国际蛛网膜下腔出血动脉瘤试验(international subarachnoid aneurysm trial,ISAT)[50]、未破裂脑动脉瘤研究(unruptured cerebral aneu-rysm study,UCAS)[51]3 项动脉瘤研究中,均未对囊性动脉瘤进行明确的定义或提出诊断标准,但MRA、CTA和DSA均可作为颅内动脉瘤的诊断工具,同时DSA 是诊断颅内动脉瘤的“金标准”。但对膨出的程度、形态等达到何标准可做为动脉瘤的定义,现尚无定论。
2. 1. 2 分类:依据是否破裂,可将颅内动脉瘤分为未破裂及破裂动脉瘤;依据病因,可将其分为感染性、外伤性动脉瘤等。基于动脉瘤影像学特征的判读,本共识主要就动脉瘤大小及形态进行推荐。
根据形态学特征,可将颅内动脉瘤大致分为囊性与非囊性动脉瘤。囊性动脉瘤是指动脉侧壁发出的异常类圆形膨出,通常具有瘤颈小于瘤体的特征。非囊性动脉瘤主要包括梭形动脉瘤、蛇形动脉瘤等,其中梭形动脉瘤较为常见,主要表现为节段性血管壁向各方向的异常膨出;蛇形动脉瘤较为少见,主要表现为长节段的迂曲扩张,并常伴有瘤内血栓形成。临床常用的标准是依据动脉瘤最大径,将其分为小型动脉瘤(最大径<5mm)、中型动脉瘤(5mm≤最大径<15mm)、大型动脉瘤(15mm≤最大径<25mm)以及巨大型动脉瘤(最大径≥25mm),动脉瘤大小通常被认为与其破裂风险存在相关性[52-53]。ISUIA一期研究表明,对于最大径<10mm且不伴SAH病史的动脉瘤患者,其年破裂率为0.05%;对于最大径≥10mm且伴有SAH病史的动脉瘤患者,其年破裂率为1.00%,后者的破裂风险是前者的20倍[6]。ISUIA二期研究结果显示,无SAH病史且位于ICA、前交通动脉、ACA或MCA的未破裂动脉瘤,最大径分别为<7、7~12、13~24、≥25mm患者的5年累积破裂率分别为0、2.6%、14.5%和40.0%;而最大径相同,但位于后循环、后交通动脉的未破裂动脉瘤患者,其5年累积破裂率分别为2.5%、14.5%、18.5%和50.0%[54]。UCAS研究结果表明,与最大径为3~4mm的未破裂动脉瘤相比,最大径为5~6、7~9、10~24和≥25mm未破裂动脉瘤的破裂风险分别增至1.13倍(95%CI:0.58~2.22)、3.35倍(95%CI:1.87~6.00)、9.09倍(95%CI:5.25~15.74)和76.26倍(95%CI:32.76~177.54)[51]。此外,有研究结果表明,对于最大径<3mm的微小动脉瘤,不治疗而进行定期的影像学随访是获益最大的处理方式[55]。
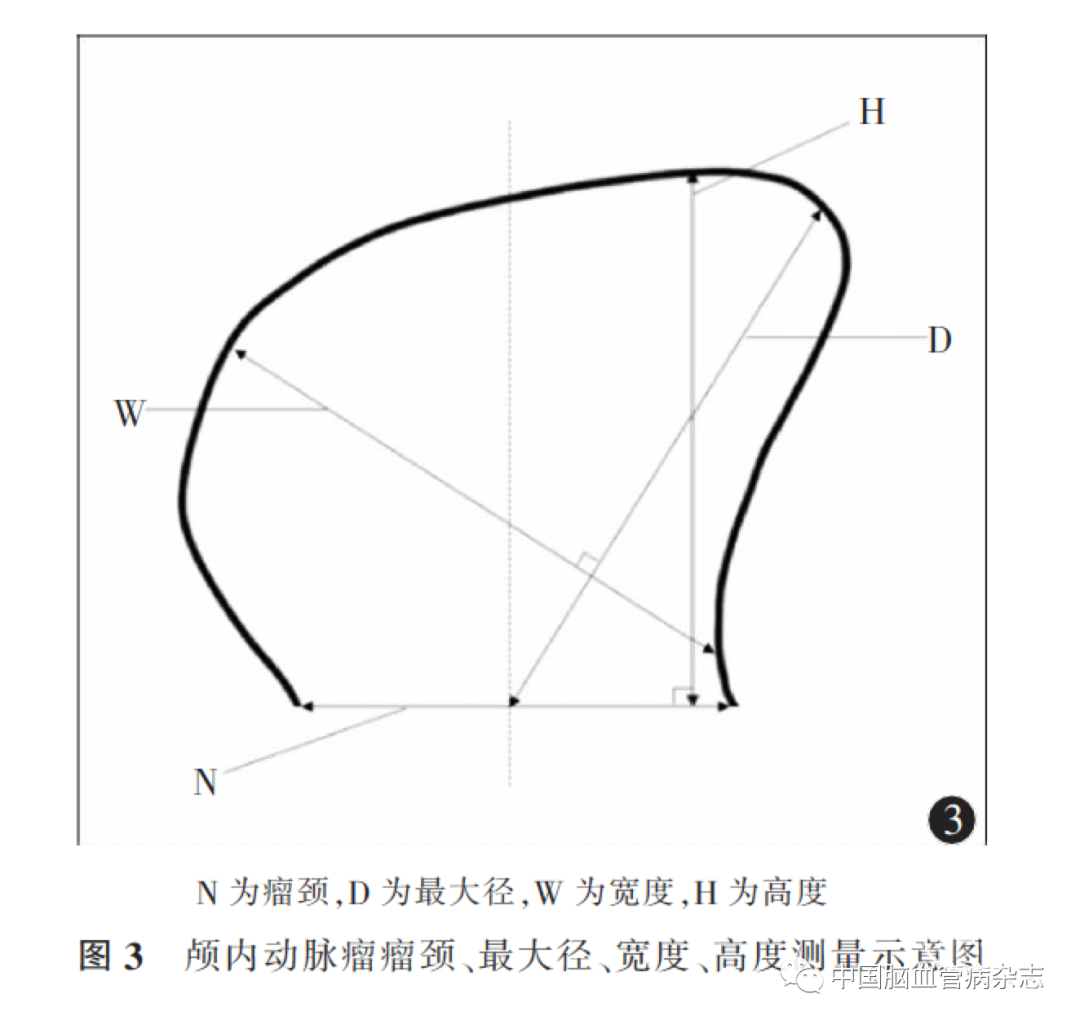
2. 2. 1 瘤颈:沿载瘤动脉走形方向,动脉瘤凸起处的根部连线即为动脉瘤的瘤颈[56]。见图3。
2. 2. 2 最大径、宽度、高度:动脉瘤最大径是指广义的瘤颈中点至动脉瘤瘤顶的最大距离;宽度是指最大径的垂直线与动脉瘤壁相交形成的最长线段;高度是指广义的瘤颈垂直线至动脉瘤瘤顶的最大距离[56]。见图3。
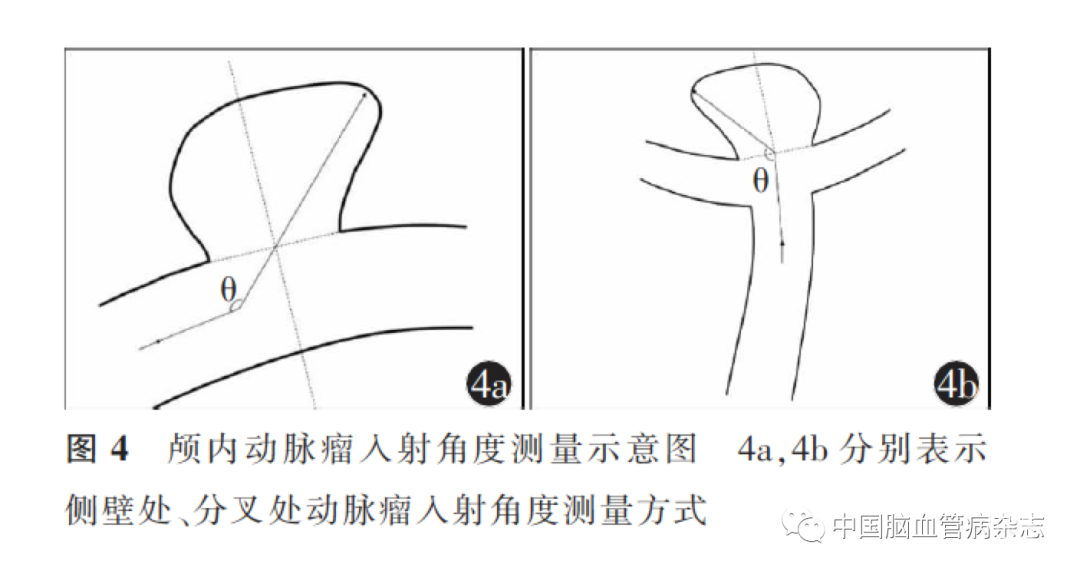
2. 2. 3 入射角度:入射角度是指载瘤动脉中心线与动脉瘤最大径方向所呈的平面投影夹角。见图4。入射角度与瘤顶部血流的流速峰值和动能呈正相关,是影响侧壁动脉瘤破裂的重要危险因素[56-57]。对于伴子囊的动脉瘤,其入射角度的测量应发生变化[58]。
2. 2. 1 瘤颈:沿载瘤动脉走形方向,动脉瘤凸起处的根部连线即为动脉瘤的瘤颈[56]。见图3。
2. 2. 2 最大径、宽度、高度:动脉瘤最大径是指广义的瘤颈中点至动脉瘤瘤顶的最大距离;宽度是指最大径的垂直线与动脉瘤壁相交形成的最长线段;高度是指广义的瘤颈垂直线至动脉瘤瘤顶的最大距离[56]。见图3。

2. 2. 3 入射角度:入射角度是指载瘤动脉中心线与动脉瘤最大径方向所呈的平面投影夹角。见图4。入射角度与瘤顶部血流的流速峰值和动能呈正相关,是影响侧壁动脉瘤破裂的重要危险因素[56-57]。对于伴子囊的动脉瘤,其入射角度的测量应发生变化[58]。

有研究报道,对于梭形动脉瘤,需要对其病变长度及垂直于长轴的宽度进行测量,便于更好地判定其形态学变化[59]。
随访时,若颅内未破裂动脉瘤出现增长,其破裂风险增加12倍[60]。然而,判断动脉瘤是否增长尚无统一标准。现有研究报道,在判断动脉瘤增长时,多基于DSA二维或三维重建图像,或MRA及CTA的容积重建或MIP重建图像的测量数据。现将常用的动脉瘤增长判断标准列举如下:
2. 4. 1 基于MRA 的动脉瘤增长判断:有研究表明,动脉瘤最大径出现任何的明显增长或动脉瘤形态学的整体改变即可定义为动脉瘤增长[61],但该种无量化指标仅基于医师的主观判断,因此,推广使用存在难度。对于最大径<5mm的动脉瘤,在任何一条径线上出现≥1mm的增长,即可认为动脉瘤发生增长[61]。对于最大径≥5mm的动脉瘤,在任何一条径线上出现≥2mm的增长,才可认为动脉瘤发生增长[62-63]。上述定义方式考虑到了每次MRA扫描可能存在的不确定性和系统误差,但标准值的设立是否合理难以验证。因此,有研究提出,MRA上动脉瘤任一径线增长超过1.5倍,或出现明显形态学改变,即认为动脉瘤发生增长[63]。该测量方法比较适合小型动脉瘤,而对于中、大型动脉瘤,该标准则过于宽泛。多项研究表明,将MRA上动脉瘤最大径增加1.0mm[64-66],或两条径线上的增加均>0.5mm,或动脉瘤出现明显小阜或分叶等形态学变化,即可认为动脉瘤发生了增长[65]。该判断方法覆盖较广,不容易漏诊,但仍存在因选取工作角度不同而致出现不同判读结果的情况。
2. 4. 2 基于CTA的动脉瘤增长判断:基于CTA的动脉瘤增长判断与MRA类似,但标准更不统一。在目前已报道的研究中,对CTA上的动脉瘤增长有最大径增长0.5mm[62]、1.0mm[64]或2.0mm[67]等不同标准。目前,较高质量证据研究结果显示,仍以最大径增加1.0mm,或两条径线上的增加均>0.5mm,或动脉瘤出现明显小阜或分叶等形态学变化作为动脉瘤增长的判断标准[64-65]。
2. 4. 3 基于DSA的动脉瘤增长判断:因DSA图像质量相对较高,动脉瘤最大径增长>1.0mm即认为动脉瘤发生增长[66]。此外,也有研究提出,动脉瘤体积相关概念,包括体积增长>20%被认为动脉瘤发生增长[68-70]。但由于基于公式演算得到的体积数值存在较大误差,体积增长概念尚未在临床中广泛应用。同时,因DSA检查存在一定程度的血管损伤、辐射等相关风险,故该影像学方式在未破裂动脉瘤随访中的应用存在局限性。
综上所述,相比于CTA或DSA,MRA更多应用于动脉瘤增长的研究,又因其无创、操作相对简便,目前,被首先推荐应用于判断动脉瘤是否增长的相关研究[60]。目前,覆盖最广且最不易漏诊的判断方法是最大径增加1.0mm,或任意两条径线上的增加均>0.5mm,或动脉瘤出现小阜或分叶等明显的形态学变化,因此,可推荐作为判断动脉瘤增长的标准。但仍期待未来出现相关三维的动脉瘤增长标准,以消除工作角度带来的测量和(或)判断误差。
2. 5. 1 长宽比:长宽比的定义为动脉瘤最大径与动脉瘤宽度的比值。长宽比与动脉瘤破裂风险存在高度相关性,且代表了动脉瘤的形态,即长宽比的值越大,动脉瘤越细长、破裂风险越高;反之,动脉瘤越短宽,破裂风险相对越低[70-71]。
2. 5. 2 尺寸比:尺寸比的定义为动脉瘤高度与载瘤动脉平均直径的比值。尺寸比与动脉瘤破裂风险相关(OR=1.41,95% CI:1. 03 ~1. 92)[56]。
2. 5. 3 纵横比:纵横比的定义为动脉瘤高度与瘤颈的比值。纵横比大于某区间上限时,血流流入动脉瘤瘤腔的速度明显升高,继而可致动脉瘤破裂风险增加,区间上限临界值为1.4或1.6[72]。
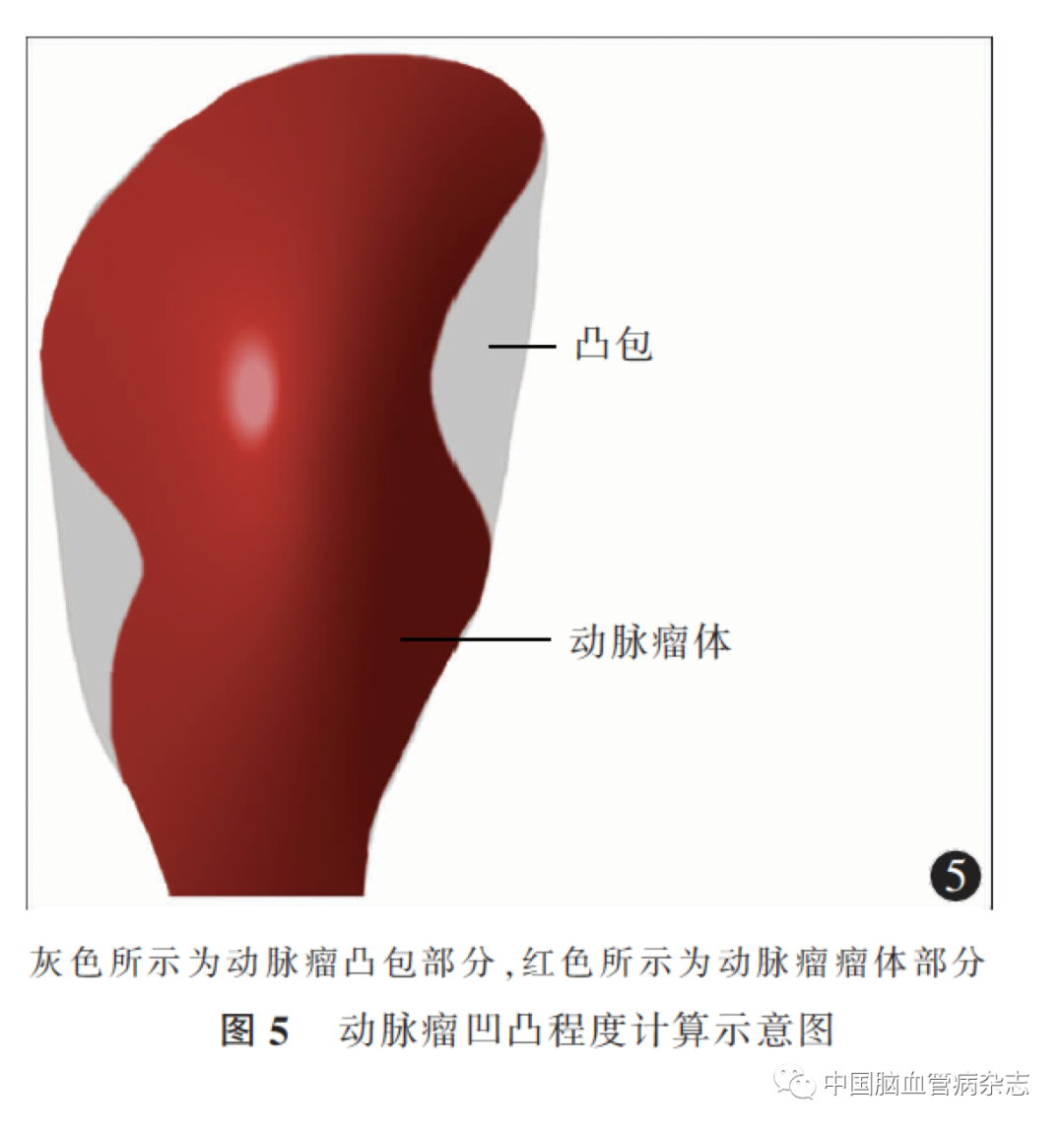
2. 5. 4 动脉瘤的凹凸程度:动脉瘤凹凸程度的三维形态学参数主要有椭圆形指数、波动指数和非球面指数,其中椭圆形指数用以评价动脉瘤的拉伸程度,波动指数用以描述动脉瘤表面的波动情况,而非球面指数是波动指数与椭圆形指数的综合评价参数,其与动脉瘤破裂风险呈正相关[56]。相关计算公式:波动指数=1-(V/Vch),椭圆形指数=1-(18π)1/3Vch2/3/Sch,非球面指数=1-(18π)1/3V2/3/S,其中V、Vch、S、Sch分别表示动脉瘤体积、凸包体积、动脉瘤表面积、凸包表面积。研究报道,与椭圆形指数和波动指数有关的参数有动脉瘤凸包体积和动脉瘤凸包表面积,波动指数与动脉瘤凸包体积呈正相关,而与动脉瘤实际体积呈负相关,波动指数越大,动脉瘤越不规则,则破裂风险增加;动脉瘤凸包表面积值越大,则动脉瘤形态越接近长椭圆形,反之,动脉瘤越接近圆形,椭圆形指数与动脉瘤表面光滑程度越无关[56]。见图5。
2. 5. 1 长宽比:长宽比的定义为动脉瘤最大径与动脉瘤宽度的比值。长宽比与动脉瘤破裂风险存在高度相关性,且代表了动脉瘤的形态,即长宽比的值越大,动脉瘤越细长、破裂风险越高;反之,动脉瘤越短宽,破裂风险相对越低[70-71]。
2. 5. 2 尺寸比:尺寸比的定义为动脉瘤高度与载瘤动脉平均直径的比值。尺寸比与动脉瘤破裂风险相关(OR=1.41,95% CI:1. 03 ~1. 92)[56]。
2. 5. 3 纵横比:纵横比的定义为动脉瘤高度与瘤颈的比值。纵横比大于某区间上限时,血流流入动脉瘤瘤腔的速度明显升高,继而可致动脉瘤破裂风险增加,区间上限临界值为1.4或1.6[72]。
2. 5. 4 动脉瘤的凹凸程度:动脉瘤凹凸程度的三维形态学参数主要有椭圆形指数、波动指数和非球面指数,其中椭圆形指数用以评价动脉瘤的拉伸程度,波动指数用以描述动脉瘤表面的波动情况,而非球面指数是波动指数与椭圆形指数的综合评价参数,其与动脉瘤破裂风险呈正相关[56]。相关计算公式:波动指数=1-(V/Vch),椭圆形指数=1-(18π)1/3Vch2/3/Sch,非球面指数=1-(18π)1/3V2/3/S,其中V、Vch、S、Sch分别表示动脉瘤体积、凸包体积、动脉瘤表面积、凸包表面积。研究报道,与椭圆形指数和波动指数有关的参数有动脉瘤凸包体积和动脉瘤凸包表面积,波动指数与动脉瘤凸包体积呈正相关,而与动脉瘤实际体积呈负相关,波动指数越大,动脉瘤越不规则,则破裂风险增加;动脉瘤凸包表面积值越大,则动脉瘤形态越接近长椭圆形,反之,动脉瘤越接近圆形,椭圆形指数与动脉瘤表面光滑程度越无关[56]。见图5。

颅内动脉瘤形态学改变可以反映其发生、增长、破裂的过程,动脉瘤参数与制定治疗计划、预测破裂风险等紧密相关,因此,颅内动脉瘤的形态学测量是临床诊治的基础。目前,颅内动脉瘤的测量分为传统的人工测量与创新的自动测量,随着智能技术的发展,自动测量已显现出越来越重要的地位。
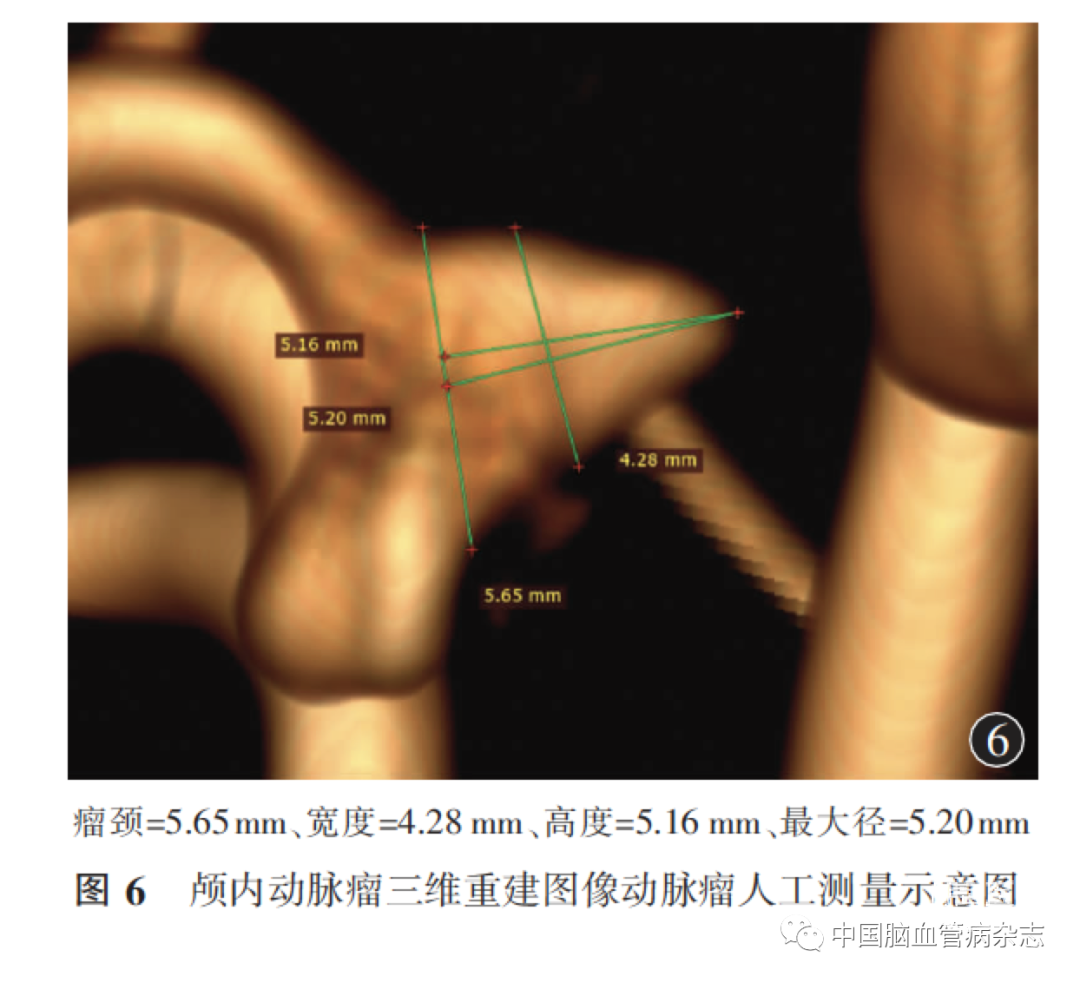
2. 6. 1 人工测量:DSA作为颅内动脉瘤检出的“金标准”,目前基于三维DSA进行的人工测量仍是动脉瘤形态学测量最常用的方式。首先,从图片存储及传输系统重建后的三维DSA影像中,根据动脉瘤形态、部位、是否累及分支血管等情况选择最佳工作角度,必要时对周围遮挡的血管进行裁剪;其次,在所选工作角度基础上,逐一选点对动脉瘤的瘤颈、长、宽、高等参数进行测量。见图6。整个操作过程相对简便快捷,自由度较高,测量结果也较为直观,因此,人工测量在临床诊疗以及科学研究方面均得到了广泛的应用。但人工测量仍存在一定的缺陷,首先,选择最佳工作角度是其中的关键步骤,但其主观性较强,不同术者进行测量时乃至同一术者进行两次测量时很难选取相同的工作角度;其次,虽然各径线测量均有明确的定义,但人工测量在瘤颈中点的选取、最长径的选择、宽径作线测量等方面很难做到精准。因此,以上因素均可能导致在测量同一个动脉瘤时出现测量值不一致或偏差等情况[73]。此外,在处理多发、不规则动脉瘤等复杂动脉瘤时,人工测量可能会耗时较常用的方式。首先,从图片存储及传输系统重建后的三维DSA影像中,根据动脉瘤形态、部位、是否累及分支血管等情况选择最佳工作角度,必要时对周围遮挡的血管进行裁剪;其次,在所选工作角度基础上,逐一选点对动脉瘤的瘤颈、长、宽、高等参数进行测量。见图6。整个操作过程相对简便快捷,自由度较高,测量结果也较为直观,因此,人工测量在临床诊疗以及科学研究方面均得到了广泛的应用。但人工测量仍存在一定的缺陷,首先,选择最佳工作角度是其中的关键步骤,但其主观性较强,不同术者进行测量时乃至同一术者进行两次测量时很难选取相同的工作角度;其次,虽然各径线测量均有明确的定义,但人工测量在瘤颈中点的选取、最长径的选择、宽径作线测量等方面很难做到精准。因此,以上因素均可能导致在测量同一个动脉瘤时出现测量值不一致或偏差等情况[73]。此外,在处理多发、不规则动脉瘤等复杂动脉瘤时,人工测量可能会耗时较长。
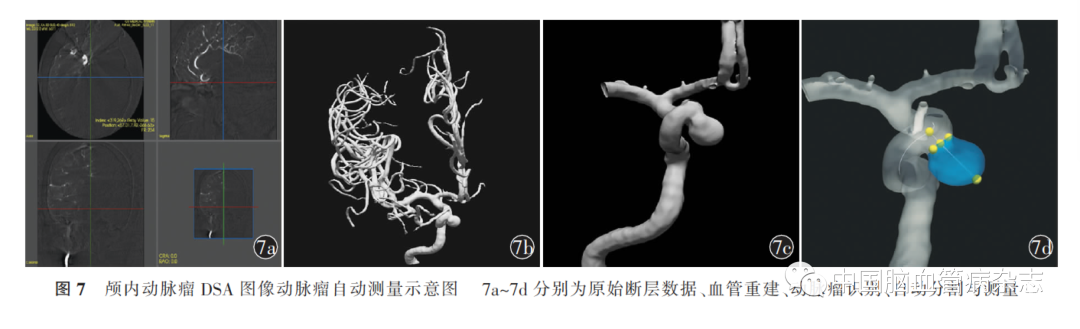
2.6.2 自动测量:随着计算机及人工智能技术的不断发展,自动测量技术应运而生,相关技术的报道最早可追溯到2004年[74]。自动测量大致可分为血管还原、动脉瘤识别、动脉瘤分割、动脉瘤测量等步骤。首先,血管还原,即计算机通过容积重建方式,将断层影像学数据进行重建,以获取可视化血管形态(图7a,7b)。其次,动脉瘤识别,即经过大数据训练和深度学习后,计算机通过U型网络将动脉瘤影像学特征转化为可识别的二进制代码,并建立动脉瘤识别模型,搭载相关模型后,计算机即可在全脑血管中识别动脉瘤(图7c)。再次,动脉瘤分割,即明确动脉瘤位置后,计算机对载瘤动脉中心线进行还原,通过最大内切圆的方式完成瘤颈分割,继而得到分割后的动脉瘤。最后,动脉瘤测量,完成动脉瘤分割即可对各测量径线进行定义,并直接进行相关参数的测量(图7d)。
自动测量的优势主要体现在针对同一动脉瘤进行多次测量的结果可具有良好的一致性。一项基于数字模体与实际动脉瘤不同测量方式的对比研究结果表明,自动测量在动脉瘤最大径、瘤颈、宽、高、入射角度等形态学参数测量结果的一致性优于人工测量[75]。该研究中报道的是半自动测量方式,需辅以部分人工手动操作,完全自动化测量有待进一步探讨。随着人工智能与大数据技术的不断发展,自动测量将会朝着全自动、更便捷、更准确的方向不断发展。
在完成自动测量并获取相关参数后,计算机可同时完成长宽比、尺寸比等衍生参数的计算。此外,自动测量还可实现人工测量无法实现的波动指数、非球面指数等衍生参数的测量和计算。未来,随着动脉瘤量化分析需求的增加,将有更多既往人工测量无法实现但存在潜在意义的参数纳入智能测量中,如动脉瘤体积及其体积的前后变化、载瘤动脉直径波动范围等。
在临床应用中,自动测量存在一定的局限性。目前,人工测量仍是颅内动脉瘤临床诊疗以及科学研究中应用最为广泛的测量方式,自动测量的可行性在部分研究中已得到了初步验证,但现阶段主要用于囊性动脉瘤,梭形等特殊动脉瘤自动测量的相关技术仍需通过大数据深度学习的方式进一步优化。
推荐意见:
(1)根据动脉瘤最大径,将大小分为微小动脉瘤(最大径<3mm),小型或中小型动脉瘤(3mm≤最大径<10mm),中型动脉瘤(10mm≤最大径<15mm),大型动脉瘤(15mm≤最大径<25mm)以及巨大动脉瘤(最大径≥25mm)。
(2)人工测量动脉瘤时,需由有经验的医师选取最佳角度,严格按照相关径线定义对动脉瘤的瘤颈、最大径、宽、高及入射角度进行测量,从而为破裂风险的预测以及相关衍生参数的计算奠定基础。
(3)长宽比、尺寸比、纵横比等衍生参数均被证实与动脉瘤破裂或增长存在一定的相关性,相关参数对动脉瘤破裂风险预测存在一定的参考价值。
(4)最大径增加1.0mm,或两条径线上的增加均>0.5mm,或动脉瘤出现小阜或分叶等明显的形态学变化,满足以上任一标准可判定动脉瘤出现了增长。
(5)人工测量仍是临床动脉瘤诊疗过程中最常用的方式,其准确性与一致性均得到了验证。自动测量的准确性与一致性均得到了初步验证,相比人工测量,自动测量更方便、快捷、可重复性强,且在复杂参数计算等方面存在优势,但特殊形态动脉瘤的自动测量仍有待进一步优化与验证。
血流动力学诱导的血管壁炎性反应在颅内动脉瘤形成、发展和破裂过程中发挥着至关重要的作用[76-77]。近20年来,计算流体力学技术飞速发展,成为目前动脉瘤血流动力学研究的主要手段。计算流体力学对动脉瘤血流动力学的模拟主要通过DSA、CTA或MRA的三维断层影像学数据进行三维血管建模,然后进行网格化处理,并使用相关软件进行有限元分析得出结果。目前,计算流体力学主要作为针对颅内囊性动脉瘤的形成、发展和破裂机制的研究方法被广泛运用,而在不规则动脉瘤中,计算流体力学的应用则较为局限。
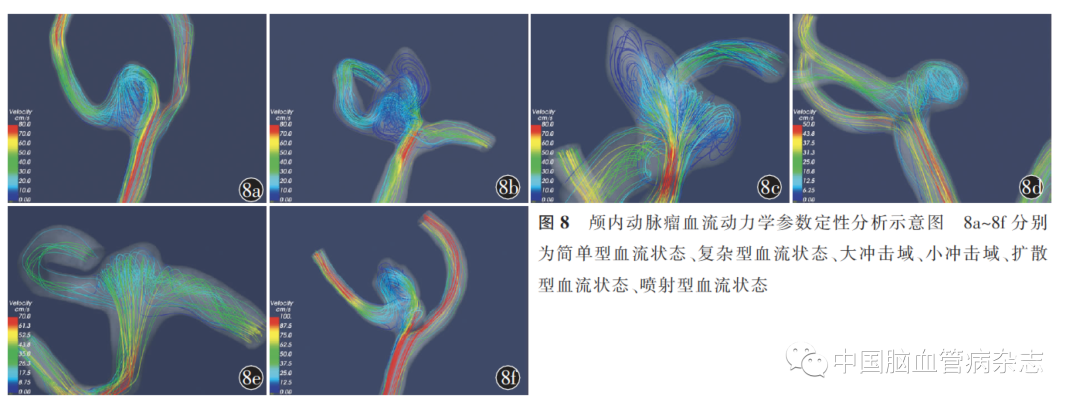
3. 2. 1 定性分析:动脉瘤血流动力学的定性分析主要包括血流复杂程度、血流的稳定性、血流的集中性和血流冲击域大小等方面[78]。见图8。(1)血流复杂程度方面,简单型指血流经过动脉瘤内仅形成一个环流或涡流;而复杂型则指流束发生分离,产生了多个环流或涡流。(2)血流的稳定性方面,稳定性指在一个完整心动周期内,血流特征未发生变化;不稳定性指在一个心动周期内,血流方向发生了分离,涡流结构发生了移动或被破坏。(3)血流的集中性方面,喷射型血流状态是指血流流入动脉瘤后,血流流束仍保持原来的方向继续深入动脉瘤内,流束集中。扩散型血流状态是指血流穿过动脉瘤瘤颈后很快发生扩散,流束宽而分散。(4)血流冲击域大小方面,血流冲击域定义为血流射入动脉瘤,撞击瘤壁后方向发生改变或发生弥散的区域。该区域常呈现增高的剪应力。当冲击域面积小于动脉瘤面积的一半时,定义为小冲击域,反之定义为大冲击域。
未破裂动脉瘤多表现为简单的单涡流模式,而破裂动脉瘤多表现出复杂的多涡流[78]。相较于未破裂动脉瘤,破裂动脉瘤的血流模式更复杂和不稳定[79]。随访期间,未破裂动脉瘤的增长与不稳定的血流状态显著相关[80]。一项对210 例颅内动脉瘤血流动力学进行分析发现,更加聚集的射流、小的射流承受区域、复杂及不稳定的血流模式是动脉瘤破裂的危险因素[78]。有研究对颅内动脉瘤行进一步量化分析表明,集中的血流、高的平均WSS及低的瘤壁黏滞扩散是动脉瘤破裂的危险因素[81]。
3. 2. 2 WSS 和壁面剪应力梯度(wall shear stress gradient,WSSG):WSS是指血液流动对血管内壁产生的剪切力,可理解为血流作用于血管内壁的摩擦力[82]。剪切力与两物体之间的速度梯度成正比,WSSG定义为切应力沿流动方向的空间导数,即沿血管长度的WSS变化[83]。多项研究结果表明,高WSS和WSSG与血管重构和最终动脉瘤形成有关[82-85]。但血流动力学因素对动脉瘤增长的影响尚未确定。高WSS和低WSS均与动脉瘤的增长有关,主要有高WSS和低WSS两种理论对动脉瘤发展过程中血流动力学所发挥作用的解释[86-88]。目前,关于动脉瘤破裂的血流动力学危险因素存在争议,但多项研究结果均提示,相较于未破裂动脉瘤,破裂动脉瘤与低WSS相关[76,85]。有研究报道了一项关于动脉瘤血流动力学破裂风险的荟萃分析,共纳入11项动脉瘤血流动力学破裂风险的研究(包括331个未破裂动脉瘤和168个破裂动脉瘤),结果显示,破裂动脉瘤的平均WSS和标准化WSS明显更低[85]。
3. 2. 3 低壁面剪应力区域(low shear area,LSA):LSA定义为动脉瘤WSS低于1/10载瘤动脉的平均WSS区域[89]。瘤体表面LSA越大,动脉瘤破裂风险越高。有荟萃分析纳入了15项研究,共779例患者的900个动脉瘤,结果表明LSA与颅内动脉瘤破裂显著相关[90]。一项研究纳入了67例位于MCA的动脉瘤患者,对动脉瘤的血流动力学进行分析,结果提示破裂动脉瘤组平均LSA 明显高于未破裂动脉瘤组[89]。
3. 2. 4 能量损耗:根据能量守恒原理,血液流动损耗的动能将转化为其他形式的能量,如热能、势能等,而其他形式的能量可致动脉瘤壁变形,甚至破裂,发生SAH。能量损耗能够精确地评估动脉瘤内压力变化和血流动能的改变,能够展示血流动力及其与血管壁碰撞间的关系[91]。通过对破裂及未破裂动脉瘤随访过程中的血流动力学进行分析,发现高的能量损耗是动脉瘤破裂的危险因素[92]。有研究在前交通动脉动脉瘤的血流动力学分析中发现,破裂动脉瘤能量损耗明显高于未破裂动脉瘤,且血流模式更为复杂和不稳定[93]。
3. 2. 5 振荡剪切指数(oscillatory shear index,OSI):OSI主要用于评价血流方向上的时间变化,用来衡量在心动周期中WSS 方向改变的程度[76]。若在整个心脏周期中,动脉瘤内血流在某一特定点的方向保持不变,那么,此时的OSI值则很低。血流时间的变化可以通过整个心脏周期中的血流漩涡来说明。一项基于血流动力学的系统回顾结果显示,破裂动脉瘤的OSI值较高,但也有研究提出破裂与未破裂动脉瘤OSI值的差异无统计学意义(P>0.05)[85]。因此,OSI在预测动脉瘤破裂中的作用仍需进一步探讨[83]。
3. 2. 6 梯度振荡数值(gradient oscillatory number,GON):GON是心动周期内血流作用在内皮细胞上的血流动力学参数,主要用来量化振荡张力和压缩力的程度。GON的局部升高可能提示是入射角度形成的区域。有荟萃分析纳入了22项动脉瘤血流动力学分析,其中19个动脉瘤的高GON与动脉瘤形成区域高度相关[94]。有研究报道,在5个侧壁动脉瘤中有4个动脉瘤的高GON与动脉瘤形成存在关联[95]。
3. 2. 7 其他参数:随着对颅内动脉瘤血流动力学研究的深入,更多有意义的血流动力学相关参数被发现,如相对阻滞时间代表了血液在血管壁周围的停滞时间,相对阻滞时间越高表示血流阻滞时间越长,流速越慢,WSS则越低[96-97]。高振荡速度指数可测量三维空间中流速矢量方向的变化,反映出流速的复杂性和稳定性,高振荡速度指数与破裂动脉瘤有关[98]。
3. 2. 1 定性分析:动脉瘤血流动力学的定性分析主要包括血流复杂程度、血流的稳定性、血流的集中性和血流冲击域大小等方面[78]。见图8。(1)血流复杂程度方面,简单型指血流经过动脉瘤内仅形成一个环流或涡流;而复杂型则指流束发生分离,产生了多个环流或涡流。(2)血流的稳定性方面,稳定性指在一个完整心动周期内,血流特征未发生变化;不稳定性指在一个心动周期内,血流方向发生了分离,涡流结构发生了移动或被破坏。(3)血流的集中性方面,喷射型血流状态是指血流流入动脉瘤后,血流流束仍保持原来的方向继续深入动脉瘤内,流束集中。扩散型血流状态是指血流穿过动脉瘤瘤颈后很快发生扩散,流束宽而分散。(4)血流冲击域大小方面,血流冲击域定义为血流射入动脉瘤,撞击瘤壁后方向发生改变或发生弥散的区域。该区域常呈现增高的剪应力。当冲击域面积小于动脉瘤面积的一半时,定义为小冲击域,反之定义为大冲击域。

未破裂动脉瘤多表现为简单的单涡流模式,而破裂动脉瘤多表现出复杂的多涡流[78]。相较于未破裂动脉瘤,破裂动脉瘤的血流模式更复杂和不稳定[79]。随访期间,未破裂动脉瘤的增长与不稳定的血流状态显著相关[80]。一项对210 例颅内动脉瘤血流动力学进行分析发现,更加聚集的射流、小的射流承受区域、复杂及不稳定的血流模式是动脉瘤破裂的危险因素[78]。有研究对颅内动脉瘤行进一步量化分析表明,集中的血流、高的平均WSS及低的瘤壁黏滞扩散是动脉瘤破裂的危险因素[81]。
3. 2. 2 WSS 和壁面剪应力梯度(wall shear stress gradient,WSSG):WSS是指血液流动对血管内壁产生的剪切力,可理解为血流作用于血管内壁的摩擦力[82]。剪切力与两物体之间的速度梯度成正比,WSSG定义为切应力沿流动方向的空间导数,即沿血管长度的WSS变化[83]。多项研究结果表明,高WSS和WSSG与血管重构和最终动脉瘤形成有关[82-85]。但血流动力学因素对动脉瘤增长的影响尚未确定。高WSS和低WSS均与动脉瘤的增长有关,主要有高WSS和低WSS两种理论对动脉瘤发展过程中血流动力学所发挥作用的解释[86-88]。目前,关于动脉瘤破裂的血流动力学危险因素存在争议,但多项研究结果均提示,相较于未破裂动脉瘤,破裂动脉瘤与低WSS相关[76,85]。有研究报道了一项关于动脉瘤血流动力学破裂风险的荟萃分析,共纳入11项动脉瘤血流动力学破裂风险的研究(包括331个未破裂动脉瘤和168个破裂动脉瘤),结果显示,破裂动脉瘤的平均WSS和标准化WSS明显更低[85]。
3. 2. 3 低壁面剪应力区域(low shear area,LSA):LSA定义为动脉瘤WSS低于1/10载瘤动脉的平均WSS区域[89]。瘤体表面LSA越大,动脉瘤破裂风险越高。有荟萃分析纳入了15项研究,共779例患者的900个动脉瘤,结果表明LSA与颅内动脉瘤破裂显著相关[90]。一项研究纳入了67例位于MCA的动脉瘤患者,对动脉瘤的血流动力学进行分析,结果提示破裂动脉瘤组平均LSA 明显高于未破裂动脉瘤组[89]。
3. 2. 4 能量损耗:根据能量守恒原理,血液流动损耗的动能将转化为其他形式的能量,如热能、势能等,而其他形式的能量可致动脉瘤壁变形,甚至破裂,发生SAH。能量损耗能够精确地评估动脉瘤内压力变化和血流动能的改变,能够展示血流动力及其与血管壁碰撞间的关系[91]。通过对破裂及未破裂动脉瘤随访过程中的血流动力学进行分析,发现高的能量损耗是动脉瘤破裂的危险因素[92]。有研究在前交通动脉动脉瘤的血流动力学分析中发现,破裂动脉瘤能量损耗明显高于未破裂动脉瘤,且血流模式更为复杂和不稳定[93]。
3. 2. 5 振荡剪切指数(oscillatory shear index,OSI):OSI主要用于评价血流方向上的时间变化,用来衡量在心动周期中WSS 方向改变的程度[76]。若在整个心脏周期中,动脉瘤内血流在某一特定点的方向保持不变,那么,此时的OSI值则很低。血流时间的变化可以通过整个心脏周期中的血流漩涡来说明。一项基于血流动力学的系统回顾结果显示,破裂动脉瘤的OSI值较高,但也有研究提出破裂与未破裂动脉瘤OSI值的差异无统计学意义(P>0.05)[85]。因此,OSI在预测动脉瘤破裂中的作用仍需进一步探讨[83]。
3. 2. 6 梯度振荡数值(gradient oscillatory number,GON):GON是心动周期内血流作用在内皮细胞上的血流动力学参数,主要用来量化振荡张力和压缩力的程度。GON的局部升高可能提示是入射角度形成的区域。有荟萃分析纳入了22项动脉瘤血流动力学分析,其中19个动脉瘤的高GON与动脉瘤形成区域高度相关[94]。有研究报道,在5个侧壁动脉瘤中有4个动脉瘤的高GON与动脉瘤形成存在关联[95]。
3. 2. 7 其他参数:随着对颅内动脉瘤血流动力学研究的深入,更多有意义的血流动力学相关参数被发现,如相对阻滞时间代表了血液在血管壁周围的停滞时间,相对阻滞时间越高表示血流阻滞时间越长,流速越慢,WSS则越低[96-97]。高振荡速度指数可测量三维空间中流速矢量方向的变化,反映出流速的复杂性和稳定性,高振荡速度指数与破裂动脉瘤有关[98]。
目前,以计算流体力学技术为主的血流动力学研究仍存在诸多技术上的缺陷。首先,为方便计算,通常将血液假设为牛顿流体,血管壁假设为刚性壁,建模过程未考虑周围结构及组织的影响,如颅内血管周围的骨性结构、硬膜环、蛛网膜小梁和脑组织等,这些理想化的处理显然会造成结果不准确。其次,因为无法准确获取患者特异性边界条件,一般采用统计平均的边界条件,计算结果无法反映真实的个体特异性血管内血流动力学情况。再次,供血流动力学分析的动脉瘤三维模型的原始数据通常包括CTA、MRA和DSA三种来源,血管重建的精确程度及不同数据间的可比性均存在误差。最后,计算流体力学分析标准尚未建立,不同研究团队对计算流体力学测算的方法不尽相同,其中任一步骤的差别即可造成结果的差异。上述问题所致的血流动力学研究量化分析困境,使许多动脉瘤风险分析研究只能用参数的“高”或“低”来描述其趋势,无法建立量化的衡量标准。
近年来,4D Flow MRI血流动力学分析可对血流速度进行直接测量,并获得整个流速场信息,但其分辨率不高,受噪声和MR设备涡流影响较大,同时还可受心率和复杂血流状态的影响,其可重复性仍需进一步验证。另外,有研究使用流固耦合技术及其与HR-MRI血流动力学相结合等手段,以提高判断的精准性。未来,随着影像学研究和计算模型的不断完善,同时结合颅内动脉瘤病理生理学研究,将有助于将动脉瘤血流动力学研究发展为更新的高度。
推荐意见:
(1)颅内动脉瘤血流动力学分析存在一定局限性,缺少量化的衡量标准,相关血流动力学参数平均值与相对值的定性意义更大,参数自身的临床应用价值有待进一步提高,可结合形态学及动脉瘤壁信息进行综合分析。
(2)高WSS 和WSSG被认为与血管重构和最终动脉瘤形成有关。
(3)低WSS 或高OSI被认为与动脉瘤破裂相关。
执笔
●吉喆(首都医科大学宣武医院);
●耿介文(首都医科大学宣武医院);
●翟晓东(首都医科大学宣武医院);
●傅璠(首都医科大学宣武医院);
●樊欣鑫(西安市第三医院)
审稿专家
(按姓氏拼音排序)
白小欣(广东省中医院);蔡艺灵(解放军战略支援部队特色医学中心);曹毅(昆明医科大学第二附属医院);陈劲草(武汉大学中南医院);陈左权(上海市第十人民医院);邓剑平(空军军医大学唐都医院);段传志(南方医科大学珠江医院);范新东(上海交通大学医学院附属第九人民医院);冯军(华中科技大学同济医学院附属协和医院);高旭(北部战区总医院);管生(郑州大学第一附属医院);杭春华(南京鼓楼医院);贺民(四川大学华西医院);洪波(海军军医大学第一附属医院);胡鹏(首都医科大学宣武医院);黄昌仁(西南医科大学附属医院);黄理金(南方医科大学第三附属医院);蒋宇钢(中南大学湘雅二医院);蒯东(山西省心血管病医院);李明昌(武汉大学人民医院);李天晓(河南省人民医院);李永利(哈尔滨医科大学附属第二医院);李真保(皖南医学院弋矶山医院);梁旭光(赤峰市医院);刘加春(首都医科大学三博脑科医院);刘圣(南京医科大学第一附属医院);刘增品(河北医科大学附属第二医院);卢洁(首都医科大学宣武医院);卢旺盛(北京天坛普华医院);买买提力·艾沙(新疆医科大学第一附属医院);南光贤(吉林大学中日联谊医院);潘力(解放军中部战区总医院);屈延(空军军医大学唐都医院);任军(兰州大学第二医院);史怀璋(哈尔滨医科大学附属第一医院);石忠松(中山大学孙逸仙纪念医院);孙军(温州市中心医院);田新华(厦门大学附属中山医院);佟志勇(中国医科大学附属第一医院);万杰清(上海交通大学医学院附属仁济医院);王朝华(四川大学华西医院);王东海(山东大学齐鲁医院);汪阳(首都医科大学附属北京朝阳医院);王以舟(广东省中医院);吴科学(西藏自治区人民医院);夏鹰(海口市人民医院);谢晓东(四川大学华西医院);徐斌(复旦大学附属华山医院);徐浩(武汉市中心医院);许丽华(佳木斯市中心医院);徐翔(唐山市工人医院);杨铭(解放军中部战区总医院);杨新健(首都医科大学附属北京天坛医院);于加省(华中科技大学同济医学院附属同济医院);喻孟强(中南大学湘雅二医院);张桂莲(西安交通大学第二附属医院);张鸿祺(首都医科大学宣武医院);张猛(深圳市第二人民医院);张品元(河北医科大学第三医院);张强(青海省人民医院);张晓龙(复旦大学附属华山医院);张占普(内蒙古医科大学附属医院);赵建农(海南省人民医院);赵沃华(华中科技大学同济医学院附属协和医院);赵元立(首都医科大学附属北京天坛医院);赵振伟(空军军医大学唐都医院);钟鸣(温州医科大学附属第一医院);朱良付(河南省人民医院)
参考文献 请见原文










