
胶质母细胞瘤(Glioblastoma Multiforme, GBM)是原发性脑肿瘤中最常见且致死率最高的恶性肿瘤,我国胶质瘤的发病率是 5-8/10万,病人的中位生存期在一年半左右[1]。随着医疗技术的进步,对于胶质母细胞瘤的治疗,我们有了更完整的手术方案、新的抗癌药物以及更先进的放化疗技术,但GBM患者的生存期并没有显著提升。导致这一现象的主要原因是放化疗等传统疗法虽然可以杀伤部分肿瘤细胞,但通常会引起肿瘤复发[2],而肿瘤干细胞(Cancer Stem Cells, CSCs)的存在是胶质母细胞瘤复发的根源[3,4]。
肿瘤干细胞是恶性肿瘤细胞中的一个小亚群,具有高干性和相对分裂不活跃性等特征,是多种肿瘤转移扩散和抵抗治疗的根源。小鼠和胶质母细胞瘤病人的研究都证明胶质母细胞瘤中含有肿瘤干细胞即胶质母细胞瘤干细胞(Glioblastoma Stem Cells,GSCs)[5]。GSCs的高度自我更新与分化能力是 GBM 生长的关键[6]。传统的放化疗等治疗手段主要针对分裂期的肿瘤主体细胞,而分裂缓慢的肿瘤干细胞能在放疗和化疗中生存下来,引起肿瘤复发[7,8]。肿瘤干细胞具有超强的DNA损伤修复能力及抗活性氧损伤能力,通过高表达肿瘤耐药相关蛋白MRP抵抗放疗和化疗[9-11]。胶质母细胞瘤一线化疗药物替莫唑胺(TMZ)、 洛莫司汀(CCNU)、卡莫司汀(BCNU)均不能彻底清除肿瘤干细胞[7]。综上所述,GSC 细胞对化疗药物不敏感,是GBM复发的关键[12](图1)。消除GSC细胞有助于降低肿瘤的恶性程度,显著延长生存期。
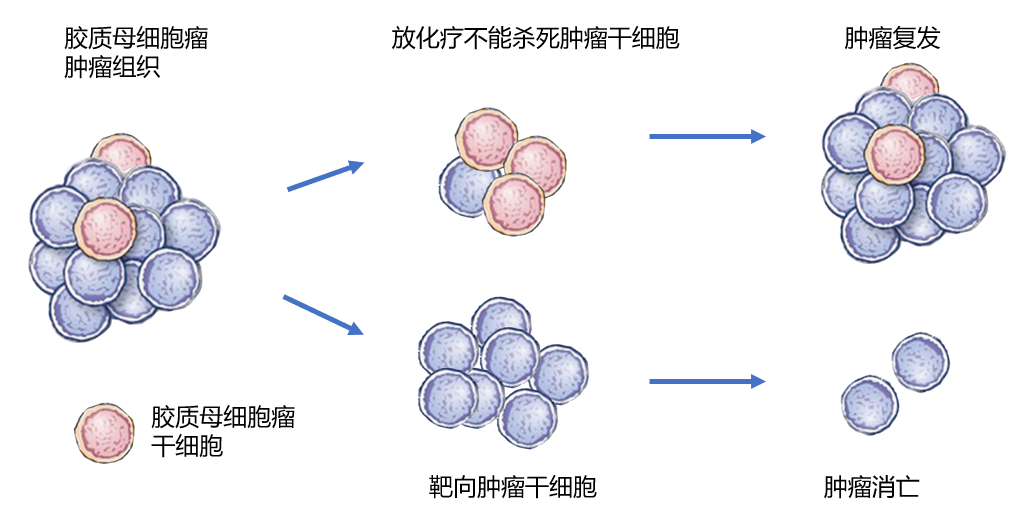
图1:胶质母细胞瘤干细胞(GSCs)引起肿瘤复发[12]
活性氧(Reactive Oxygen Species , ROS)是细胞代谢的重要副产物。维持活性氧稳态对癌细胞的生存至关重要[13,14]。肿瘤干细胞与正常组织干细胞类似,活性氧水平较低,这可能会促进干细胞自我更新,增强其抗药性[9]。那么GSC细胞和正常干细胞应对氧化还原刺激的机制是否相同呢?ROS在GSC细胞中的调控机制亦不清楚。
2021年6月17日,国家蛋白质中心、生物医学分析中心的满江红研究员和夏晴研究员团队合作在《自然.通讯》上发表论文,详细阐明了GSC生长与线粒体ROS的关系,解析了ROS在GSC细胞中的调控机制,即阻抑素通过抑制胶质母细胞瘤干细胞中活性氧的浓度来促进肿瘤生长、增强肿瘤细胞耐药性。

通过质谱筛选GSC细胞和已分化的非肿瘤干细胞(non-stem tumor cells,NSTCs)的差异蛋白谱,研究人员通过一系列条件设定:比如此蛋白需要在GSC中表达丰度较高、和GBM生长密切相关并且能被小分子抑制剂抑制活性,找到了阻抑素(Prohibitin,PHB)这个高度保守的蛋白。接着通过免疫共沉淀实验发现PHB在6株GSC细胞中表达量远高于其在NSTCs细胞中的表达量,并且随着GSC的分化,PHB的表达逐渐降低。PHB的表达量在GBM病人样本分离的细胞中比正常人的星形角质细胞和神经元前体细胞(NPC)中的含量高很多。通过体内实验以及免疫荧光等手段,研究人员发现PHB的表达与GBM组织中的干性标记物SOX2、Olig2的表达呈正相关关系。在高级别的神经胶质瘤中,PHB的表达量更高,PHB表达量高的病人的预后更差,生存期更短。PHB包含一个3’端的非翻译区,此区域有一个microRNA-27a的结合位点,因此研究人员猜测microRNA-27a可能调控PHB在GSC中的表达。通过研究发现miRNA-27a在NSTC中表达很高,而在GSC中表达很低。在GSC中过表达miR-27a可以上调PHB的表达。miR-27a介导了GSC中PHB的高表达,总之以上实验证明了PHB在GSC中高表达并且和GBM的恶性生长密切相关。
为了检测PHB在GSC中的功能,研究人员建立了敲除PHB的GSC细胞系,发现敲除PHB后 SOX2和Olig2表达显著降低,这一结果也在PHB敲低的细胞系中得到了证明。通过细胞成球实验发现敲除或者敲低PHB的GSC细胞活力大幅度相抵,自我更新能力降低。但是干扰PHB表达并不影响已经分化的NSTC细胞以及其他细胞的生长,这大概是由于PHB本身在这些细胞中的表达量较低。通过GBM原位瘤异种移植实验,发现种植敲除了PHB的GSC细胞的小鼠肿瘤比对照组小很多,生存期显著延长。使用DOX诱导系统敲低PHB的体内实验得到了相同的结果。但是过表达PHB对NSTC中SOX2的表达以及肿瘤形成没有显著影响。敲除PHB降低了GSC细胞的自我更新能力和肿瘤生长速度,说明PHB可能是GBM治疗的潜在靶点。
那么PHB是如何促进GSC细胞自我更新的呢?其内部的分子机制如何?通过定位实验发现PHB主要位于线粒体中。在PHB敲除的GSC中,氧化磷酸化通路以及ATP产量没有显著变化,但是过氧化物酶体生成量显著提高。氧化还原状态对维持肿瘤干细胞的干性以及抗药性至关重要。肿瘤干细胞中活性氧含量和对应的正常干细胞中一样低。GSC中线粒体过氧化物酶体含量比NSTC低很多,敲除PHB不影响其他神经细胞中过氧化物酶体的含量。这说明PHB可能特异性地维持GSC线粒体中活性氧含量,也表明GSC中ROS调控和其他前体神经细胞不同。使用活性氧清除剂NAC处理细胞,发现PHB敲低或敲除的GSC中过氧化物酶被清除,这一过程补救了由于PHB被干扰造成的干细胞标记蛋白表达量低和肿瘤成球能力低的现象。研究人员进一步在体内检验了PHB表达和细胞氧化应激的关系,发现PHB的表达可以抑制ROS的含量。在GBM病人肿瘤分离的GSC中发现ROS含量很低。敲除PHB诱导线粒体内ROS生成,导致调控细胞分化和细胞死亡的基因的表达上调。GSC通过高表达PHB来维持线粒体中低ROS含量,从而促进自身的更新和生长。
敲除PHB降低了过氧化还原酶PRDX3的表达,敲除PHB不影响PRDX3 mRNA水平的表达,表明PHB可能调控了PRDX3蛋白的稳定性。敲除PHB对NSTC细胞以及其他神经细胞中PRDX3水平的表达影响不明显。PRDX3 在清除GSC线粒体中过氧化物中起主要作用。GSC线粒体中PHB和PRDX3发生共定位,co-IP实验发现内源性的PHB和带有标签的PRDX3相互作用。PRDX3蛋白表达相当稳定,使用放线菌酮处理12小时不影响其稳定性。但是在PHB敲除的GSC细胞中,PRDX3蛋白的半衰期大幅度降低,表明蛋白发生了降解。进一步研究发现PHB通过泛素蛋白酶途径促进了PRDX3蛋白的稳定性。PHB通过和PRDX3结合,抑制泛素-蛋白酶途径导致的降解,从而抑制GSC线粒体中ROS的生成。
众所周知,ROS是红外辐射(Infrared ,IR)诱导细胞杀伤的关键介质。IR直接导致DNA双链断裂或通过增加ROS产量间接诱导DNA损伤。研究人员通过一系列小鼠体内实验发现,在已建立的GBM模型中,敲除PHB可以有效抑制肿瘤生长,延长生存期。IR单一疗法对抑制小鼠肿瘤生长作用有限。敲除PHB使肿瘤对IR疗法更为敏感。除了放射治疗外,使用DNA烷基化剂替莫唑氨(TMZ)是治疗GBM的常用方法,敲除PHB增强了GSC对TMZ的敏感性,但协同效应弱于PHB联合处理。综上所述,高水平的PHB通过减少ROS积累保护GSC免受IR诱导的细胞死亡,并且消除PHB与辐射协同作用可以提高GBM治疗效果。
已有研究表明,罗卡格列胺A(RocA),通过阻断PHB与其结合蛋白之间的相互作用直接靶向PHB,研究人员发现RocA可与内源性PHB结合,阻断GSC中PHB和PRDX3之间的关联。RocA处理后,PRDX3以及干细胞标记物表达降低,ROS水平显著增加,SOX2+肿瘤细胞减少,细胞凋亡增加。PHB在RocA诱导ROS中起着重要作用。通过NAC清除过氧化物显著地挽救了RocA对GSC生长的抑制。RocA治疗选择性靶向GSC,抑制原位GBM异种移植物的生长,但对正常组织没有严重毒性。RocA和IR联合治疗显著诱导GSC中过氧化物生成,细胞凋亡增加。这些结果表明RocA可以有效抑制GSC衍生的肿瘤生长,显著提高GBM放疗的疗效。
综上所述,将ROS控制在低水平对肿瘤干细胞保持其干性和耐药性非常重要。作者发现PHB在胶质母细胞瘤干细胞中可以调控ROS水平。在GSC中,PHB上调,促进GMB转移,导致预后较差。PHB同PRDX3结合,通过泛素蛋白酶通路稳定过氧化物还原酶PRDX3。敲除PHB可以大幅度提升ROS水平,抑制GSC细胞更新。敲除PHB或者用药物抑制PHB可以降低肿瘤生长,增强肿瘤对放疗的敏感性,延长胶质瘤干细胞原位瘤小鼠和异种移植小鼠的生存期。这些说明PHB在调控GSC线粒体活性氧中起重要作用,干扰PHB可以提高胶质瘤干细胞对放疗的敏感性,提升治疗神经胶质瘤的效率。
参考文献
[1] Tan, A. C. et al. Management of glioblastoma: State of the art and future directions. CA Cancer J Clin 70, 299-312, doi:10.3322/caac.21613 (2020).
[2] Crunkhorn, S. Targeting cancer cell metabolism in glioblastoma. Nat Rev Drug Discov, doi:10.1038/d41573-019-00054-3 (2019).
[3] Lan, X. Y. et al. Fate mapping of human glioblastoma reveals an invariant stem cell hierarchy. Nature 549, 227-+, doi:10.1038/nature23666 (2017).
[4] Stopschinski, B. E., Beier, C. P. & Beier, D. Glioblastoma cancer stem cells--from concept to clinical application. Cancer Lett 338, 32-40, doi:10.1016/j.canlet.2012.05.033 (2013).
[5] Lathia, J. D., Mack, S. C., Mulkearns-Hubert, E. E., Valentim, C. L. & Rich, J. N. Cancer stem cells in glioblastoma. Genes Dev 29, 1203-1217, doi:10.1101/gad.261982.115 (2015).
[6] Zhu, Y. et al. Early inactivation of p53 tumor suppressor gene cooperating with NF1 loss induces malignant astrocytoma. Cancer Cell 8, 119-130, doi:10.1016/j.ccr.2005.07.004 (2005).
[7] Sharifzad, F. et al. Glioblastoma cancer stem cell biology: Potential theranostic targets. Drug Resist Updat 42, 35-45, doi:10.1016/j.drup.2018.03.003 (2019).
[8] Chen, J. et al. A restricted cell population propagates glioblastoma growth after chemotherapy. Nature 488, 522-526, doi:10.1038/nature11287 (2012).
[9] Diehn, M. et al. Association of reactive oxygen species levels and radioresistance in cancer stem cells. Nature 458, 780-783, doi:10.1038/nature07733 (2009).
[10] Nakai, E. et al. Enhanced MDR1 expression and chemoresistance of cancer stem cells derived from glioblastoma. Cancer Invest 27, 901-908, doi:10.3109/07357900801946679 (2009).
[11] Bao, S. et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature 444, 756-760, doi:10.1038/nature05236 (2006).
[12] Shi, Y. et al. Gboxin is an oxidative phosphorylation inhibitor that targets glioblastoma. Nature 567, 341-346, doi:10.1038/s41586-019-0993-x (2019).
[13] Circu, M. L. & Aw, T. Y. Reactive oxygen species, cellular redox systems, and apoptosis. Free Radic Biol Med 48, 749-762, doi:10.1016/j.freeradbiomed.2009.12.022 (2010).
[14] Finkel, T. Reactive oxygen species and signal transduction. IUBMB Life 52, 3-6, doi:10.1080/15216540252774694 (2001).
1

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。





