2021年4月接诊一例来自陕西西安的10月龄男性患儿(身高:80cm,体重7.5kg),主因呕吐、纳差一周伴烦躁,来院就诊。家长诉孕期胎儿超声检查提示脑积水,出生后6月龄行头颅磁共振提示脑室扩张较之前有所缓解,未见明确占位性病变。10月龄时患儿出现呕吐、烦躁等症状,遂复查头颅磁共振,提示后颅窝占位,广泛播散,梗阻性脑积水,髓母细胞瘤可能性大。
鉴于肿瘤位于后颅窝,软膜下播散明显,首先考虑髓母细胞瘤,需要手术辅以化疗,风险大,预后差,家长经慎重考虑后,未再进行后续治疗。
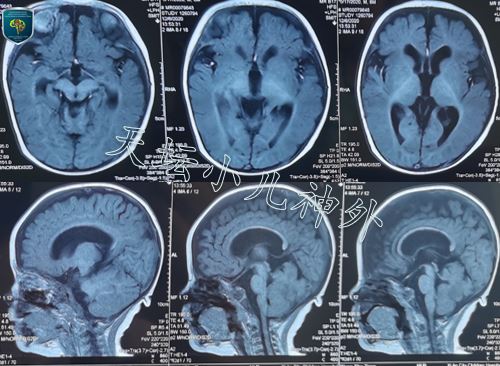
图1.患儿6月龄时行头颅MRI,未见明确后颅窝占位(未行增强扫描).
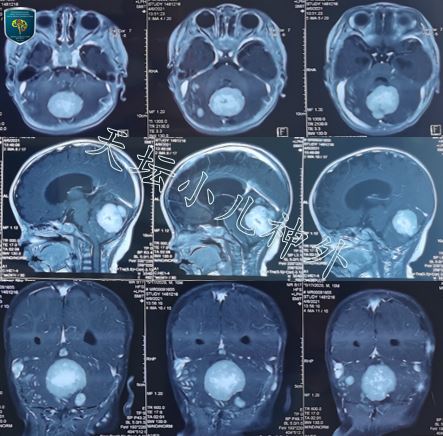
图2.患儿10月龄时因烦躁、纳差,复查头颅MRI显示后颅窝多发瘤结节形成,强化明显,主体位于小脑蚓部,伴小脑半球广泛软膜下播散,髓母细胞瘤可能性大.
治疗体会
在小儿神经外科日常诊疗工作中,广大患儿一旦被发现颅内肿瘤,家长首先会问是“先天性”的还是“后天性的”。事实上,中枢神经系统(CNS)的先天性肿瘤可分为“绝对先天性”(出生即发现)和“可能先天性”(出生后6月龄内发现)1。儿童先天性颅内肿瘤中,畸胎瘤最常见,还包括颅咽管瘤、皮样囊肿、表皮样囊肿、脉络丛乳头状瘤等,同时,恶性肿瘤中,原始神经外胚层肿瘤(PNET)、髓母细胞瘤等也有报道。随着产前神经放射诊断学的发展,胎儿先天性颅内肿瘤的检出率显著提高2。
本例患儿10月龄时发现后颅窝多发占位伴软膜下广泛播散,髓母细胞瘤可能性大。髓母细胞瘤(MB)是儿童常见颅内恶性肿瘤(WHOIV级),发病机制不明,遗传因素是唯一被证实的风险因素(TP53、PTCH1、SUFU、APC、PALB2、BRCA2突变等)3-7。
2016年,WHO首次公布了髓母细胞瘤分子分型,婴幼儿多为SHH型或Group3型8,9,预后较差。先天性髓母细胞瘤少见,新生儿髓母细胞瘤约占新生儿期颅内肿瘤的8.3%10。
产前超声筛查的广泛应用,显著提高了胎儿期先天性疾患的检出率,但对于中枢神经系统疾病,胎儿磁共振扫描(MRI)可提供优越的软组织对比度、几乎消除了运动伪影,极大提高了对先天性中枢神经系统肿瘤的检出率11,应在筛查中广泛使用。有研究表明,7.5%的髓母细胞瘤早期表现为非增强性、CT呈等密度或者低密度肿块。与正常胎儿脑组织相比,先天性髓母细胞瘤的影像学特征是表观扩散系数(ADC)显著降低,大分子质子分数(MPF)增加12。
2018年俄罗斯科学院西伯利亚分院国际层析成像中心Alexandra M.Korostyshevskaya教授报道一例胎儿产前超声提示脑积水,孕期31周行胎儿MRI显示小脑中线凹陷≤2cm,病变呈短T1短T2信号,ADC明显下降,MPF显著升高(图3)。足月分娩后,患儿5月龄时出现颅高压症状,再行头颅MRI检查显示髓母细胞瘤可能性大(图4),遂行手术部分切除,组织病理为促纤维增生/广泛结节生成型髓母细胞瘤,分子病理显示SHH型12;继而行五次HIT-SKK化疗,随访至1.5岁,肿瘤控制良好,患儿仅轻度共济失调,正常生活。
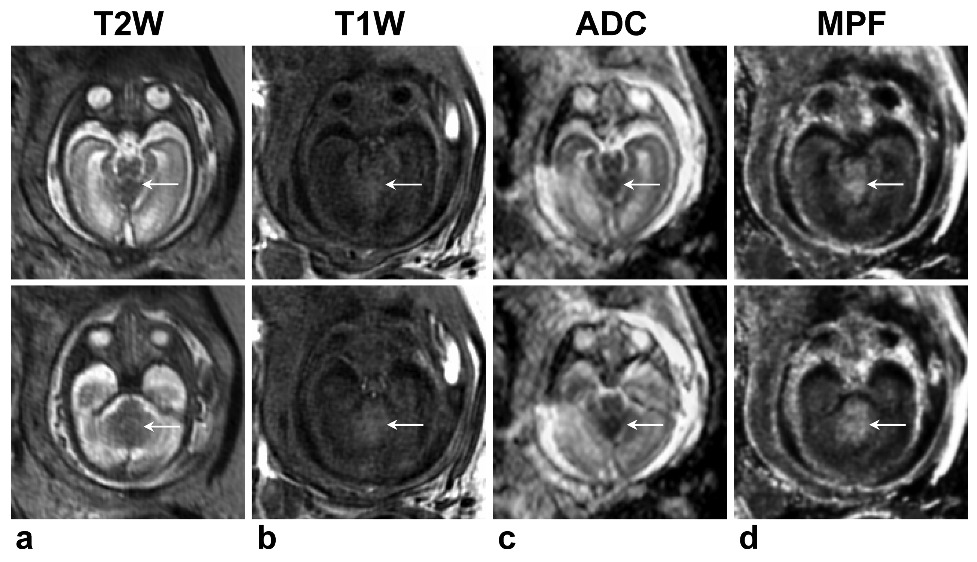
图3.胎儿孕31周产前MRI12.
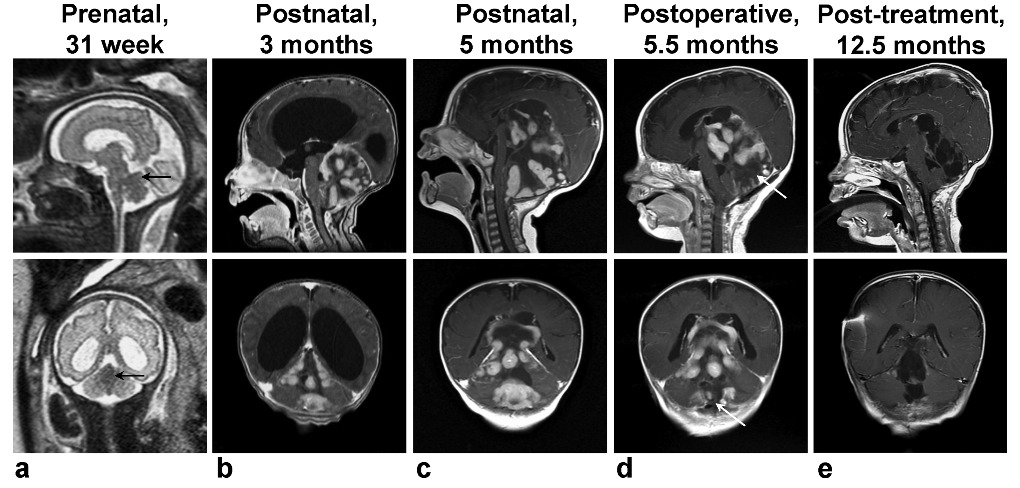
图4.患儿产前MRI、产后MRI、术前MRI、术后MRI、化疗后MRI12.
上述病例极为罕见,不应做为常规处理。我们认为,目前先天性颅内肿瘤的产前检出率不到5%,一旦确诊,应及时终止妊娠;若坚持生产,对6月龄以内的患儿施行脑肿瘤切除术风险大,围手术期死亡率高,不做推荐2。因此,如何提高胎儿产前颅内肿瘤的检出率,是神经影像科医生面临的巨大挑战。我们认为,胎儿产前超声若提示脑积水,应及时进行胎儿磁共振(MRI)检查,并着重对ADC、MPF序列进行研判,上述序列对先天性髓母细胞瘤敏感性高12,一旦检出,应建议及时终止妊娠。
参考文献
1.Woodward PJ, Sohaey R, Kennedy A et al (2005) From thearchives of the AFIP: a comprehensive review of fetal tumorswith pathologic correlation. Radiographics 25(1):215–242.
2. Mariasavina Severino,Erin S. Schwartz,Majda M. Thurnher et al, Congenital tumors of the central nervous system. Neuroradiology (2010) 52:531–548.
3.Cho, Y. J. et al. Integrative genomic analysis of medulloblastoma identifies a molecular subgroup that drives poor clinical outcome. J. Clin. Oncol.29, 1424–1430 (2011).
4 .Kool, M. et al. Integrated genomics identifies five medulloblastoma subtypes with distinct genetic profiles, pathway signatures and clinicopathological features. PLOS ONE3, e3088 (2008).
5. Thompson, M. C. et al. Genomics identifies medulloblastoma subgroups that are enriched for specific genetic alterations. J. Clin. Oncol.24, 1924–1931 (2006).
6. Remke, M. et al. Adult medulloblastoma comprises three major molecular variants. J. Clin. Oncol.29, 2717–2723 (2011).
7. Northcott, P. A. et al. Medulloblastoma comprises four distinct molecular variants. J. Clin. Oncol.29, 1408–1414 (2011).
8.Louis, D. N. et al. The 2016 World Health Organization Classification of tumors of the central nervous system: a summary. Acta Neuropathol.131, 803–820 (2016).
9. Paul A. Northcott, Giles W. Robinson, Christian P. Kratz, Medulloblasto ma, Nature Reviews Disease Primers ,(2019) 5:11.
10. Fuminari Komatsu ,Hitoshi Tsugu ,Masani Nonaka et al, Congenital Medulloblastoma with Atypical MRI Appearance, Pediatr Neurosurg 2008;44:165–168 .
11. NishioS, Morioka T, Fukui M. Medulloblastoma in the first year of life: A report of five cases. J Clin Neurosci 1998;5:265-9.
12. AlexandraM.Korostyshevskaya,AndreyA.Savelov, et al,Congenital medulloblastoma:Fetal and postnatal longitudinal observation with quantitative MR,j.clinimag.2018.06.001.





