
阿尔茨海默病(Alzheimer disease, AD)是痴呆最常见的病因,也是老龄化人群中老年疾病和死亡的主要原因之一。AD的标志性神经病理学改变是弥散性的神经炎性斑块形成,其实是一种叫做β-淀粉样物质(amyloid beta, Aβ)在细胞外的沉积,同时Aβ的沉积也会导致tau蛋白过度磷酸化,使得神经纤维像绳子缠绕一样,在细胞内形成众多缠结。目前,对于AD发病有一种经典假设:Aβ增加、聚集后的毒性以及神经缠结的共同作用会导致突触功能障碍和神经变性(Figure1),从而导致相关的认知功能下降。但是大家搞了这么多年的相关研究,也想开发一种降低Aβ水平的有效治疗方法,都没有很大成功。直到2016年Jeff Sevigny及其同事的发现——Aducanumab抗体,不仅在一定程度上验证了Aβ沉积假说,还为最新的治疗AD的药物Aducanumab单抗的出现做出了巨大研究贡献。

Jeff Sevigny及其同事的文章发表在《Nature》上,他们在动物实验(Figure2)的基础上使用双盲法以及安慰剂对照组的研究参与了PRIME项目,实验周期为期一年。他们使用了安慰剂组,以及使用1、3、6、10mg/kg剂量的Aducanumab处理组对入选的165名患有轻度AD或AD前驱期的患者(均经过Aβ特异性PET扫描,确认Aβ阳性)进行了每月静脉注射Aducanumab。
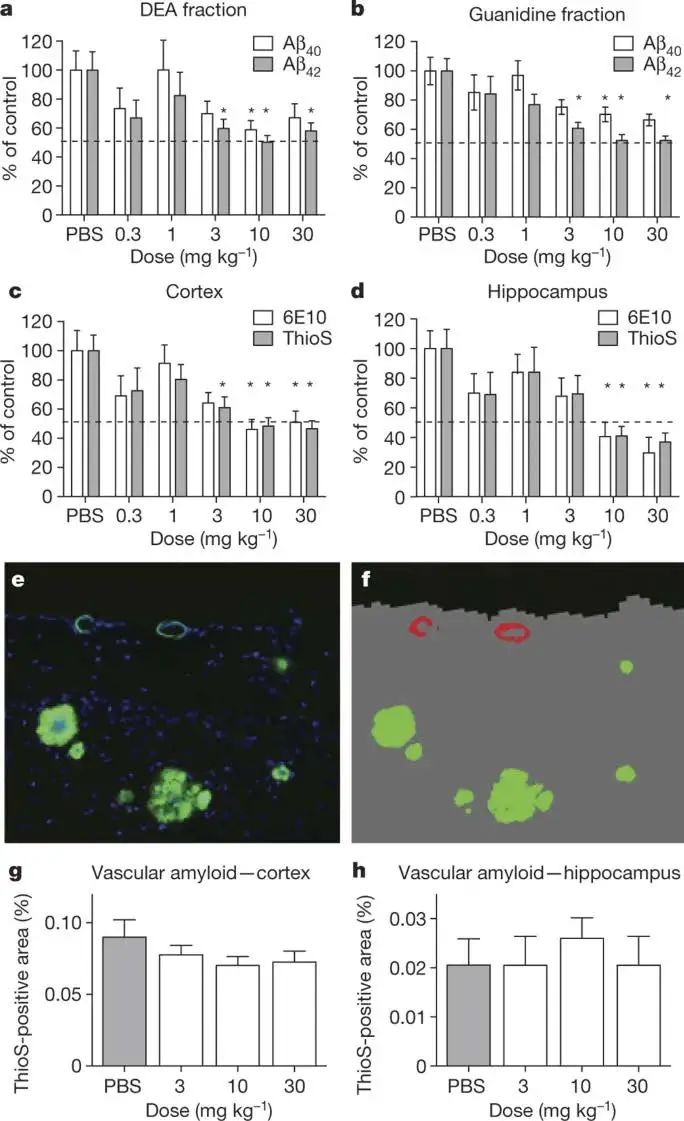
(Figure2. a-d可以看出Aducanumab处理对于各区域Aβ均有清除作用,且大致呈剂量依赖性;e-h则表明其对血管的影响较小。)
为期一年的实验结束后,165名研究对象中有125名完成的研究,其余40名则因为治疗不良反应、自愿退出而终止实验。
对于实验的结果,总体来说是令人激动的。首先,Jeff Sevigny和他的同事发现,实验组的淀粉样斑块较对照组显著减少:在第26周和54周时,Aducanumab处理组与安慰剂组相比,使用3、6和10mg/kg剂量的Aducanumab,其淀粉样斑块显著减少,同时他们还发现,淀粉样斑块的减少程度与Aducanumab呈剂量依赖关系,即在使用10mg/kg剂量的Aducanumab时,淀粉样斑块的减少最为显著(Figure3、Figure4)。

Figure3.
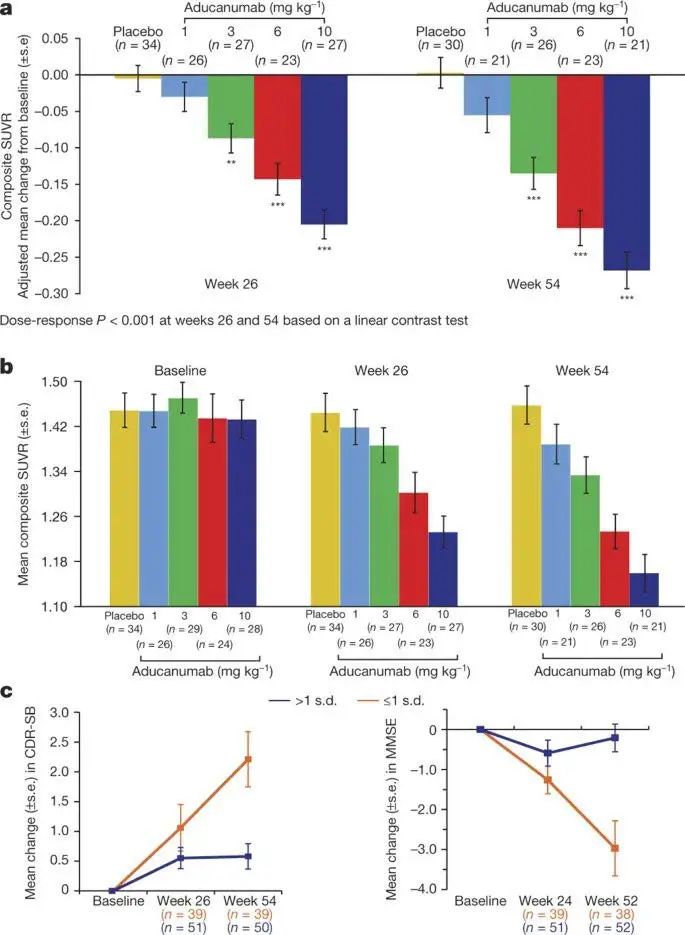
Figure4.
(Figure3为PET图像,显示基线与相应处理一年后脑中Aβ吸收值平均改变,可以看出一年后随处理剂量增加,Aβ的吸收信号逐渐减小,表明其含量逐渐减少;Figure4为相关统计数据,a为使用 ANCOVA 分析的变化数据,b为SUV值数据,c为CDR-SB与MMSE数据,其结果与Figure2类似。)
其次,团队在对于Aducanumab处理组的临床表现也做了探究。对于Aducanumab处理组,10mg/kg剂量组在54周时的临床痴呆评分总和量表(CDR-SB,分数越低越正常)和简易精神状态检查(MMSE,分数越高越正常)较26周时有所改善,其余组别效果均较差(Figure4)。
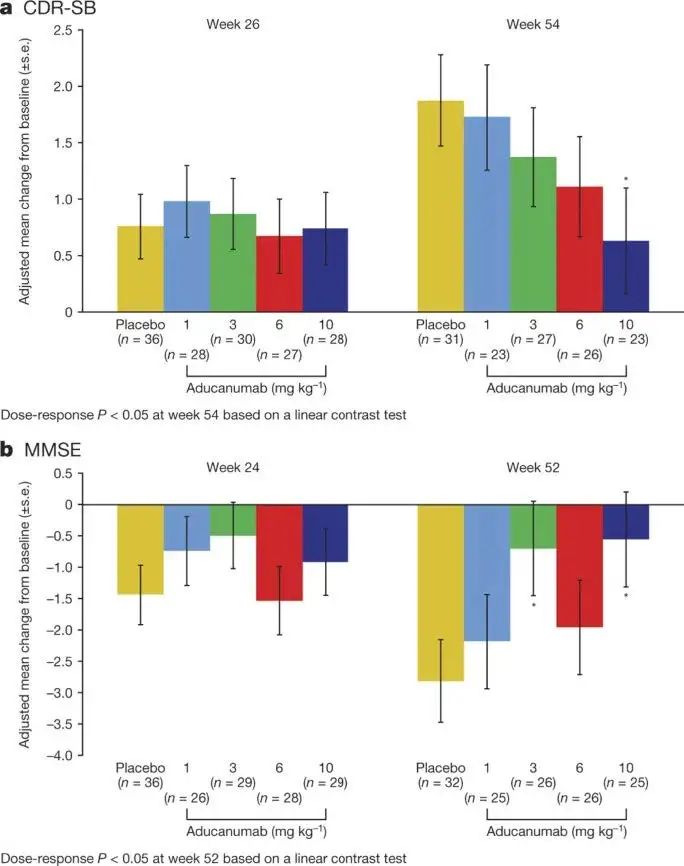
(Figure5. 代表了Aducanumab处理组与对照组的临床改变,可以看出24、26周对比52、54周,改变最明显的为10mg/kg剂量的Aducanumab处理组,其CSD-SB相较于26周降低、MMSE相较于24周升高)
再者,对于相关不良反应,如淀粉样蛋白相关影像学异常(ARIA,是在AD患者中发现的一种异常MRI图像,主要可分为血管性脑水肿ARIA-E以及微出血ARIA-H)以及注射相关反应,团队也做了相关探究:对于ARIA-E,1、3、6和10mg/kg组分别有1(3%)、2(6%)、11(37%)、13(41%)发生,但只有12名患者退出了实验,剩下患者在4-12周内都顺利康复,没有人因此住院。团队认为ARIA-E也是剂量依赖性的。结合动物学实验,动物学实验中团队发现Aducanumab会优先与大脑实质中的Aβ结合,而ARIA-E的原因可能不仅与ApoE基因ε4载体有关,还可能是由于血管Aβ的清除能力弱于实质(Figure2),引起血管损伤所致,这一发现可能有助于之后对于大剂量Aducanumab治疗时防治ARIA-E。
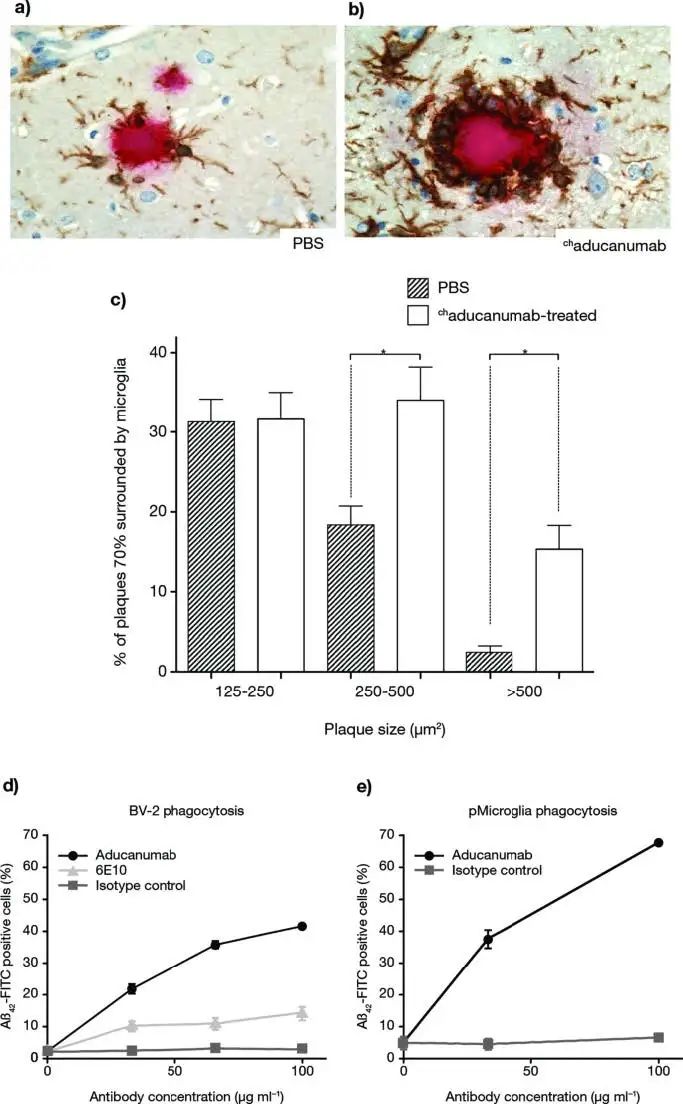
最后,团队还对Aducanumab的机制进行了探究。他们认为Aβ 沉积物的清除伴随着小胶质细胞募集的增加,活化的小胶质细胞可能会包裹淀粉样斑块的核心,将它们与周围的神经纤维网隔离开来,从而限制了Aβ对神经元的毒性作用(Figure6)。这一点可能有助于将来对于AD的免疫治疗进行研究拓展。
综上,Jeff Sevigny及其同事的研究,表明了Aducanumab可以由静脉注射后跨过血脑屏障,参与脑中淀粉样斑块的清除过程,同时这种效应呈剂量依赖性;在研究过程中,团队选择的基于Aβ特异性PET检测,将来对于AD的临床评估能起到一定辅助作用;对于帕金森患者,20%的帕金森患者具有Aβ的病理改变,因此,Aducanumab未来也许可以用于某些帕金森患者的治疗。目前Aducanumab单抗已经通过FDA审批正式上市,未来的治疗效果令人期待。
参考文献
2. Aducanumab reduces Aβ plaques in Alzheimer's disease. Vaillancourt, D.E. Mov Disord 31: 1631-1631(2016).
1

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。




