《Acta Neurochirurgica Supplement》 2021年7月1日[128:101-106.]在线发表美国 University of California San Francisco (UCSF)的Lijun Ma, Steve E Braunstein, Encouse Golden,等撰写的《大分割放射外科治疗大的脑肿瘤的中心靶剂量热点的再分布:一项原理验证研究。Redistributing Central Target Dose Hot Spots for Hypofractionated Radiosurgery of Large Brain Tumors: A Proof-of-Principle Study 》(doi: 10.1007/978-3-030-69217-9_10. )。

目的
本研究旨在探讨在大分割立体定向放射外科(HSRS)治疗颅内大的肿瘤的过程中,在不同次分割治疗中的中心靶剂量热点的再分布(Redistribution of central target dose hot spots)的放射生物学效应。
方法
模拟大分割立体定向放射外科(HSRS)治疗过程中中心靶剂量热点的再分布,并对8例脑转移瘤进行疗效评价。为了评估N次治疗分割中靶剂量的变化,制定出广义生物效应剂量( generalized biologically effective dose,gBED)。gBED增强比(enhancement ratio )定义为所测治疗计划(在不同分割间的中心靶剂量热点的再分布)中的gBED与常规治疗计划(无中心靶剂量热点再分布)的比值。
结果
在α值为0.3/Gy时,α/β比为2和10 Gy时,试验方案的平均gBED增幅分别为15.6± 3.5%和8.3± 1.8%。与常规治疗方案相比,Paddick适形性指数和梯度指数差异不超过2%。
结论
在HSRS过程中,在不同次分割治疗的中心靶剂量热点的再分布可能是增强靶区gBED的有效途径。这么做可能有利于颅内较大肿瘤的治疗;因此,有必要进行进一步的临床试验。
介绍
大分割立体定向放射外科(HSRS)已经应用于大的脑肿瘤的微创治疗,局部控制率良好且与治疗相关的毒性低。引入(瑞典斯德哥尔摩Elekta AB)ICON型Leksell伽玛刀之后,HSRS也可以应用于伽玛刀放射外科,Leksell GammaPlan (Elekta AB)的更新版本允许在图像引导下叠加大量等中心点的情况下进行大分割剂量分布的治疗计划和剂量测定(>10)。这种治疗的显著特点之一是靶区内的剂量不均匀性突出,热点可达处方剂量的200%(prominent dose inhomogeneity within the target, where hot spots may reach 200% of the spanscription dose)。最近的研究表明,不均匀的剂量分布可能与HSRS治疗后脑转移瘤(BM)有较好的局部控制有关。
基于我们之前在单次立体定向放射外科(SRS)中对大的靶内剂量热点进行优化和再分布的经验,在本研究中,我们研究了同样的策略是否可应用于HSRS。
材料和方法
用Icon型Leksell伽玛刀模拟和评价8例大BM(体积> 7cc)在接受HSRS治疗过程中中心靶剂量热点的再分布。为此目的,采用了以下治疗计划策略。首先,,在覆盖部分靶体积的剂量矩阵内创建制定治疗计划(类似于体积分期SRS治疗的计划)并加以优化(a treatment plan within a dose matrix covering the partial target volume (similar to planning for a volume-staged SRS) was created and optimized)。第二,根据之前报道的方法,通过在剂量矩阵中放置4 mm等中心来调整中心靶剂量热点(the central target dose hot spots were adjusted by placing 4 mm isocenters inside the dose matrix according to a spanviously reported method)。第三,继续扩大剂量矩阵,并在部分靶体积外逐步放置等中心,随后就剂量分布反复调整其权重和位置,优化整个靶体积的治疗计划(optimization of the treatment plan for the entire target volume was continued by expansion of the dose matrix and gradual placement of isocenters outside the partially targeted volume,with subsequent iterative adjustment of their weights and locations with respect to dose distributions.)。最后,通过将剂量矩阵移到另一个部分靶体积,对另一个治疗分割重复同样的过程(the same process was repeated for another treatment fraction by shifting the dose matrix to another partial target volume )。
广义生物效应剂量公式
为了评估N个不同治疗分割中靶内体素间的时空剂量变化,我们制定了一个广义生物效应剂量(gBED)公式。
首先,假设的靶体积的总体生存概率(S)为:

公式中,vi为接受一致分割剂量(Di)的第i个小体积(即,(vi, Di)构成感兴趣体积(VOI)的微分剂量体积直方图的第i个文件(bin)。如果只关注第i个分割体积,则公式为:

式中,Dk,i为第k个分割(k = 1,2, N)第i个体积的剂量;Di和δi分别为N治疗分割第i体素平均剂量和标准差;α和β是标准线性二次(LQ)模型的参数。值得注意的是,如果Di值在所有治疗分割都相同,则δi = 0;因此,将式(2)转化为常规的LQ公式。
如果考虑到Eq.(1)所表征的生物效应在不同治疗分割间的时空剂量变化均可再现,假设S = e −αgBED,则gBED可解析求解为:

比较分析
为进行对比分析,gBED增强比定义为所测治疗计划(中心靶剂量热点在各次分割中再分布)中gBED与常规治疗计划(中心靶剂量热点不作再分布)中gBED的比值。值得注意的是,与本研究的目的相对应,常规治疗计划被明确定义为在整个治疗过程中持续应用可产生最大gBED值的任何分割治疗计划。由于gBED依赖于α和β值,α值从0.1/Gy到0.5/Gy(中位数0.3/Gy)的范围和α/β比值从2到20 Gy的范围被认为是缓慢和快速生长肿瘤的原因。并分析比较两种治疗策略的放射外科治疗方案中Paddick适形性指数和梯度指数的差异。
结果
经过测试的治疗计划(中心靶剂量热点在各个部分再分布)在靶体积中始终产生较高的gBED值。作为一个例子,图1显示了gBED增强比对不同的α值和α/β比的依赖关系。α值和α/β比值的增加导致gBED增强比的降低。α值中值为0.3/Gy时,α/β比为2和10 Gy时,试验方案的平均gBED分别增加15.6 ±3.5%和8.3±1.8%(图2)。
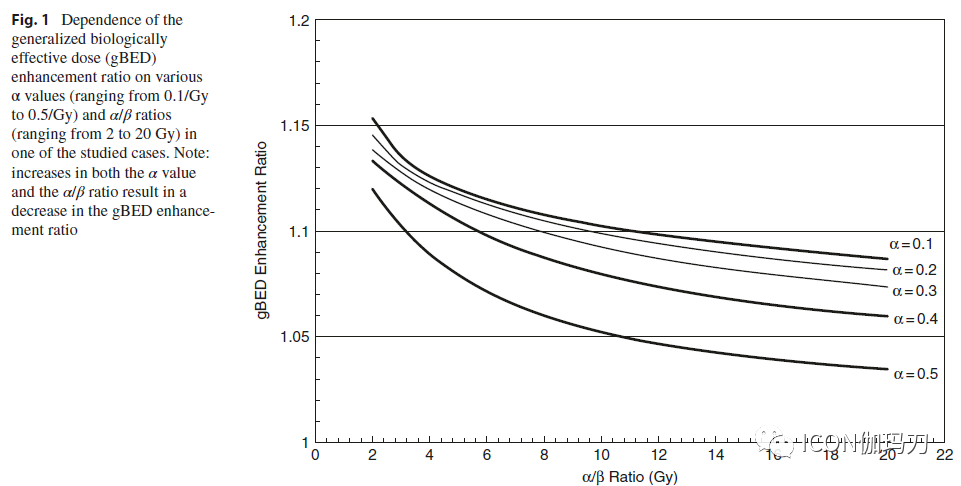
图1.在一个研究病例中,广义生物效应剂量(gBED)增强比与不同α值(从0.1/Gy到0.5/Gy)和α/β比值(从2到20 Gy)的依赖关系。注:随着α值和α/β比值的增加,gBED增强比减小。
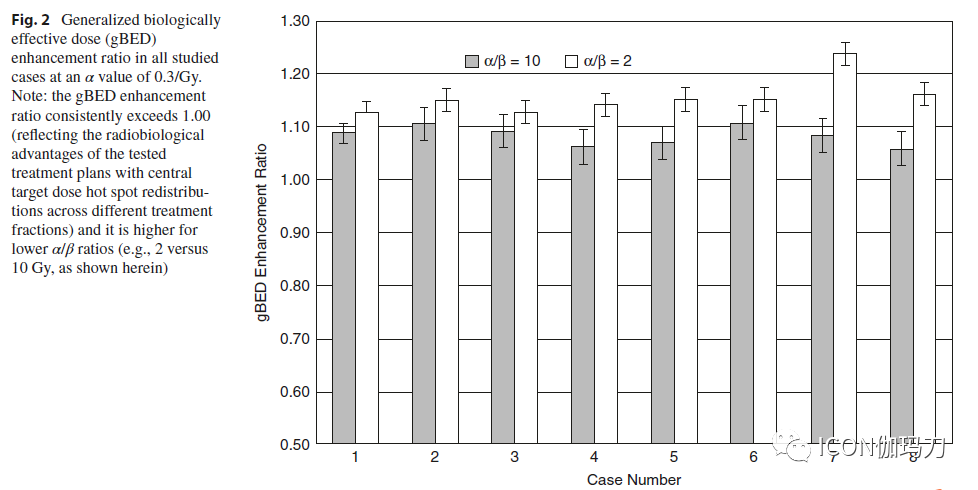
图2.在α值为0.3/Gy时,所有研究病例的广义生物效应剂量(gBED)增强比。注:gBED增强比始终超过1.00(反映了试验治疗方案的放射生物学优势,中心靶剂量热点在不同治疗部分重新分布),并且在较低的α/β比值(例如,2 Gy对10 Gy,如图所示)时更高。
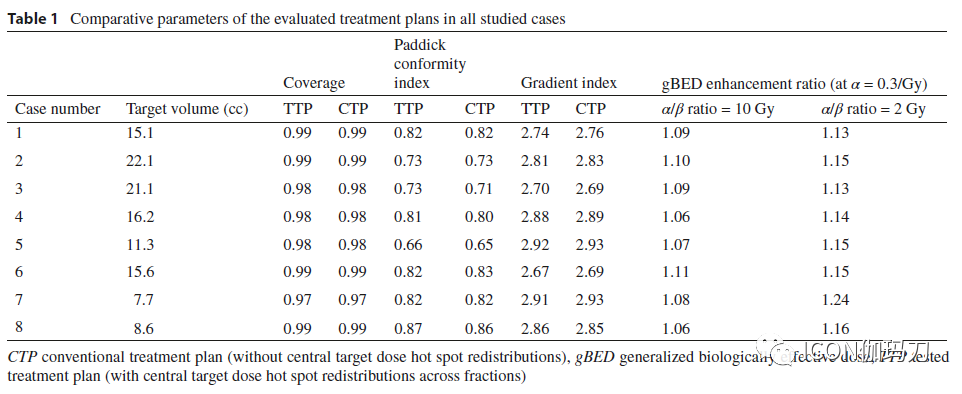
剂量热点在各次治疗的再分布不影响靶区覆盖率;此外,Paddick适形性指数和梯度指数的差异不超过2%(图3;表1)。
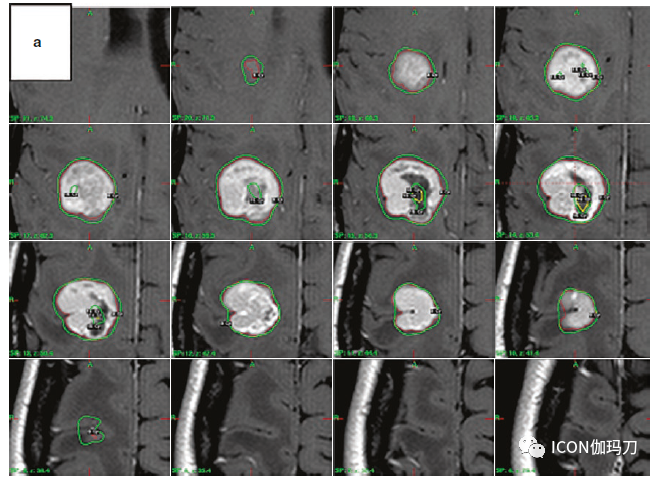
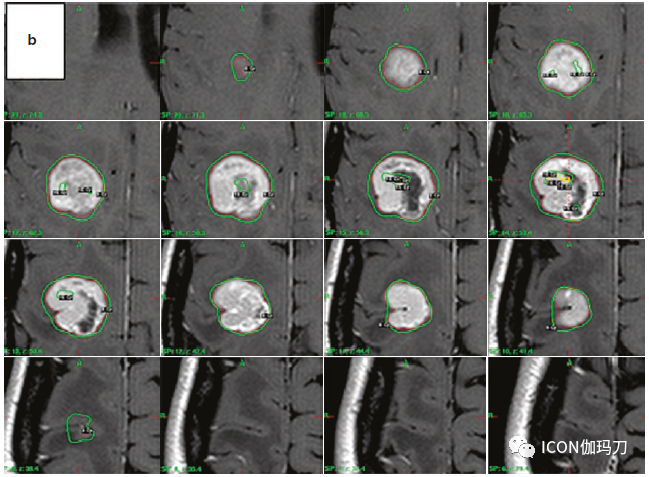
![]()
图3.大的脑转移瘤患者中两种不同次分割治疗(a和b)的中心靶剂量热点的再分布。注意在靶覆盖和适形性方面没有重大的变化。
表1在所有研究患者中评价治疗方案的比较参数。
讨论
在常规的HSRS中,中心靶剂量热点在整个治疗过程中一般保持在相同的位置。但是,它们可以在不同次分割治疗的剂量再分布,(因此能在连续治疗期间有时空剂量变化)。我们的原理证明研究的目的是评价这种新型策略对HSRS的放射生物学效应。
结果表明,与常规治疗方案(无中心靶剂量热点再分布)相比,试验治疗方案(分割治疗中有中心靶剂量热点再分布)显著增加gBED。特别是因为由于幂定律控制的周围等剂量体积高剂量会转化为相邻正常的大脑受照剂量的增加(since it translates into an increase in the adjacent normal brain radiation dose due to the power law governing peripheral isodose volumes),对应用高处方剂量并不可靠的颅内较大肿瘤的患者中,可能对HSRS的疗效有潜在的积极影响。事实上,显示gBED上升与中心靶剂量热点再分布相关,对应增加大约10%的处方剂量如果使用常规的治疗计划(例如,在5次分割25 Gy的标准HSRS相当于照射一个额外的2-3 Gy辐射剂量,但相邻正常脑的受照辐射剂量没有任何增加)。此外,gBED的增加在低α/β比时最为显著,这表明,与快速生长的肿瘤(BM)相比,试验治疗策略的放射生物学优势可能在(如脑膜瘤)缓慢生长的肿瘤中最为显著。最后,在不同次分割间的剂量热点再分布在靶覆盖率、Paddick适形性指数、梯度指数等方面都未影响放射外科治疗方案的质量(redistributions of dose hot spots across fractions did not affect the quality of radiosurgical treatment plans with regard to the target coverage, Paddick conformity index, and gradient index),这些结果与我们之前的研究结果相一致。
结论
在颅内肿瘤的大分割立体定向放射外科(HSRS)中,在不同次分割治疗的中心靶剂量热点的再分布可能被认为有希望增强靶区广义生物效应剂量(gBED),并且不会对放射外科治疗计划的定性参数产生任何负面影响。这可能有利于对大的肿瘤的治疗。进一步的临床研究应会证明,所观察到的颅内HSRS治疗策略的放射生物学优势是否可转化为改善局部肿瘤控制和有更好的临床结果。



