
撰写:王状、马宗亚,复旦大学脑科学转化研究院肠道神经生物学实验室
指导老师:倪金飞
前言
大脑是神经系统的最高级部分,是思维的器官,主导机体的情感、情绪、记忆以及学习等高级认知功能。有趣的是,一些其他器官依然拥有自己的“思想”,将想法传递给大脑,然后经大脑整合并指导它们的生理活动。大脑和外周器官间的相互信息传递对于维持机体的稳态和基本生命体征至关重要。
胃肠道(人体重要的消化器官)便是其中的一员。谚语有云:“You are what you eat!”进食后胃肠道感受到的信息会传入大脑,进而调控我们的消化,代谢,并带来美味又健康的食物供我们的享受。那肠道是如何与大脑沟通,又跟大脑说了些啥呢?下面,就让我们一探究竟吧!
近些年来的研究逐渐揭示了在肠道与大脑之间的确存在一个复杂的联系—肠脑轴,其主要调控胃肠道(GI) 和中枢神经系统(CNS)之间的神经和内分泌信号传导,以此不仅确保了胃肠道内稳态的正常维持,而且可能对情感、动机乃至于更高的认知功能产生深远影响。并且,在调节摄食和食欲、葡萄糖稳态、代谢以及胃肠道功能等多个生理领域也发挥着重要作用[1]。
肠道和大脑之间的信号传递主要是通过迷走神经和脊髓传入神经实现的。支配肠道的感觉神经元是肠脑轴的主要传入通路[2,3],其支配着胃肠道的不同器官。广泛的外科损伤和药理学研究已经证明,这些神经元是将食物来源的信号从肠道传递到大脑的关键。它们的功能是在进食后将相关信号从肠道传递给大脑,以产生饱腹感并调节营养代谢。尽管感觉神经元在肠脑通路中占有不可或缺的地位,但仍不清楚是哪种类型的感觉神经元与大脑通过何种方式的“交流”进而调控生命体的血糖和进食过程。
之前,哈佛大学Liberles实验室一个开辟性的研究发现:在迷走神经节中存在两种类型的神经元将信号从肠道传递给大脑进而控制消化。一种类型为GLP1R神经元,主要与机械感受相关,通过形成特殊的突触终端来监测胃和肠的舒张。另一种是GPR65神经元,与化学感受相关,其能够支配肠道绒毛、检测营养物质和控制肠道运动。此外,这两种类型的神经元在胃肠道投射的位置也不尽相同[4](图1)。那么这两类神经元在控制进食以及调节血糖水平方面发挥怎样的作用呢?
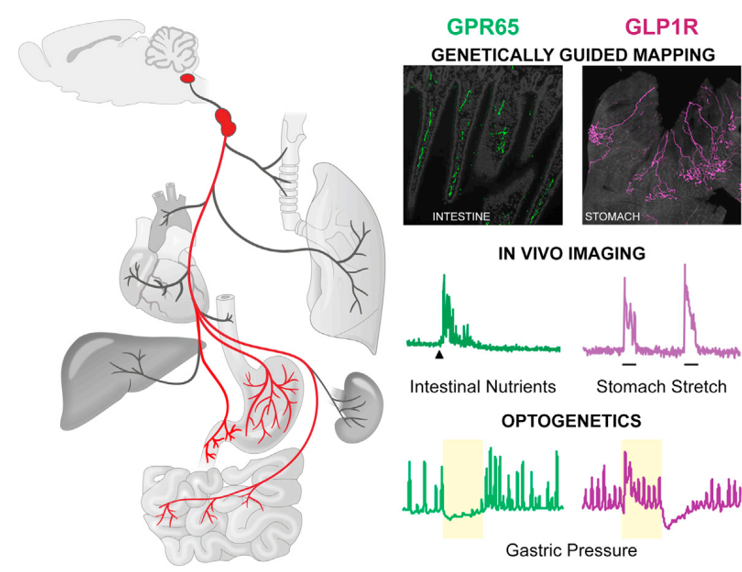
图1
研究简介
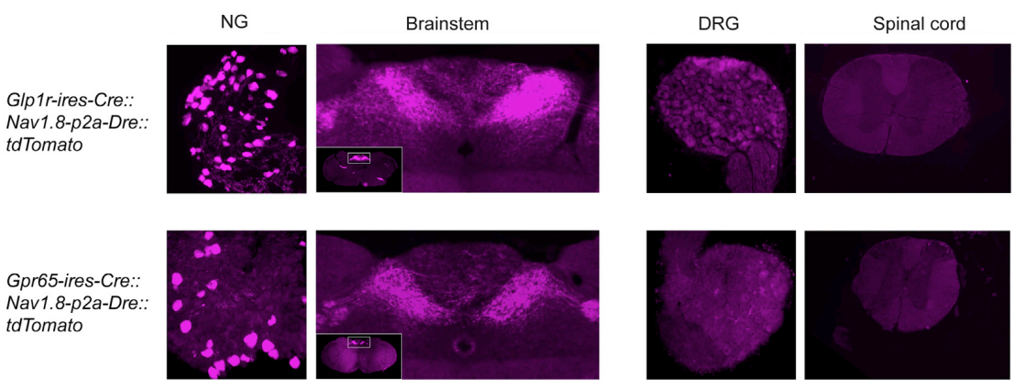
图2
为了研究这两类神经元在调控进食上的作用,研究人员使用化学遗传手段激活GLP1R和GPR65迷走神经传入神经。结果显示:在黑夜环境或者禁食16小时条件下,激活GLP1R迷走神经传入神经后,小鼠的进食量减少,而激活GPR65迷走神经传入神经后并没有改变小鼠的食物摄入量(图3)。此外,激活GLP1R迷走神经传入能够增加介导产生饱腹效应的PBeCGRP神经元的活性(图3)。说明GLP1R迷走神经传入神经能够将厌食信号传递到控制进餐终止的臂旁核神经元。以上结果表明:GLP1R迷走神经传入神经介导的胃肠机械张力信号可能足以减少进食。
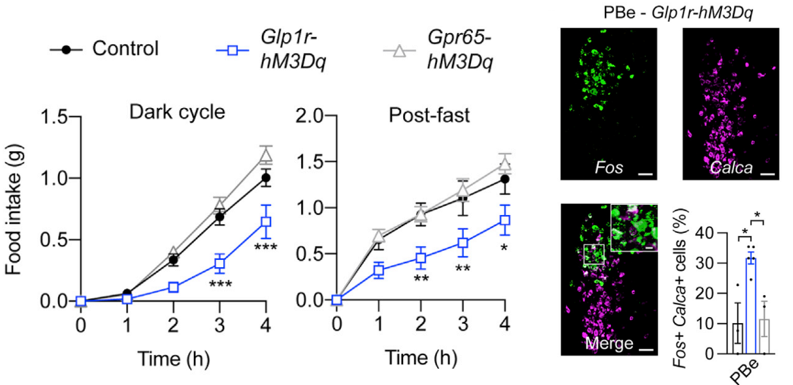
图3
在氯化锂(LiCl)和胆囊收缩素(cholecystokinin,CCK)介导的厌食症模型中,抑制GLP1R而非GPR65迷走神经传入神经能够改善小鼠的厌食反应(图4)。以上结果说明:GLP1R迷走神经传入神经在调控进食方面发挥着重要的作用。
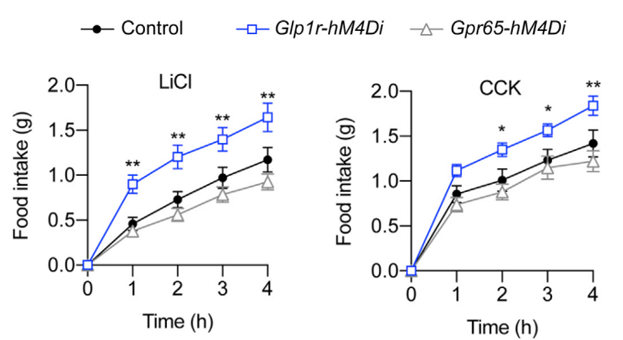
图4
除了进食外,支配肠道的感觉神经元也参与葡萄糖稳态的调节。因此,研究人员也想知道GLP1R和GPR65迷走神经传入是否也参与了血糖调节。在进行葡萄糖耐量实验(glucose tolerance tests,GTTs)和胰岛素耐量实验(insulin tolerance tests,ITTs)时发现:刺激GLP1R 迷走神经传入可能有改善葡萄糖耐受的趋势,而在刺激GPR65迷走神经传入期间没有观察到任何变化。抑制GLP1R和GPR65迷走神经传入对GTTs和ITTs均无显著性影响(图5)。另外,通过急性激活GLP1R 迷走神经传入增加骨骼肌中的葡萄糖摄取来改善葡萄糖耐受量,而激活GPR65迷走神经传入是通过增加磷酸烯醇丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,Pck1)来促进生成肝葡萄糖(Hepatic glucose production,HGP)(图6)。由此可见这两种类型的迷走神经传入神经对血糖代谢有不同的调节作用。
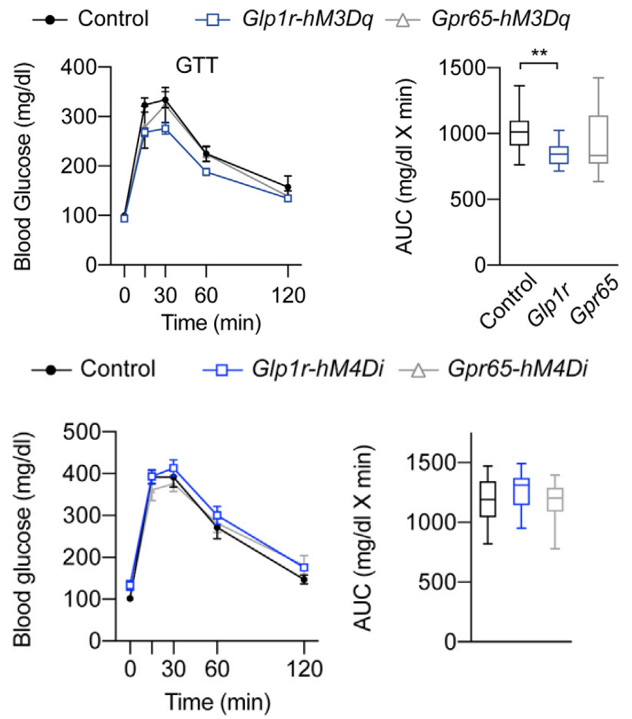
图5
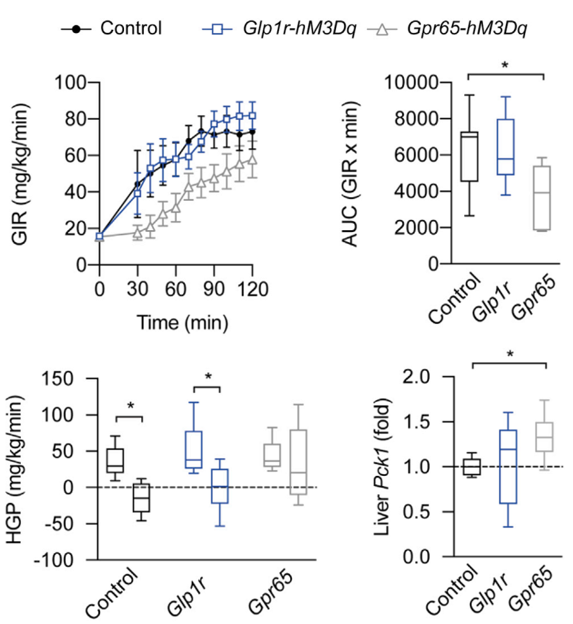
图6
总结与展望
本研究通过使用神经解剖示踪和化学遗传学介导的神经调控等手段揭示了两种支配肠道的迷走神经特异的生理功能(图7)。胃肠道内的机械张力和营养化学信号通过不同的迷走感觉神经通路传入各自投射的脑区,并且带来各自独特的生理现象。胃肠的机械张力能抑制进食带来的饱腹感并对摄食期间的血糖水平的调控起着至关重要的作用。而食物消化后的营养信息则由另外的迷走神经传入大脑,进而促进肝脏葡萄糖的产生,为机体吸收这些营养后的代谢做准备。由此可见,支配肠道不同的感觉神经元可能参与了不同进食和血糖调节的神经回路,并可能为代谢调控提供特定目标。
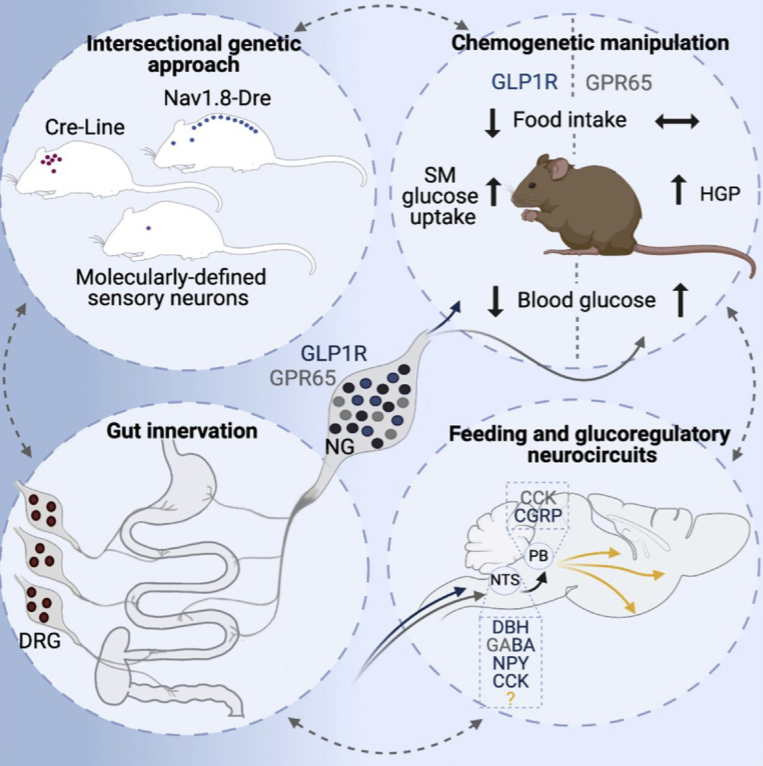
图7
本研究主要揭示了两种支配肠道的感觉神经元迷走神经传入在控制进食和血糖调节方面发挥了重要的作用。胃肠感受到的信息不仅仅局限于进食后的机械张力和营养刺激,介导这些感觉信息的神经通路也有很多,譬如,在肠道内部就星罗棋布着一个复杂的神经网络,被称为“肠道中的大脑”的肠道内神经系统。另外,背根神经节(dorsal root ganglia,DRG)也通过脊神经和脊髓上行环路将胃肠道的信息传入大脑。本文的研究也强烈的引起了小编的兴趣:肠道内神经和背根神经节(DRG)中是否也存在某一类或者某几类支配肠道的感觉神经元,分别介导着哪些独特的感觉信息进入我们的大脑,又和哪些生理功能密切相关?我们是否能够利用这些感觉通路,特异的设计药物靶点,通过解析胃肠和大脑的对话,以此改善我们的健康和治疗相关疾病。研究大脑和周围器官的对话未来可期!
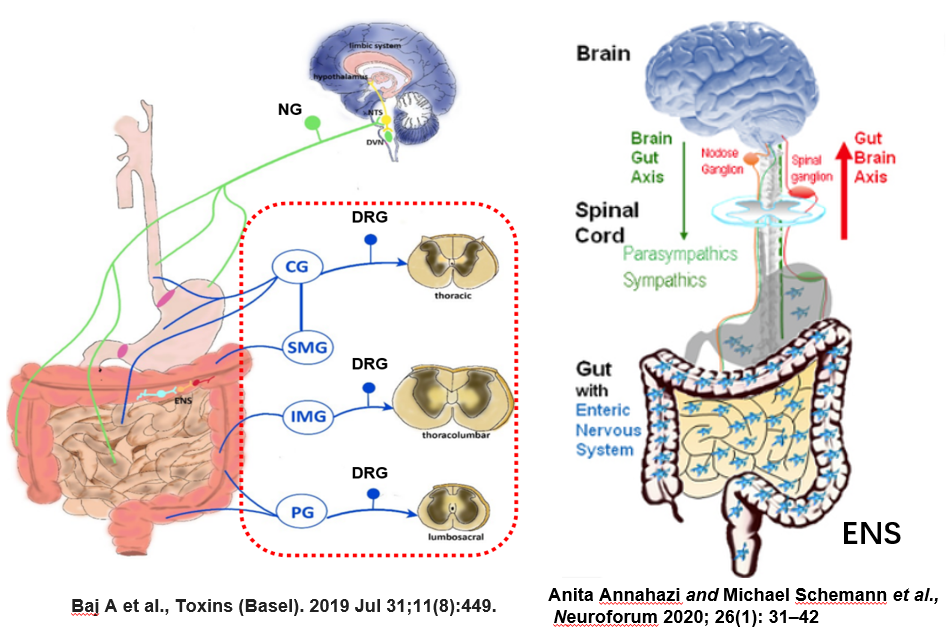
图8
参考文献:
[1] RHEE S H, POTHOULAKIS C, MAYER E A. Principles and clinical implications of the brain-gut-enteric microbiota axis [J]. Nat Rev Gastroenterol Hepatol, 2009, 6(5): 306-14.
[2] CLEMMENSEN C, MÜLLER T D, WOODS S C, et al. Gut-Brain Cross-Talk in Metabolic Control [J]. Cell, 2017, 168(5): 758-74.
[3] KIM K S, SEELEY R J, SANDOVAL D A. Signalling from the periphery to the brain that regulates energy homeostasis [J]. Nat Rev Neurosci, 2018, 19(4): 185-96.
[4] WILLIAMS E K, CHANG R B, STROCHLIC D E, et al. Sensory Neurons that Detect Stretch and Nutrients in the Digestive System [J]. Cell, 2016, 166(1): 209-21.
注:部分图片来自网络,如有侵权,请联系作者删除。

1

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。






