
引言
肢端肥大症是一种慢性容貌毁损的(disfiguring)疾病,通常由分泌生长激素(GH)的垂体腺瘤引起。腺瘤引起的GH超量分泌,以及周围激素胰岛素样生长因子-I(IGF-I)的超量,均是患者特有特征的原因:肢端骨骼和软组织过度生长,尤其影响脸、手和脚;骨病和骨骼脆弱;而且有患癌症的高风险。此外,肢端肥大症引起一系列代谢改变和解剖功能障碍,包括血脂异常和胰岛素抵抗,导致高血糖和糖尿病的风险增加,动脉高血压,心肌病,阻塞性睡眠呼吸暂停综合征(OSAs)伴频繁的心血管相关事件。此外,在大腺瘤(Ø>1cm)肿瘤肿块症状,如视觉障碍、头痛、颅神经麻痹等可能代表临床关切,应及时由专家医生处理。
值得注意的是,由于临床医生对该疾病的认识较低,且发病较晚,诊断迟发性仍然较高,因此大多数患者在诊断时为大腺瘤。到目前为止,所有上述特点都显著降低肢端肥大症患者的生活质量(QoL)和预期寿命。然而,早期诊断和对这种疾病及其并发症的充分控制对正常生存率是有效的,现在被认为是肢端肥大症现代临床治疗的里程碑。
肢端肥大症及其合并症的治疗是复杂和昂贵的,需要多位垂体肿瘤专家临床医生综合多学科的方法来提供最好的医疗标准,并应根据患者的需要进行个性化治疗。最近的指南证实,经蝶窦入路(TNS)手术,因为可以立即治愈患者,切除垂体病变,明显地,解决GH分泌超量,仍然是治疗肢端肥大症的金标准。神经外科对微腺瘤的疗效(缓解率为85%)明显优于大腺瘤(50% - 60%)。实际上,成功率不仅与腺瘤的放射影像学特征(如大小、鞍上伸展、海绵窦受累、硬脑膜和骨)有关,还与神经外科医生的经验有关,每年至少要进行50例TNS手术。
考虑到在大多数患者中存在大腺瘤,因而治愈的机会很低,因此,对于所有尽管接受了神经外科手术但病情持续的患者,建议将药物治疗作为辅助治疗。最后,对于手术治愈可能性低或拒绝TNS的患者,也可建议将药物治疗作为一线治疗。
治疗目标
肢端肥大症治疗的目的包括使血清GH和IGF-I水平正常化,控制肿瘤生长,减少和恢复并发症,最后像一般人群一样降低死亡率。
生化结果
定义肢端肥大症治愈的Cortina共识标准明确了GH升高和IGF-I扩展(augmented)作为肢端肥大症患者临床结局的决定因素的作用。确实,GH和IGF-I提供了不同但互补的信息,因为前者更与肿瘤活动相关,而后者更好地反映了疾病的外周活动。众所周知,实现IGF-I的正常化和GH达到安全水平,是达到治疗目标的基石。
然而,在日常临床实践中,多达三分之一的肢端肥大症患者在TNS手术后或在药物治疗期间观察到生长激素和IGF-I水平之间的差异。例如,在第一种情况下,由于IGF-I延长了半衰期,延缓了衰退,所以经常检测到正常的GH,伴血清IGF-I的增高。考虑到这一观察结果,建议术后至少等待12周来评估IGF-I水平,但IGF-I正常化可能需要更长的时间。事实上,不一致的数据可能与遗传(GH受体多态性)或依赖检测的因素有关。但是,即使生化检测的标准化得到了最新方法的保证,生长激素和IGF-I也可能受到年龄、性别、体重体重指数或伴随的疾病的不同影响。
Cortina 共识定义肢端肥大症的治愈是指在口服糖耐量试验(OGTT)中,生长激素谷值低于1μg/L。由于近年来,检测技术的相关改进,随后的更新提出了OGTT中GH更严格的临界值(即0.4μg/L)加上在性别和年龄校正范围内的IGF-I来定义神经外科手术后的肢端肥大症治愈。实际上,在TNS后的生长激素谷值比在药物治疗期间的生长激素谷值提供更为可靠的信息,所以随机GH<1μg/L和正常的IGF-I定义了生长抑素受体配体(SRLs)或多巴胺激动剂(DA)治疗期间的疾病控制。
此外,近十年来,出现了一个关于SRL治疗结果的理论概念:对SRLs治疗有部分应答者是指那些在临床上GH和IGF-I显著降低(即相对于基线50%)而没有达到上述目标的患者,而无应答者是指那些没有显著降低的(即低于基线值50%)的患者。
最后,由于分子的生化特性,GH在那些使用培维索孟(pegvisomant)治疗的患者中,不是一个可靠的生化控制参数。在这些患者中,临床医生的主要终点将是IGF-I下降到正常范围内。
肿瘤缩小和临床终点
伴有垂体大腺瘤的肢端肥大症患者,常有头痛、视觉障碍和颅神经麻痹的报道。在这种临床情况下,减少肿瘤体积和防止进一步生长是相关的目标,因为它们与较差的临床结果相关。世界范围内公认的腺瘤体积的显著减少至少应该有20%到25%,因为较低的阈值可能与方法的不同有关。事实上,技术障碍(如肿瘤形状、观察者内部的矛盾或不同的放射影像学扫描)可能会妨碍体积的准确测量。因此,最近的指南建议以如直径等单一尺寸对腺瘤缩小作评估,在常规临床实践中这样足以以更简单的方式评估显著的肿块变化。最后,越来越多的证据表明,诊断时T2加权MRI低信号是预测SRL药物治疗后肿瘤缩小的有用标志。
在肢端肥大症中,心血管事件和呼吸并发症可导致生活质量降低和死亡率增加,而糖脂代谢损害、胰岛素抵抗和动脉高血压也可增加心血管风险。此外,患者关注的焦点可能集中在一些癌症亚群的高风险上,即使一些研究未能证明这种特殊情况下,或由于脊柱畸形和骨关节炎过程引起的骨骼疼痛)的死亡率增加。
虽然代谢改变、高血压和心肌病的早期阶段在早期治愈后可能是可逆的,但即使疾病得到控制,也可能持续存在许多其他并发症(如OSAs或椎体骨折)。因此,建议评估并积极处理与肢端肥大症相关的合并症,以防止过度死亡以及患者健康的进一步恶化。在这种情况下,临床报告的结果工具(如SAGIT或ACRODAT)有助于客观化肢端肥大症的体征/症状、并发症和肿瘤特征。在以患者为中心的方法中,特定的问卷,如AcroQoL,可以提供关于生活质量和患者视角的数据,尽管这一领域的特定研究未能证明与生化控制有显著相关性。
治疗方案
目前,根据国际指南,有不同的治疗选择,以获得疾病的生化控制和缓解症状。此外,其中一些药物还对肿瘤肿块有直接作用。治疗方案通常是多模式的,包括TNS和药物治疗,甚至在某些情况下可以建议立体定向放疗或伽玛刀,以实现上述目标。
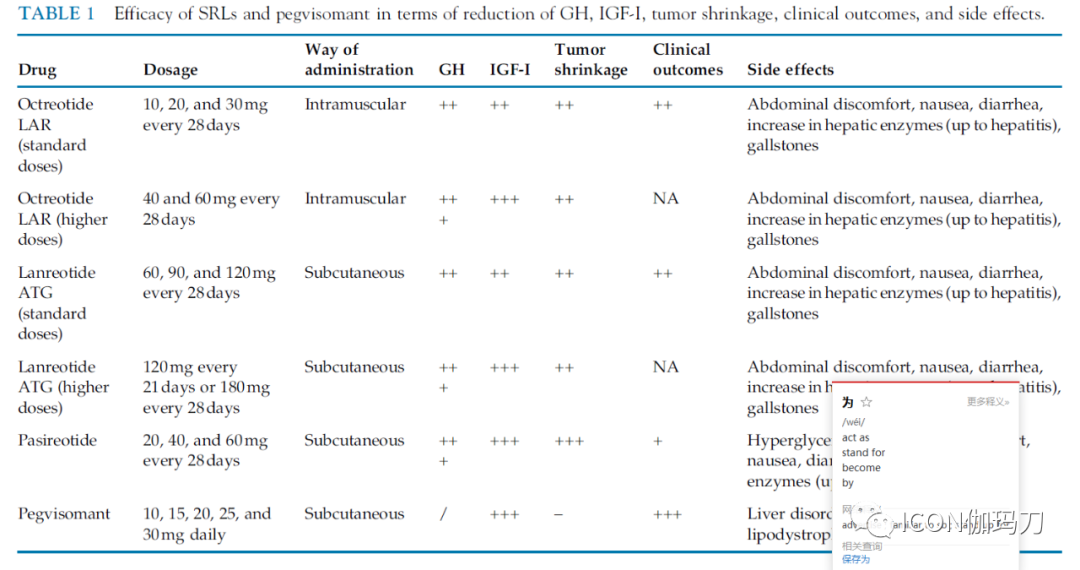
在控制生长激素超量分泌和腺瘤生长的药物治疗中,我们将重点关注SRLs(奥曲肽、兰瑞肽和帕瑞肽)和多巴胺激动剂(DA),而唯一可调节生长激素外周效应的药物是GH受体拮抗剂培维索孟(pegvisomant)(表1)。
表1 SRLs和pegvisomant在GH、IGF-I降低、肿瘤缩小、临床结果和副作用方面的疗效。
第一代SRL
作用机理和可用分子
生长抑素(SS)是下丘脑分泌的一种抑制激素,在生理上调节生长激素的分泌。SS还具有许多其他内分泌和外分泌功能,这是由几个受体(SSTR)亚型的普遍表达所证明的。到目前为止,已知6种不同的SSTR亚型(SSTR 1、SSTR2a/SSTR2b、SSTR3、SSTR4和SSTR5),分别由位于不同染色体上的5个不同基因编码(分别为14、17、22、20和16);SSTR2a和SSTR2b来自于同一基因的不同剪接变体。除了抗分泌作用,SS和SSTRs之间的结合,激活了一个信号级联,也可以控制正常和肿瘤细胞的分化和生长。SS不仅激活在细胞分化、发育和凋亡中起关键作用的酪氨酸磷酸酶,还激活参与细胞增殖过程的磷脂酰肌醇-3激酶(PI3K)通路。最后,我们推测,通过细胞周期蛋白E和Cdk2的过度磷酸化,锌指蛋白Zac1的下调可能是垂体腺瘤中肿瘤生长的原因。最近,自噬被认为是SRLs可能的附加作用。
垂体腺瘤普遍表达SSTR2,少量表达SSTR5;然而,由于其半衰期短(小于5分钟),需要每天多次皮下注射或持续静脉注射,因此,在临床实践中,天然SS不再被处方。此外,有报道称出现注射后GH水平的显著反弹。
因此,在过去的几十年里,延长半衰期的合成SRL已经被开发出来,允许增加注射间隔(通常是每个月)。目前,奥曲肽长效释放(LAR)和兰瑞肽凝胶(ATG)是肢端肥大症的一线药物治疗。它们实际上在药代动力学谱和给药模式上有所不同,因为兰瑞肽配方可在现成的预充注射器中用于深层皮下注射,而奥曲肽LAR需要在肌肉注射前进行重构(reconstitution)。
生化结果
然而,由于它们对SSTR2的具体作用,奥曲肽LAR和兰瑞肽 ATG迄今已显示出类似的效果。
在临床试验中,2 / 3接受第一代SRLs治疗的患者实现了生化控制,而对未选择队列患者的观察性研究结果不太令人满意,因为25% - 40%的入组患者报告有安全的GH和正常的IGF-I水平。这种差异可能是由于患者的选择偏倚、治疗时间短、给药剂量不足或较低的治疗依从性。此外,已发表的令人信服的证据表明,高于SRLs标准剂量会增加疗效:奥曲肽LAR 40mg和60mg被证明在降低SRLs部分反应者的GH水平和使IGF-I正常化方面是安全有效的(见上文定义)。最近,有研究表明,当给予较高剂量(即180mg/月)或缩短注射间隔(即21天)时,兰瑞肽ATG在生化控制方面也是有效的(图1)。实际上,最大有效的SRL剂量仍然是一个不确定的问题,但基于这些发现,考虑到对标准剂量的反应程度,基线IGF-I,和治疗不良反应的情况,最近的共识建议,在部分患者撤药或换到其他治疗方案前,增加SRL剂量。
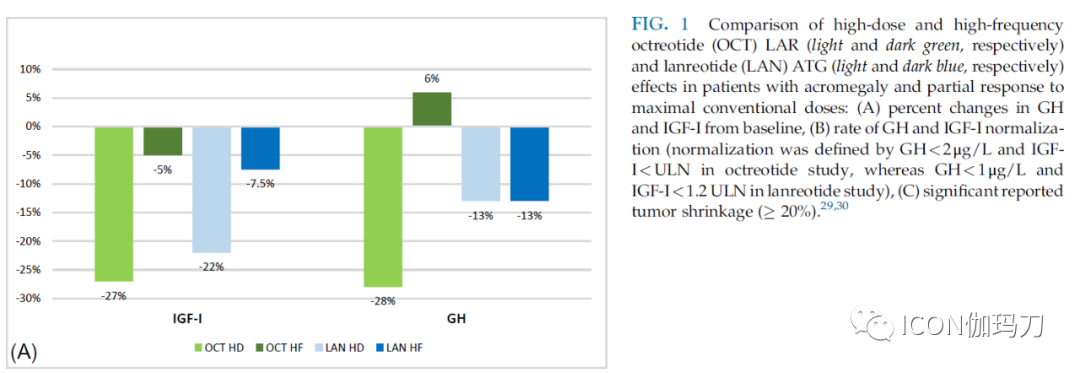
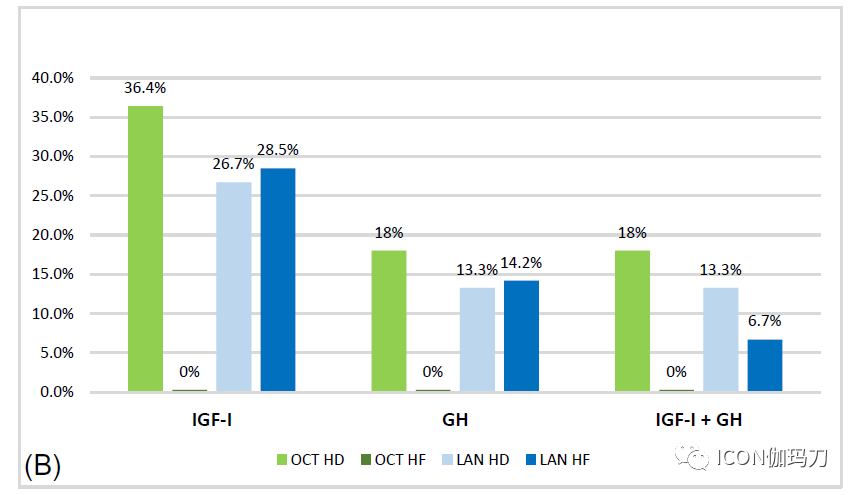
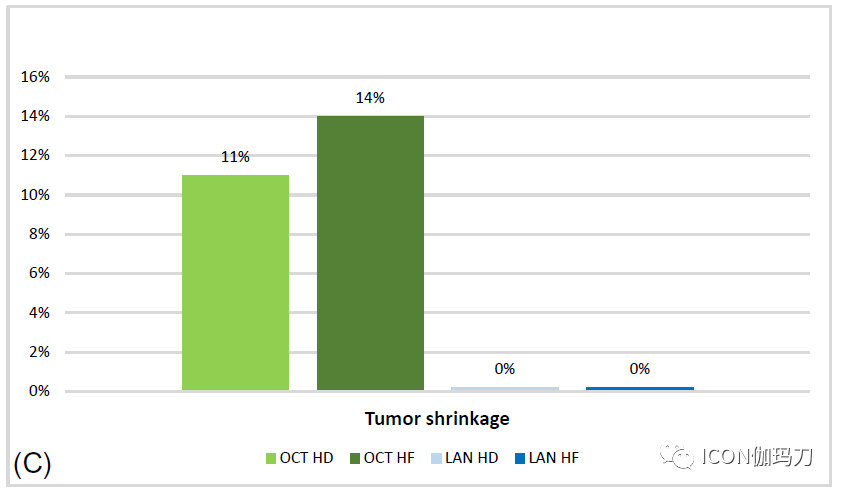
图1.高剂量与高频次奥曲肽(OCT) LAR(分别为浅绿色和深绿色)和兰瑞肽 ATG(分别为浅蓝色和深蓝色)对肢端肥大症患者的影响以及对最大常规剂量的部分反应的比较:(A)生长激素和IGF-I从基线变化否认百分比(B)生长激素和IGF-I正常化率(正常化以在奥曲肽研究中,GH<2μg/L和IGF-I<ULN;而在兰瑞肽研究中,GH<1μg/L和IGF-I<1.2 ULN);(C)有显著肿瘤缩小(≧ 20%)的报道。
肿瘤缩小
临床试验与现实生活中的研究的另一个差异与肿瘤肿块占位效应有关。实际上,在前者中,报道了相对温和的缩小效应,而在后者中,作为药物类效应,奥曲肽LAR和兰瑞肽ATG显示超过一半的患者体积减少,与治疗前相比,平均减少50%。在一项开创性研究中,这种效应显示在治疗开始后的早期出现(通常是在第一年)。
事实上,肿瘤缩小在临床实践中有一定作用,因为绝对大小的缩小不仅是放射影像学上的发现,而且与周围结构受压的减轻有关。关于这个主题的荟萃分析显示,当给予一线治疗时,SRL的缩小效应较大,更有可能出现但在对照组患者中则不一定,而基线腺瘤大小不是一个可靠的预测因素,因为微腺瘤和大腺瘤对SRL的反应相似。停药后,肿瘤可在6 - 12个月内发生再生长。
临床终点
许多研究调查了SRL对临床体征/症状或肢端肥大症并发症的影响,不同的结果与年龄、性别、疾病持续时间、生化控制和伴随的疾病有关。
奥曲肽LAR和兰瑞肽 ATG对肢端肥大患者血压影响不大(marginal effects),但已有广泛报道会改善左心室肥厚。事实上,即使在未达到生化控制的肢端肥大症患者中也显示了积极的心脏结果,这与SSTR的丰富表达使得SRLs可能具有与GH高分泌有关的直接作用的概念相一致。
通过减少软组织肿胀和降低对乏氧的化学敏感性,虽然解剖结构的恢复和症状的完全缓解很难独立于长期的疾病控制SRLs被证明,通常在第一次给药的几个月后,能有效改善阻塞性睡眠呼吸暂停综合征(OSAs)。骨代谢并发症与疾病控制密切相关,而不是特定的药物作用,而关节病往往是不可逆的,并与生活质量降低密切相关。
考虑到不同SSTR亚型(特别是SSTR5)在Langerhans胰岛的所有细胞中广泛表达,以及由此产生的SS及其类似物的抗分泌作用,人们对传统SSTR可能产生的有害影响提出了一些担忧。因此,在过去的几十年里,人们对葡萄糖稳态的影响(effects on glucose homeostasis)进行了广泛的研究,即使在一些已有高血糖或糖尿病或对SRLs“无反应”的患者中,可能检测到临床负面影响,来自荟萃分析的数据显示第一代SRL对葡萄糖代谢的总体边际临床影响(overall marginal clinical impact)(图2)。
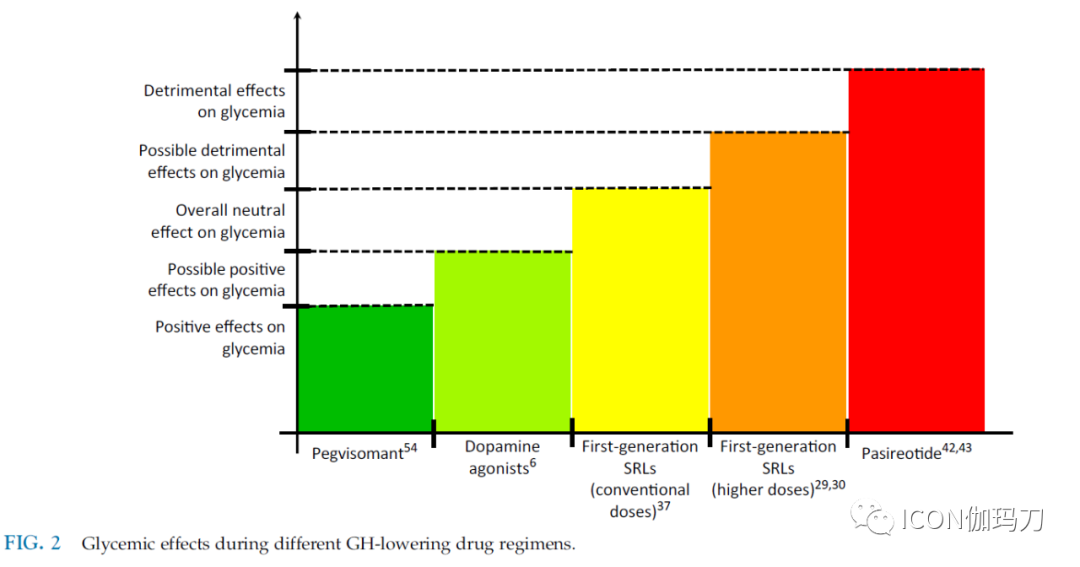
图2.不同降低GH药物方案下的血糖影响。
非经典适应证:一线治疗
对于患有有大腺瘤的肢端肥大症患者,特别是向海绵窦侧延伸且手术治愈可能性低的患者,最近的指南建议一线使用SRL。对于高龄患者或麻醉风险高的患者,也可建议使用一线治疗。有报告一线使用SRLs的区域差异。
非经典适应证:术前治疗
一些研究探讨了术前SRL固定持续时间(6 - 12个月)的治疗的效用。有三个方面可以构成这种方法的基本原理。一个非常实际的问题是,由于等待手术的名单很长,干预可能会延迟。另外两个是临床问题,与缩小效应有关,神经外科医生可以对较小的腺瘤进行手术,对于具有高麻醉风险的患者,增加完全切除的机会(也有相反的结果;例如,手术切除腺瘤后,SRL结果的改善)和临床改善的机会(减少上呼吸道肿胀,可能使插管更容易和有利心肺状况)。虽然不受控制,但随机研究也表明手术结果改善(更好的生化控制和缩短住院天数),但到目前为止,一些共识建议并没有找到足够的证据来推荐这种做法,而是将其限制在部分的患者。
对SRLs耐药的定义
如前所述,可以获得相当广泛的srl反应。有趣的是,由于越来越多的证据表明肿瘤收缩效应的临床影响,它已经被包括在耐药的定义和生化参数。39因此,一个完全应答的患者被期望显示生化参数正常化和肿瘤收缩>20%,相反,无应答的患者被定义为无肿瘤收缩的非生化正常化。部分应答者可以通过无或有限肿瘤应答的生化目标的相关生化应答(与基线相比降低50%)来定义。
第二代SRL (帕瑞肽pasireotide)
作用机制
帕瑞肽(Pasireotide)最近已在许多国家用于治疗库欣病,而长效(LAR)制剂已于2014年被FDA批准用于肢端肥大症的治疗。它是一种多受体靶向SSTR配体,比奥曲肽和兰瑞肽具有更广泛的亲和力。它是由SS的四个合成氨基酸和两个必需氨基酸以一种新的碱性反式-(L)-羟脯氨酸氨乙基脲烷延伸物、苯基甘氨酸、O -苄基-酪氨酸和D -色氨酸(Trp)的形式结合到相应位置形成稳定的环六肽。与第一代SRL 相比,帕瑞肽对SSTR1的亲和力提高了20 - 30倍,对SSTR5的亲和力提高了100倍,对SSTR2有相似的亲和力。
帕瑞肽 LAR的剂量为每28天20、40和60mg,推荐的起始剂量通常为中间剂量(即40mg)。药理作用在几周后变得明显,所以第一次生化评估应该在治疗开始后不迟于3个月进行,然后每月可以相应增加或降低剂量。
生化结果
短效皮下注射帕瑞肽的初步研究显示,其抑制血清GH和使IGF-I水平正常化的效果呈剂量依赖性,部分入组患者的GH下降明显高于奥曲肽的。根据这项初步发现,使用LAR配方完成了III期前瞻性、随机、双盲研究,研究人员证实了该药物在未接受过药物治疗的(medical naïve)和曾使用第一代SRLs治疗的患者中的有效性。
在头对头的优势方案中,帕瑞肽 LAR治疗组的生化对照(由正常范围内的IGF-I和血清GH<2.5μg/L定义)明显多于奥曲肽LAR治疗组(31.3% vs 19.2%)即使患者根据一线TNS或药物治疗进行分层(分别为39.4% vs 21.8%和25.7% vs 17.3%),也证实了与奥曲肽LAR相比的较高疗效。此外,在12个月的交叉延长期,未接受奥曲肽LAR控制的患者转为接受帕瑞肽LAR,其中17.3%报告有生化控制。相比之下,在帕瑞肽LAR失效的患者中,奥曲肽LAR不能恢复生长细胞轴的正常功能。
PAOLA试验是一项为期6个月的、多中心、随机、平行组研究,纳入了近200例以常规最高剂量使用兰瑞肽 ATG或奥曲肽 LAR治疗且疾病仍然活跃的患者,并将其分为三组。他们可以继续他们的治疗或改用帕瑞肽 LAR。在这项研究中,因为在对第一代SRL耐药的肢端肥大症患者中,生长激素和IGF-I在3个月后已经明显下降,帕瑞肽 LAR为20%的患者提供了早期生化控制,证实了比第一代SRL更为有效。
肿瘤缩小
在接受的帕瑞肽LAR治疗3个月后,近40%初次接受药物治疗的患者,在6个月的治疗后,肿瘤大小显著下降(即20%),该百分比增加超过50%。这一发现后来在头对头的研究中得到了证实,在重新诊断的患者中,帕瑞肽LAR和奥曲肽LAR引起类似的缩小。在PAOLA研究中,尽管一些患者长期使用第一代SRL治疗,但仍观察到帕瑞肽使肿瘤进一步缩小。
临床终点
最近有报道称,在有生物化学活性疾病的患者中,与接受培维索孟(pegvisomant)治疗的患者相比,接受帕瑞肽(parireotide)治疗的放射影像学脊柱骨折的发生率较低。
除了更大的药物诱发高血糖和糖尿病风险外,帕瑞肽还具有与第一代SRL重叠的副作用。众所周知,胰岛细胞广泛表达SSTR5,其对葡萄糖稳态的不利影响似乎与胰岛素和肠促胰岛素分泌的损害有关,而对胰高血糖素的产生影响较小。
与8%的接受第一代SRL治疗的患者相比,三分之一接受帕瑞肽治疗的患者出现了糖尿病前期状态。同样,在头对头的研究和PAOLA研究中,糖尿病的患病率显著较高,分别报道有19%和26%的患者(相比之下,接受第一代SRLs治疗的对照组为4%和8%)。高血糖效应实际上不是剂量依赖性的,每月注射40mg和60mg之间没有观察到显著差异。
有趣的是,PAOLA研究的一项事后分析强调,在大多数患者中,在起始剂量后不久,出现血糖和糖化血红蛋白(HbA1c)上升,随后达到平台期,并一直稳定到研究结束。此外,基线时空腹血糖超过100mg/ dL(空腹血糖受损)的患者更容易发生糖代谢紊乱。因此,建议考虑使用帕瑞肽 LAR治疗的患者应仔细筛选并监测血糖不良事件。在治疗的最初几个月,应该每周监测血糖水平,然后减少频次。继发性糖尿病应根据国际2型糖尿病指南进行治疗,处方以二甲双胍,节食和体育锻炼作为一线治疗,尽管从病理生理学的角度来看,二肽基肽酶(DPP)-IV抑制剂或GLP-1受体激动剂可能更合适,而当无法达到血糖目标,且因为帕瑞肽作为降低生长激素的药物,而没有其他可行的替代药物时,应始终作为补充治疗。
多巴胺受体激动剂(DA)
作用机理和可用分子
分泌GH的垂体腺瘤细胞可能表达多巴胺受体-2,DA激活其可抑制GH的分泌。目前,市场上有两种研究发现的不同分子:溴隐亭和卡麦角林。,因为患者依从性更好(每周给药vs每天给药),而且由于(胃肠道不适,头晕和低血压)副作用减少,耐受性较好,后者目前是最常用的。
卡麦角林通常口服每周2 - 3次,起始剂量为每周0.5 - 1mg,但如果耐受性良好,可以增加剂量至每周3.5mg(即每天0.5mg)。
生化结果
卡麦角林在使血清GH和IGF-I水平正常化方面显示出了不同的结果,几年前发表的一项荟萃分析,目的旨在更好地理解DA在肢端肥大症药物治疗中的正确地位。在这篇论文中,作者认为单用卡麦角林就能使三分之一的肢端肥大症患者的IGF-I水平正常化。尽管如此,卡麦角林对肢端肥大症患者的疗效与基线IGF-I严格相关,并且只是在IGF-I<2.5正常上限的患者中观察到疾病控制。
肿瘤缩小
特别是在那些患有协同分泌GH-PRL的垂体腺瘤的患者中,卡麦角林可在一些肢端肥大症患者中诱导肿瘤缩小。
临床终点
关于DA对肢端肥大症并发症的影响的资料较少;然而,对葡萄糖稳态的有益影响是可以预期的。在过去,有报道称,使用卡麦角林治疗的肢端肥大症患者有心脏瓣膜性疾病,包括三尖瓣纤维化;然而,随后的纵向研究未能证实患有肢端肥大症的患者瓣膜返流或重塑(remodeling)的发生率较高,而这些患者由于其基础疾病已经存在心脏瓣膜异常的高风险。
GH受体拮抗剂(培维索孟)
作用机制
培维索孟(Pegvisomant)是一种199个氨基酸的重组GH拮抗剂,该拮抗剂由Gly120Arg突变产生。能有效抑制IGF-I的合成和分泌,阻断GH受体的二聚化。此外,它被聚乙二醇化以稳定分子结构,降低免疫原性,延迟肾脏清除,因此,将半衰期延长至100小时。由于其与生长激素具有较高的结构同源性,使用不同的检测方法,评价血清生长激素时的交叉反应已被广泛报道;因此,也考虑到其独有的外周作用和没有负反馈,建议在培维索孟治疗期间只评估IGF-I。
培维索孟最初在至少15年前获得监管机构的批准,每日剂量为10mg、15mg和20mg,但剂量可以增加到每天30mg。起始剂量通常是可用的最低剂量(10mg),在达到生化控制(年龄正常范围内的IGF-I)之前,可以继续增加。皮下注射前需要重组(be reconstituted)药物,并使用整个鼓起的区域小心旋转注射部位(the injection site should be carefully rotated using the entire belly area),以减少脂肪营养不良和/或轻度皮肤红斑反应,这是患者经常报道的。
培维索孟(pegvisomant)治疗的另一个常见副作用是肝功能损害:约5%的患者在治疗的第一年出现血清转氨酶升高;然而,少数,因为肝天冬氨酸和丙氨酸转氨酶上升到正常上限的三倍,需要停用培维索孟。第一代SRLs联合治疗可能会增加肝脏酶升高的频率。此外,肝损伤与培维索孟治疗期间Gilbert综合征中检测到的一种常见多态性相关。基于这些发现,强烈建议在开始用药前检查肝功能,然后在治疗的前6 - 12个月经常检查肝功能。
生化结果
如前所述,血清IGF-I水平是评估培维索孟治疗下疾病控制的唯一生化参数,在不同的研究中,其相应的正常化率是不同的。事实上,在临床试验中,多达95%的患者,都表现出疾病控制,而报告的真实生化中经验成功率较低,这可能与选择偏差或不适当的剂量方案有关,尽管在部分患者中也可能假设存在真正的耐药性。事后分析显示,基线时IGF-I水平较低的患者预后较好;男性的有效较高,而身体成分和既往放疗史是相关的预测因素。
在肢端肥大症患者对SRL耐药时应考虑培维索孟(Pegvisomant),并可与SRL联合使用(见后面)。尽管如此,由于这种罕见的疾病与严重的SRL耐药有关,已经提出将其作为McCune-Albright的一线药物治疗。
肿瘤效应
在培维索孟治疗期间,已经报道患者有肿瘤生长,但在几乎所有的病例中,腺瘤生物学是特别进袭性的。因此,假定培维索孟本身不是腺瘤生长的原因,但临床医生应始终考虑培维索孟本身不可能有任何缩小的效应,因为它只作用于周围。
临床终点
一些关于培维索孟的研究,特别关注肢端肥大症的合并症和临床结果,在软组织肿胀、大汗淋漓、虚弱无力和心血管并发症方面提供了实质性的益处,但尚未完全阐明其对骨骼健康的影响。长期治疗可显著减少心肌肥厚,增强收缩期和舒张期心房功能和血压,有助于恢复多动综合征和降低心律失常风险。与SRL不同,更具体地说与帕瑞肽不同,培维索孟可改善胰岛素敏感性,降低空腹和餐后血糖以及HbA1c。所有这些有益的影响被证明与显著降低心血管风险有关,正如Framingham评分预测的那样。
联合治疗
肢端肥大症患者术后控制不佳和一线药物治疗具有挑战性,应解决所有患者的特点,包括GH/IGF-I水平、肿瘤体积和位置、症状和合并症、患者偏好和联合治疗的成本效益比。当传统的SRLs不能控制GH的超高分泌时,卡麦角林可以保证多达50%的患者的疾病得到控制,独立于血清泌乳素水平。加用卡麦角林治疗可能是一种选择,特别是对于那些有轻度但持续升高的IGF-I水平和轻度生长激素超量症状的患者。
培维索孟-卡麦角林(pegvisomat - caberoline)联合治疗的数据有限,但这可能是SRL不耐受下的一种选择。
如果肿瘤肿块值得关注,可以推荐使用培维索孟与第一代SRL联合治疗,因为这种联系被证明在控制激素分泌和腺瘤生长方面非常有效。可以早期观察到SRL加上培维索孟的叠加效应,在这种情况下,每周只能使用培维索孟两次或三次,增加了依从性,减少了患者的主诉,同时降低了成本。然而,肝脏酶显著升高的风险高于SRL单药治疗;因此,在接受这种联合治疗的患者中,建议密切监测肝功能。
PAPE研究的目的是评估帕瑞肽LAR(单独或联合培维索孟)的疗效和安全性,将第一代SRL加培维索孟控制良好的肢端肥胖患者改为帕瑞肽LAR加或不加培维索孟。初步结果显示,无论是单药治疗还是联合培维索孟治疗,大多数患者都能控制IGF-I水平。此外,尽管高血糖仍然是最重要的安全问题,但与第一代SRLs相比,帕瑞肽 LAR显示出保留50% - 66%的培维索孟效果。
最近有报道称,帕瑞肽LAR和培维索孟联合治疗可以有效降低IGF-I水平,并且在一组非常选定的巨大侵袭性分泌GH的垂体腺瘤患者(n=6)中耐受性良好(图3)。
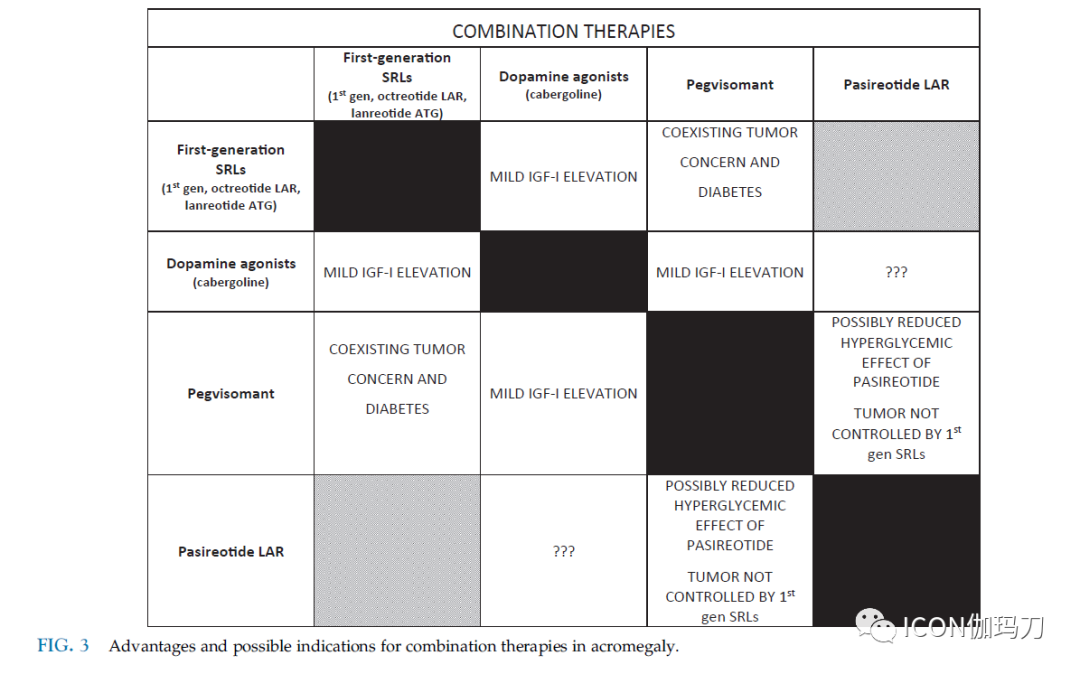
图3.肢端肥大症联合治疗的优势和可能的适应证。
前景
SRL
(II期和III期研究)已经研发或正在研发奥曲肽和非肽SS类似物的新配方,以使给药(如口服片剂和Depot[非胃肠道途径给药的埋植或可注射的缓释制剂])更简单,并增加对药物治疗的依从性。数据很有希望,但到目前为止还没有得到药品监管机构的官方批准。
Octreolin是奥曲肽的新剂型,可口服。为了提高其生物利用度,人们将其与亲水颗粒和瞬态渗透性增强剂(transient permeability enhancer)相结合。事实上,这种增强剂可以通过间隙连接的瞬时开放增强来传递大分子,从而增加肠道的通透性。在人类的临床研究显示通过抑制生长激素分泌50%到90%,与皮下奥曲肽类似的药代动力学情况。一项III期临床试验报告称,在以前使用第一代SRL控制的大多数患者中,维持了生化控制。最近的一项试验也证实了octreolin的有效性和安全性,该试验满足其主要终点和所有四个次级终点。
Paltusotine(也称为CRN00808)建立了用于肢端肥大症治疗的一类新的口服选择性非肽SSTR2激动剂。在99例健康志愿者中的1期、双盲、随机、安慰剂对照、单剂量和多剂量试验评估Paltusotine的安全性、药代动力学和药效学,在这些受试者中,通过有效抑制刺激的生长激素和基线IGF-I证明了这一概念的临床证据。
Somatoprim是一种新型的环状七肽多配体SS类似物,除SSTR2和SSTR5外,对SSTR4具有毫微摩尔亲和力。初步结果显示,即使对第一代SRL无反应的患者,对GH分泌也有选择性抑制作用,但对胰岛素分泌没有显著影响。对数量非常有限的不受控制的肢端肥大症患者和健康受试者的II期研究最近已经完成,结果令人满意。
GH拮抗剂
反义合成寡核苷酸是单链DNA或RNA的短分子,与给定序列互补,停止其翻译。at1103能够抑制人生长激素受体mRNA的翻译,进而抑制其合成。在一项II期研究中,一种针对GH受体mRNA翻译的第二代反义寡聚物,每周给药两次,结果显示第14周时IGF-I降低27.8%,13例患者中有2例(15%)达到正常IGF-I水平。通常耐受性良好,但(85%的患者)经常出现轻中度的注射部位反应。
通过翻译融合突变的生长激素结合到生长激素结合蛋白,已经合成了长效的生长激素受体拮抗剂,目前已经测试了三个候选分子。所有分子都有氨基酸变化(例如,G120R),产生竞争性的GHR拮抗作用。对兔子单次皮下注射同一种变体后,7天内IGF-I下降了14%。
雌激素和选择性雌激素受体调节剂(SERMs)
这些化合物可以降低肢端肥大症患者的IGF-I水平,已被提出单独使用,或与SRLs或DA联合使用。雌激素可能对伴有垂体功能低下的年轻女性特别有用,也可用于恢复性腺功能。而SERMs(通常用于绝经后骨质疏松症)也可能在脆性骨折高危患者中发挥有益的骨代谢作用。最后,还需要对肢端肥大症和性腺功能减退症患者的其他益处进行研究,因为这些药物可能也会增加雄激素水平。事实上,值得注意的是,到目前为止,这些药物在肢端肥大症的治疗中可能发挥的作用仍然存在争议。
结论
肢端肥大症及其合并症的现代治疗复杂且费用昂贵,需要综合多学科的治疗,因为不同阶段和不同患者的治疗都需要手术、药物和放疗。
由经验丰富的神经外科医生进行TNS手术,仍然是大多数患者的首选治疗方法,只要有可能,我们都推荐这种手术,因为它仍然是治愈的最佳机会。然而,由于腺瘤的特点和侵袭性,治愈率仍远未达到最佳,而第一代SRLs(奥曲肽LAR和兰瑞肽 ATG)作为一线药物治疗,通常用于术后持续疾病的患者,或作为有手术禁忌或预期成功可能性较低的患者的一线治疗。事实上,在大多数未接受过治疗或作为辅助治疗的患者中,这些药物普遍耐受性良好,在减少GH高分泌同时诱导肿瘤缩小方面有效。与此同时,在评估(特别是心肺)合并症的研究中报告了更积极的结果,证实了这些化合物临床作用多效性的假设。
然而,目前,大量使用奥曲肽LAR或兰瑞肽ATG常规剂量治疗的患者可能无法达到疾病控制的标准。因此,在这种情况下,应始终从以患者为中心的角度考虑增加这些药物或二线药物(即培维索孟或帕瑞肽 LAR)和放疗的剂量。
只在手术切除肿瘤残余的情况下可能进行二次神经外科手术,二线治疗的选择应根据残留腺瘤的大小或糖稳态损伤的个体化。在第一种情况下,建议从第一代SRL切换到帕瑞肽 LAR,以处理肿瘤肿块。相反,如果血糖控制是临床相关问题,则可以单独或与之相关对培维索孟作评估。
要点
肢端肥大症的治疗是基于多模式、以患者为中心的方法,包括神经外科、药物治疗和放射治疗。
由于持续显著的诊断延迟和随后发病时的大腺瘤高发生率,一些患者神经外科无法控制疾病,因此其受益于术后药物治疗。
第一代SRL是大多数神经外科未治愈患者的首选。事实上,在一些临床试验和现实生活研究中,它们已经被证明可以有效地控制生长激素的高分泌和肿瘤的再生长。
当第一代SRL不能控制疾病和肿瘤团块引起关注时,帕瑞肽可能是有指证的。尽管如此,它的高血糖效应,特别是对已经存在糖代谢障碍的患者,需要仔细考虑和适当的监测和管理。
只有在GH和IGF-I轻度升高的情况下才会使用多巴胺激动剂,因为它们的疗效显著低于第一代SRL。
培维索孟可以使大多数肢端肥大症患者的IGF-I正常化并改善糖代谢,尽管其广泛使用受到成本、每日注射的需要和仅限外周作用水平的限制,对于临床关注残留肿瘤大小的患者,需要对此仔细考虑。
结合不同的药物选择,特别是第一代SRL和培维索孟,可能意味着在糖代谢受损和肿瘤相关的患者中获得生化控制。




