01. OGD后,SNAP29蛋白水平持续下降
首先,作者在体外培养的原代皮层神经元中进行了氧糖剥夺(OGD)实验。通过将细胞培养基更换为无糖培养基并在缺氧培养箱中进行处理,氧糖剥夺实验可以在体外培养细胞中很好地模拟缺氧缺血的状态。
蛋白质印迹(Western blots,WB)结果显示,氧糖剥夺以及不同的再灌注时间下,SNAP29的蛋白量表现出持续下降的趋势。高内涵细胞成像分析也证实了这一蛋白水平的变化(图1A-C)。为了确定SNAP29蛋白量变化的原因,作者接下来采用实时定量PCR手段检测了Snap29的mRNA含量。结果显示再灌注后1小时(OGD/R 1 h)和12小时组(OGD/R 12 h)中Snap29的mRNA含量均出现了显著的下降,但这并不包括再灌注前(图1D)。这一结果提示,氧糖剥夺初期SNAP29蛋白量的下降可能是转录后的调控因素所导致的,而SNAP29的生物发生则是导致其再灌注阶段蛋白量降低的原因。
泛素-蛋白酶体途径是一种高度特异性的蛋白降解途径,这一途径可能在SNAP29的降解过程中扮演了重要的角色。为了验证这一假说,作者使用MG132,一种泛素-蛋白酶体途径的特异性抑制剂处理神经元。WB结果表明,MG132处理使SNAP29的蛋白水平在氧糖剥夺后得到了恢复,但是这一处理并未显著影响再灌注过程中SNAP29的蛋白量(图1E-F)。以上的结果提示了在缺氧过程的早期阶段,SNAP29首先通过蛋白酶体途径遭到降解;而在缺氧后的再灌注过程中,Snap29的生物发生过程被抑制。这两个因素先后导致了氧糖剥夺再灌注过程中SNAP29蛋白量的下调。
接下来,作者探索了SNAP29是否在缺氧过程中发挥了神经保护作用。借助慢病毒载体在原代皮层神经元中将Snap29基因过表达(Lenti-CMV-Snap29),然后再对细胞进行氧糖剥夺处理。然而CCK和LDH测试结果都显示,过表达Snap29未能显著改善细胞的存活率(图1G-H)。基于此结果,我们得出结论,虽然在缺氧-再灌注过程中SNAP29蛋白水平被维持在一个较低的水平,但是这一变化与细胞的命运并无可靠的联系。

图1. OGD后,SNAP29蛋白表达量显著降低
02. 突触位点SNAP29的减少抑制了突触传递效率
为研究SNAP29的下降在缺血再灌注过程中的功能,作者采用免疫共沉淀的手段将正常状态和OGD状态下SNAP29的结合蛋白分离出来,并联合质谱分析鉴定出了这些蛋白。生物信息学的手段研究了在正常状态及OGD状态下表达发生改变的蛋白所处的生理过程和信号通路。一系列生物信息学分析提示,SNAP29相关的蛋白主要以蛋白-蛋白互作的形式在细胞的囊泡转运过程中发挥作用(图2)。
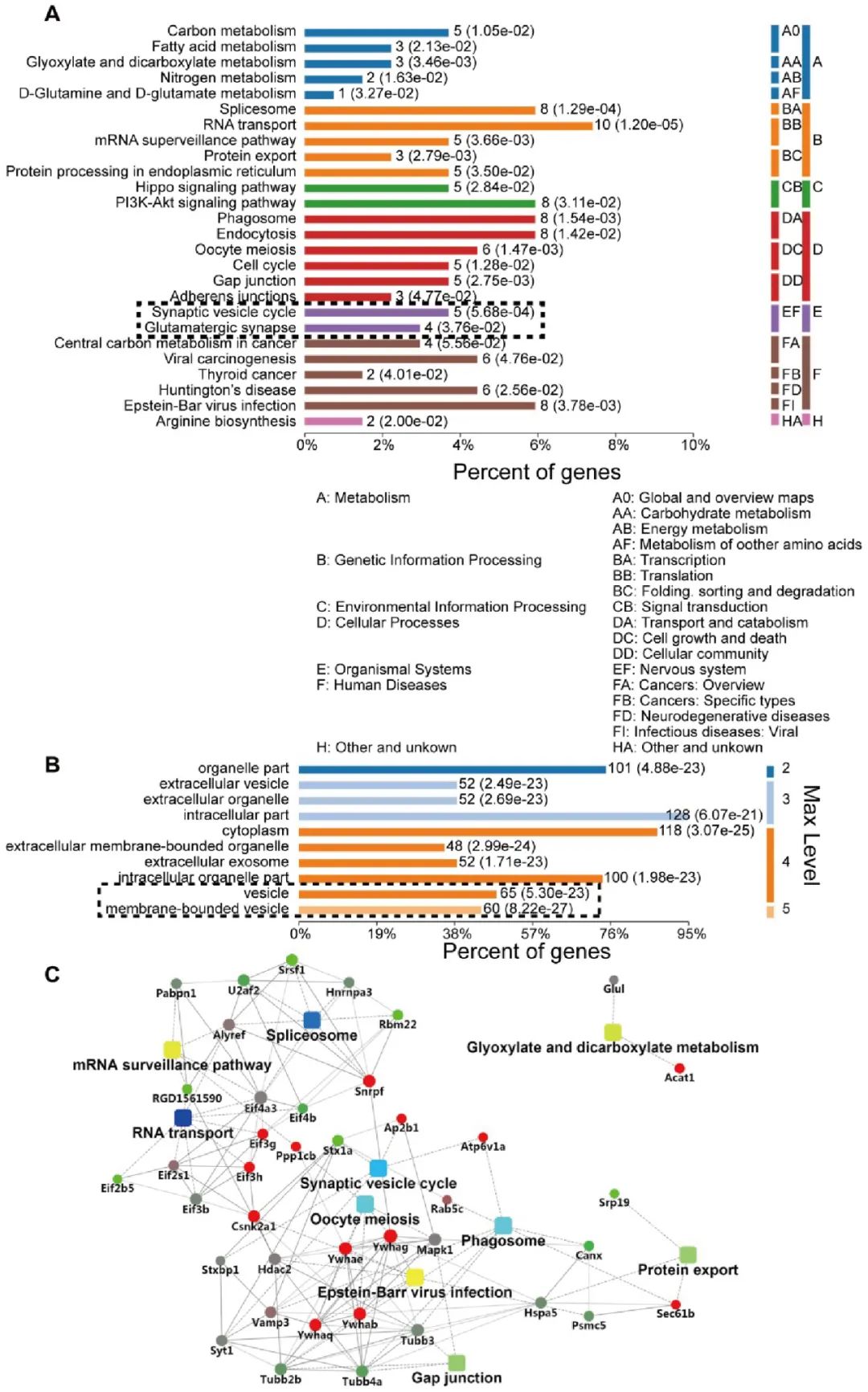
图2. 基因本体(Gene Ontology,GO)分析
为了验证生物信息学的结果,研究者首先研究了SNAP29蛋白与突触的标志物——突触素(synaptophysin)的共定位(图3A)。在缺血再灌注过程中,SNAP29斑点的数量出现了下降,同时SNAP29和突触素的共定位相比正常状态也出现了显著的减少(图3B-C)。这提示了SNAP29也许参与了突触前功能的调控。为了检验这一假说,作者借助慢病毒载体介导的小发卡RNA(short hairpin RNA,shRNA)在培养神经元中敲减了SNAP29的表达量(图3D-E)。突触素和另一种突触前特异性标记物PSD95的共定位实验证实了SNAP29的敲减并没有破坏突触的超结构。而当过表SNAP29时,突触结中的突触前囊泡池的数量表现出了上升。
因为缺氧再灌注后多种生理过程都会发生变化,为了排除这些生理过程的影响,作者评价了使用shRNA敲减SNAP29是否能够模拟OGD后SNAP29在突触前的下调作用。作者使用SNAP29与突触素的荧光共定位情况指示SNAP29在突触前的积累量,通过计算SNAP29的积累指数(accumulation index),作者发现不论是OGD还是shRNA敲减之后,SNAP29在突触前的积累都发生了显著的下降(图3G)。
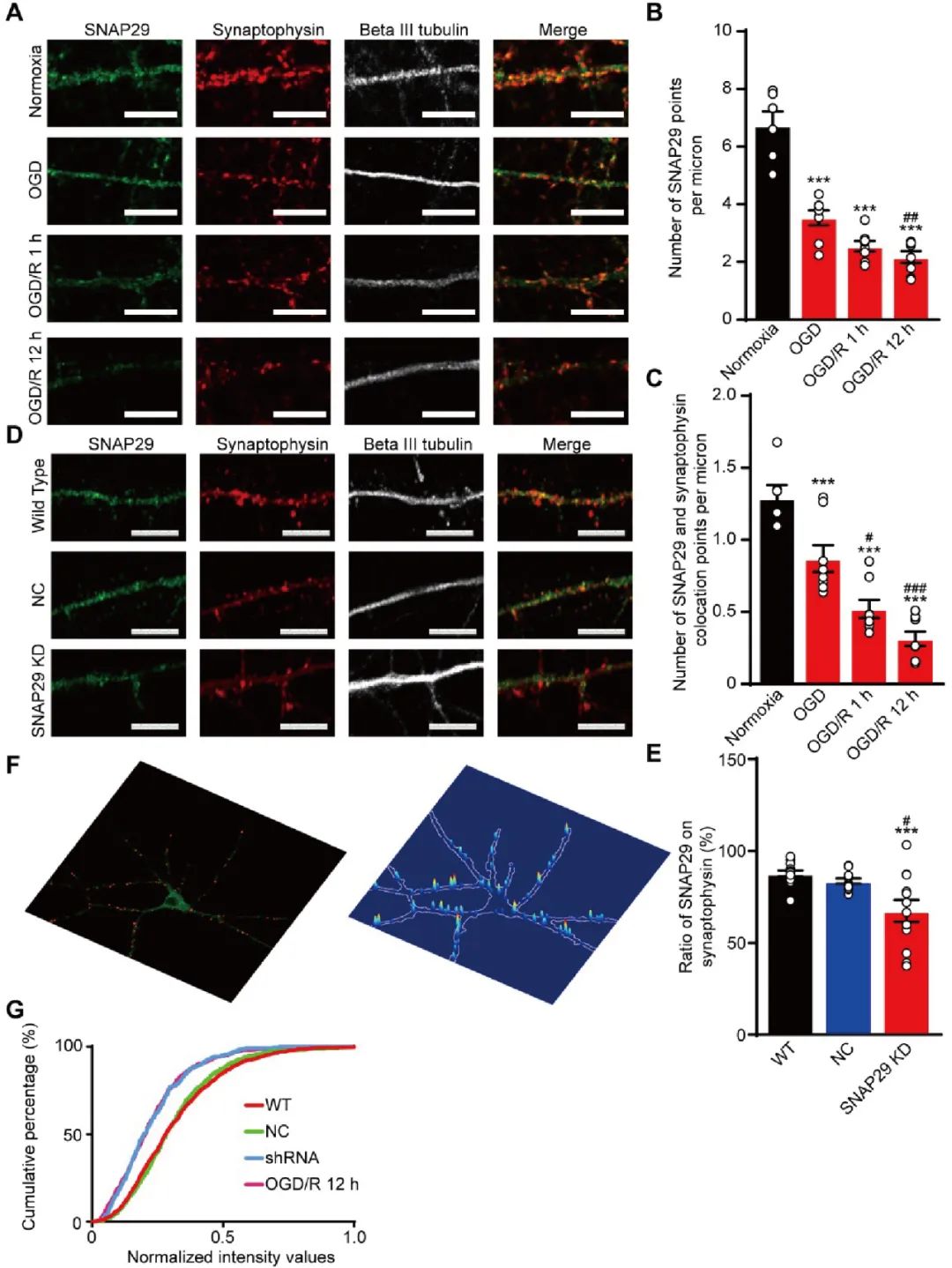
图3. OGD/R或敲低SNAP29导致SNAP29在突触位点的分布显著降低
03. SNAP29表达下调导致突触功能受损
接下来,作者使用SNAP29敲减的模型研究其对突触功能的影响。首先研究者使用全细胞膜片钳技术发现,SNAP29敲减显著地降低了AMPA受体介导的兴奋性突触后微小电流(mEPSCs)的频率,但并未显著改变其幅度(图4A-B)。这说明谷氨酸的突触传递受阻是由于突触前释放的影响所致。透射电镜的结果也显示,SNAP29敲减使突触前囊泡的分布更加分散,并显著降低了待释放囊泡池的大小(图4C-D),从而进一步提示SNAP29下调导致的突触功能受损是由于突触前释放功能障碍导致的。
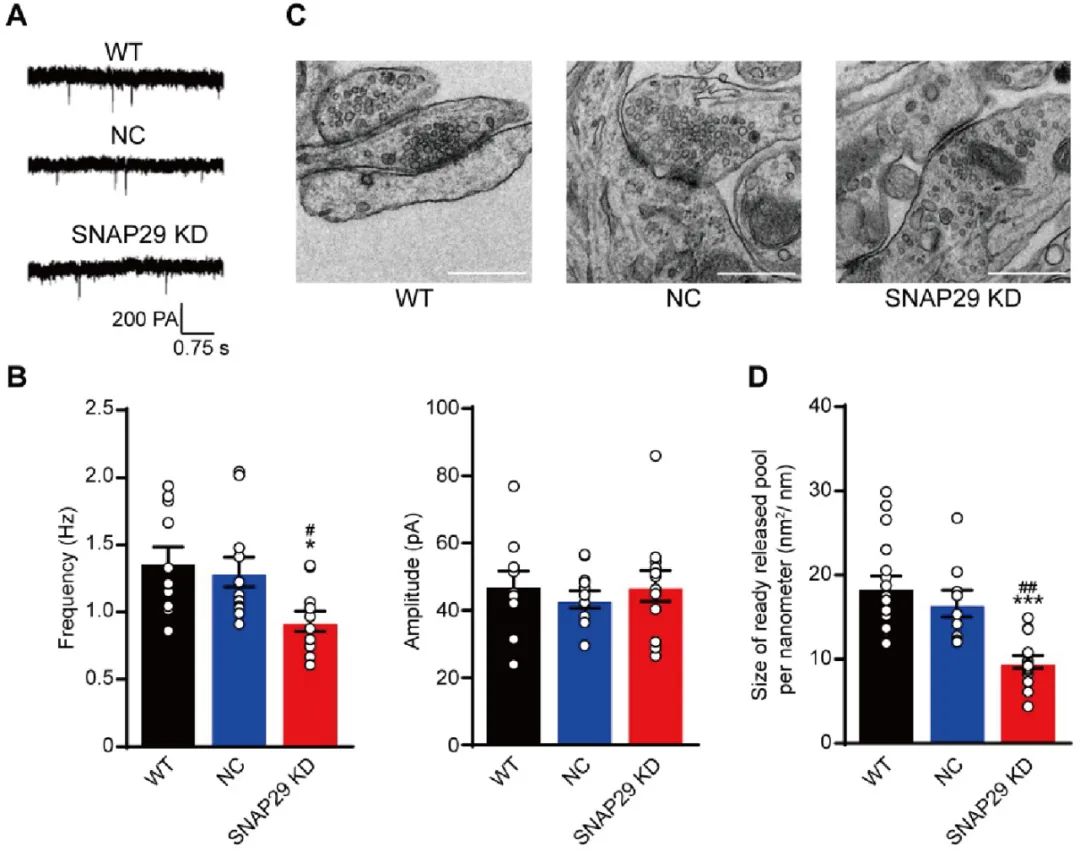
图4. SNAP29下调导致的突触功能受损是由于突触前释放功能障碍导致的
体外的结果证实了氧糖剥夺-再灌注会降低SNAP29的蛋白水平,而SNAP29的降低则在突触功能中发挥了重要的作用。因此,研究人员进一步研究在大脑中动脉栓塞(Middle cerebral artery occlusion, MCAO)的小鼠中是否也会出现相同的影响。WB结果显示SNAP29的蛋白水平在MCAO造模后的半影区出现了显著的下降(图5A-B)。中动脉栓塞会影响多个脑区的功能,其中海马区作为认知功能的主要区域也是首当其冲。因此作者接下来检验了海马区结构和功能的损伤情况。为了在体内研究SNAP29下调对神经功能的影响,AAV病毒载体携带着Snap29的shRNA被注入到海马的CA1区。电镜下发现突触结构受损情况与体外培养的神经元类似(图5C)。
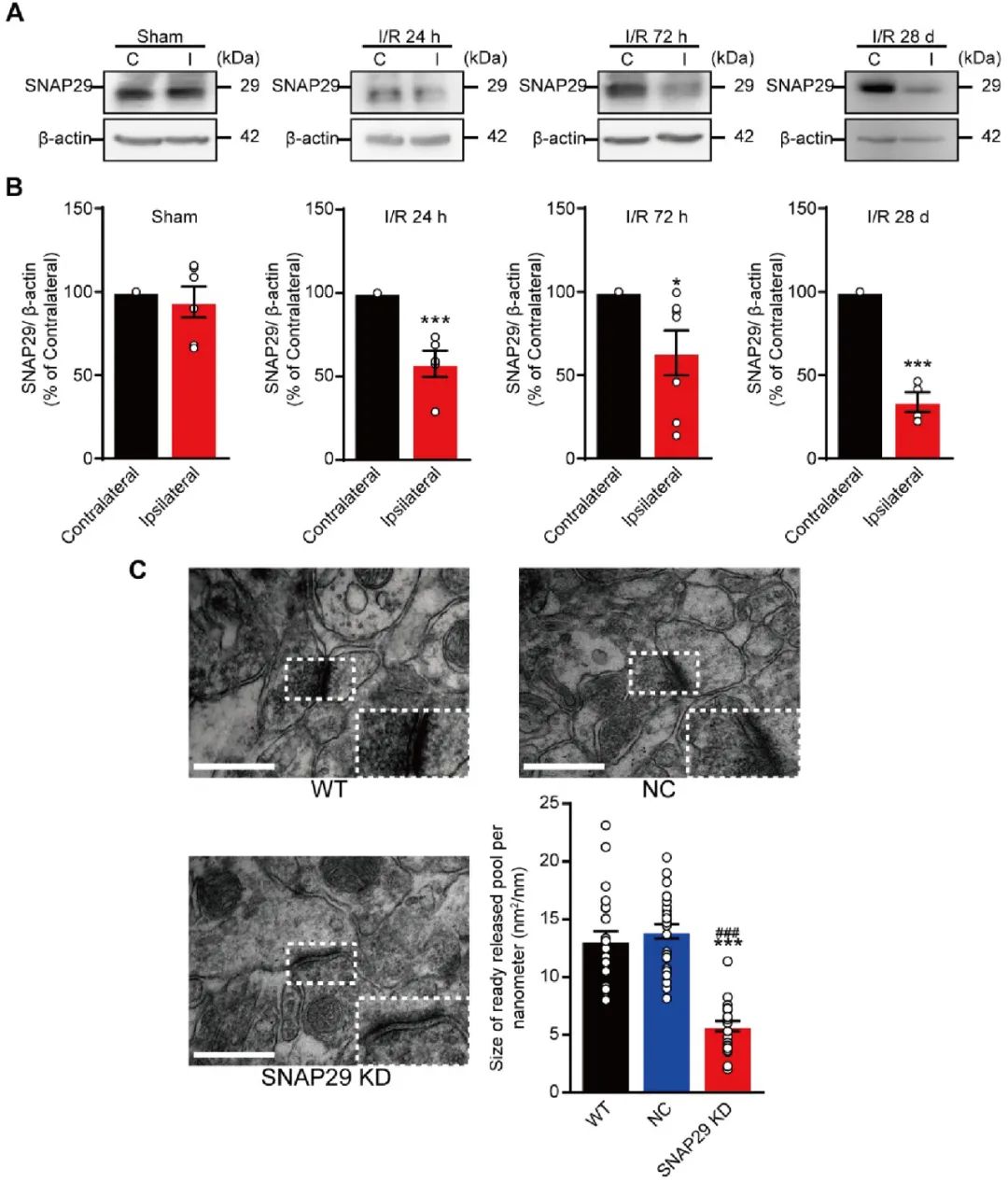
图5. MCAO小鼠急性缺血-再灌注不同时期后同侧脑区SNAP29蛋白水平下降
04. SNAP29表达下调损害长期神经投射导致认知障碍
接下来,作者借助光遗传的方式验证这一损伤是否会影响到神经环路的功能。作者将AAV-CMV-hChR2(H123R)-mCherry-U6-shRNA(Snap29) 注射小鼠海马CA1,并埋入光纤,光刺激的同时记录内侧前额叶皮层(mPFC)的场电位。结果发现光刺激诱发的场电位改变在mPFC被阻止,提示SNAP29的下调损伤了海马-前额叶皮层的通路(图6A-B)。同时,作者也测量了光刺激海马区后mPFC的δ,θ,β波以及γ波的功率,结果发现,SNAP29的表达下调可抑制由光刺激导致的所有相位功率上升的现象(图6C-D)。综上,SNAP29的下调损害了脑区间的通讯。
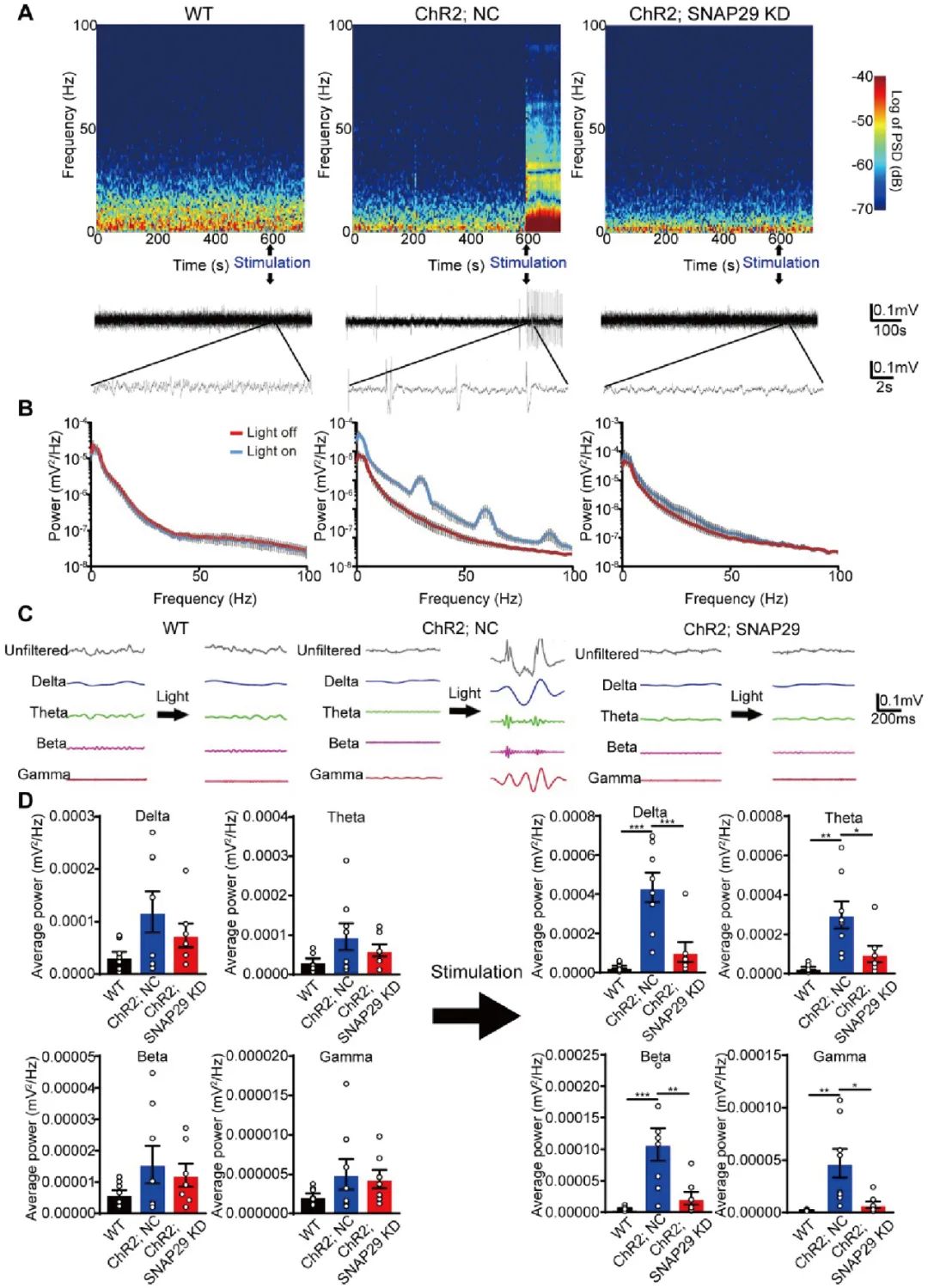
图6. SNAP29的下调损伤了海马-前额叶皮层的通路
上文的研究证实了SNAP29敲减会损害神经元的长距离投射。接下来作者探究这种下降是否能够导致认知能力的损伤。借助旷场实验(图7A)发现,SNAP29敲减组小鼠停留在中间区域待的时间显著升高(图7C-E),这提示SNAP29的敲减鼓励小鼠进行探索并且显示出了对危险的漠视。随后,作者采用三箱社交实验观察动物的社交能力(图7B),结果发现,SNAP29敲减小鼠表现出社交记忆缺失的症状(图7F-H)。
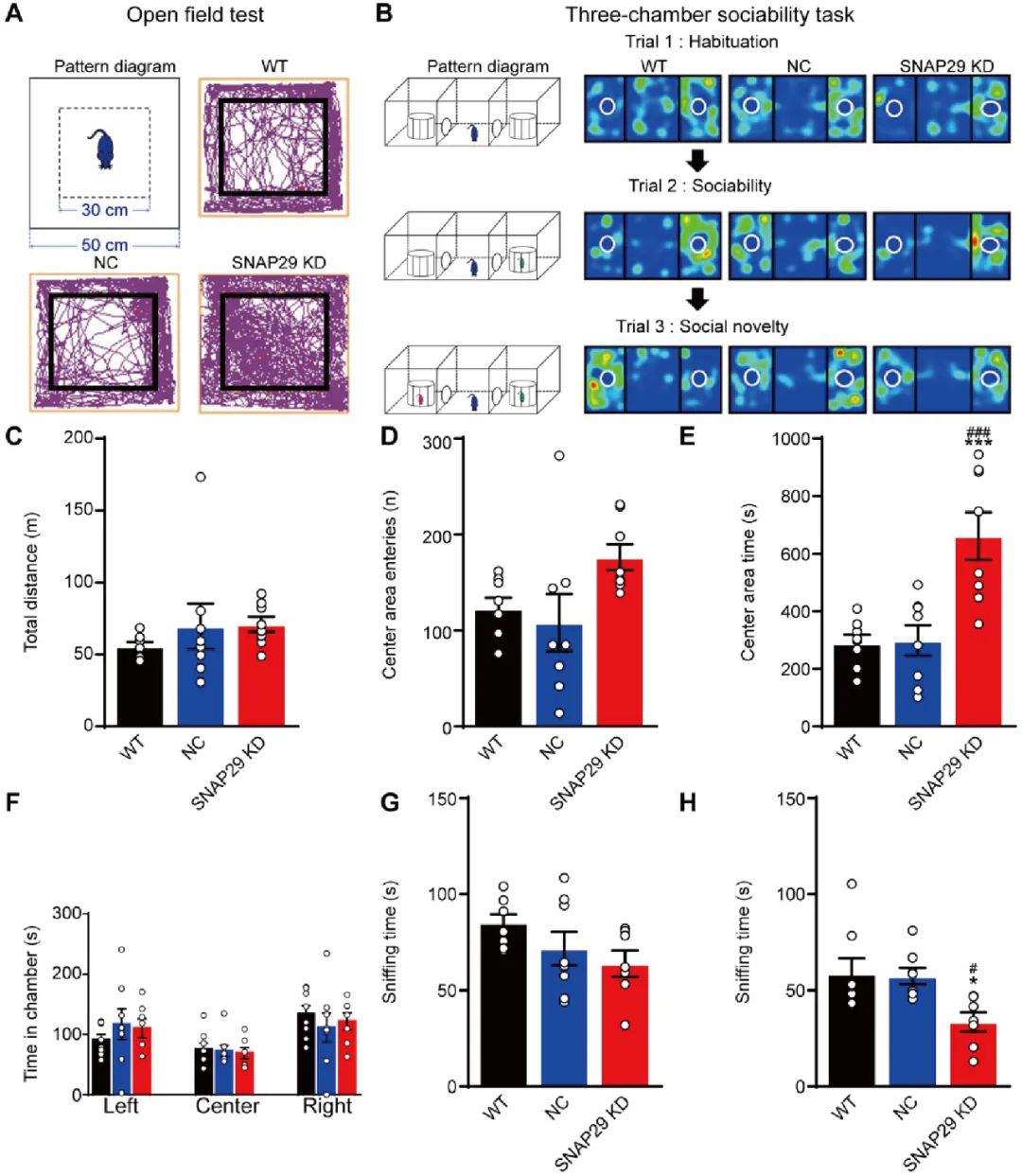
图7. SNAP29表达下调导致小鼠表现出社交记忆缺失症状
最后,作者研究了SNAP29敲减对动物的学习记忆能力的影响。借助新物体识别行为学范式发现,SNAP29敲减组的小鼠明显花费了更多时间探索熟悉而非新物体(图8A-C)。而在Morris水迷宫实验中,SNAP29敲减组小鼠表现出明显的学习和记忆功能障碍(图8D-I)。以上的结果表明,SNAP29表达下调显著地损伤了小鼠的认知和记忆功能。
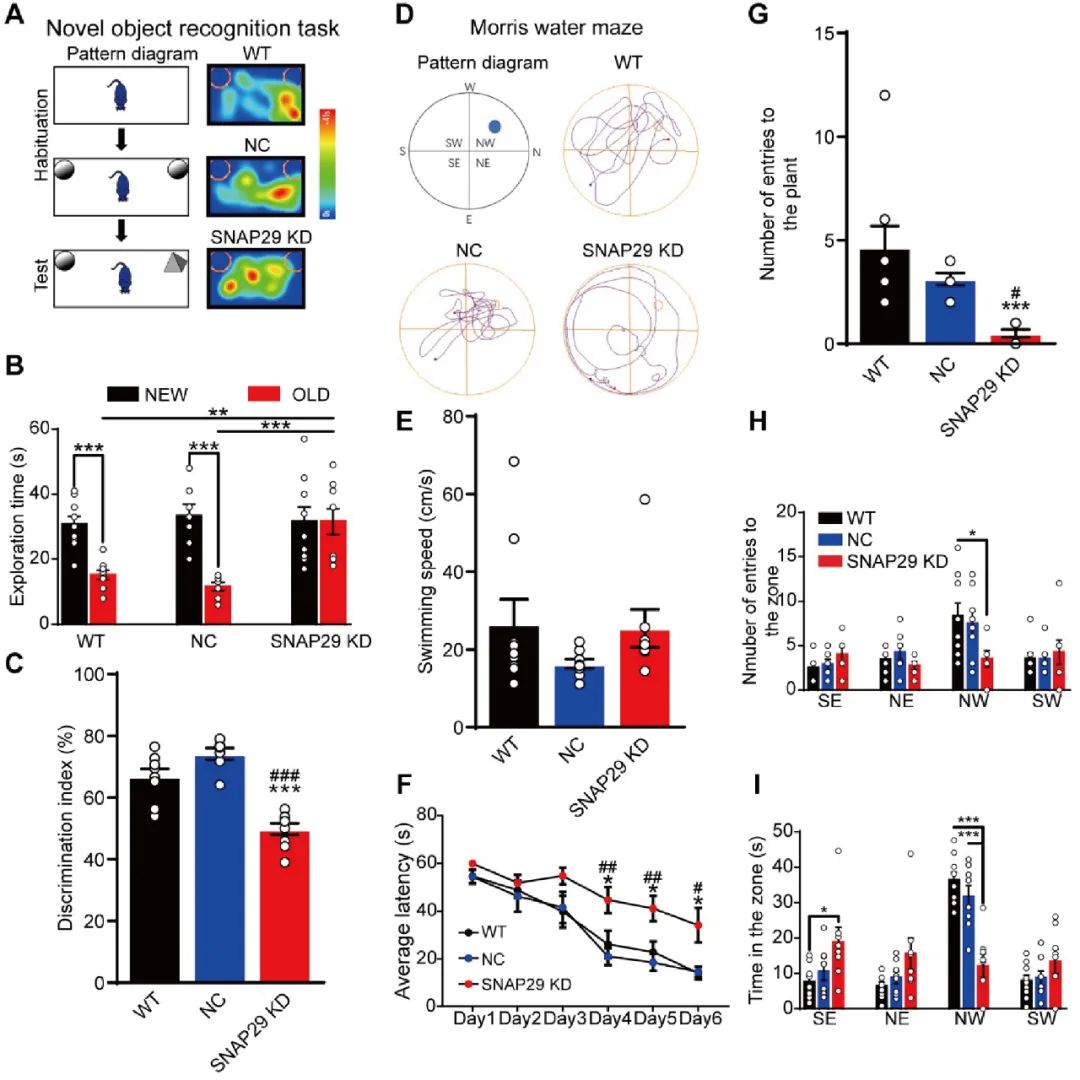
图8. SNAP29表达下调损伤了小鼠的认知和记忆功能















