复旦大学脑科学转化研究院官方学术公众号
墨镜一戴谁都不爱?
神经元的电发放是大脑活动的基础,人类大脑神经元的复杂活动性决定了自己作为万物之灵的特殊性。
随着老龄化社会的加剧,脑肿瘤近年来也愈发呈现高发的态势,给社会和家庭带来了沉重的经济负担。脑肿瘤患者可伴随多种严重症状,如头疼及认知功能减退等。鉴于脑部的特殊性,脑肿瘤的生长迅速和免疫冷环境的特点给肿瘤的治疗带来了难度。如何理解脑肿瘤发生发展的机制,解析其肿瘤微环境的特点对我们开发相应的治疗方式具有重要的作用。
神经元&肿瘤
近年来,科学家们陆续发现神经元在神经肿瘤的微环境中扮演了一种特殊的角色。2019年,《Nature》同时刊出三篇长文,以“背靠背”形式共同报道了脑内肿瘤与神经元之间形成的兴奋性突触结构,并揭示这种突触联系如何促进肿瘤生长,并附上“Synaptic input drives brain tumor progression”的同期评述。

这三篇《Nature》长文都报道了神经元与肿瘤细胞之间交互作用的存在,肿瘤细胞依赖兴奋性突触的神经递质来促进自身的生长。这三篇文章利用电镜、dSTROM、电生理和光遗传等技术完善解释了兴奋性突触和胶质细胞在肿瘤微环境中对于肿瘤侵袭和增生的重要作用,并利用电生理等工具药物手段开启了脑肿瘤演化的一个全新方向,揭示了靶向谷氨酸受体、突触形成和突触后信号通路途径可能成为降低脑肿瘤增生的重要治疗手段(图1)。
图1
2021年5月26日,来自圣路易斯华盛顿大学医学院和斯坦福大学医学院的Michelle Monje和David H. Gutmann团队在《Nature》上再次发表长文“NF1 mutation drives neuronal activity-dependent initiation of optic glioma”,这项研究显示,神经元的正常日常活动同样可以推动具有脑瘤危险基因携带者中脑肿瘤的形成和生长。这项工作是Michelle Monje团队先前工作的延伸。以往的工作证明了神经元活动可以推动肿瘤的生长,但并不清楚是神经元活动本身启动了肿瘤形成的过程还是引发了其它过程从而导致的肿瘤生长。
在此项研究中,研究人员主要关注基因上易患视神经胶质瘤(optic pathway glioma, OPG)的小鼠。NF1是遗传性1型神经纤维瘤病中发现的关键肿瘤基因,大约15%的遗传性1型神经纤维瘤病的儿童在7岁时会发展成低级别神经肿瘤。身体中几乎所有细胞都携带小鼠 Nf1 基因的突变,但其中只有转化为视神经胶质瘤(神经祖细胞)的细胞缺乏功能Nf1基因的完全拷贝。这两种情况都是小鼠在年轻时(约 9 周)发生视神经胶质瘤的先决条件,反映了患有 NF1 的儿童和年轻人的情况,他们可以发展为缺乏 NF1 表达的神经胶质瘤。潘等人使用这种相对简单且可控的小鼠模型——称为 NF1 光通路神经胶质瘤 (Nf1OPG) 模型可以来解决一个令人兴奋的问题,即暴露于光(会增加视通路中的神经元活动)是否会触发视通路神经胶质瘤的形成。
作者测试了在黑暗中饲养 6 至 12 周龄的年轻 Nf1OPG小鼠是否能阻止视神经胶质瘤的形成。结果确实如作者所料。此外,在生命后期(从 12 到 16 周)将已经有肿瘤的 Nf1OPG小鼠置于黑暗中会大大减少肿瘤的生长。光遗传学的技术人工激活视神经中的神经元,同样促进了 Nf1OPG 小鼠视神经胶质瘤的生长。换言之,肿瘤发生期的视觉刺激对视神经胶质瘤形成至关重要,越多的视觉刺激会造成肿瘤的体积明显增大。
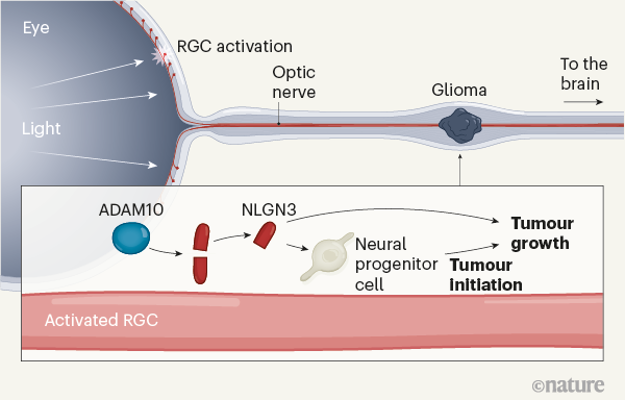
图2
接下来,作者探索了视觉刺激对神经胶质瘤生长影响背后的分子决定因素(图2)。之前对另一种脑肿瘤(侵袭性高级别胶质瘤)的研究(同一个研究小组)证明激活的神经元会分泌一种称为脑源性神经营养因子的蛋白质,并释放另一种称为neuroligin-3(NLGN3) 的蛋白质,进而刺激神经胶质瘤的生长(图3)。在 Pan 及其同事的研究中,该团队发现视网膜神经元的光遗传学刺激增加了视通路中这两种因子的水平,从而促进了培养的中低级别胶质瘤细胞的增殖。Neuroligin-3 在驱动 Nf1OPG模型中的肿瘤生长中的作用随后通过敲除等方式进行了证实。
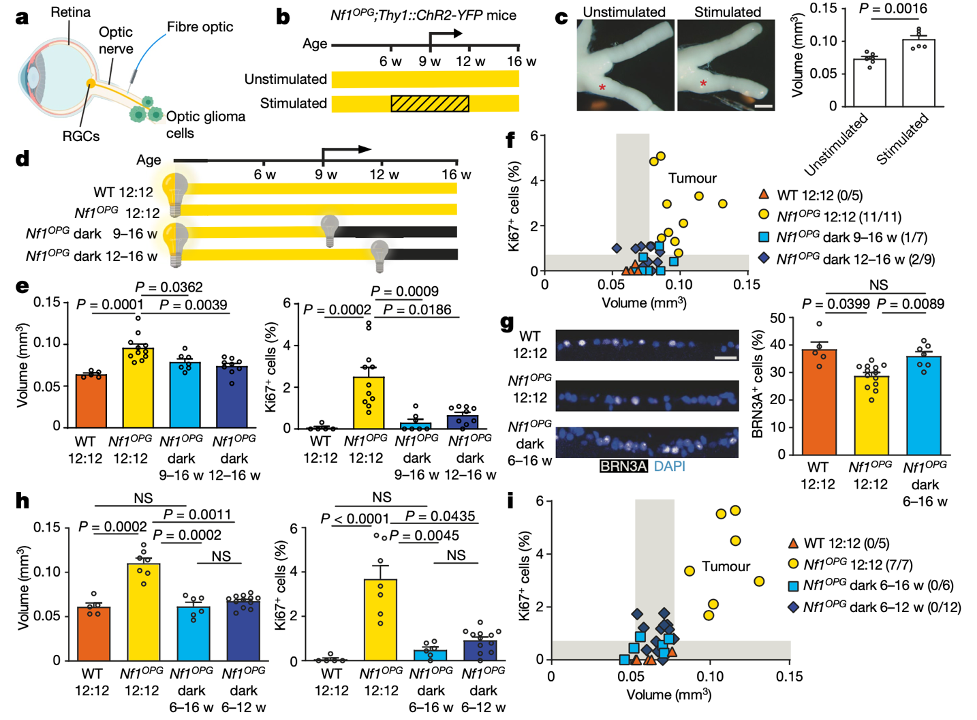
图3
Pan等人还在来自人类的肿瘤样本中(毛细胞星形细胞瘤)检测到高水平的NLGN3,尽管样本之间的表达水平有所不同。值得注意的是,显示出NLGN3特别高表达的肿瘤样本也显示出与突触形成相关的基因的高表达。因此高级别神经胶质瘤中发现的神经元-神经胶质瘤突触是否存在于NF1相关的低级别神经胶质瘤中也未可知。通过进一步的实验,作者证明 Nf1OPG小鼠视通路中激活的神经元比普通小鼠视通路中激活的神经元释放更多的NLGN3(图4)。这建立了一种以前未知的机制,通过该机制,NF1突变可以使神经元活动启动肿瘤,从而使 NF1 患者对它们敏感。这对于例如恶性周围神经鞘瘤等已知的与NF1有关的肿瘤而言也是一个新的视角。
随后,研究人员又通过敲除NLGN3和药理性抑制NLGN3,发现可以抑制NF1-OPGs的形成和进展。这种化合物已经在用于高级别神经胶质瘤的临床试验中(参见由儿科脑肿瘤联盟进行的这项美国试验;go.nature.com/3w3mx44),因此其预防或治疗 NF1 相关神经胶质瘤的潜力令人感兴趣。
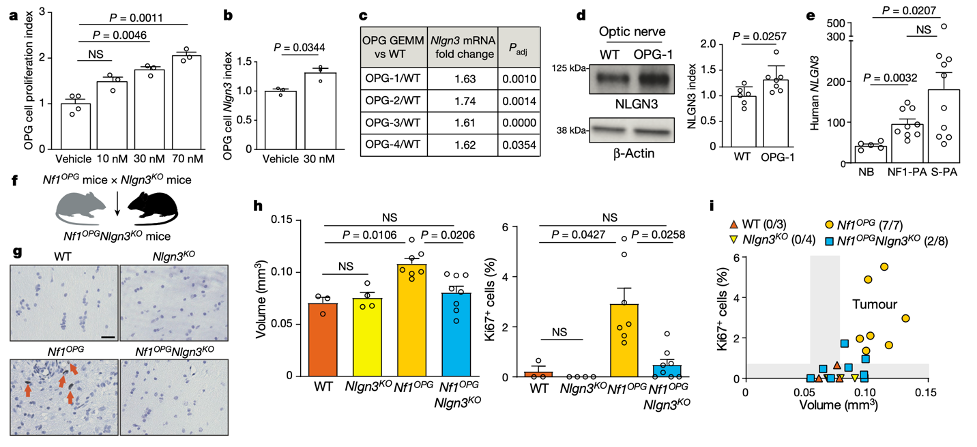
图4
Pan 及其同事的研究强化了这样一种观点,即神经元活动不仅可以驱动肿瘤的生长,而且对于癌症的发生也至关重要。在前列腺癌和其他癌症中,来自大脑的祖细胞甚至可以追踪肿瘤,在那里它们有助于肿瘤的发展和生长。在小鼠中,去除将感觉信息从胰腺传递到中枢神经系统的神经元可防止胰腺肿瘤的形成。在小鼠皮肤中,发现肿瘤优先起源于具有特别高神经元神经支配的细胞群。Pan和同事的研究将这种联系扩展到了中枢神经系统和癌症易感综合症。
通讯作者David H. Gutmann在采访中说到:“视神经胶质瘤在患NF1的儿童中非常常见,它们会导致视力下降,我们没有一个好的方法来预测谁会患上肿瘤或任何方法来预防它们。但现在我们知道这些脑瘤是由暴露于光和神经元活动引起的,我们可以开始思考下一代的预防策略。也许我们可以给孩子们酷酷的太阳镜,戴上滤镜或镜片来阻挡特定波长的光,或者重新利用药物来抑制过度的神经元活动,保护这些孩子不患脑瘤和失明。”
所以,笔者在此推荐:大家在不知道自己是不是NF1基因拷贝缺失的情况下,带好墨镜,不仅很帅还防癌。
排版 | 吕莹莹
复旦大学脑科学转化研究院

官网:itbr.fudan.edu.cn
邮箱:itbr@fudan.edu.cn
扫码关注我们

1

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。







