
引言
垂体功能减退是一种罕见的疾病,其特征是由于垂体和/或下丘脑疾病而缺乏一种或多种垂体前叶激素垂体腺瘤是成人获得性垂体功能减退最常见的原因,其次是垂体肿瘤的手术治疗和放射治疗,而炎症性/浸润性、血管性和感染性疾病很少见。临床表现主要与潜在的疾病的病因和疾病程度(the cause and acuity)以及激素缺乏的严重程度和类型有关。垂体功能减退的体征和症状通常是隐匿的和非特异性的(insidious and unspecific),尽管也可能发生急性发病(acute debut),但经常导致诊断延迟。对于(如垂体腺瘤患者,和经垂体放射治疗后),有垂体功能减退高风险患者应定期评估垂体功能,必要时进行激素替代治疗。在垂体肿瘤患者中,放射治疗后,垂体功能障碍通常以生长激素轴首先受影响,然后是性腺轴、甲状腺素轴和促肾上腺皮质激素轴受影响。当垂体激素丢失的顺序不同时,应怀疑其他潜在原因,特别是当也存在尿崩症时。垂体功能减退与过高的死亡率相关,主要由心血管疾病引起。垂体功能减退患者需要终身替代治疗,定期监测以避免替代不足或过度替代。
历史的前瞻
垂体腺最早由希腊医师帕加马的盖伦(Galen of Pergamon )(129-201CE)在解剖学上描述的。然而,直到19世纪初,Joseph Babinski和Alfred Fr ohlich才分别描述了人类垂体功能减退症。两者都描述了垂体肿瘤患者具有相似的临床表型,肥胖和外生殖器发育不全,Frohlich称之为脂肪性生殖无能(dystrophia adiposogenitalis),今天称为垂体功能减退(hypopituitarism)。
临床症状和体征
垂体功能减退的患者
垂体功能减退症的临床表现不同,取决于下丘脑-垂体区域损害的性质和速度,以及激素损失的顺序和程度。当潜在的疾病是良性垂体肿瘤时,起病通常是隐匿的。
急性起病
垂体卒中可引起急性垂体功能减退,如果不治疗,有很高的死亡率,通常继发于急性肾上腺功能不全。与垂体卒中相关的其他症状是由于对视神经/视交叉或海绵窦内颅神经的迅速膨胀和急性压迫引起的。虽然急性垂体功能低下是罕见的,它是认识的一个重要的临床条件。突然起病的急性剧烈头痛,通常是眶后性质的,应提醒临床医生警惕急性垂体损伤的可能性。由于出血、梗死或炎症引起的鞍内压力增加,产生疼痛,并与高达70%的患者的神经眼科体征相关。许多急性垂体功能减退的患者同时伴有恶心、呕吐、低血压和低钠血症,这是由急性肾上腺功能不全引起的。尿崩症也可能是急性垂体损伤的一个表现特征。肾上腺功能不全可能掩盖尿崩症,因此尿崩症的症状可能直到皮质醇被替代后才显现出来。对于伴有肾上腺功能不全的急性垂体功能减退患者,在开始任何其他替代疗法之前,快速用氢化可的松替代是至关重要的,特别是甲状腺激素替代疗法,因为这可能会加重皮质醇缺乏的症状。在急性情况下,皮质醇浓度小于500nmol/L将被认为是低于正常水平,低ACTH将支持垂体功能减退,而不是原发性肾上腺功能不全。由于肾上腺皮质萎缩尚未发生(见内分泌评估和替代疗法部分),在这种情况下进行短的Synacthen测试是正常的。
因为其他由急性垂体功能减退引起的垂体激素缺乏很少导致急性症状和体征,它们在循环中的半衰期比皮质醇长得多。
隐匿起病
隐匿性垂体功能低下是最常见的表现,其临床表现通常是非特异性的。症状和体征的模式取决于激素丧失的顺序和程度。与每种激素缺乏相关的典型症状和体征在下面的部分中描述(图1)。
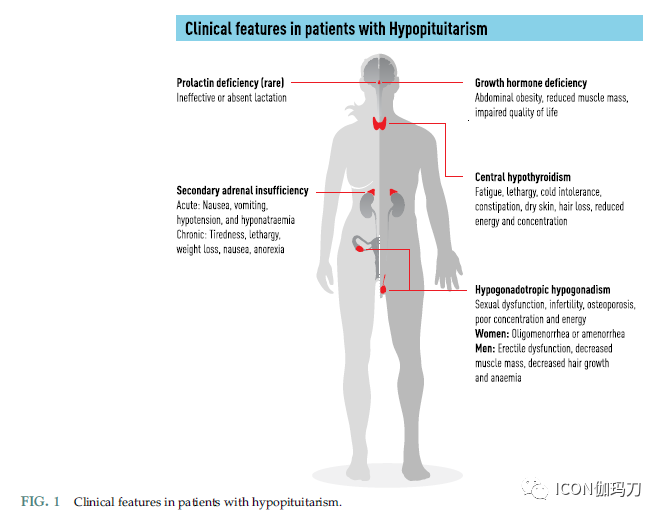
图1垂体功能减退患者的临床特征。
流行病学
仅在一项研究中报道垂体前叶激素缺乏,包括生长激素缺乏(GHD)的发病率和患病率,该研究对西班牙加利西亚南部(south Galicia in Spain)的14.6万名成年居民进行了抽样调查。结果显示,垂体功能减退的发病率在1992年至1999年间不断上升,从每10万人中290人上升到455人。年平均发病率为每10万居民42例,在研究期间保持稳定。无功能垂体腺瘤的发病率已在几项研究中报道。在瑞典,无功能垂体腺瘤的发病率在1975年至1991年间从每10万人6例增加到每10万人11例,而在2002年至2011年间,在芬兰年的发病率为每10万人中20例,无功能垂体腺瘤的年发病率在1992年至2007年间为10 / 10万,而在研究期间意外发现的垂体肿块增加了3倍。因此,这些研究表明垂体功能减退的患病率在增加,可能是由于垂体病变患者越来越多地使用高分辨率成像和内分泌评估。
垂体功能减退的病因
垂体功能减退最常见的原因是良性垂体肿瘤及其治疗(表1)。这包括无功能垂体腺瘤、功能性垂体腺瘤和颅咽管瘤。其他需要确认的扩张性病变是非垂体肿瘤,如脑膜瘤、感染和非感染性垂体炎,有时很难与垂体肿瘤鉴别(表1)。此外,最近报道的免疫检查点抑制剂诱导的垂体炎患者越来越多。免疫检查点抑制剂是一种新兴的治疗多种癌症的方法,可引起垂体炎,在MRI上表现为垂体肿块和垂体功能减退。另一个扩展的领域是关于垂体功能低下的遗传原因的知识,这可能导致多种激素缺乏(GLI2, LHX3, LHX4, PROP1,和POU1F1)或孤立性垂体前叶激素缺乏(FGF8, HESX1, SOX2, SOX3, OTX2,和TBX19)。
表1 获得性垂体功能减退的病因

内分泌评估和替代治疗
对疑似垂体功能减退的患者的内分泌检查应该是整体的方法,通过评估由腺垂体前叶调控的所有内分泌轴(表2)。这意味着,需要考虑到一个轴的缺乏如何影响另一个轴的测试结果。两个众所周知的例子是,严重的甲状腺功能减退可以掩盖存在的肾上腺功能不全,以及无法替代的生长激素缺乏,可以掩盖存在的中枢性甲状腺功能减退。诊断激素缺乏症的临界值也是依赖于检测化验方法的,这需要加以考虑。
ACTH缺乏
诊断
继发性肾上腺机能不全(AI)在大约三分之一的垂体功能减退患者中可见。在垂体肿瘤患者中,ACTH缺乏的发生频率在17%到62%之间。ACTH缺乏症导致皮质醇和肾上腺雄激素分泌受损。醛固酮的分泌主要受肾素-血管紧张素-醛固酮系统(RAAS)的调控,较少受ACTH的调控。
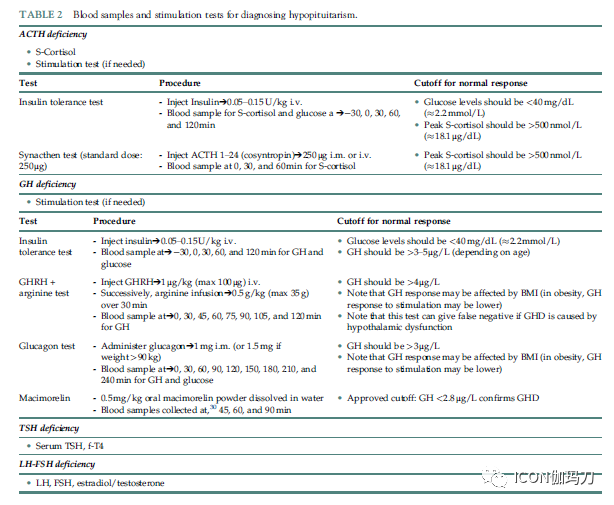
表2 诊断垂体功能减退的采血样本和兴奋试验。
继发性肾上腺机能不全(AI)的隐匿性起病具有非特异性的临床特征,包括疲劳、嗜睡、恶心、厌食、头晕和体重减轻(图1)。诊断时也可能出现低血糖症,尤其是儿童,和低钠血症。高钾血症在原发性肾上腺机能不全(AI)中很常见,但由于有完整的肾素-血管紧张素-醛固酮系统(RAAS),而不是继发性肾上腺机能不全(AI)的特征。ACTH缺乏症妇女常因肾上腺雄激素缺乏而导致阴部和腋窝毛发脱落。部分肾上腺机能不全(AI)患者可能无症状,症状只在并发疾病或应急事件中出现。
诊断继发性肾上腺机能不全(AI)需要仔细的临床检查和内分泌评估。上午8时-9时评估血清皮质醇浓度,应作为一线检测。皮质醇浓度<80nmol/L (≈3μg/dL)强烈表明ACTH缺乏,而在无应急情况下收集的样本中皮质醇浓度>400nmol/L (≈15μg/dL)排除了大多数患者继发性肾上腺机能不全(AI)的诊断。对于怀疑ACTH缺乏和皮质醇水平在80 - 400nmol/L之间的患者,经常需要进行兴奋试验来排除或确认诊断。
胰岛素耐受性试验(ITT)是测试下丘脑-垂体-肾上腺(HPA)轴完整性的金标准。该试验通过静脉注射0.05-0.15U/kg胰岛素,并在-30、0、30、60和120分钟时测量血清皮质醇(表2)来完成。胰岛素耐受性试验(ITT)的原理是诱导低血糖[葡萄糖<2.2mmol/L (≈40mg/dL)],类似受控制环境中的生理性应激。刺激的皮质醇水平<500nmol/L (≈18μg/dL)表示继发性肾上腺机能不全(表2)。胰岛素耐受性试验(ITT)有某些局限性,它需要医疗监督,它可能有与严重低血糖有关的副作用,在某些情况下,不能达到适当的低血糖。此外,有癫痫和缺血性心脏病患者也对ITT有禁忌。
高剂量短Synacthen(二十四肽促皮质素) (cosyntropin促皮质素)试验通常被用作ITT的替代方法。该试验通过测量0、30和/或60分钟时血清中的皮质醇浓度,评估肾上腺皮质对250μg促皮质素(cosyntropin)(肌肉注射或静脉注射)的反应能力。血清皮质醇>500nmol/L (≈18μg/dL)排除继发性肾上腺机能不全(AI)。然而,为达到诊断目的的临界值依赖于检测(表2)。Synacthen试验被广泛使用,耐受性良好。然而,对过敏和哮喘患者,建议谨慎使用,因为在极少数情况下已经有报道会有严重的过敏反应。重要的是要考虑到,如果继发性肾上腺机能不全(AI)最近起病(例如,垂体损伤后4-6周),Synacthen测试可能是不可靠的。事实上,继发性肾上腺机能不全(AI)是由于ACTH缺乏导致肾上腺皮质的进行性萎缩。肾上腺萎缩所需的时间因人而异。在此期间,Synacthen试验可以提供假阳性结果,因为肾上腺仍然能够对ACTH作出反应。有一些数据支持使用低剂量(1μg) Synacthen代替标准剂量250μg。然而,对低剂量试验的诊断价值仍存在争议,在获得更多数据之前,应使用标准剂量(250μg)试验。其他兴奋试验,但较少经过验证,包括美泰拉酮,胰高血糖素和促肾上腺皮质激素释放激素兴奋。
临床指南建议对所有诊断为垂体肿瘤的患者都应进行体格检查和实验室评估,以发现继发性肾上腺机能不全。对于接受垂体手术治疗的垂体瘤患者,术后应对HPA轴进行评估,以发现HPA轴的机能不全或恢复,且HPA轴可能在术后4 - 12周内恢复。
激素替代疗法
对于确诊的ACTH缺乏症患者,应立即开始糖皮质激素替代治疗(图2)。在欧洲,氢化可的松(HC)是最常用的糖皮质激素,其次是醋酸可的松(CA)。HC是具有生物活性的皮质醇,而CA需要在肝脏中通过酶11-β-羟基类固醇脱氢酶1 (11-β HSD1)将可的松转化为皮质醇来激活。据报道,健康成年人每天的皮质醇产量为15.5-19毫克。基于这些发现,目前推荐的肾上腺皮质机能减退患者的HC剂量为15-20mg,在一天的时间里分成2或3个剂量。CA的当量剂量是每天20-25mg。可以使用长效合成和更强有力的糖皮质激素,如地塞米松、泼尼松龙和泼尼松,但可能更容易导致糖皮质激素过度暴露,因此应限制在部分选定的患者。相对20mg 氢化可得松(HC)的等效剂量分别为泼尼松龙5mg和地塞米松0.75mg,但由于后者的半衰期较长,因此需要谨慎。
对于部分继发性肾上腺机能不全(AI)患者(即分泌ACTH的残留患者)是否应该采用低剂量的HC治疗,如每天5-10mg,或仅在与应急相关的情况下接受应急剂量治疗,仍存在争议。然而,剂量应根据临床症状、生化结果、临床症状和患者偏好进行个体化。在开始左旋甲状腺素替代治疗前,继发性肾上腺机能不全和合并存在的中枢性甲状腺功能减退患者应充分用皮质醇替代,因为这将增加皮质醇的代谢清除,并可能触发肾上腺危象。
皮质醇的分泌遵循一个昼夜节律,在清晨达到峰值,在一天中逐渐下降,在午夜达到谷值。因此,HC的最高剂量(如10mg)应在早晨醒来时给药,较低剂量(如5mg)应在12点 - 15点之间给药。当需要额外剂量时,白天晚些时候(但不迟于18点)使用每日三次的方案可与2.5 -5mg HC媲美,,以避免在深夜过度暴露于皮质醇,这与不良的代谢结果和睡眠障碍有关。
目前用HC或CA的常规口服制剂替代的方案无法模拟皮质醇的生理昼夜节律,导致反复出现高峰和低谷。此外,缺乏可靠的生物标志物来监测和优化糖皮质激素替代,使个体化糖皮质激素替代困难。这导致治疗过度和治疗不足(例如,在并发疾病或应急事件期间),可能分别导致库欣样临床特征或肾上腺危象。长期过度使用糖皮质激素治疗与不良代谢相关。特别的是,已经表明HC剂量每日>20- 25mg与较高的BMI、较大的腰围、不良的脂质情况和较差的生活质量相关。为了优化糖皮质激素的替代,新的制剂已经被开发出来。经欧洲批准的改良释放HC,包括一种每日一次的片剂,具有一种立即释放的外部涂层和一种延长释放的核心。这种配方已被证明提供了一个更生理性的皮质醇暴露,这似乎改善了心脏代谢结果。
患有SAI的女性也可能出现与雄激素不足相关的症状,包括性欲降低和健康受损。对于这些妇女,用脱氢表雄酮替代治疗(通常每天20-50mg)可能是有益的。
肾上腺危象
在继发性肾上腺机能不全(AI)的患者中,肾上腺危象是一种潜在的危及生命的事件,当皮质醇的可用性不足以满足临时增加的对皮质醇的需求时,例如,在中途并发疾病(intercurrent illness)期间或应急事件。肾上腺危象也可能是垂体衰竭的第一个表现,然后往往与严重的低钠血症相关,需要缓慢纠正,以避免渗透脱髓鞘综合征的发生。最近发现继发性肾上腺机能不全(AI)的肾上腺危象的发生率为3.6 (95% CI 3.1-4.1) / 100人-年。因严重感染而住院治疗的风险显著增加。肾上腺危象的临床特征包括严重嗜睡、腹痛、呕吐、发烧、意识混淆和低血压,并有低血容量性休克和死亡的危险。因此,及时识别和使用静脉氢化可的松(HC)的适当治疗以及盐水输注再水化(rehydration with saline infusion)是至关重要的(图3)。肾上腺危象的触发因素是中途并发的疾病(胃肠炎、其他感染、严重低血糖、严重过敏反应等)、受伤和教育程度低的患者的不依从性。为预防肾上腺危象,应仔细告知患者,在中途并发疾病或其他应急事件期间,HC剂量应增加一倍或三倍,并在需要时寻求医疗帮助。此外,所有继发性肾上腺机能不全的患者都应收到类固醇急诊卡(rehydration with saline infusion),上面有关于如何提供肾上腺危象治疗的简单说明。这种卡片目前在几个欧洲国家使用,一面用本国语言说明,另一面用英语说明。此外,所有患者都应该有一个自我肌注/皮下注射氢化可的松(HC)的应急包,以防口服HC无效。
TSH缺乏症
诊断
中枢性甲状腺功能减退的典型生化特征是血清游离甲状腺素浓度低,血清TSH浓度低。然而,游离甲状腺素在低-正常范围并不排除轻度或部分中枢性甲状腺功能减退。此外,并非所有患者TSH浓度都很低。事实上,许多患者的TSH浓度可能正常,甚至轻度升高。这些患者中可测量的TSH分子具有生物学活性,其半衰期比具有生物学活性的TSH更长,并且不能刺激甲状腺中的TSH受体产生和分泌甲状腺激素。然而,在大多数情况下,由于临床背景为垂体疾病患者和原发性甲状腺功能减退患者有TSH明显升高,因此很容易区分原发性甲状腺功能减退和中枢性甲状腺功能减退。
总三碘甲状腺原氨酸或游离三碘甲状腺原氨酸的测量在疑似中枢性甲状腺功能减退的患者的诊断检查中没有任何附加价值,TRH兴奋的动态检测也没有任何附加价值。
管理
中枢性甲状腺功能减退的标准治疗是口服左旋甲状腺素。根据病人的年龄和临床状态,建议左旋甲状腺素1.1 - 1.7μg /公斤/天的成人替代剂量(图2)。应根据临床判断适当调整剂量,和剂量滴定的目标应该是实现游离T4浓度在正常参考区间范围的中到上部。
建议对≧60岁的患者采用低剂量( 1.1-1.4μg /kg / d),建议对年轻患者采用高剂量( 1.4-1.7μg /kg / d)。与原发性甲状腺功能减退患者不同,中枢性甲状腺功能减退的患者不能使用TSH浓度来调整剂量。中枢性甲状腺功能减退用左旋甲状腺素替代治疗会导致TSH水平下降。因此,与原发性甲状腺功能减退患者不同,对TSH水平的抑制不应被认为是过度治疗的症象。
对于中枢性甲状腺功能减退的替代治疗的目标应该是患者的临床甲状腺功能正常,通常当游离甲状腺素浓度在参考范围的中上半部时获得治疗。治疗不足导致残留的甲状腺功能减退症状、疲劳、高BMI和腰围以及血脂异常,这些症状可随着左旋甲状腺素剂量的增加而改善。同时,由于骨质疏松和房颤的风险增加,应避免过度治疗。
由于缺乏关于有效性和安全性的数据,应避免使用其他甲状腺激素制剂,如L-T3和甲状腺提取物进行替代治疗。
促性腺激素缺乏和生育能力
促性腺激素性功能减退症是垂体腺和/或下丘脑各种结构障碍患者常见的并发症。原因可能是垂体促性腺激素分泌减少或下丘脑GnRH分泌减少。由高泌乳素血症(泌乳素瘤或垂体柄受压)或非结构性原因如放射治疗、高皮质醇血症、低体重和/或过度运动,引起的功能性促性腺激素性腺功能减退症也很常见,即使是对鞍区已知的结构病变的患者,也应总是进行鉴别诊断。
诊断
绝经前年纪的妇女的促性腺激素性功能减退症通常表现为继发性闭经和/或不孕症。低雌激素和正常或低LH和FSH浓度是其特有的生化特征。
所有绝经后的妇女雌激素低。下丘脑-垂体-性腺轴完整的妇女通常LH和FSH浓度显著增加,而促性腺激素性功能减退症的妇女出现低浓度或正常浓度。
男性促性腺激素性功能减退症的临床和生化特征是勃起功能障碍和性欲减退(Erectile dysfunction and decreased libido),同时伴有低睾酮和低或正常的LH和FSH。所有性腺功能减退的男性都不会因为自己的症状而寻求医疗帮助。事实上,在大多数患有垂体肿瘤的男性中,当垂体疾病本身得到诊断时,促性腺激素性功能减退往往是第一次被生物化学方法证实。
管理
未治疗的女性促性腺激素性腺功能减退症可能是解释垂体功能减退女性死亡率过高的一个重要因素。在许多研究中,未经治疗的促性腺激素性功能减退症妇女的死亡率是背景人群的两倍,而接受适当替代治疗的妇女有正常标准化死亡率。因此患有促性腺激素性功能减退的绝经前年龄的女性,如果子宫没有被手术切除,应该接受使用雌激素和孕激素的替代疗法(图2)。然而,治疗的目标是,不仅要防止过早死亡,也为了避免绝经后症状,提高生活质量,并保持骨密度。
绝经后妇女的性腺功能减退症不需要性激素的特定替代治疗。
男性促性腺激素性腺功能减退症的标准治疗是睾酮替代,最常见的是肌肉注射或经皮注射。除了提高性欲、勃起功能和康乐(well-being),睾酮替代还能增加肌肉质量和力量,减少脂肪含量,改善骨密度。接受睾酮替代治疗的垂体功能减退的男性并不增加患前列腺癌的风险。然而,所有年龄超过45岁的男性都应该测量前列腺特异性抗原,以排除未确诊的前列腺癌。目前的指南建议,对于患有前列腺癌或乳腺癌、前列腺特异性抗原水平高、睡眠呼吸暂停综合征未得到治疗、最近6个月有卒中或心肌梗死病史的男性,以及患有晚期心衰、血栓形成和血球压积增高的男性(in men with advanced heart failure, thrombophilia,and elevated hematocrit),不推荐睾酮治疗。对接受睾酮治疗的性腺功能减退的男性,继发性红细胞增多症(Secondary polycythemia)是一种常见的不良事件。因此,特别是对患有睡眠呼吸暂停综合征、慢性肺部疾病和吸烟等有其他合并危险因素的患者,应定期测量红细胞压积。如果出现红细胞增多症,应停止睾酮治疗,直到红细胞压积恢复正常,然后重新以较低剂量维持正常水平。特别是在治疗停药期间,患者经历严重的睾酮缺乏症状情况下,静脉切开术(Phlebotomy)是另一种有效的治疗选择。
生育能力
垂体功能减退的患者的生育能力大大降低。对于有垂体功能减退的女性,包括促性腺激素性功能减退的女性,可以使用人绒毛膜促性腺激素和重组人促卵泡激素或通过泵的GnRH给药来诱导排卵。对垂体功能低下的妇女进行辅助生殖治疗,可使生育率达到47%至76%,生命出生率(a life birth rate)达到61至100%。同样,对促性腺激素性功能减退症患者,无论用促性腺激素还是GnRH治疗,75%的患者能成功诱导精子发生(induces successful spermatogenesis),60%以上的患者能成功怀孕。治疗持续时间和成功率可能受到起病年龄、垂体功能减退持续时间和促性腺激素治疗开始时睾丸体积的影响。
其他激素缺乏也会影响生育能力。有趣的是,据报道,垂体功能低下的女性比孤立性促性腺激素性功能减退的女性有更低的生育率,可能是由于她们有多种垂体激素缺乏。
GH缺乏
儿童GHD缺乏症(GHD)的主要特征是生长速度减慢和身材矮小(reduced growth velocity and short stature)。成人GHD的临床特征不太明显。第一例报告的成人垂体前叶功能减退采用GH替代的作用,已经发表在20世纪60年代。然而,直到20世纪80年代重组人生长激素问世后,GHD在成人中的特征和替代作用才得到描述。
垂体肿瘤患者和接受下丘脑垂体区域放射治疗的患者对GHD的认识应该很高,因为GH经常是第一个受到影响的激素。GHD在成人的临床特征主要是非特异性的,即腹部肥胖、肌肉质量和细胞外水减少、肌力降低、骨密度降低、骨折风险增加、运动能力降低,GHD患者也有不良的心血管风险状况,脂质和糖代谢与代谢综合征患者相似。GHD患者有较高的心血管并发症发生率和死亡率。然而,如果这是由于GHD本身,或由于一般的垂体功能减退和其他缺乏症的次优替代疗法,还没有完全阐明。
诊断
成人GHD的诊断应该在患有垂体肿瘤或任何其他大体下丘脑-垂体疾病的受试者中作出。在适当的临床背景下进行。由于内源性GH以脉动的方式分泌,在白天很长一段时间内水平很低,需要兴奋试验来确诊。然而,临床指南一致认为,患有三种或三种以上垂体前叶激素缺乏、血清IGF-I浓度较低的垂体功能低下的成人,患GHD的可能性非常高,这些患者不需要进行兴奋试验来确诊。
多次兴奋试验已被用于诊断成人GHD。目前的建议是使用ITT、精氨酸生长激素释放激素(Arg-GHRH)试验或可乐定,即那些已在垂体功能减退的成人中得到充分验证的试验。这些测试具有不同的特定测试诊断临界值,这些临界值也受到用于测量GH的方法的影响。其他已被采用的测试,如精氨酸和多巴胺测试,没有那么可靠,而且在较大程度上受到肥胖的影响,增加了在肥胖但其他方面健康的成年人中错误诊断GHD的风险。最近,一种新的口服促生长激素分泌剂马西瑞林(macimorelin)已被研发为一种诊断GHD的试验,它可能简化和改善成人GHD的诊断程序。
管理
1989年发表的一项精心设计的关键研究表明,生长激素替代对伴有GHD的垂体功能减退患者有好处。此外,包括前瞻性随机研究在内的荟萃分析显示,生长激素替代增加了去脂体重(lean body mass)(肌肉质量),减少了全身体脂含量(total body fat mass)、低密度脂蛋白胆固醇、还有舒张压,这些作用可能是基于GH和IGF-I的作用机制,即由血管内皮中增加的一氧化氮合成介导的脂类分解、蛋白质合成代谢、肝脏LDL受体的上调和心脏后负荷的降低。在一些(但不是所有)研究中,生长激素替代也被证明可以改善与健康相关的生活质量和认知功能。
通过每天皮下注射重组人生长激素来替代生长激素缺乏。治疗起初是低剂量给药,接着是剂量滴定法指导下的血清IGF-I和临床反应(图2)。其目的是获得在正常范围内的血清IGF-I浓度,最好是正常范围上限内,不会导致剂量相关的副作用,例如由细胞外液量迅速增加引起的周围水肿、关节痛、肌肉僵硬。老年受试者的初始剂量应相对较低(0.2-0.3mg/天),而年轻受试者和使用口服雌激素替代的女性的初始剂量应较高(0.3-0.4mg/天)。生长激素替代的大部分效果可以在3 - 6个月内客观测量。
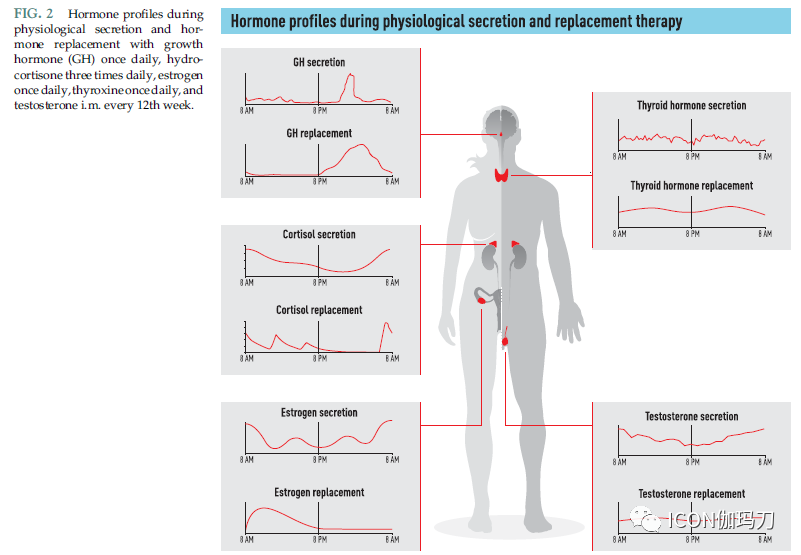
图2.生理分泌的激素情况和采用生长激素(GH)每日1次,氢化可的松每日3次,雌激素每日1次,甲状腺素每日1次,睾酮每12周注射一次的激素替代。
对于成人长期生长激素用药的安全性一直存在一些担忧。然而,目前的数据并不支持垂体肿瘤进展或复发风险的增加。也不会增加新发和复发性恶性肿瘤的风险。一些前瞻性研究表明,启动GH替代后,易感患者的2型糖尿病发病率增加,但其他研究尚未发现这一点。因此,指南指出,生长激素替代在垂体瘤残留患者或糖尿病患者中并无禁忌。然而,对于有发展为糖尿病风险的患者,应该仔细的剂量滴定并监测葡萄糖代谢。此外,成人体内生长激素替代的长期研究并未显示心血管事件风险增加。事实上,最近的研究表明,这一风险甚至可能比在GH替代之前进行的研究所报告的风险还要低。
激素-激素相互作用
垂体功能减退的患者经常需要用包括糖皮质激素、左旋甲状腺素、性激素和生长激素等多种激素替代。治疗医生应该意识到这些激素之间的一些相互作用。其中最著名的是对未确诊的肾上腺机能不全(AI)患者启动甲状腺素替代后诱发肾上腺危象。其他需要注意的临床重要的相互作用如下:(a)未经治疗的生长激素缺乏症(GHD)可能会掩盖存在的中枢性甲状腺功能减退,也就是说,在开始替代GH后,血清游离T4浓度的下降可能第一次变得明显。(b)生长激素替代的启动可能通过抑制11ßHSD1型酶诱导明显的肾上腺机能不全。(c)口服替代,而不是经皮替代,雌激素减弱(attenuates)生长激素替代的IGF-I反应。这意味着对于垂体功能减退的患者,在开始任何新的替代治疗前,应该了解垂体前叶总功能的当前状态,并通过治疗定期监测这些状态。
当前替代策略的局限性
虽然对潜在的肿瘤进行了仔细的治疗,对垂体功能减退进行了充分的诊断和治疗,但一些患者并没有恢复到以前的健康状态。许多因素可以解释这一现象,如生活负担与慢性终身障碍和下丘脑病变引起的肿瘤或其治疗。另一个合理的解释是目前可用的内分泌替代疗法不是生理性的。
事实上,所有替代疗法都是如此,但糖皮质激素和生长激素替代最明显。皮质醇以次昼夜的脉冲方式(ultradian pulses)分泌,并遵循一个昼夜节律的分泌模式(a circadian secretion pattern),清晨暴露量最高,午夜暴露量最低(highest exposure in the early morning and lowest exposure around midnight)(图3)。皮质醇分泌还受到压力、睡眠模式、进食和运动的影响,这很难用目前可用的氢化可的松(HC)口服配方模拟。生长激素以脉动的方式分泌,受禁食、进食、运动和睡眠的影响。每天睡前皮下注射产生夜间最大暴露量,这是生理上的,但只有一次单个脉冲会持续数小时。
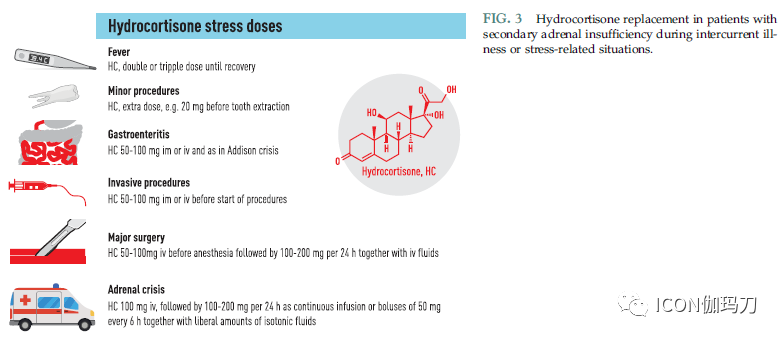
图3.氢化可的松替代在并发疾病或压力相关情况下出现继发性肾上腺功能不全的患者。
在促性腺激素性功能减退症( hypogonadotropic hypogonadism)中,中枢性甲状腺功能减退症和继发性肾上腺机能不全患者被靶器官产生的激素所替代,忽略了垂体激素除了产生刺激激素外,还有其他外周作用。尚未研究这对垂体功能减退患者的预后是否重要。
妊娠期间垂体功能减退
孕前应优化激素替代。此外,在怀孕前在临床或生物化学方面,应始终排除肾上腺功能不全。事实上,由于雌激素诱导产生皮质醇结合球蛋白,妊娠期间血清皮质醇显著增加。因此,患有肾上腺功能不全的孕妇的血清皮质醇浓度可在正常范围内,这使得肾上腺功能不全的诊断具有挑战性。
妊娠期间,应密切监测有垂体功能减退的妇女,并根据临床及生化状况调整替代治疗。由于尚未在随机试验中对治疗策略进行评估,关于如何在妊娠期间优化替代治疗的数据有限。氢化可的松应该是首选的糖皮质激素替代疗法,因为它在胎盘中被11-羟基类固醇2型脱氢酶(11-hydroxysteroid dehydrogenase type 2 in the placenta)灭活(in activated)。相反,应该避免使用塞米松,因为它不是灭活的。由于没有可获得的能个体化进行糖皮质激素替代治疗的生物标志物,应根据临床判断对糖皮质激素剂量进行调整。特别是对于使用接近生理剂量的糖皮质激素剂量的女性,在妊娠晚期可能需要较高剂量的氢化可的松(HC)。在分娩过程中,应给予应激剂量的氢化可的松(图3)。
甲状腺功能减退的孕妇通常需要增加L(左旋) -甲状腺素的剂量。对于原发性甲状腺功能减退的女性,建议在怀孕初期增加20% - 50%的L -甲状腺素剂量。由于胎盘人类绒毛膜促性腺激素(hCG)对甲状腺的兴奋作用,患有中枢性垂体功能低下的女性可能有生理性甲状腺激素的增加,目前尚未提出标准剂量的调整。事实上,人绒毛膜促性腺激素(hCG)在结构上与TSH相似,并可能与TSH受体结合,导致甲状腺激素的增加。根据现行指南,妊娠期间每4-6周监测游离T4浓度,并调整L -甲状腺素剂量,使游离(f)-T4浓度维持在正常范围的上部。
对于有垂体功能减退的孕妇是否应该停止GH替代是有争议的。目前的指南建议在确认妊娠后停止GH替代,因为关于其在妊娠中的安全性的数据有限。然而,在一些中心,生长激素替代在妊娠早期得到维持,然后在妊娠中期逐渐减少,大约在孕20周停止,这是一种模拟胎盘生长激素产生的方案。在一项大型前瞻性研究中,包括5092名妇女,总计173名孕妇,超过四分之一的患者在整个妊娠期间继续使用GH替代,对妊娠并发症和/或婴儿安全出生(live births)没有任何影响。因此,现有资料表明,GH替代,不管替代方案如何,都不会影响妊娠结局。
总结
垂体功能减退是由一种或多种垂体前叶激素缺乏引起的,最常见的原因是垂体腺瘤或对垂体肿的外科治疗和放射治疗。在大多数患者中,垂体功能减退的临床特征是隐匿性发展的。然而,也可能发生急性起病,这是一种危及生命的情况,有很高的死亡风险,主要由于急性肾上腺功能不全。
对于垂体腺瘤患者或接受垂体手术或放疗的患者,应定期评估垂体功能。垂体功能减退的诊断基于内分泌检查,包括临床检查、基线采血和必要时的刺激兴奋试验。替代治疗包括糖皮质激素、甲状腺素、性激素和生长激素。当确诊激素缺乏时,应根据临床判断和生化结果,及时开始替代治疗并进行个体化治疗。治疗医生应该意识到激素之间的相互作用,在诊断检查和替代治疗期间。垂体功能低下患者的死亡率和并发症发生率增加,这可能与激素替代不足或替代过度以及潜在的条件有关。因此,终生监测和治疗应掌握在致力于垂体疾病的团队手中,以改善垂体功能减退患者的结局。
要点
垂体功能减退是由于缺乏一种或多种垂体前叶激素,最常见的原因是垂体腺瘤。
垂体功能减退的临床特征通常是隐匿性的。
由于其潜在原因和肾上腺功能不全,可发生急性起病的垂体功能减退,且常危及生命。
当确诊激素缺乏时,应根据临床判断和生化结果,及时开始替代治疗并进行个体化治疗。
垂体功能减退患者的死亡率和罹病率增加。
终身监测和治疗应掌握在致力于垂体疾病的团队手中,以改善结果。




