
胶质母细胞瘤(GBM)是中枢神经系统最常见且恶性程度最高的原发性肿瘤。其生长非常迅速,预后极差,近三十年来GBM患者的临床结果几乎没有改善。由于GBM呈浸润式生长,没有包膜,因此,手术难以根治。目前的治疗以放射疗法和化学疗法为主,通过伤害正常增殖细胞来靶向增殖的肿瘤细胞,并诱导非常强的毒副作用。当前GBM治疗的重难点主要包括肿瘤放化疗抵抗、肿瘤转移和复发。有研究表明,肿瘤中处于相对静止状态的肿瘤干细胞(CSCs)可能是导致这些发生的主要原因。CSCs是在许多恶性肿瘤中鉴定出的侵袭性肿瘤细胞群,具有自我更新,治疗抗性和驱动肿瘤进展的高能力。因此,研究这些拥有干细胞特性且具有成瘤功能并驱动其进展的CSCs的生物学特性,探究它们所依赖的分子和细胞机制,可为靶向CSCs治疗GBM提供新的治疗方案。
细胞能量代谢重编程是肿瘤的一个重要标志。CSCs具有不同于肿瘤细胞和正常体细胞增殖的线粒体代谢。尽管增殖性肿瘤细胞依赖于有氧糖酵解来获得能量(称为Warburg效应),但缓慢循环的CSCs可能更倾向于以线粒体呼吸作为能量的主要来源。氧化磷酸化(OXPHOS)在细胞供能中起重要作用。其电子传递链包含四个复合物(I至IV),它们将来自TCA循环和脂肪酸氧化产生的电子(供体)转移至氧。复合物I至IV将质子泵入线粒体膜间隙,从而提高线粒体内膜内的pH并形成电势差。复合物V(F0F1 ATP合成酶)使用质子梯度中存储的能量来产生ATP。研究发现,靶向电子传递链复合物Ⅰ如metformin,IACS-010759等可抑制肿瘤增殖并促进其凋亡。
2019年3月6日,美国纪念斯隆凯特琳癌症中心Luis F. Parada团队在《Nature》发表题为“Gboxin is an oxidative phosphorylation inhibitor that targets glioblastoma”的研究论文。


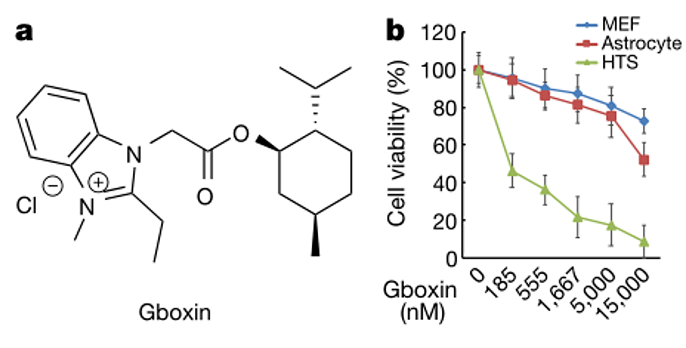
Gboxin特异性杀死HTS细胞
课题组通过使用原代胶质瘤细胞利用高通量筛选20万种化合物,筛选出了17种特异性杀伤脑胶质瘤细胞的化合物,并对其中一个化合物-Gboxin进行了深入分析,发现小分子化合物Gboxin可特异性地抑制原代神经胶质瘤母细胞生长。
作者利用高通量筛选能够抑制具有成球能力的原代GBM干细胞样细胞(HTS 细胞)生长的小分子化合物,在初筛得到的几千个能有效杀死HTS 细胞的小分子中,去除对野生型增殖细胞(MEF/Astrocyte)亦有杀伤能力的小分子,再经过一系列筛选,最终得到了3个小分子化合物, 其中包括Gboxin。Gboxin可借助其正电荷在GBM线粒体内蓄积,依赖线粒体内膜质子梯度阻断OXPHOS中F0F1 ATP合成酶从而特异性地杀死HTS细胞,而野生型增殖细胞可通过打开线粒体通透通道(mPTP)维持较低的线粒体内膜电势差来逃脱Gboxin对OXPHOS的抑制。而mPTP在HTS细胞中是不活跃的,Gboxin可迅速、持续且不可逆转地损害GBM中的氧消耗,最终导致HTS细胞的凋亡。同时研究发现代谢稳定的Gboxin衍生物可有效抑制小鼠GBM的生长,且未出现明显的毒性作用,表明Gboxin类药物具有较高的安全性。此外,作者在多种不同类型的人源性肿瘤细胞中发现线粒体mPTP处于不活跃状态,且与野生型MEF和Astrocyte相比,大多数肿瘤细胞对Gboxin敏感,表明Gboxin类药物的作用可能不局限于GBM。
总而言之,抗肿瘤药物的开发并不一定要针对肿瘤细胞特异性突变,或者和DNA互作的蛋白。那些让肿瘤细胞高度依赖,或者更加脆弱的通路也很可能是很好的靶点,如靶向肿瘤细胞线粒体内膜质子梯度及非活跃的mPTP具有良好治疗前景。

组稿:施裕丰教授-同济大学
编译:Alice-复旦大学
审校:杨辉教授-复旦大学
1
1

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。







