美国德克萨斯大学休斯顿健康科学中心麦戈文医学院病理和检验系的Antonio Dono等研究胶质瘤注册机构和cBioPortal数据库(https://www.cbioportal.org/)中BRAF突变型胶质瘤的其它基因改变;结果发表于2020年9月《Journal of Neuro-Oncology》杂志。
——摘自文章章节
【Ref: Dono A, et al. J Neurooncol. 2020 Sep;149(3):463-472. doi: 10.1007/s11060-020-03634-1. Epub 2020 Oct 3.】
最近,神经肿瘤专家建议将BRAF V600E突变而无CDKN2A/B缺失的IDH野生型(IDH-wt)胶质瘤定义为“BRAF V600E突变型弥漫性胶质瘤”。但是,BRAF突变合并其它基因改变的胶质瘤含义尚不明确。美国德克萨斯大学休斯顿健康科学中心麦戈文医学院病理和检验系的Antonio Dono等研究胶质瘤注册机构和cBioPortal数据库(https://www.cbioportal.org/)中BRAF突变型胶质瘤的其它基因改变;结果发表于2020年9月《Journal of Neuro-Oncology》杂志。研究者分析其所在医学中心2010年至2017年期间372例胶质瘤中的315例肿瘤相关基因的二代测序结果。同时,分析cBioPortal数据库内具有基因突变和拷贝数改变的IDH-wt胶质瘤,进一步阐明BRAF突变型胶质瘤的特点。
在医学中心的372例患者,年龄2-87岁,平均为57岁;男性219例(58.9%)。372例肿瘤组织学诊断:GBM IDH-wt(249/372例,66.9%);GBM IDH-mut(24/372例,6.5%);少突胶质细胞瘤(OD)IDH-mut和1p/19q共缺失(22/372例,5.9%);间变性星形细胞瘤(AA)IDH-mut(16/372例,4.3%);弥漫性星形细胞瘤(DA)IDH-mut(15/372例,4.0%);AAIDH-wt(13/372例,3.5%);间变性少突胶质细胞瘤(AO)IDH-mut和1p/19q共缺失(12/372例,3.2%);DA IDH-wt(9/372例,2.4%);毛细胞星形细胞瘤(PA)(6/372例,1.6%);多形性星形细胞瘤(PXA)(3/372例,0.8%);上皮样GBM(E-GBM)(2/372例,0.6%)和室管膜下巨细胞型星形细胞瘤(1/372例,0.3%)。
BRAF突变型胶质瘤(17/372例,4.6%)包括DA IDH-wt(1/9例,11.1%);GBM IDH-wt(8/249例,3.2%);E-GBM(2/2例,100%);AO(1/12例,8.3%);PA(3/6例,50%)和PXA(2/3例,66.7%)。17例BRAF突变型胶质瘤中,8例女性,9例男性;中位年龄为50岁(2-83岁)。诊断时中位年龄:GBM IDH-wt为51.5岁(23-71岁);E-GBM为23.5岁(23-24岁);PXA为24岁(21-27岁);PA为15岁(2-26岁)。癫痫发作5/17(29.4%)。大多数病灶位于颞叶(9/17例,53%);其中,GBM IDH-wt(4/8例),E-GBM(1/2例),PXA(2/2例),DA IDH-wt(1/1例)和PA(2/3例)(图1、2)。
BRAF突变型GBM IDH-wt患者的中位OS为12.8个月;死亡7例(87.5%)。PA、PXA和E-GBM的患者均存活,平均OS分别为52.4个月、145.6个月和12.1个月。BRAF突变型DA IDH-wt和AO患者的OS分别为16.1和22.7个月。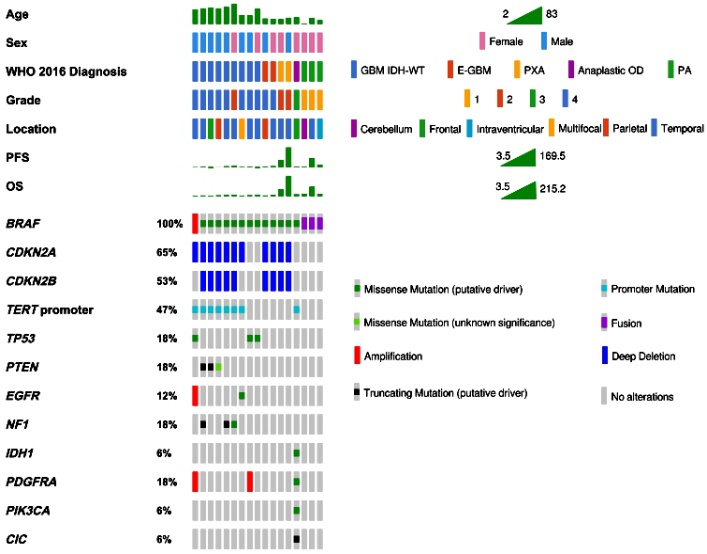
图1. 17例BRAF突变型胶质瘤患者的肿瘤相关基因突变。BRAF突变型GBM常见TERTp、CDKN2A/B、PTEN和/或TP53突变。E-GBM和PXA在诊断时基因突变和年龄相似。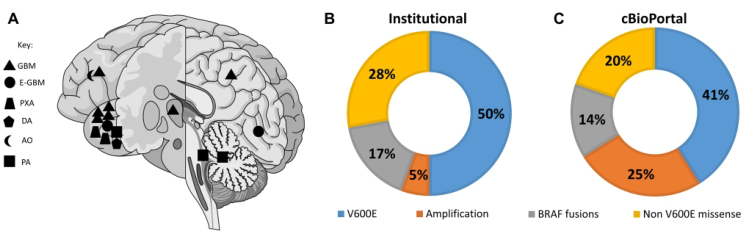
图2. A.17例患者BRAF突变型胶质瘤的位置,52%(9/17例)位于颞叶。1例位于中线部位(丘脑),1例累及额叶和脑干。B.医疗中心数据库的BRAF突变型胶质瘤中,53%的患者有V600E突变。C.cBioPortal数据库的BRAF突变型胶质瘤中,44%的患者有V600E突变。其它突变包括BRAF扩增、非V600E错义突变、缺失和KLH7-BRAF融合。
BRAF突变型胶质瘤合并其它基因突变,包括BRAF p.V600E突变(9/17例,53%);非p.V600E突变(9/17例,53%),其中1例同时出现两种BRAF突变,即p.V600E和非V600E突变。其它还有突变,包括PAM中BRAF-KIAA1549融合,GBM IDH-wt中BRAF p.K483E、p.D594N和p.N5811扩增,以及DA IDH-wt中BRAF p.L597Q扩增。
BRAF突变型胶质瘤除BRAF突变外,可见TP53、TERTp、CDKN2A/B和PTEN突变。8例BRAF突变型GBM IDH-wt患者5例出现PTEN突变,6例CDKN2A/B和6例TERTp突变。而E-GBM和PXA均显示CDKN2A/B缺失和BRAF p.V600E突变,而无TERTp、TP53和PTEN突变。此外,2例患者(1例E-GBM和1例PXA)发生MTAP突变。
研究者分析cBioPortal数据库数据,发现BRAF突变型胶质瘤82例,占3.8%;55例资料完整,纳入该研究。55例中,p.V600E突变为23例(41%),基因扩增14例(25%),非p.V60E突变11例(20%)和基因融合8例(14%),包括KLHL7-BRAF、BRAF-TPR、BRAF-ATF7、FAM131B-BRAF、BRAF-UBE2H、BRAF-KIAA1549融合基因。cBioPortal数据库中,BRAF突变型胶质瘤最常合并的其它突变是CDKN2A/B、TERTp、TP53、PTEN、TP53、IDH1/IDH2和ATRX。BRAF扩增是IDH-mut星形细胞瘤中最常见的BRAF突变(7/11例,63.7%),而在PA则表现为BRAF融合(BRAF-KIAA1549或FAM131B-BRAF)。
该研究中只有2例患者(病例7和12)接受BRAF抑制剂(cobimetinib和vemurafenib)靶向治疗。病例7,63岁女性,诊断为浸润性BRAF突变型(p.N581I-BRAF 3类突变)和TP53突变型(p.L257Q)GBM IDH-wt胶质瘤。经多次治疗后,患者MRI显示,肿瘤进展加快(图3)。给予cobimetinib(MEK抑制剂),6周后MRI显示与肿瘤相关的强化和水肿明显减少。开始cobimetinib治疗后的5个月死亡。病例12是21岁女性,诊断为BRAF突变型(p.V600E)和CDKN2A/B突变型Ⅱ级PXA。经多次治疗后,患者MRI显示肿瘤进展(图3)。随后,给予cobimetinib和vemurafenib治疗(MEK和BRAF抑制剂)。cobimetinib和vemurafenib治疗10周后MRI显示疗效明显。目前距上次复发已有10个月,患者仍存活并继续接受cobimetinib和vemurafenib治疗,而肿瘤无进展。
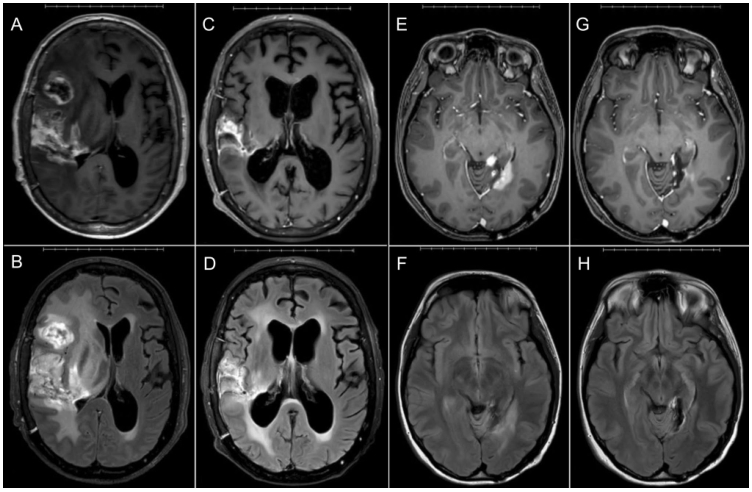
图3. BRAF p.N581I突变型GBM患者(病例7)在cobimetinib治疗前(A、B)和治疗6周后(C、D)MRI T1增强和T2 Flair序列图像。BRAF p.V600E突变型PXA患者(病例12)在cobimetinib和vemurafenib治疗前(E、F)和治疗10周后(G、H)MRI T1+C和T2 Flair图像。
该研究结果表明BRAF突变型胶质瘤常出现TP53、TERTp、CDKN2A/B和PTEN等突变,并对BRAF抑制剂或MEK抑制剂反应良好。通过检测BRAF突变型合并其它基因突变可进一步明确诊断胶质瘤亚型,例如PXA、E-GBM和“BRAF突变型GBM IDH-wt”,有助于预测胶质瘤患者的预后和确定治疗方案。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。










