腰酸背痛,
来点干扰素?
接到BOSS下达的供稿任务,笔者陷入了沉思之中,然而绞尽脑汁却寻不得一个好的idea。于是乎,决定听歌放松放松心情,来个头脑风暴。
带上耳机,打开播放器,悠扬的旋律响起,不由让人闭上眼睛开始沉睡。嗯,沉睡?醒醒,说好的头脑风暴呢?哎,不管了,睡了再说。

正在笔者昏昏欲睡之际,一个沧桑而高亢的男声在耳边炸响:我痛…哦哦哦哦哦…瞬间把笔者的意识拉回了电脑屏幕。此时,屏幕上显示的正是脑海Yeah上一期文章:外围嗅觉编码中受体的广泛调制。此情此景,笔者灵机一动,不禁感慨自己真是个平平无奇的小天才。既然上期关注了嗅觉的调制,这次为什么不写一写痛觉的感受和调控呢?
说干就干,笔者先来简单介绍下痛觉感受的相关知识。
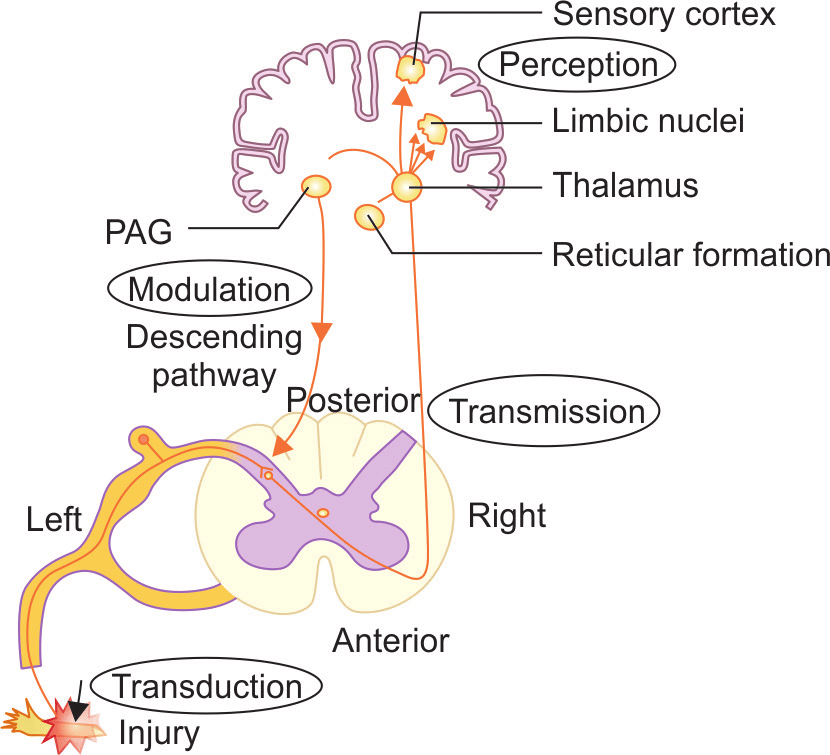
The afferent pain pathway
我们都知道,经典的反射弧由感受器、传入神经、中枢神经、传出神经和效应器组成,疼痛也是如此。其中,机体感知痛觉的神经元属于伤害感受器(nociceptors),这类神经元主要位于背根神经节(dorsal root ganglia, DRG)和三叉神经节(trigeminal ganglia, TG),其外周神经末梢广泛分布于全身组织,包括皮肤、骨膜、血管壁、关节、内脏器官等结构。根据解剖学结构和功能,痛觉相关神经纤维可分为Aδ纤维和C纤维两大类,其中Aδ有髓鞘包裹,接受刺激后产生第一痛觉诱发电位,其疼痛特点为感觉清晰、尖锐、定位明确、迅速发生、迅速消失;而C纤维无髓鞘包裹,产生第二痛觉诱发电位,表现为疼痛的感觉相对缓慢形成,定位不明确,呈烧灼痛,持续时间较久(图1)。两种纤维传导的电信号都会传入脊髓或三叉神经脊束核,并上行至丘脑,最终投射到大脑皮层感觉区形成痛觉。伤害感受器作为痛觉感受的一级神经元,负责将各种刺激信号转化为电信号,是痛觉感受的起点,也是今天的主角。
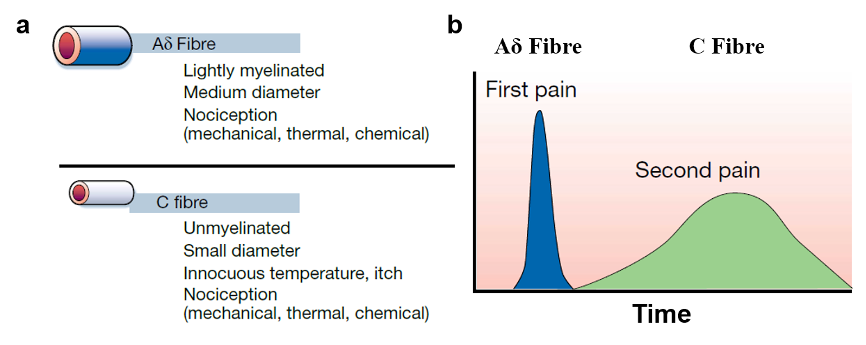
图1:Aδ纤维和C纤维及其感受疼痛特点
伤害感受器
大家好,我是今天的主角。
大家好,我也是今天的主角。
STING
2021年1月份,杜克大学的纪如荣实验室在Nature上发表了一篇题为“STING controls nociception via type I interferon signaling in sensory neurons”的研究型文章,发现STING可以通过外周感觉神经元的Ⅰ型干扰素信号通路感知和调节疼痛。STING是细胞中的固有免疫调节因子,在内源和外源DNA感知通路中有关键作用。
首先,作者提出,很多炎症和免疫反应过程中都伴随着慢性疼痛,STING作为固有免疫的调节因子,其mRNA在伤害感受器中表达也很高,那么STING是否直接参与了痛觉感受的调控呢?
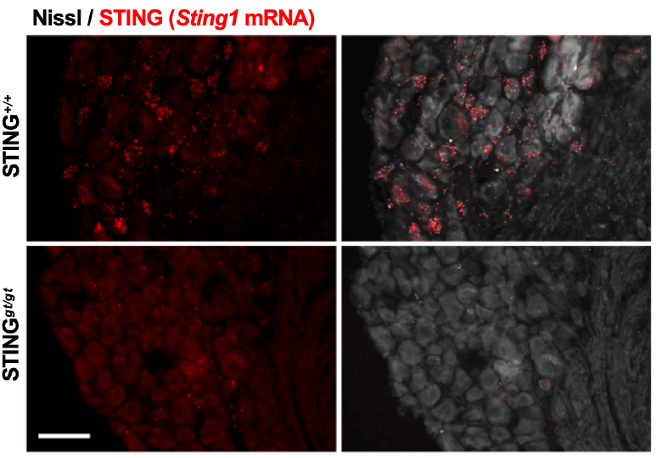
图2:STING mRNA在DRG感觉神经元中高表达
伤害感受器
编号Q3TBT3,你不在自己岗位呆着,跑我这作甚?
报告Sir,不知道,上头没告诉我有啥任务。
STING
(UniProt ID
Q3TBT3)
伤害感受器
编号Q3TBT3,上头来命令了,让你立刻激活,你去工作吧。
Yes Sir!
STING
于是,作者在小鼠的脊柱内直接注射STING的激动剂,发现激活STING可以提高小鼠感知疼痛的阈值。这种抑制疼痛感知的现象不仅存在于生理情况下,在多种病理情况下也存在,包括骨肿瘤导致的疼痛和神经病理性疼痛。与传统的阿片类、NSAIDS或局麻药等镇痛药物相比,STING激动剂的镇痛作用要更加持久,并且无明显的副作用。
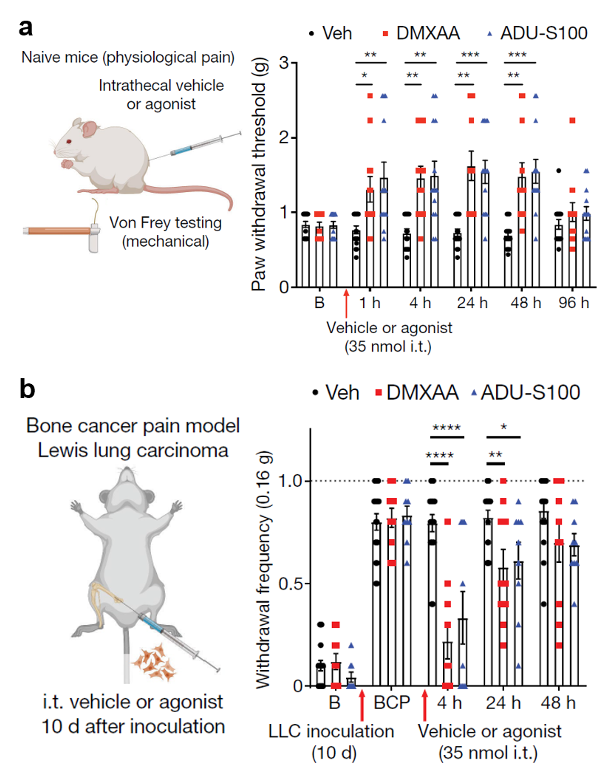
图3:脊髓内注射两种STING激动剂可以在:a)正常小鼠 b)骨肿瘤疼痛小鼠模型中长时程镇痛

STING
报告Sir,我发现我可以提高您的兴奋阈值,达到镇痛的效果。
编号Q3TBT3,你小子还挺有用,怎么做到的?
伤害感受器

STING
报告Sir,我的下线是Ⅰ型干扰素两兄弟,应该是他们的功劳。
接下来,作者分析了激活STING镇痛的机制。STING在细胞中最为重要的功能是启动Ⅰ型干扰素IFN-α和IFN-β的表达。作者发现,注射了激动剂的小鼠,其血清和DRG中的IFN-α水平明显上升,而在STING缺陷鼠中则没有类似现象。此外,几乎在背根神经节的所有感觉神经元中都表达Ⅰ型干扰素受体Ifnar1。(图4)
伤害感受器
编号Q3TBT3,你是说编号P01572和编号P01575吗,把他们喊过来,我有话要问。
Yes Sir!
STING
伤害感受器
编号P01572和编号P01575,你们刚刚做了什么?
报告Sir, 我们通过抑制Na+动作电位发放和钙电流,使您处于静息状态,不被疼痛信号激活。
IFN-Is
伤害感受器
原来如此,我说今天怎么这么舒坦,你们辛苦了,下去吧。
Yes Sir!
IFN-Is
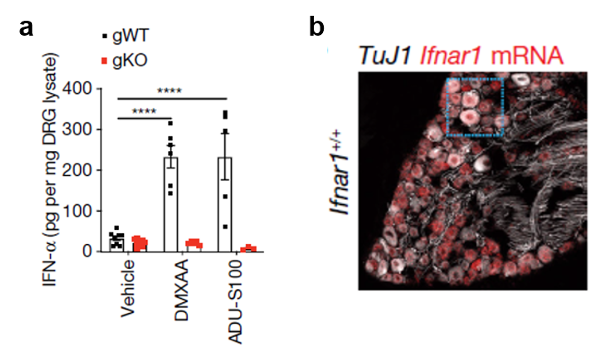
图4:a) STING激动剂DMXAA和ADU-S100增加DRG中IFN-α水平;b) IFN-Is的受体Ifnar1在感觉神经元中表达
随后,作者探究了Ⅰ型干扰素对痛觉感知的调控。作者发现IFN-Is可以直接减弱伤害感受器的Na+动作电位和钙电流来抑制神经元的兴奋性,最终实现镇痛。(图5)
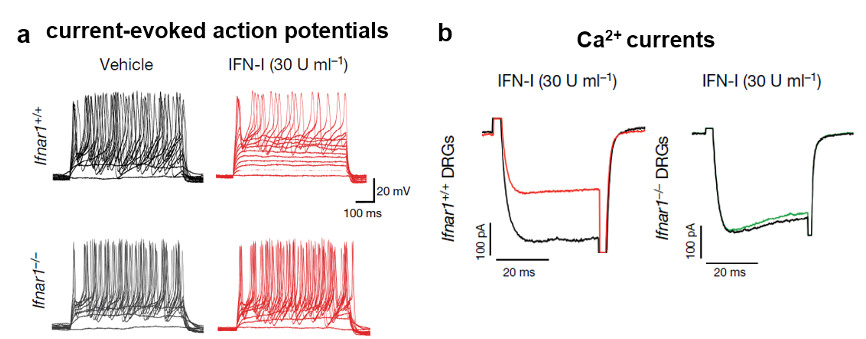
图5: IFN-I抑制小鼠DRG神经元的动作电位的发放(a)和钙电流(b)
不管黑猫白猫,能抓老鼠的就是好猫。所以评价一项研究优劣最有效的方式,自然是它的转化价值啦。

那么,这项研究的转化价值如何?为此,作者采用非人灵长类动物猕猴开展了研究,发现STING的激动剂ADU-S100对猕猴也有镇痛效果,并且所需剂量远低于小鼠。此外,作者直接用Ⅰ型干扰素作用于猕猴的伤害感受器,也可以达到镇痛的效果。最终,作者利用体外培养的人背根神经元测试了Ⅰ型干扰素的作用,并得到和动物模型中一致的结果。(图6)
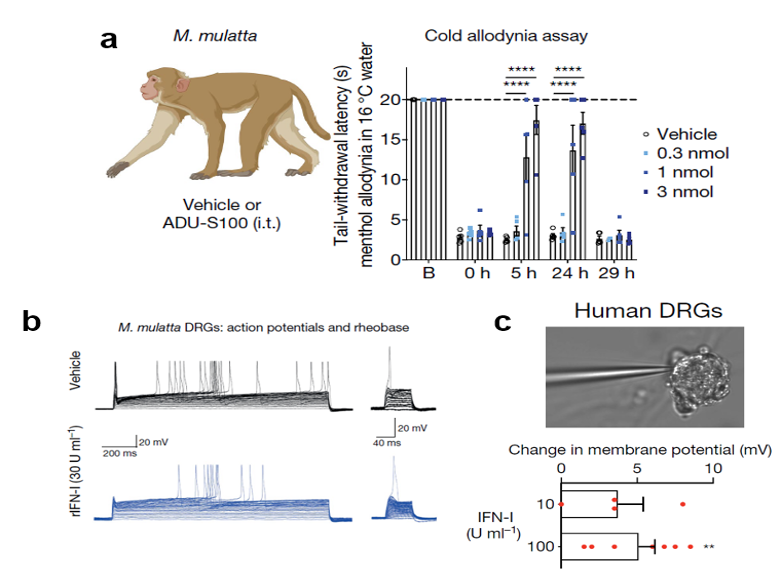
图6:a) 脊髓注射ADU-S100显著提高猕猴的疼痛阈值;b) IFN-I 抑制猕猴背根神经元的动作电位发放;c) IFN-I 诱导人背根神经元膜电位的超极化
嗯,看来这是只好猫。

综上,该研究揭示了伤害感受器中STING/IFN-I信号通路的镇痛作用,以及它对痛觉感受神经元信号的调控机制。这也让笔者脑洞大开,且不论STING激动剂目前在肿瘤免疫治疗领域中的研究热潮,干扰素作为内源信号分子,已经用于多种疾病的临床治疗,其安全性拥有良好的保证。所以,这是否意味着干扰素可作为一种止痛药用于慢性疼痛的治疗,尤其是在肿瘤放化疗和病毒感染导致的疼痛过程中,干扰素更是有一箭双雕的作用。
本期小彩蛋:
各位知道笔者在听的是哪首歌吗?欢迎转发并给出答案哟~

原文链接:
https://www.nature.com/articles/s41586-020-03151-1
参考文献
[1] Julius, D. & Basbaum, A. I. Molecular mechanisms of nociception. Nature 413, 203–210 (2001).
[2] Donnelly, C. R., Chen, O. & Ji, R. R. How do sensory neurons sense danger signals? Trends Neurosci. 43, 822–838 (2020).
[3] Woo, S. R. et al. STING-dependent cytosolic DNA sensing mediates innate immune recognition of immunogenic tumors. Immunity 41, 830–842 (2014).
文稿 | 孙仁强
插图、排版 | 吕莹莹