美国阿拉巴马大学细胞,发育和综合生物学系的Nathaniel H. Boyd等总结缺氧和酸性应激对GSCs信号通路和生物表型的影响,以及抑制该通路的方法;结果发表于2021年1月《Theranostics》在线。
——摘自文章章节
【Ref: Boyd NH, et al. Theranostics. 2021 Jan 1;11(2):665-683. doi: 10.7150/thno.41692. eCollection 2021.】
肿瘤微环境对癌细胞的无限制生长、增殖和肿瘤进展起重要的作用。肿瘤微环境的缺氧和酸性应激都是胶质母细胞瘤微环境的核心特征,可调节血管生成和治疗耐药。胶质瘤干细胞(GSCs)是肿瘤生长、血管生成和治疗耐药的关键因素。研究肿瘤微环境与GSCs的相互作用对于寻找更好的胶质母细胞瘤治疗方案至关重要。美国阿拉巴马大学细胞,发育和综合生物学系的Nathaniel H. Boyd等总结缺氧和酸性应激对GSCs信号通路和生物表型的影响,以及抑制该通路的方法;结果发表于2021年1月《Theranostics》在线。
胶质瘤干细胞是胶质瘤细胞中的有无限增殖能力细胞,具有自我更新、多向分化、侵袭性、血管生成及产生治疗耐药的作用。GBM肿瘤内部存在多种亚型,GSCs细胞可诱导GBM细胞对放化疗产生抵抗作用。GSCs在其生态位(niche)内通过复杂的相互作用帮助建立肿瘤微环境,比如血管周围生态位和坏死周围生态位,而肿瘤微环境的改变则会激发GSCs细胞的特性,提高癌症复发率,表明肿瘤微环境与细胞分化状态之间存在联系,因此开发靶向GSCs的治疗药物是重要的途径(图1)。
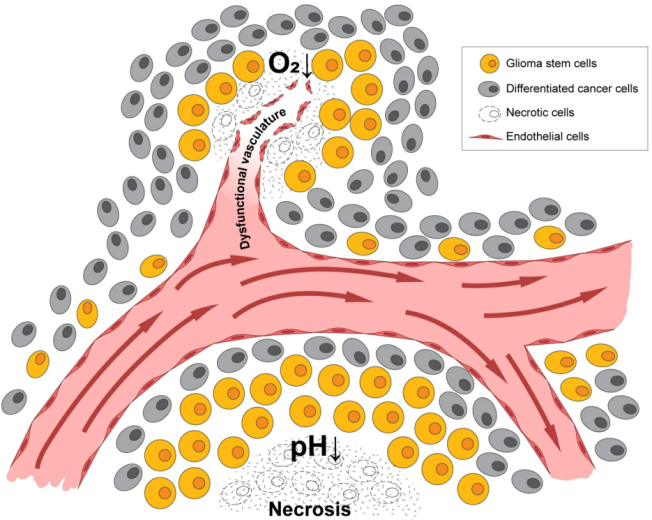
图1. 脑瘤起始细胞的微环境存在缺氧和酸性应激。通常在坏死区表达,也可在脑肿瘤中单独发现,独立影响肿瘤生物学和基因表达模式。
GBM的病理学标志是肿瘤细胞位于破坏的血管周围,呈假性栅栏样,在缺氧和酸性应激的细胞包围中生存。在GBM患者和GBM小鼠模型中,发现肿瘤通常有低氧分压及PH值下降现象。研究表明,缺氧的存在促进细胞通过无氧糖酵解产生能量和产生细胞生长所需的前体,包括核酸、氨基酸和脂质。无氧糖酵解结果生成酸性代谢物,如乳酸,改变微环境的酸碱平衡。所以缺氧或低pH值对肿瘤耐药性、肿瘤侵袭和患者生存有较大影响。了解肿瘤微环境对GBM生长和复发的作用是至关重要的。
研究表明,缺氧可以激活相关靶基因的表达、促进GSCs的生长,同时缺氧促使GSCs内缺氧诱导因子HIF1α和HIF2α发生改变,对GSCs的生长有不同的表达;在缺氧的环境中HIF1α可促使GSCs自我更新,抑制分化,促进胶质母细胞的生长。缺氧导致hf2α的表达,上调干细胞得相关基因,而抑制hf2α则降低体外GSCs的自我更新能力,降低体内肿瘤的生长。缺氧和HIF通过多种机制在维持GSCs表型发挥重要作用。
GBM的PH值改变对于肿瘤细胞的生长有重要影响,将GBM细胞暴露在酸性应激下增加GSCs标记物的表达以及自我更新和肿瘤进展,同时酸中毒也与缺氧起协同作用。临床上已有相关研究证实,改变肿瘤周围的酸性环境,抑制肿瘤生长,为胶质瘤的治疗提供新的方法。
GBM细胞增殖首先需要脑部现有血管的支持,这过程称为“血管增选过程”。随着肿瘤迅速生长,颅内血流供血不足造成进一步的缺氧。研究表明,与非GSCs形成的肿瘤相比,GSCs源性肿瘤的血管密度和血液灌注增加。GSCs可通过HIF1α和HIF2α对VEGF进行调控,从而诱导肿瘤血管的生成。
缺氧环境中的CSCs型GBM更具有侵袭性和转移能力。缺氧是GSCs在上皮细胞向间充质转化过程中的重要调节因子,常导致肿瘤细胞大量迁移和侵袭,最终肿瘤复发。研究表明,GSC侵袭和迁移与缺氧、间充质表型和细胞外基质之间存在重要联系。与此同时,缺氧和酸性环境也可使GSCs诱导GBM的相关靶基因突变,抑制机体的免疫系统;促使GBM对于放化疗不敏感以及调节神经干细胞的增殖和分化。
作者指出,由于血脑屏障的存在,药物治疗GBM的效果不理想。缺氧和酸性环境是GBM实体肿瘤常见的微环境应激因素,更重要的是在该微环境中表现为GCSs生态位。因此认为,可通过改变肿瘤细胞周围微环境调控GSCs的表达,改善GBM的预后。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。





