
患儿女,3岁3月,间断性恶心、呕吐、头痛1月入院,门诊给予CT检查,诊断:左侧额叶占位伴出血,遂收入神经外科。入院查体:神志清,精神反应欠佳,呼吸平稳,头颅外形无明显异常,瞳孔等大等圆,对光反射存在,四肢肌力肌张力可,自主活动良好,无明显受限,双侧膝反射存在,双侧巴氏征(-),入院后给予地塞米松等减轻水肿等治疗,完善肿瘤标志物,颅脑MRI等相关检查,完善术前准备。MRI结果显示:左侧额叶见一巨大混杂信号肿块影,边界欠清,包块前部为实性部分,以等T1等T2为主,包块后部为一较大囊,大小约66.9*71.3*70.9mm,信号均匀,呈长T1长T2信号,增强后实性部分呈花环样不均匀强化,囊壁呈均匀强化。
科室讨论后考虑占位较大,对脑组织压迫时间长,直接手术切除颅脑压力变化大,风险较大,先给予囊内ommaya囊置入术,术后2次/天,抽取囊液约30ml,囊液呈微黄色,稍浑浊,抽取囊液行脱落细胞检查(未见肿瘤细胞),继续给予对症治疗,三天后给予左额叶占位切除术治疗,手术顺利,术后给予对症治疗,患儿恢复顺利,术后病理结果示切片示肿瘤细胞呈卵圆形或梭形,细胞异形明显,核分裂像多见,可见假菊形及血管周围无细胞区,大片坏死。免疫组化:肿瘤细胞CK(-)、EMA点状(+)、P53(+)、Olig-2散在(+)、GFAP(+)、S100(+)、CD34(-)、SYN(-)、Ki67约40%(+),考虑间变性室管膜瘤,建议家长进一步行分子检测,进一步分型,为下一阶段治疗提供更多参考数据。根据分子诊断结合病理诊断该患者可以被诊断为幕上室管膜瘤-RELA融合阳性,这类室管膜瘤好发于幕上,较其他幕上预后较差。
术后定期影像学检查,左额叶混杂信号,占位切除周缘强化,颅内情况稳定,硬膜下积液无明显增多,椎管内无异常信号灶,患儿与术前对比,精神反应良好无肢体活动,语言视力等功能障碍,建议行进一步放射治疗,定期复查。

术前CT影像
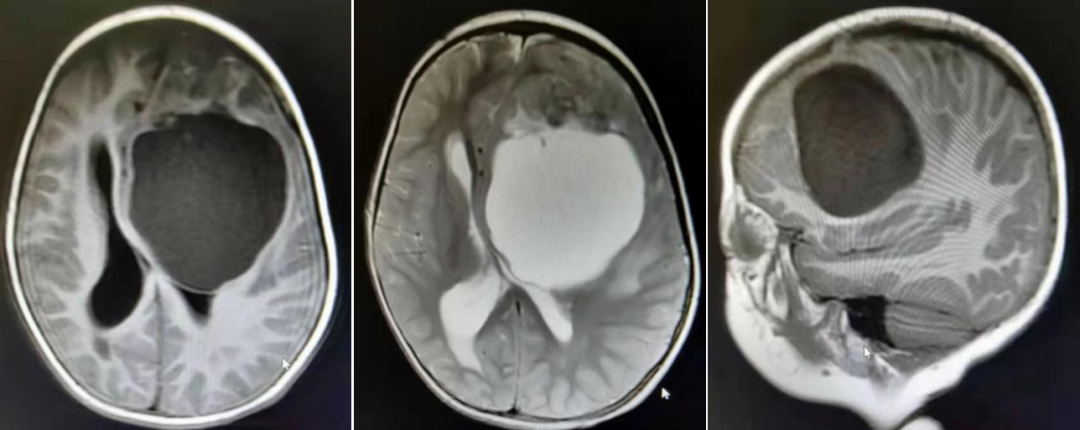
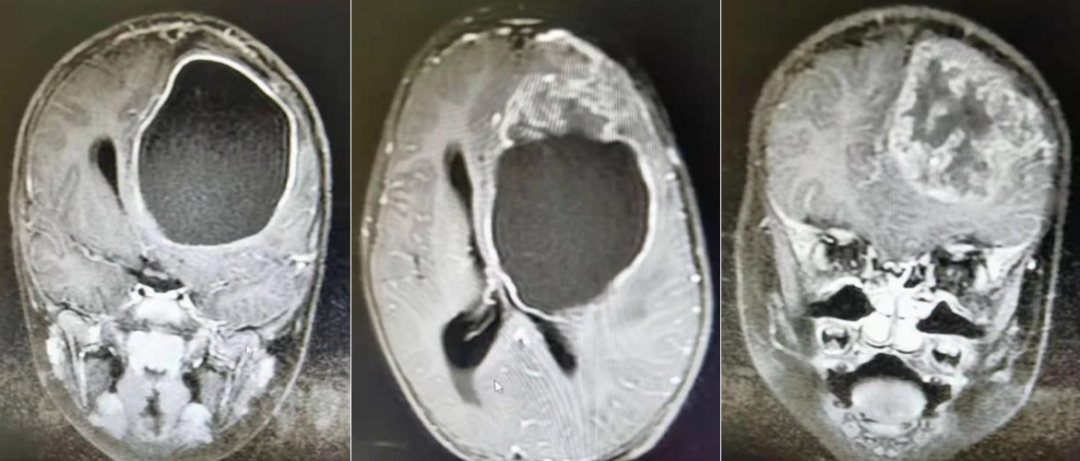
术前MRI影像
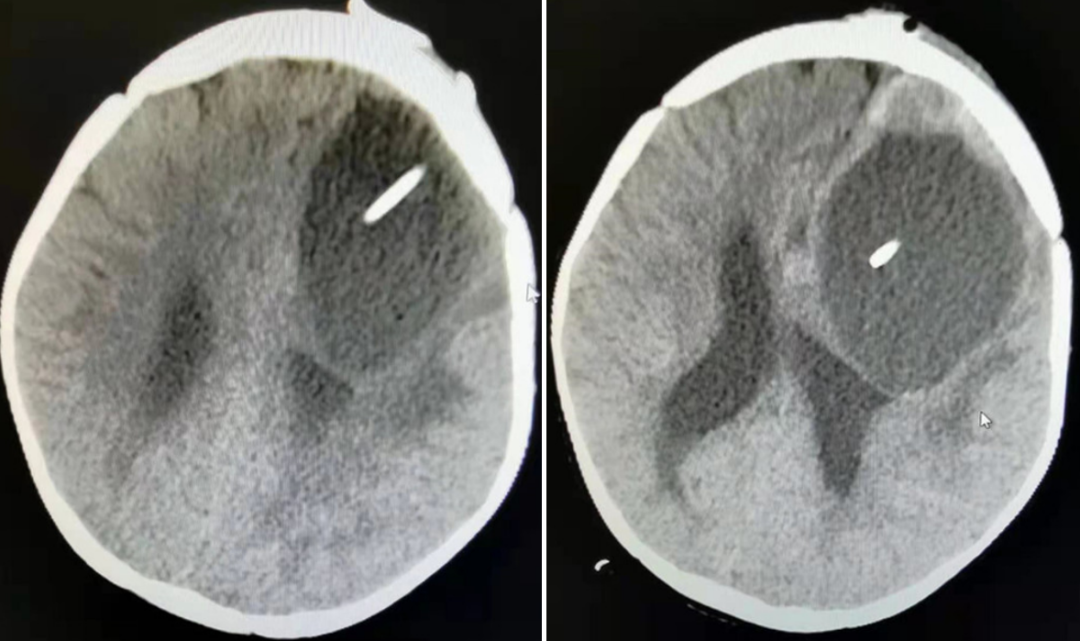
置入ommaya囊术后复查CT
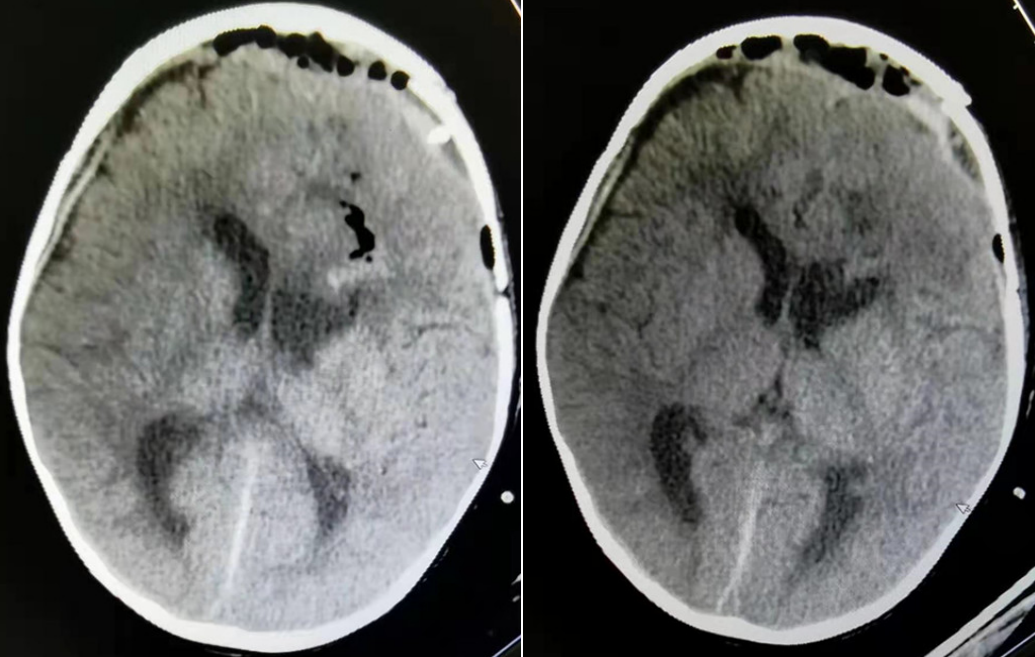
肿瘤切除术后第二天复查CT影像
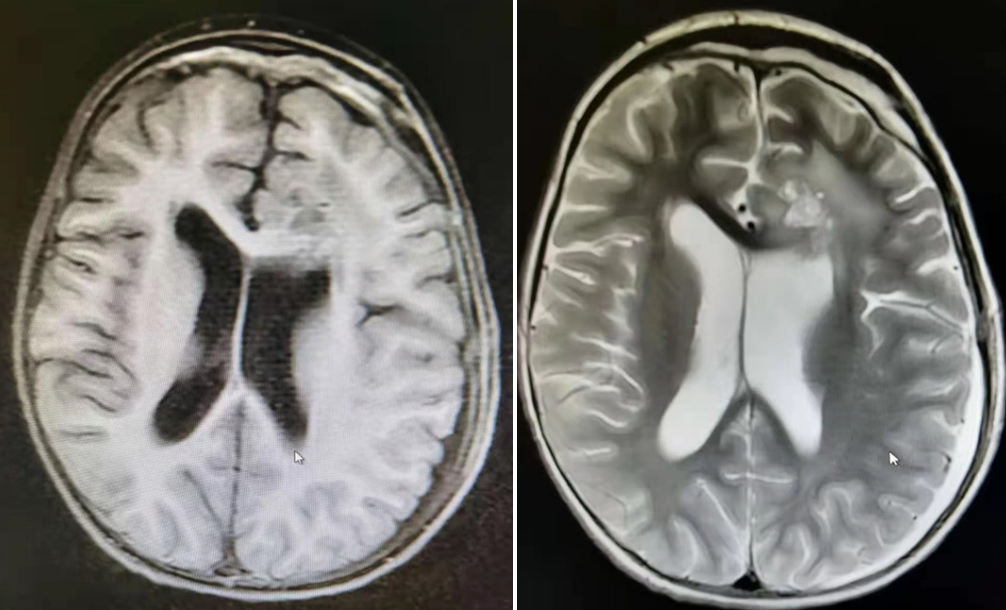
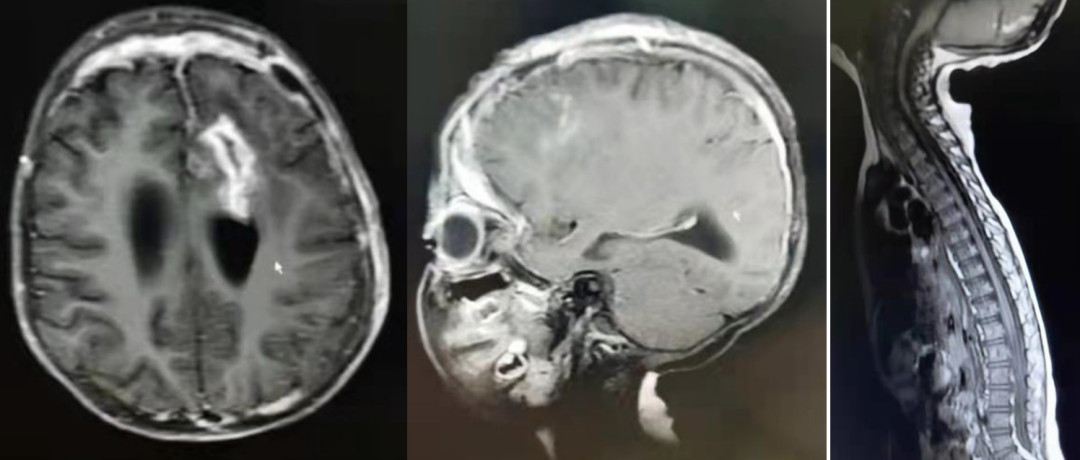
术后三周复查MRI影像

术后病理报告
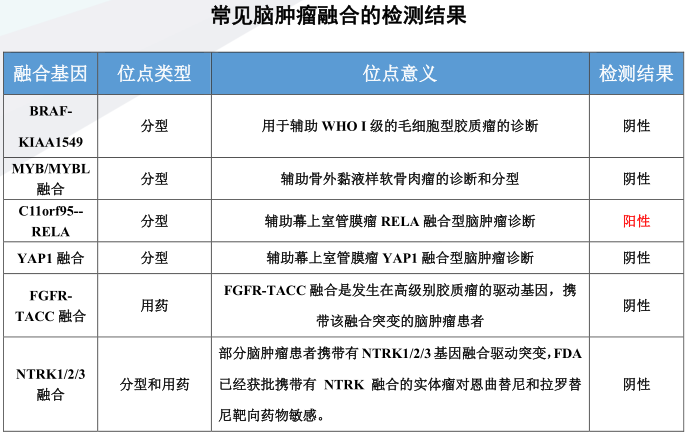
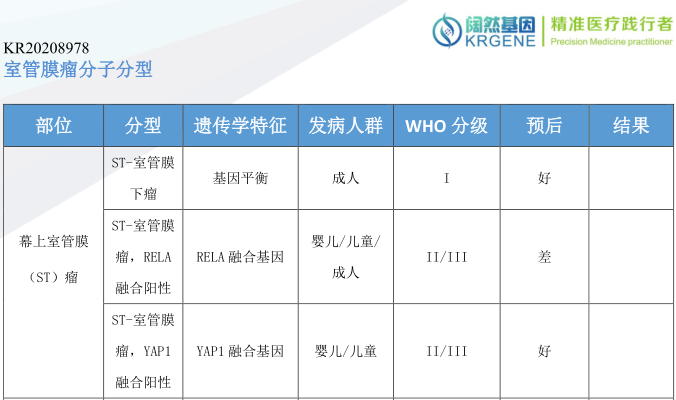
分子检测结果
讨 论
室管膜瘤是儿童中枢神经系统肿瘤较为常见的肿瘤,是儿童第三常见的颅内肿瘤,仅次于星形细胞瘤和髓母细胞瘤。儿童室管膜瘤三分之二位于幕下,并起源于第四脑室的底部,有时可通过Luschka和Magendie的孔进行生长[1],幕上室管膜瘤大多见于年龄较大的儿童及成年人[2],脊髓是成人室管膜瘤最常见的部位,儿童室管膜瘤发生在脊髓的很少见。室管膜瘤主要起源于脑室和脊髓中央管的室管膜细胞,但也有一部分室管膜瘤发生在脑室系统之外,与脑室系统没有任何联系[3]。这类室管膜瘤只发生在幕上,主要累及额叶、顶叶,被称为“皮质室管膜瘤”、“半球室管膜瘤”或“异位室管膜瘤”等[4-6];在中枢神经系统肿瘤2016年WHO分类中正式将RELA基因纳入指南,将RELA融合基因阳性室管膜瘤(Ependymoma,RELA Fusion-positive)作为独立的室管膜瘤分子亚型。由于分子组学的发展和对室管膜瘤的深入研究目前室管膜瘤根据肿瘤生长位置和分子标志物可以被分为9个分子亚型,不同亚型的预后不同[7]。
2016年世界卫生组织中枢神经系统肿瘤分类[13]
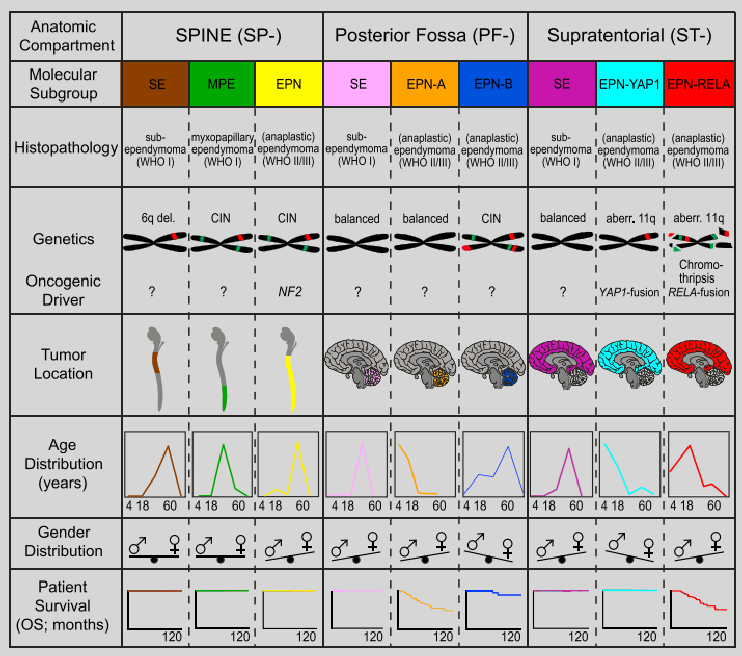
各室管膜瘤亚组的基因表达特征及临床特征总结[8]
影像学检查对脑实质囊性病变室管膜瘤的诊断具有重要价值[9]。头部CT平扫肿瘤实质多表现等低密度,形态多规则,部分有出血、钙化、坏死等,瘤周可有轻微水肿表现。MRI平扫肿瘤实质多表现为不均匀长T1、长T2信号;MRI增强示肿瘤的实性部分和囊壁明显强化,囊性部分无明显强化,且肿瘤位置多邻近侧脑室,部分起源于脑室,术前临床不易明确诊断,根据发病年龄、多发部位、影像学检查与其他疾病相鉴别,但明确诊断仍需病理检查。
根据2016年WHO中枢神经系统肿瘤分类,室管膜肿瘤分为:室管膜下室管膜瘤(WHO Ⅰ级)、黏液乳头型室管膜瘤(WHO Ⅰ级) 、室管膜瘤(WHO Ⅱ级)、室管膜瘤(RELA融合阳性,WHO Ⅱ~Ⅲ级)、间变性室管膜瘤(WHO Ⅲ级)[10]。其中间变性室管膜瘤恶性程度高,较为罕见,仅见于国内外个案报道,其预后较差,复发率高,生存率低[11]。对于间变性室管膜瘤的治疗,目前还没有一个公认的治疗方案。对于室管膜肿瘤标准的治疗措施是尽量手术全切,术后给予适量局部照射与化疗药物等辅助治疗[12]。
参考文献
[1] Gamboa NT, Karsy M, Gamboa JT, et al. Preoperative and intraoperative perfusion magnetic resonance imaging in a RELA fusion-positive anaplastic ependymoma: A case report[J]. SurgNeurol Int, 2018, 9(1):144.
[2] Godfaind C. Classification and controversies in pathology of ependymomas [J]. Childs 19Nervsyst, 2009, 25(10):1185-1193.
[3] Kharosekar H, Bhide A, Velho V, et al. Pediatric Isolated Cortical (Ectopic) Anaplsstic Ependymoma [J]. Asian J Neurosurg, 2018, 13(1):144-146.
[4] Khatri D, Bhaisora K, Das KK, et al. Surgical outcome in cortical ependymoma: A singlecentre experience of 18cases[J]. J ClinNeurosci, 2019, 60(49-57).
[5] Bijwe S5 Ansari S, Jadhav V, et al. Pure cortical p ependymoma: Arare entity [J]. Asian Jneurosurg, 2015, 10(2):162-165.
[6] Wang M, Zhang R, Liu X, et al. Supratententorial Cortical Ependymomas: ARetrospective Series of 13cases at a single center [J]. World Neurosurg, 2018, 112(e772-e777).
[7] E.Fuller C, Jones D T W, Kieran M W. New classification for cns tumors: Implications for diagnosis and therapy[J]. ASCO EDUCATIONAL BOOK, 2017, 753-763.
[8] Pajtler K W, Witt H, Sill M, et al. Molecular classification of ependymal tumors across all cns compartments, histopathological grades, and age groups[J]. Cancer Cell, 2015, 27(5): 728-743.
[9] 李俊彤, 王效春. 幕上脑实质室管膜瘤1例报告—影像与病理分析[J]. 影像研究与医学应用, 2019, 3(3): 138-139.
[10] Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary[J]. Acta Neuropathol, 2016, 131(6) :803-820.
[11] Freyschlag CF, Tuettenberg J, Lohr F, et al. Response to temozolomide in supratentorial multifocal recurrence of malignant ependymoma[J]. Anticancer Res, 2011, 31(3):1023-1025.
[12] Onishi S, Yamasaki F, Nakano Y, et al. RELA fusion-positive anaplastic ependymoma: molecular characterization and advanced MR imaging[J]. Brain Tumor Pathology, 2018, 35(1) : 41-45.
[13] Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, Ohgaki H, Wiestler OD, Kleihues P, Ellison DW. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol. 2016 Jun;131(6):803-20. doi: 10.1007/s00401-016-1545-1. Epub 2016 May 9. PMID: 27157931.
作者简介

李政委
脑肿瘤全景基因检测个体化诊疗解决方案(CaptioX-G3)是一款以NGS技术为基础的检测产品。检测涵盖脑胶质瘤、室管膜瘤、脑膜瘤、髓母细胞瘤、AT/RT等脑肿瘤分子分型相关基因,脑肿瘤潜在靶向药物、化疗药物敏感性和临床试验相关的基因,微卫星状态(MSI)、肿瘤突变负荷(TMB)和错配修复评估免疫治疗,检测脑肿瘤易感性基因胚系突变,提示遗传风险提供精准检测结果,辅助医生制定个体化治疗方案,展示肿瘤突变图谱促进临床科学研究。
“阔然生物医药科技(上海)有限公司(Shanghai KR Pharmtech, Inc. , Ltd.)”简称“阔然基因”,是一家专注于医学研究与转化的企业,专注于脑肿瘤的分子诊断与个体化治疗业务,现已有两家(上海、徐州)国家卫生健康委员会认证的医学检验实验室,在基因检测领域有自主知识产权,拥有完善的全国医疗市场的销售渠道,战略合作的神经外科医生的媒体“神外资讯”,目标成为脑肿瘤分子诊断与个体化治疗领域中国第一品牌。阔然基因重视自有技术开发,目前已建高通量测序平台、单细胞测序平台、多标荧光免疫组化平台,阔然基因在硬件与试剂盒产品端发力,布局术中、术后诊断领域,打造自有技术和行业壁垒,成为并巩固在脑肿瘤领域的领跑者地位。目前阔然基因已布局了术后分子诊断、ddPCR脑脊液检测技术和应用,以及术中实时诊断系统。




