美国哈佛大学医学院神经科和分子影像研究中心的Marike L. Broekman等阐述胶质母细胞瘤与微环境中正常细胞的复杂而动态的相关性,讨论肿瘤募集和改变正常细胞表型、促进肿瘤发展以及抑制免疫应答、逃避治疗干预的机制。文章发表在2018年8月《Nature Reviews Neurology》杂志。
——摘自文章章节
【Ref: Broekman ML, et al. Nat Rev Neurol. 2018 Aug;14(8):482-495. doi: 10.1038/s41582-018-0025-8.】
胶质母细胞瘤(GBM)是一类异质性疾病,致残率和致死率高。肿瘤细胞的遗传学和表观遗传学差异大,导致治疗困难。促进胶质母细胞瘤生长的一项重要因素是肿瘤细胞与脑内微环境中的其它细胞的信息交通并操控这些细胞,促使肿瘤细胞生长和对治疗的抵抗。胶质母细胞瘤募集固有免疫细胞,改变其表型加快肿瘤生长;肿瘤细胞也抑制适应性免疫反应。肿瘤细胞还能够改变内皮细胞、神经元和星形细胞等正常脑细胞,形成有利于肿瘤生长的微环境。总的来说,胶质母细胞瘤诱导表型发生变化后,肿瘤细胞与正常细胞相互作用促使肿瘤生长、浸润脑组织、抑制免疫反应和诱导血管再生。胶质母细胞瘤对脑细胞的操控涉及到多个方面,包括可溶性因子,如化学因子和细胞因子,细胞--细胞直接相互作用,细胞外囊泡(包括外泌体和微泡)的形成、释放等。了解胶质母细胞瘤与微环境中各种细胞的交互作用,为新的治疗方法提供思路。美国哈佛大学医学院神经科和分子影像研究中心的Marike L. Broekman等阐述胶质母细胞瘤与微环境中正常细胞的复杂而动态的相关性,讨论肿瘤募集和改变正常细胞表型、促进肿瘤发展以及抑制免疫应答、逃避治疗干预的机制。文章发表在2018年8月《Nature Reviews Neurology》杂志。胶质母细胞瘤和小胶质细胞、单核细胞及巨噬细胞之间的作用:胶质母细胞瘤微环境包括,脑常驻小胶质细胞和浸润性单核细胞,一旦单核细胞浸润肿瘤,即可分化为巨噬细胞。虽然,常统称为肿瘤相关性巨噬细胞(tumour-associated macrophages,TAMs),但它们代表着不同的细胞群。在非病理情况下,小胶质细胞是脑内重要的固有免疫细胞,在抵抗病原体和有害刺激方面起重要作用;胶质母细胞瘤破坏血脑屏障后,从骨髓造血干细胞来源的单核细胞和巨噬细胞浸润肿瘤。研究表明,在一些特定情况下,胶质母细胞瘤内超过50%是TAMs;嵌合体和细胞系分析发现,这种TAMs的确切组成成分随着时间发生变化;早期胶质母细胞瘤的TAMs由单一的小胶质细胞组成,到晚期演变为由小胶质细胞和浸润的单核细胞、巨噬细胞混合而成(图1、2)。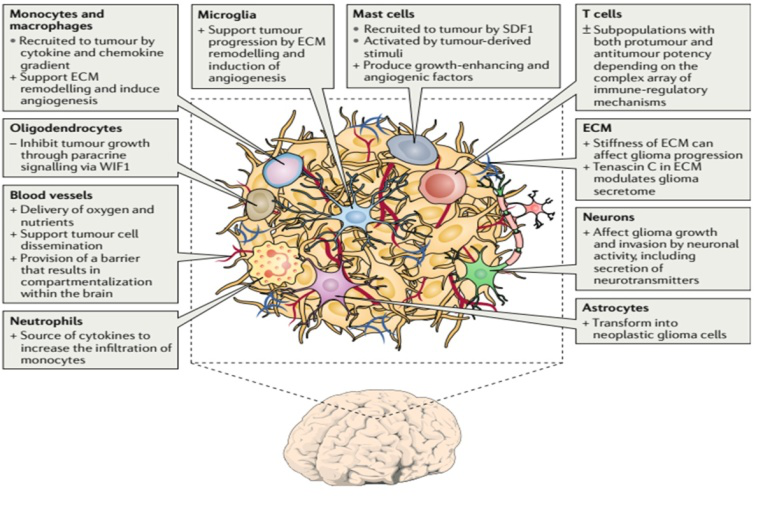
图1. 胶质母细胞瘤微环境。胶质母细胞瘤微环境包括肿瘤细胞、胞外基质(ECM)、血管、固有免疫细胞(单核细胞、巨噬细胞、肥大细胞、小胶质细胞和中性粒细胞)、T细胞和神经元、星形细胞及少突胶质细胞。+,促肿瘤作用;-,抗肿瘤作用;±,两种作用混合存在;SDF1,间质细胞衍生因子1;WIF1,WNT抑制因子。
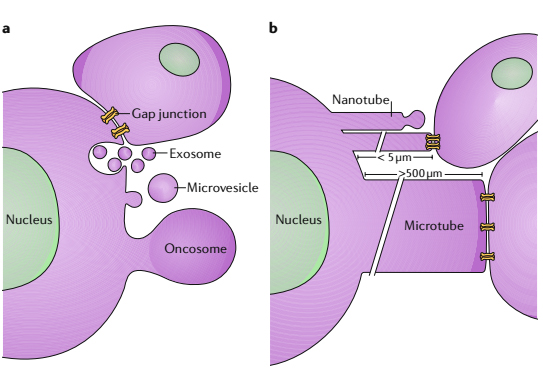
图2. 肿瘤细胞与微环境中细胞相关作用的途径。a.缝隙连接能使小分子通过。细胞也可以外泌体的形式释放与质膜融合的多囊体。另外,微囊泡和肿瘤小泡自质膜发芽后,与其它细胞相关作用并被摄取。b.纳米管通道从细胞伸出,可以在小泡的顶端萌芽或与其它细胞形成缝隙连接;微管从肿瘤细胞伸出后与其它细胞形成缝隙连接。
胶质瘤中TAMs的募集是由胶质瘤细胞释放的细胞因子和化学因子的浓度梯度调节的,这些因子包括:趋化因子配体2(CCL2)、CCL7、胶质细胞源性神经营养因子(GDNF)、肝细胞生长因子(HGF)、肿瘤坏死因子(TNF)、VEGF、ATP、巨噬细胞集落刺激因子1(CSF1)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)等。TAMs也可以募集到胶质母细胞瘤特异的亚组细胞中,如表达转录因子2的少突胶质细胞和表达转录因子SOX-2的肿瘤起始细胞。医疗干预也能够促进TAMs的募集,如脑组织活检能够提高单核细胞浸润表达的CCL2肿瘤细胞中。另外,小胶质细胞和巨噬细胞自身也能够分泌CCL2,提高单核细胞的浸润,形成髓系细胞持续浸润的正反馈环路(图3)。
胶质母细胞瘤与肿瘤相关性巨噬细胞之间的相互作用是多方面的,既包括近距离的细胞与细胞之间的直接作用,还包括释放可溶性和膜包裹的因子远距离发挥作用。胶质母细胞瘤还可以释放包含多种物质的细胞外囊泡,影响TAM的状态。但目前尚无抑制细胞外囊泡释放的技术,因此,胶质母细胞瘤的细胞外囊泡与TAMs的关系仍有待进一步的研究。
传统上将TAMs的活化状态分为肿瘤抑制的M1型和肿瘤促进的M2型;最新的RNA测序发现,TAM可以被诱导出多种活化状态,说明巨噬细胞的分化非常复杂,不仅仅是M1-M2状态。这些研究表明TAM可以在不同的刺激因子下表达相关的基因组,突出肿瘤微环境中信息传递的多样性。
已有研究发现,分泌的分子作用于TAMs影响肿瘤生长;胶质母细胞瘤和TAMs之间的相互作用在组织重塑方面尤其重要,这也是胶质母细胞瘤浸润脑组织的必要条件。基质金属蛋白酶(MMPs)是重要的组织重建蛋白,胶质母细胞瘤分泌的MMP2前体被MMP14激活后,对细胞外基质进行降解,形成有利于胶质母细胞瘤迁移和浸润的环境。
此外,在肿瘤微环境中,小胶质细胞是MMP14的重要来源,两种胶质母细胞瘤来源的因子能够促进小胶质细胞释放MMP14。首先,胶质瘤释放的细胞外基质蛋白多糖,通过其上游受体TLR2诱导TAMs释放MMP14;其次,细胞培养模型表明胶质母细胞瘤来源的细胞外囊泡可以诱导小胶质细胞表达MMP14 RNA,但具体的机制尚不清楚。
胶质母细胞瘤的迅速生长过程需要新生的血管与之相适应。在胶质母细胞瘤中,小胶质细胞和巨噬细胞在血管周围聚集,产生促血管生成因子(VEGF)和趋化因子配体2(CXCL2)。另外,胶质母细胞瘤还通过小胶质细胞间接促进血管形成;研究发现,胶质母细胞瘤分泌的CSF1在体外可以诱导小胶质细胞释放促血管生成的胰岛素样生长因子结合蛋白1(IGFBP1)。
晚期糖基化终末产物受体(receptor foradvanced glycation end products,RAGE;也称为 AGER)在多种疾病中起重要作用,能够诱导肿瘤形成。在负瘤小鼠中,阻断RAGE能够通过降低TAMs分泌的VEGFA水平提高生存率;这可能是肿瘤血管存在外漏,而干扰肿瘤的灌注。
总的来说,胶质母细胞瘤和TAMs之间的作用是相互的,受多种因素的影响。这种旁分泌环可以决定TAMs对肿瘤生长的最终作用,并且可以根据局部因素如缺氧、坏死程度、TAMs浸润密度或TAMs活化状态而不同(图3)。
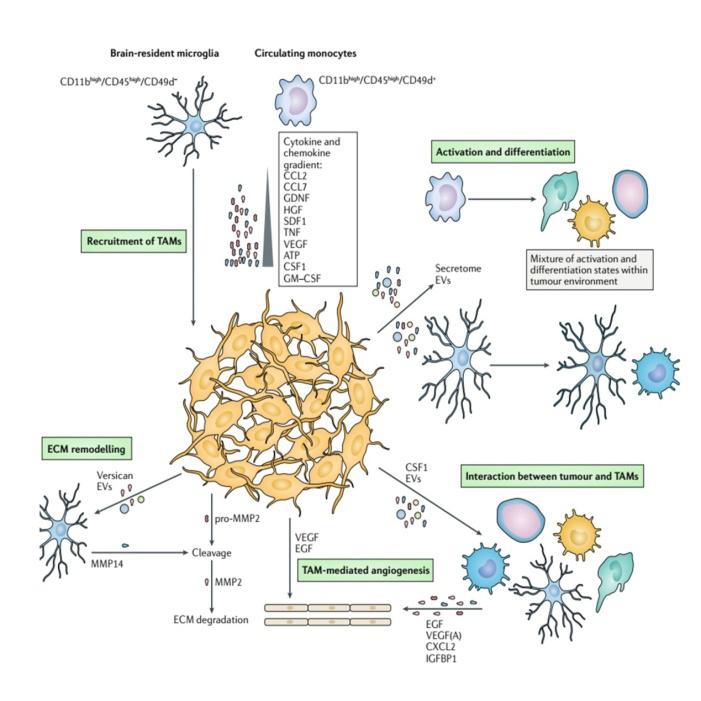
图3. 胶质瘤和TAMs的相互作用。TAMs的募集,包括单核细胞和小胶质细胞,是在肿瘤细胞释放的化学因子和细胞因子浓度梯度下进行的。募集后的TAMs在肿瘤释放的外泌体和胞外囊泡(EVs)的影响下活化;活化后的TAMs通过分泌EGF、VEGF、CXCL2、IGFBP1促进血管再生而影响肿瘤的生长;这一过程在肿瘤源性VEGF和EGF作用下进一步促进。肿瘤的侵袭和生长伴随着瘤周胞外基质的重塑。
除了巨噬细胞和小胶质细胞外,肿瘤微环境中募集的固有免疫细胞还有中性粒细胞和肥大细胞。肿瘤活检或切除后,肿瘤细胞或间质细胞可以释放各种化学因子和细胞因子,募集中性粒细胞到肿瘤微环境。肿瘤相关的中性粒细胞分泌的细胞因子进一步募集中性粒细胞和单核细胞,通过增加TAM的密度,间接促进肿瘤的增大。
同时,胶质母细胞瘤产生的化学因子,如SDF1、巨噬细胞迁移抑制因子和纤溶酶原激活物抑制剂1,募集肥大细胞到肿瘤的微环境中。激活后的肥大细胞产生可溶性因子,包括IL-6、IL-8、VEGF和TNF,促进肿瘤生长和血管再生。越来越多的研究表明,肿瘤微环境中的多个信号环路在募集和激活固有免疫系统的各种细胞方面起重要作用。深入地了解胶质母细胞瘤和固有免疫细胞之间复杂的相互作用,有望通过阻断这种相关作用而找到新的治疗方法。
固有免疫细胞除了与胶质瘤细胞直接作用外,还在适应性免疫的活化中起重要作用,反过来限制肿瘤的生长。过去人们认为大脑是免疫豁免器官,忽视包括胶质母细胞瘤在内的脑肿瘤对自发性或治疗适应性抗肿瘤免疫反应的敏感性。深入探索适应性免疫,尤其是T细胞在胶质瘤生长环境中的作用非常必要。
肿瘤抗原(neoantigen)是适应性抗肿瘤免疫反应的关键因素。研究发现,T细胞在肿瘤中的浸润与患者的临床预后相关,说明这些细胞有可能限制肿瘤的生长。脑肿瘤微环境有其独特的方式协助抗原呈递细胞(APCs)经颈深部淋巴结和淋巴管使T细胞对脑组织的抗原进行识别。(图4)
T细胞进入脑内主要有两条途径(图4)。在稳定期,表达细胞趋化因子受体(CCR6)的Thelper 17细胞能够通过脉络丛进入脑脊液并在脑表面渗透,在脑膜的APCs上可能遇到其同源抗原。这种作用可以引起初始的炎症反应,紧接着使局部的脑微血管募集更多的T细胞和其他免疫细胞,但是这种免疫监视与抗肿瘤的关系尚不明确。另外,胶质母细胞瘤浸润性生长和产生的因子能够直接驱使微小血管发生变化,为T细胞和其他固有免疫细胞的募集提供帮助。
进入胶质瘤微环境后,肿瘤反应性T细胞面临着一系列复杂的免疫调节机制(图4)。这些机制大多存在于非中枢神经系统肿瘤中,推测中枢神经系统主动免疫豁免的正常状态,也支持胶质母细胞瘤所处的特殊免疫抑制环境。TGFβ2是一种免疫抑制因子,能够抑制IL-2依赖T细胞的存活。由免疫细胞产生的TGFβ2和TGFβ1仍然是胶质瘤微环境研究的核心,不仅是因为它们参与肿瘤细胞与髓系细胞的相关作用,更重要的是它们对T细胞有直接的影响。CD8+T细胞快速诱导ITGAE的表达(编码αE整合素),这种基因的表达高度依赖TGFβ,在肿瘤微环境中表达意味着局部有很强的TGFβ信号。尽管αE整合素能够提高脑内细胞毒性T细胞的功能,但是TGFβ使这些细胞表达重要效应分子的能力减弱,如颗粒酶B和IFNγ,从而削弱抗胶质瘤的作用。
胶质母细胞瘤还产生一系列膜结合的分泌性代谢因子,包括Fas抗原配体(FasL)、程序性细胞死亡1配体1(PDL1)、VEGFA和吲哚胺氧化酶等。胶质母细胞瘤能够诱导TGFβ和IL-10在外周细胞(pericytes)的表达,与外渗的T细胞相互作用,减弱其表达共刺激分子的能力。胶质母细胞瘤和外周细胞源性的免疫调节因子可能通过直接或间接促进耐受性APCs和调节T细胞的募集功能,对抗肿瘤效应的T细胞产生作用。
T细胞功能障碍的一个重要标志是共表达多种共抑制受体,包括程序性死亡蛋白1(PD1)、T细胞膜蛋白3(TIM3)、淋巴细胞活化基因蛋白3(LAG3)和带有免疫球蛋白和ITIM结构域(TIGIT)的T细胞免疫受体。深入研究肿瘤微环境中T细胞诱导表达这些受体的机制,在没有充足共刺激的情况下,T细胞受体的活化与消耗相关基因的核因子,而不是效应基因的结合。调节T细胞(Tregcells)能够下调肿瘤相关APCs的共刺激分子,从而促进了T细胞的消耗。另外,胶质瘤产生的TGFβ和VEGFA,增强T细胞受体驱动的PD1及其它共抑制受体的诱导,这可解释为何它们在肿瘤浸润性T细胞中高表达。
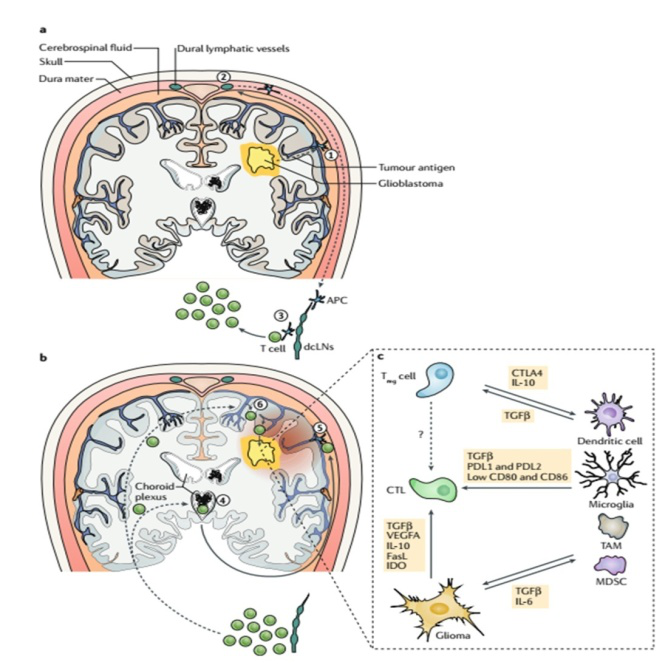
图4. 胶质母细胞瘤微环境中的淋巴细胞。a.诱导抗胶质母细胞瘤T细胞反应的设想:肿瘤抗原与组织液一起沿血管周淋巴系统传播至大脑表面(第一步),随后进入脑脊液或被APCs摄取(第二步),肿瘤抗原被传递到颈深部淋巴结,原位或迁移的APCs与肿瘤抗原特异性幼稚T细胞相互作用并激活它们(第三步)。b.活化或记忆T细胞至中枢神经系统胶质母细胞瘤的可能路径:表达CCR6的T细胞经脑室的脉络丛进入脑脊液(第四步),再次遇到相关肿瘤抗原时(第五步),引发局部炎症反应,激活局部微血管以不依赖CCR6,而依赖CXC趋化因子受体3(CXCR3)的方式募集其它的T细胞,促进其在胶质母细胞瘤环境中的积累。c.在胶质母细胞瘤内和周围,效应T细胞暴露于促进其分化成无功能状态的免疫调节机制网络。
胶质瘤细胞和胶质瘤环境中的APCs表达共抑制受体配体,与T细胞结合后减弱共存在T细胞触发的功能,最终使这些细胞抗肿瘤的活性降低。IFNγ诱导肿瘤细胞表达PDL1,反映持续的抗肿瘤免疫活动。另外,肿瘤基因的突变,如能够引起胶质瘤中PTEN功能丧失,可以激活PDL1在肿瘤细胞中的表达。所谓的检查点阻断(checkpoint blockade),即用阻断性抗体干扰共抑制受体PD1和细胞毒性T淋巴细胞蛋白4(CTLA4)与其配体的结合;目前已证明是肿瘤治疗有效的方法。但由于人类胶质母细胞瘤中新生抗原负荷较低,CTLA-4和PD1靶向性治疗的有效性有待确认。I期研究表明,PD1阻断在复发胶质母细胞瘤中能短暂地延长无进展生存期,但对总生存期无明显改善。另外,低抗原性、低炎症反应及中枢神经系统过强的免疫调节可能是失败的主要原因。因此,在PD1靶向治疗中,需要采取措施提高胶质母细胞瘤的基础免疫反应。胶质母细胞瘤的生长伴随着血管的生成。肿瘤血管系统在肿瘤生长中起输送氧和营养、调节免疫系统、支持肿瘤细胞传播和提供大脑内区域化屏障等重要作用。肿瘤起始细胞通常位于靠近内皮细胞的部位,即所谓“血管周围巢”,该区域作为多种细胞表型的中枢,在肿瘤起始细胞的维持、肿瘤与血管之间的沟通及对治疗的抵抗方面起重要作用。
胶质瘤细胞释放多种促血管生成因子对肿瘤血管进行重塑,包括TGFβ、VEGF、蛋白水解酶、核糖核酸酶和各种化学因子。这些因子以细胞外囊泡、可溶性因子及囊泡外核糖复合物的形式释放。细胞外基质中的肌腱蛋白等胶质瘤衍生因子,动态调节胶质瘤分泌蛋白组,也可能改变内皮细胞增殖和小血管发生,促进整体血管生成。高度可塑性的肿瘤起始细胞自身可能会分化为内皮细胞并促进胶质母细胞瘤中血管生成。整合的转录组学和表观基因组学分析证实,活化WVT5a通路能够驱使肿瘤起始细胞向内皮细胞分化。肿瘤血管完整性(其在胶质母细胞瘤中严重受损)的正常化代表一种提高药物递送的治疗策略。浸润性胶质母细胞瘤细胞导致星形胶质细胞从内皮细胞脱位,从而破坏血脑屏障的胶质血管耦合。VEGF能够提高药物经血脑屏障到达胶质母细胞瘤的能力。另外,胶质母细胞瘤释放的胞外囊泡可经输送semaphorin3A破坏内皮屏障。有趣的是,血管的完整性也可以通过神经元释放的细胞外囊泡递送miR-132进行远程调节,机制是间接上调紧密结合蛋白VE-cadherin。但是目前对微环境调节胶质母细胞瘤中血管完整性和血脑屏障的机制尚不明确。很多胶质母细胞瘤患者有癫痫发作、认知障碍、记忆力减退和人格改变,但胶质瘤与周围皮质神经元的相互作用尚不清楚。过去认为,肿瘤对神经元的作用主要是机械压迫;然而考虑到胶质瘤释放的一系列因子和复杂的细胞间信号机制,胶质瘤对神经元的影响并不简单。最明显的神经元毒性和癫痫与胶质瘤释放过多的谷氨酸有关。有意思的是,瘤周细胞表达的谷氨酸转运体升高,可能具有保护神经元的作用。另外,反复的癫痫发作和相关过量谷氨酸的释放可能通过活化NMDA受体增加血管通透性,导致瘤周水肿加重,但也增加药物运送到肿瘤的机会。
胶质母细胞瘤可能还有其他的机制产生神经元毒性。分析肿瘤起始细胞分泌的蛋白和胶质瘤细胞释放的核糖复合体确定多种致癌和促细胞周期的因子,包括DNA聚合酶增殖细胞核抗原(PCNA)的辅因子和许多miRNA;这些miRNA包括miR-26和miR-10b,与细胞周期抑制因子(细胞周期蛋白依赖性激酶抑制剂1和2)和视网膜母细胞瘤相关蛋白相互作用,促进细胞周期进展。这些分子促进肿瘤的生长,但也将增生信号传递到神经元,导致神经元的退行性变。
虽然肿瘤细胞的有丝分裂信号能够传递到正常细胞,但从神经元到胶质瘤生长的信号传递更令人惊讶。很多的报告认为神经传递物质能够影响胶质瘤的生长和浸润。有研究人员使用基于光遗传学的方法发现,皮质投射神经元的放电活动在体内通过调节突触蛋白neuroligin 3的分泌促进胶质瘤的增殖和生长。这种突触后连接分子由神经元和少突胶质前体细胞分泌,多发现于兴奋性突触。其作用包括下调信号通路、活化局部连接激酶(focal adhesion kinase,FAK)-磷酸肌醇3-激酶(PI3K)-mTOR(mammalian target of rapamycin)通路、生长因子受体和致癌蛋白以及胶质瘤细胞中neuroligin 3的前体表达。研究人员设想通过阻断neuroligin3的释放,进行胶质母细胞瘤的治疗。
其它受神经元活动调节的因子,如脑源性神经营养因子和内质网伴侣蛋白BiP,在正常突触中发挥核心作用;在肿瘤微环境中,可作为胶质瘤有丝分裂原,突显神经元到胶质母细胞瘤的信号通路的重要性。通过分析分子机制,将神经元和突触的活动与邻近胶质瘤细胞,包括肿瘤起始细胞和浸润性胶质瘤细胞联系起来,能够提出一种新的可选择性和靶向性的抗胶质瘤方法,而保留正常的神经元功能。星形胶质细胞是大脑的内源性细胞,其表型与大部分胶质母细胞瘤最相似,代表了胶质瘤可能起源的细胞类型之一。在诸如MYC、RAS、EGFR等致癌基因的作用下,星性细胞可以转变为胶质瘤细胞或肿瘤起始细胞。那么胶质母细胞瘤与周围反应性星形胶质细胞之间的通讯是否促进转化过程,从而新招募致癌细胞以促进肿瘤?尽管确切的机制不清楚,胶质瘤细胞调节的培养基抑制正常星形胶质细胞中p53肿瘤抑制因子的表达,从而增加ECM中的层粘连蛋白和纤连蛋白,促进胶质瘤细胞的存活。研究表明,肿瘤复发可能来自静止的肿瘤起始细胞、浸润肿瘤细胞和/或从肿瘤周围脑区募集的正常细胞。为了支持后者的细胞起源,无瘤的瘤周白质内与生长、增殖和迁移相关的基因被诱导,而正常白质中很多肿瘤抑制和神经元再生的相关基因被下调。
与肿瘤细胞单独培养或肿瘤细胞与无关的胶质细胞共同培养相比,肿瘤相关胶质细胞和胶质母细胞瘤共同培养时,胶质母细胞瘤的生长得到了促进。切除和放射诱导损伤可以引起反应性星形胶质细胞的转录组和分泌蛋白组改变,可能进一步增强肿瘤侵袭性。
胶质瘤细胞和瘤周反应性星形细胞之间的信号通路尚未完全阐明,主要是由于缺乏能够区分这些细胞群的高度特异的标志物。但是研究胶质母细胞瘤的生物学和分泌的蛋白组学展现出了一些有趣的可能性。比如星形细胞的恶性转化需要致癌基因miR-10b的表达,这在正常细胞中是沉默的。miR-10b在胶质母细胞瘤的各种亚型中非常丰富,可以被肿瘤细胞释放到胞外囊泡。从胶质母细胞瘤到瘤周星形细胞转移这种和其它促癌基因调节剂,如miR-21和miR-26,可以实现星形细胞的转化。有趣的是,肿瘤周围高密度的星形细胞可以预测胶质母细胞瘤患者生存期较短。这些发现支持肿瘤相关星形细胞被动参与促肿瘤生长和浸润过程。
相反,少突胶质细胞通过WNT抑制分子1旁分泌的通路,似乎能够抑制胶质母细胞瘤的生长和增生。尽管少突胶质细胞和胶质瘤之间的相互作用知之甚少,但少突胶质细胞、小胶质细胞和星形细胞之间通过多种细胞因子相互作用,说明这些细胞之间和胶质母细胞瘤存在复杂的关系,包括肿瘤生长和抑制信号。另外,已经鉴定出由活化的小胶质细胞诱导并促进神经元和少突胶质细胞死亡的反应性星形胶质细胞亚型,这表明了胶质瘤微环境中存在多方面的相互作用。肿瘤微环境中胶质母细胞瘤和其它细胞的相关作用新观点的提出,为胶质瘤的治疗提供了潜在的靶点,治疗点可针对胶质母细胞瘤和周围细胞的交互模式、直接或间接作用于肿瘤支持性环节,包括固有和适应性免疫系统、血管再生及其与神经元等正常细胞的作用。胶质母细胞瘤通过肿瘤源性的细胞外囊泡影响微环境的观点越来越受重视,肿瘤源性的胞外囊泡内含有各种致癌因子和促细胞周期因子,包括PCNA和miRNAs。未来的研究可以通过干扰细胞外囊泡介导的通讯来验证其对肿瘤微环境中不同细胞类型的功能作用。GW4869是一种中性的鞘磷脂酶抑制剂,可防止神经酰胺介导的多泡体向内萌芽以及防止成熟的外泌体释放到细胞外间隙,减少胞外囊泡的释放。另外,肝素可以减少受体细胞对胞外囊泡的摄取。但这些方法仅是在临床前研究中进行,未来需要探索其在临床应用的特异性、有效性及安全性。胶质瘤治疗更深入的方法包括靶向作用于其它的通讯机制,如细胞因子、缝隙连接及微管。在小鼠模型中证实抑制特定的细胞因子能治疗胶质母细胞瘤,如CCL2。拮抗剂CCR4阻断CCL2对CCR4+Treg细胞的调节,可以提高负肿瘤动物的生存期。缝隙连接形成于胶质母细胞瘤和星形细胞之间,肿瘤细胞通过连接蛋白43促进生长和侵袭,环氧合酶抑制剂甲氯芬酸钠或托那博沙可以对其进行调节。这些环氧合酶抑制剂能减少颅内转移瘤。改变质膜结构的治疗,如局部高温,能够抑制纳米管和微管的形成以及胞外囊泡的释放。另外,胞外基质是肿瘤环境中胞外通讯的重要部位。细胞培养研究表明,胞外基质的弹性影响胶质瘤的进展,因此通过干扰该物质能提供有效的治疗,可使用胞外MMPs抑制剂和肝素阻断胞外基质的重建。胶质母细胞瘤和免疫细胞的相互作用日益受到重视,有研究发现通过抑制CSF1受体(CSF1R)调节肿瘤和固有免疫的通讯,降低了TAMs的促肿瘤活性,提高了小鼠胶质母细胞瘤的存活率。然而,随后的研究发现通过巨噬细胞诱导分泌胰岛素受体因子1(IGF1)阻断CSF1R,可导致胶质母细胞瘤中PI3K的激活,反而促进肿瘤的生长。而同时用CSF1R和IGF1拮抗剂治疗小鼠胶质瘤效果明显。由于胶质母细胞瘤中新生抗原不足,使适应性免疫的治疗未能取得明显的成就。迄今为止,尚无树突状细胞免疫接种引发抗胶质瘤T细胞反应的大型临床研究的成功经验。尽管针对免疫检查点治疗的方法未能提供复发胶质瘤患者的总生存期,但仍有多种潜在的方法值得探索,尤其是新诊断的患者中,PD1阻断治疗新诊断的胶质母细胞瘤患者的III期研究正在进行。在大多数情况下,免疫检查点治疗时还需要增加其它干预措施以增强细胞对免疫检查点治疗的敏感性。一项研究表明,抗PD1和抗CTLA4疗法联合使用时,表达IL-12的溶瘤性单纯疱疹病毒对小鼠胶质母细胞瘤高度有效;免疫检查点抑制剂结合一些炎症物质也能够提高疗效,如溶瘤腺病毒和单纯疱疹病毒载体等。诸如抗血管形成的贝伐单抗等肿瘤血管的靶向性治疗正深入研究,但在改善总生存期方面,研究结果仍有争议。目前,通过正常化肿瘤血管以提高药物输送的策略被广泛关注,VEGF受体和血管生成素2双抑制剂使肿瘤血管正常化,延长胶质母细胞瘤小鼠模型的生存期。肿瘤血管的正常化,提高化疗药物向肿瘤输送的能力。
最后,深入了解胶质瘤细胞与周围的神经元及其他内源性细胞的行为联系机制,可能会催生新的治疗机会。如ADAM10裂解神经元和少突胶质细胞释放的neuroligin3具有促肿瘤生长的作用,ADAM10抑制剂GI254023X能缓解儿童胶质母细胞瘤和弥漫性桥脑桥胶质瘤的生长;ADAM10抑制剂INCB7839和 XL-784已在进行乳腺癌的临床试验,并被证实具有通过BBB的能力。后期仍需对抑制神经元促肿瘤生长进行深入研究。
胶质母细胞瘤是一类在遗传学和表观遗传学方面异质性很大的肿瘤,周围的内源性细胞通过复杂的双向通讯,转化为支持肿瘤生长的基质细胞。肿瘤微环境中这种多维的相关作用,为治疗提供新的策略,同时也提出新的挑战。这些机制还强调在开发新疗法时,必须着力切断胶质母细胞瘤对其周围环境的依赖。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享












