《Endocrine Connections》 2020年12月刊载[ 9(12): R274–R285.] 巴西Universidade Federal do Rio de Janeiro的Bernardo Maia, Leandro Kasuki, 和 Mônica R Gadelha 撰写的综述《肢端肥大症的新疗法。Novel therapies for acromegaly》(doi: 10.1530/EC-20-0433)。

肢端肥大症是一种全身性疾病,合并症发生率和死亡率均增高。通过适当的对疾病的治疗,大多数这些并存疾病是可以预防或延迟的。虽然有三种治疗方式(手术、药物和放射治疗),而且在过去几十年里批准了新药,但仍有一些病人即便接受治疗但仍保持疾病活动性。因此,需要要对肢端肥大症的新的疗法,为此,正在研究目前使用的药物的新配方和新药物。本文就肢端肥大症的新疗法作一综述。
引言
肢端肥大症是最常见由生长激素细胞垂体腺瘤引起的慢性全身性罕见的疾病,伴有自发产生过量的生长激素(GH)(autonomous overproduction of growth hormone)以及主要由肝脏产生的胰岛素样生长因子I(IGF-I)水平随之增加。临床表现包括促生长激素细胞的作用(somatotrophic effects)(肢端肥大[acral enlargement],面容改变[facial alterations],关节痛[arthralgia]),心血管、呼吸、代谢并发症,且一些肿瘤可能增加)。如果不及时治疗,肢端肥大症导致增加合并症发生率和死亡率(morbi-mortality),显著降低生活质量和减少平均10年的预期寿命。通过降低GH <1 g / L)和IGF-I正常化达到疾病控制,从而恢复死亡率至一般人群的正常比率。除了生化控制,治疗目标是预防肿瘤的生长,或理想情况下,诱使肿瘤缩小。目前,肢端肥大症的治疗包括神经外科、药物治疗和放疗。
目前的治疗
手术治疗
外科手术是肢端肥大症的金标准治疗,因为它代表着唯一能迅速治愈肢端肥大症的治疗。对于垂体手术经验丰富的外科医生,经蝶手术可以达到约85%的微腺瘤和40-60%大腺瘤的缓解率。有几个因素预测手术成功:肿瘤大小和侵袭性,术前GH水平,患者性别和外科医生的经验。
药物治疗
药物治疗在肢端肥大症中起着重要的辅助治疗作用,一部分患者可通过手术达到外科治愈,也有少数有临床禁忌证或拒绝手术的患者,药物治疗可作为初始主要(primary)治疗。目前,有三种治疗肢端肥大症的药物:生长抑素受体配体(SRLs)、多巴胺激动剂和生长激素受体拮抗剂(表1)。
表1目前已经批准的肢端肥大症的药物治疗。
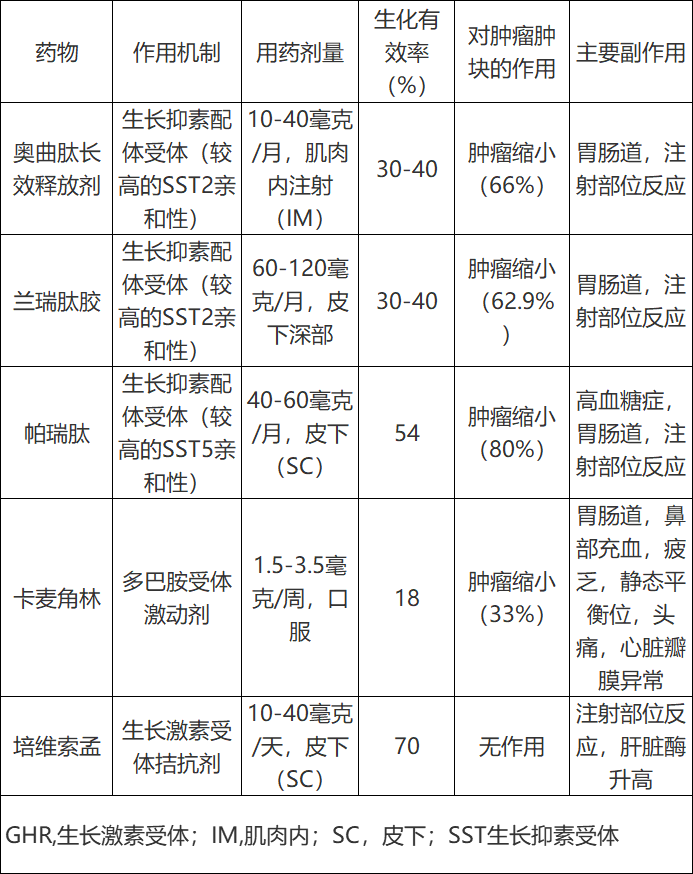
生长抑素受体配体(Somatostatin receptor ligands)
生长抑素受体配体是最常用的规定治疗(the most frequently spanscribed therapy),这类药物有三种不同的可用药物,分为两代:第一代生长抑素受体配体(SRLs) (fg-SRLs),代表药物是奥曲肽长效释放剂(octreotide long-acting release,OCT-LAR)和兰瑞肽胶(lanreotide autogel),被认为是一线治疗;第二代SRL,以帕瑞肽(pasireotide, PAS)为代表。在现实生活中,两种:第一代生长抑素受体配体(fg-SRLs)似乎在大约30% - 40%的患者中对控制生长激素和IGF-I水平同样有效。在低剂量:第一代生长抑素受体配体(fg-SRL)控制良好的患者中,可以尝试延长剂量间隔,使大多数患者保持疾病控制。帕瑞肽(Pasireotide)是一种多生长抑素受体配体,与生长抑素受体(SST) 1、2、3。且主要与5,有亲和性。第一代生长抑素受体配体(fg-SRLs)优先绑定SST2。在未接受过治疗(treatment-naïve)的患者和:第一代生长抑素受体配体(fg-SRLs)控制不充分的患者中,帕瑞肽(Pasireotide)已被证明具有优于第一代生长抑素受体配体的临床疗效。在一项真实的研究中,在使用fg-SRLs没有得到控制的肢端肥大症患者中,有54%的患者实现了IGF-I正常化。然而,帕瑞肽(pasireotide)也可能导致葡萄糖稳态恶化(a worsening of glucose homeostasis),与使用fg-SRLs相比,不良反应较少。
多巴胺激动剂(Dopamine agonists)
以卡麦角林(cabergoline)为代表的多巴胺激动剂对肢端肥大症疗效不明显,在轻度IGF-I水平升高(<2.5倍正常上限[ULN])的患者中起辅助治疗作用。在单药治疗的患者中观察到18%的患者疾病得到长期控制。
培维索孟(Pegvisomant)
培维索孟(PEGV)是一种选择性生长激素受体拮抗剂,通常作为二线治疗,在临床试验中生化控制率达到90%以上,实际控制率(real-life control rate)约为70%。然而,依从性(compliance)(每日注射),副作用(肝脏毒性,注射部位反应),不恰当地上升滴定(inadequate up-titration和没有肿瘤抑制作用限制了其的使用。在一些国家限制其使用的另一个非医疗因素是由于成本效益问题而难以获得。
联合用药治疗(common therapy)
既往证明,在临床实践中,对于相当数量的患者,单药治疗不能实现完全的生化控制,需要联合用药来改善临床疗效。在这些有部分反应的患者中,联合用药治疗可能通过减少注射频率和/或总的药物剂量来减少与个别较高剂量药物相关的副作用。用于肢端肥大症治疗的联合用药是:fg-SRL +卡麦角林(能让约23%的患者达到控制疾病);fg-SRL + PEGV和PEGV +卡麦角林,能使疾病控制率与PEGV单药治疗相似,但对肿瘤方面的作用有额外的获益,并能允许较低的PEGV剂量。
其他药物治疗
除上述提到的治疗肢端肥大症的三类药物外,还有其他药物治疗,仅在特殊情况下使用。
口服雌激素和选择性雌激素受体调节剂(selective estrogen receptor modulators, SERMs)能够通过诱导SOCS2的表达从而负面抑制GHR-JACK2-STAT5信号通路来调节GH的反应,以降低IGF-I水平。单独使用或联合使用SRL或卡麦角林,这种所谓的首效( first-pass effect )可能出现在肢端肥大症患者身上。然而,这些药物并不是常规肢端肥大症治疗手段( the regular acromegaly management arsenal )的一部分,需要进一步的研究来证明其真正的有效性和安全性。
替莫唑胺(Temozolomide )是一种烷基化剂,可诱导DNA损伤,导致肿瘤细胞死亡。这是一种保留针对进袭性(aggressive)垂体肿瘤和垂体癌而准备的化疗,对上述常规治疗来说具有难治性(refractory)。
放射治疗
放射治疗(RT)通常被认为是三线选择,保留作为手术和药物治疗的进袭性(aggressive)肿瘤患者的辅助治疗。RT并不即刻起作用,5 - 15年后,方才取得生化缓解,在此期间(interim)需要使用药物。在随访15年的患者中,立体定向放射外科治疗的缓解率为50-70%。将其作为最后一线治疗方法的最大缺点是并发症的频繁发生,如垂体功能低下(5-10年10-50%患者发生)、认知改变、辐射诱发的颅神经损伤、脑血管疾病、继发性肿瘤和放射性坏死。
新的治疗方法
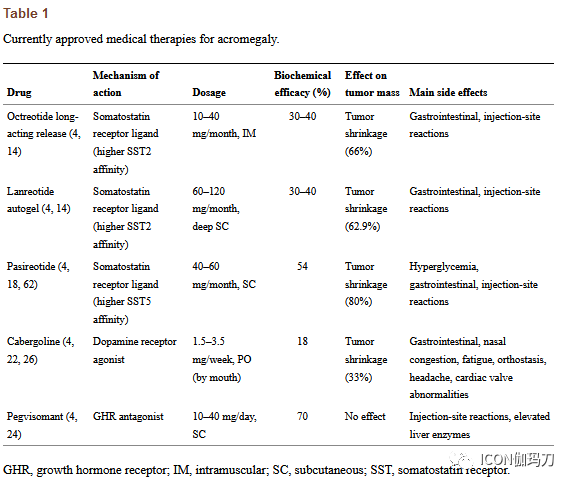
目前肢端肥大症的临床治疗还很不理想,并非所有患者都能达到生化控制;不良事件可能对某些个体至关重要,导致不能耐受和有限使用;除多巴胺激动剂(DA)外,其他常用药物均需定期注射,从而降低生活质量。近年来,新疗法已进入临床前和临床试验研究,其中一种已于2020年获批开展临床治疗。其中一些对应新的治疗药物,另一些代表新的SRLs,不同的给药途径,甚至是现已有药物的新的组合用药(表2)。
表2肢端肥大症的新药物治疗。
已经被批准的新的组合用药
帕瑞肽(PAS)和培维索孟(PEGV)是目前已应用于肢端肥大症药物治疗的两种最有效药物,但它们的联合用药治疗尚未得到广泛研究。这种组合的潜在好处可能是减少PEGV剂量,反映治疗总费用的减少;减少与PAS单药治疗相关的葡萄糖异常;以及生化控制对常规药物治疗有抵抗耐药性的肢端肥大症。
PAPE研究是目前唯一发表的旨在评估单独PAS或联合PEGV的疗效和安全性的试验,其目的是将fg-SRLs联合PEGV治疗控制良好的肢端肥大症患者转换为联合或不联合PEGV的PAS治疗。这是项涉及61例入选研究前至少6个月每周注射PEGV以及每月注射奥曲肽(OCT-LAR )30毫克或兰瑞肽(lanreotide autogel)120毫克,且控制良好的(定义为IGF-I≦1.2 ULN)肢端肥大症患者的24周,前瞻性、单中心、非盲、研究者发起的研究。在基线时,继续进行fg-SRL治疗,至12周时减少50%的PEGV剂量。12周后,当IGF-I水平保持≦1.2倍ULN时,受试者每4周切换到使用PAS60mg单药治疗。12周后,当IGF-I水平超过1.2倍ULN时,患者改用PAS60 mg,并继续按50%减少PEGV的剂量。在12至24周期间,除非IGF-I低于按年龄校正的正常限度,否则不允许改变PEGV剂量。在这些患者中,在IGF-I水平达到正常值前,每周减少PEGV剂量20毫克。在基线,平均IGF-I为0.97倍ULN (95% CI, 0.91-1.02),平均PEGV剂量为134 mg/周(95% CI, 103 -166)。在12周,在24.6%的患者中观察到,平均IGF-I水平增加到1.59 ULN (95% CI, 1.45- 1.73)和IGF-I≦1.2倍ULN,因此将他们转换到PAS单药治疗组。24周时,PAS单药治疗组中93.3%的患者IGF-I水平下降到参考范围,联合用药治疗组中67.4%的患者IGF-I水平下降到参考范围。在基线和24周之间,PEGV的平均剂量可以降低到48 mg/周(95% CI, 21-74),而在67.8%的患者中,PEGV可以被停止使用。记录到的最常见的不良反应是高血糖(88.5%),糖尿病(DM)发生频率从基线的32.8%上升到24周时的68.9%。基线HbA1c是试验结束时发生糖尿病的主要预测因素。这些数据表明PEGV无法补偿PAS引起的高血糖,可能由于药物的作用机制:PEGV对GH起反作用,从而改善胰岛素敏感性(improves insulin sensitivity by antagonizing GH action),而PAS的高血糖作用除了抑制肠促胰岛素外(in addition to supspanssion of incretins),还与抑制β-胰腺细胞产生胰岛素有关( is related to inhibition of insulin production by β-pancreatic cells),而与胰岛素抵抗性无关。
本研究表明,对于之前联合fg-SRL和PEGV用药得到控制的患者,PAS是一种可能的治疗选择。这种SRL治疗的转换具有重要的比拼PEVG的作用(PEVG-sparring effect),并因此减少了总的治疗成本。然而,尽管该疗法疗效高,且据称能降低成本,但患糖尿病的风险,以及与治疗糖尿病相关的医疗费用却增加了。因此,有必要谨慎选择从这种新的联合用药治疗中获益最大的患者,这需要进一步的长期研究。
与此相一致的是,PAPE拓展( extension)研究给出了单独使用PAS或联合使用PEGV治疗肢端肥大症48周的长期疗效和安全性结果。这是一项前瞻性、非盲、单中心随访研究,直到24周核心试验后的48周,纳入了61例原研究患者中的59例。在研究结束时,77%的患者达到了正常的IGF-I水平(≦1.2倍 ULN),平均IGF-I为0.98倍ULN (95% CI, 0.90-1.06)。在各治疗组中,PAS单药组93.3%的受试者在24周时IGF-I恢复正常,并持续到48周;而联合用药治疗组中67.4%的患者在24周时实现IGF-I正常化,在48周时这个比率增加到71.7%。在拓展实验中,阶段性平均PEGV剂量必须从47增加到64毫克/周(95%CI,33-95),但在48周后,与基线相比,总体累计PEGV剂量减少52%,试验结束时50.8%的患者停用PEGV治疗,证实PAS的比拼PEVG的作用(PEGV-sparring effect)。
高血糖仍然是研究中最常见和重要的不良事件,糖尿病的发生率从24周时的68.9%增加到48周时的77%。PAS诱导的高血糖与基线胰岛素分泌呈负相关,说明基线胰岛素分泌较低,治疗过程中出现高血糖的风险较大。使用PAS单药治疗和联合用药治疗的患者在基线(P = 0.36)、24周(P = 0.72)和48周(P = 0.26)后的HbA1c水平无显著差异。这项扩展性研究证实(corroborate)了先前发表的数据,表明PAS在生化上控制了很大一部分肢端巨症患者,其对拼PEGV作用为50%。然而,它与糖尿病的高发生率相关,这似乎与开始治疗前胰腺β细胞分泌胰岛素的能力呈负相关。
此外,最近的一项研究表明,在6例对所有常规药物治疗都有耐药性的肢端肥大症患者中,PAS和PEGV联合用药治疗的生化控制协同作用的有效性。对照组包括49例对fg-SRL耐药的患者,使用PAS(单药)或PEGV(单药或联合fg-SRLs)为对照组。除1例患者因插管及麻醉诱导技术困难外,其余6例患者都采用垂体神经外科手术作为一线治疗。由于肿瘤的侵袭性特点和对腺瘤的次全切除,所有患者都接受了fg-SRL治疗。6例患者都出现完全的耐药性,因此对该组采用二线药物治疗,其中2例患者采用fg-SRL和PEGV联合用药治疗,3例患者采用PAS单药治疗,1例患者尝试两种治疗方法。在这6例患者中,有4例接受了第二次神经外科手术,以寻求减瘤。在其他治疗失败后,6例患者通过PAS和PEGV联合用药治疗达到肢端肥大症的生化控制。没有观察到残留肿瘤的再生长,一位病人表现出病变的缩小。1例以前有糖尿病的患者的血糖控制恶化,另1例新发糖耐量受损,但这些不良反应分别在对既往胰岛素治疗作调整和引入低热量降血糖饮食(hypocaloric hypoglycidic diet)后得到改善。重要的是要注意,研究小组是由生化-影像学-组织学(biochemical-radiological-histological)肿瘤预后不好,GH水平较高,较大的肿瘤尺寸和侵袭性,较高的增殖指数(Ki - 67)表达式,和对fg-SRL组织病理学的抵抗模式(低SST2表达式和低SST2 / SST5比率)。尽管本研究的主要局限性是样本量小,但它加强了肢端肥大症个体化治疗的重要概念,为联合用药控制进袭性疾病提供了新的可能性。
现有类别的新药
奥曲肽胶囊(Octreotide capsule )是一种口服剂型的奥曲肽,能够取代目前需要终身使用肠外药物的肢端肥大症的治疗,这对许多患者的疾病治疗来说是一个有趣的观点。口服用药时,奥曲肽主要以空肠中完整的肽(an intact peptide in the jejunum)的形式被吸收,但遗憾的是,肠道黏膜屏障降低了其吸收,导致血浆水平低,生物利用度低(low bioavailability)。
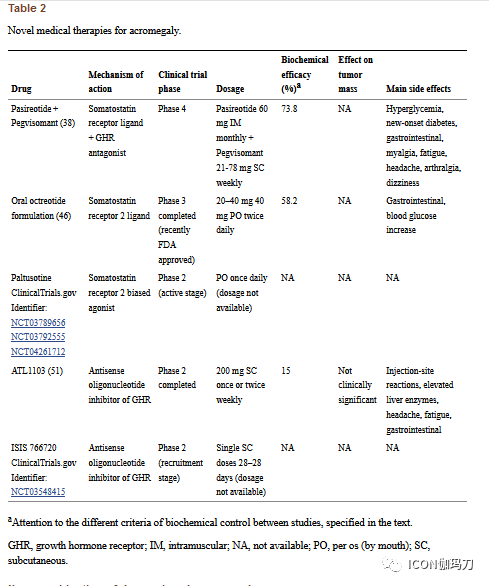
口服奥曲肽制剂通过引入瞬时通透性增强剂(transient permeability enhancer, TPE)技术绕过了这一限制,通过瞬时和可逆的开放小肠上皮紧密连接来提高药物吸收,从而导致高肠通透性。紧密连接对应于一种跨膜蛋白复合物,与水溶性大分子的细胞旁通透性(paracellular permeability of water-soluble macromolecules)有关,具有肠屏障功能。它的功能,通过增加例如,胆盐和中链脂肪酸的渗透性,受到生理细胞外刺激的动态调节。奥曲肽胶囊包含由在油状悬浮液中中链脂肪酸钠盐和药物肽结合,并置于肠溶涂层中(图1)(medium chain fatty acid sodium salt with the drug peptide in an oily suspension in an enteric coating)的TPE技术。
图1、Octreolin的作用机理。奥曲肽胶囊与瞬时渗透性增强剂(TEP)技术,促进短暂和可逆的上皮紧密连接开放,穿越肠道屏障。这一过程提高了药物的吸收,并使奥曲肽达到血清治疗水平。
在临床前研究中,大鼠和灵长类动物的药代动力学特征显示,口服胶囊和SC注射后,奥曲肽的血清水平相似,导致两种给药模型中GH水平的快速和持续抑制。说明口服途径保留了奥曲肽的生物抑制活性。对灵长类动物的研究显示,奥曲肽胶囊和注射剂量的安全性,且没有器官损伤,毒性也相当。荧光示踪剂在大鼠模型中显示,TPE通过重组紧密连接蛋白(ZO-1)在大鼠肠道内通过细胞旁运输瞬时增强通透性。药物摄入后1-1.5小时,肠道通透性恢复到基线水平。大鼠模型中另一个重要的方面是肠通透性与被吸收分子之间的反比关系,其中葡聚糖分子最小(4 kDa)结合TPE的吸收效果最好。较大的右旋糖酐(40 - 70 kDa)被最低限度地吸收,限制了肠道病原体和免疫球蛋白的内在化风险(the risk of internalization)。TPE对肠道通透性的时间限制和大小限制是影响健康个体安全性的两个重要因素。
一项I期研究在75例健康受试者中进行,使用单剂量(3,10,20 mg)的奥曲肽胶囊(奥曲肽)和单剂量的100μg奥曲肽SC注射。药代动力学数据显示,口服奥曲肽血浆浓度与剂量有关,20 mg剂量与100μg注射剂量相当。注射SC后,奥曲肽在0.6 h达到峰值,而口服制剂的升高较慢,在2.7 h出现血清峰值。同时,两种给药途径的奥曲肽血浆浓度均有所下降,平均半衰期相当,注射6 h后,口服胶囊8 h后达到亚治疗水平(<0.5 g/mL)。食物摄入和质子泵抑制剂对奥曲肽(Octreolin)的吸收有显著影响,分别降低了近90%和40%的血药浓度。在本研究中,口服剂量20 mg强烈地抑制了基础生长激素(GH)水平,使平均生长激素(GH)浓度降低44% (P <0.05)。此外,在奥曲肽组生长激素释放激素(GHRH)-精氨酸刺激可显著抑制80%的GH分泌(P <0.001)。除注射不良反应外,两治疗组安全性类似,胃肠道不良反应和头痛发生率为8-15%。
一项3期多中心、非盲、剂量滴度、病例对照研究旨在测试在155例肢端肥大症患者中奥曲肽胶囊的有效性和安全性,这些患者此前曾接受稳定剂量的可注射SRLs治疗3个月,并得到完全或部分型控制(IGF-I<1.3 ULN和2-h集成(integrated)GH <2.5 ng / mL)。主要目的是确定口服奥曲肽在维持注射性SRLs有反应的患者生化控制方面的效果。第一次给药是在最后一次SRL注射后4周,开始剂量为40mg (20mg,每天2次,餐前>1小时或餐后2小时)。在滴定阶段,根据IGF-I水平的反应,剂量逐渐增加到高达每天80毫克,达到后期维持阶段,固定剂量核心治疗7个月,随后自愿延长6个月。在102例完成核心治疗的受试者中,86%选择继续延长阶段。在改良意向治疗组(modified intention-to-treat group )的151例可评估个体中(所有参与者在第一次剂量后至少有一项疗效评估),65%显示持续缓解,并达到核心治疗期结束时,IGF-I<1.3倍ULN的和平均集成GH <2.5 ng/mL主要终点,延长期(13个月)结束时则为62%。效果是持久的,85%的患者进入固定剂量的方案,并维持他们的反应长达13个月。预测口服胶囊反应度的指标包括使用注射用SRLs得到良好的基线控制 (IGF-I ≦1 ULN, GH <2.5 ng/mL)和低至中剂量的注射用SRLs (奥曲肽长效释放剂<30 毫克或兰瑞肽胶<120毫克)。在试验期间,肢端肥大症症状(头痛、虚弱、出汗、四肢肿胀和关节疼痛)的临床控制也得到了改善。基线时,接受注射SRL得到生化控制的受试者中,81%持续存在至少一种肢端肥大症的活跃症状。在固定剂量期结束时,54%的患者表现出改善,26%的患者维持其症状的严重程度。大多数不良反应是短暂的,随着治疗的继续而消失,发生在治疗的第60天,与剂量无关。在155例患者中,89%的患者经历了不良反应,其中92%的患者被划分为轻度到中度。最常见的副作用是胃肠道(恶心、腹泻、消化不良、腹痛、气胀、呕吐)、神经系统(头痛、头晕)、肌肉骨骼(关节痛、背痛)。23名参与者因不良事件退出,其中19人与研究药物相关。据报道有两例死亡,但均与该药物无关。副作用与已知的SRL特征和肢端肥大症疾病负荷一致,没有与新的剂型和给药途径相关的安全信号。
一项为期9个月的3期双盲、随机、安慰剂对照、多中心研究也对口服奥曲肽进行了评估,该研究旨在评估奥曲肽胶囊在可注射SRL治疗的肢端肥大症患者中的有效性和安全性。在这项试验中,56名先前得到控制的肢端肥大症患者(基于两项评估的平均值,IGF-I≤1.0 ULN)注射注射用fg-SRL(按稳定剂量治疗≧3个月,使用≧6个月)被转换为口服奥曲肽或安慰剂。口服奥曲肽治疗的患者中有58%的IGF-I水平保持正常化,而安慰剂组只有19% (P = 0.0079)(。2020年6月26日,FDA批准口服奥曲肽胶囊作为首个口服SRL用于对注射用SRL治疗有反应和耐受的肢端肥大症患者的长期维持治疗。这代表了肢端肥大症治疗库(the treatment arsenal of acromegaly)的改进,增加了一种有效和安全的口服药物,可替代相当比例的患者所接受的长期注射用药物治疗。
生长抑素受体2偏向激动剂(Somatostatin receptor 2 biased agonist )
另一种新兴的治疗方法是paltusotine(以前称为CRN00808),这是一种口服选择性非肽SST2偏向性激动剂。偏向激动(biased agonism)一词反映了与其他配体不同的配体选择性激活受体信号通路子集的能力。2018年,我们设计了一项1期、双盲、随机、安慰剂对照、单剂量和多剂量上升试验,在99名健康志愿者中评估咪达唑仑(midalozam)联合该药物的安全性、药代动力学、药效学和潜在的相互作用(ClinicalTrial.gov 标识符: NCT03276858)。数据表明,该药物吸收良好,半衰期42 - 50 h,支持每日给药1次。在3- 5天内达到了稳定状态。当与食物一起服用该胶囊时,全身暴露明显减少,表明血浆CRN00808曲线下面积降低(83%)。口服可导致GHRH刺激的GH和IGF-I分泌的剂量依赖性抑制。在10毫克剂量下观察到最大的GH轴抑制。药物相互作用组共给药咪达唑仑,评估与CYP3A4/5底物相互作用的风险,结果显示20mg CRN00808没有咪达唑仑药代动力学变化,这意味着很少或没有风险。治疗不良事件与已知的SRL特征一致,通常是轻微和短暂的。约30%的受试者出现胃肠道反应,10%的受试者出现轻度胰腺酶升高。没有与药物相关的严重事件。
目前有两个活跃的2期临床试验来评估肢端肥大症中的paltusotine。ACROBAT EDGE是一项非盲探索性研究,旨在评估该药物在用SRL方案治疗但单药治疗不完全有效的肢端肥大症患者中的安全性、有效性和药代动力学(ClinicalTrials.gov标识符: NCT03789656)。ACROBAT EVOLVE是一项双盲、安慰剂对照、随机撤药研究,以评估与安慰剂相比,在对奥曲肽长效释放剂(OCT-LAR)或兰瑞肽(lanreotide)单药治疗有反应的肢端肥大症患者中使用paltusotine的安全性、有效性和药代动力学(ClinicalTrials.gov I标识符: NCT03792555)。EVOLVE和EDGE研究在同一中心全面进行,完成任一项试验的患者将有资格参加非盲扩展研究(ACROBAT ADVANCE)。这项进展是一项2期、非盲、长期扩展性研究,旨在评估paltusotine在肢端肥大症患者中的安全性和有效性(ClinicalTrials.gov 标识符: NCT0461712)。
药物新类别
反义寡核苷酸(Antisense oligonucleotide)
反义寡核苷酸是一种单链合成核苷酸序列,它与特定的mRNA结合,抑制基因的转录,从而抑制蛋白质的合成。ATL1103是一种反义寡聚药物(antisense oligomer drug ),旨在阻断GHR的表达,从而降低IGF-I水平。它有一个嵌合排列,由一个由20个核苷酸组成的DNA核心(或“缝隙(gap)”)和一个硫代磷酸主链,两侧是末端5个核苷酸的2 -O -甲氧基乙基修饰,从而增加了血浆半衰期和对mRNA的亲和力。因此,ATL1103与GHR mRNA形成复合物并激活核糖核苷酸H(RNase H), RNase H将该杂交产物裂解,降解GHR mRNA并阻止基因转录(图2)。
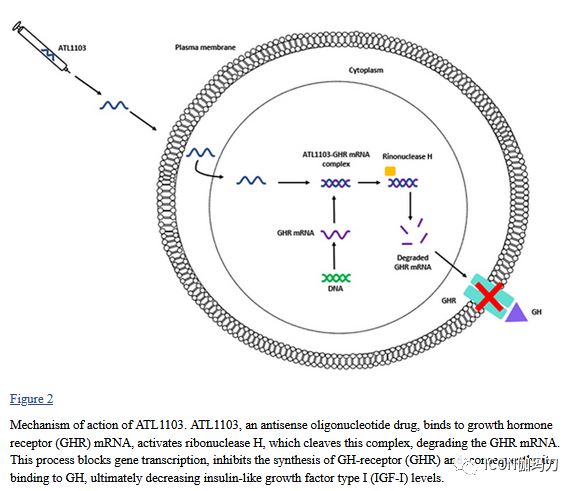
图2、ATL1103的作用机制。ATL1103是一种反义寡核苷酸药物,与生长激素受体(GHR) mRNA结合,激活裂解这个复合物的核糖核酸酶H,降解GHR mRNA。这一过程阻断基因转录,抑制GH受体(GHR)的合成,从而抑制其与GH的结合,最终降低胰岛素样生长因子I型(IGF-I)的水平。
在临床前研究中,ATL227446(后来改名为ATL1103)在调节GH信号方面展示了有希望的结果。在体外小鼠细胞中,GHR mRNA表达降低87%,在正常小鼠体内,GHR mRNA表达降低70% (P <0.0001)肝组织GHR mRNA水平降低。在治疗10周的小鼠中,血清IGF-I水平下降了59%,证明了抑制生长激素信号的作用。
一项1期随机、安慰剂对照、双盲研究对32例健康男性成人皮下注射ATL1103,进行了两个阶段的试验。在单向上升剂量阶段的试验(In the single ascending dose stage of the trial),24例受试者接受了4个剂量水平的ATL1103或安慰剂,从25mg开始,逐步增加到75mg、250 mg和400mg。在多剂量阶段,8名受试者接受6次250mg剂量的ATL1103, 4名受试者接受安慰剂。治疗组在第14天至第28天出现了IGF-I水平下降的趋势,在第21天有统计学意义的效果(P = 0.034),平均IGF-I水平比基线水平下降了7%。第21天,由于GH受体裂解产生GH结合蛋白(GHBP)水平也显著降低了16% (P = 0.007)。因此,这种降低为其靶点的药物亲和力提供了支持。
一项2期随机、非盲、平行组研究评估了ATL1103治疗肢端肥大症的潜力。26例活动性肢端肥大症患者(就诊筛查时的IGF-I水平>1.3倍ULN)被平均分为两个研究组,接受每周1次或2次200mg ATL1103,共13周。药物给药期结束后,再监测患者8周,不进行肢端肥大症治疗。
第14周,为期2周的研究结果显示,与基线相比,IGF-I水平中位下降27.8% (P = 0.0002), 13例患者中有2例(15%)达到了IGF-I参考范围内的水平。每周给药一次,IGF-I没有发生变化。在2周的队列中,IGF-I水平在第14周仍在下降,在洗脱期(the washout period)结束时(第21周)中位数仍低于18.7% (P = 0.0005)。这表明,ATL1103研究治疗的时间太短,无法达到最大的有效性,延长所使用剂量的治疗可能会导致IGF-I水平更大的下降。GHBP水平在第14周也有显著下降,1周和2周队列的中位分别下降了23.6和48.8% (P = 0.027和P = 0.005)。这些结果一直维持到第21周。在第14周,每周两次的组的中位生长激素水平增加了46% (P = 0.001),但在每周一次的组中,没有显现变化。
ATL1103的耐受性良好,虽然两组患者中有85%的患者经历了轻到中度的注射部位反应。报告了4例严重的不良反应,但没有一例感觉与药物有关。垂体肿瘤大小无明显变化,但研究时间较短是评价该效应的局限性所在。
因此,ATL103的目前发现证明GH受体反义寡聚物降低肢端肥大症患者IGF-I水平的概念。它有实现疾病控制的潜力,但需要对较高的剂量和/或较长的时间治疗的研究,以确定这种新疗法的潜力。
目前,有两项涉及另一种GHR反义抑制剂的临床试验,均处于招募阶段。第一项研究是一项双盲、安慰剂对照的2期研究,旨在评估ISIS 766720 (IONIS-GHR-LRx)的安全性、耐受性和有效性,每28天给药一次,共16周,用于60例接受fg-SRLs治疗的肢端肥大患者。这些患者必须在筛查时接受最大程度稳定的或最大耐受剂量的fg-SRL,血清IGF-I在1.3 - 5倍 ULN之间,校正年龄和性别(clintrials .gov标识符:NCT03548415)。另一项临床试验是同一种药物的非盲延伸试验,包括所有保持之前研究的相同剂量53周的60例参与者,。在这一阶段结束时,参与者将进入一个14周的治疗后评估过程(ClinicalTrials.gov标识符:NCT03967249)。
在肢端肥大症治疗中的精准药物(Precision medicine)
考虑到肢端肥大症治疗的所有可用的选项和评价中的所有新兴药物,在当前治疗的情况下,在大多数患者手术失败后接受相同的(fg-SRL)治疗,可以通过对帮助确定每个病人个体化的最佳药物的反应的生物标志物的描述,加以优化。某些生物标志物已经在文献中得到了描述,一些研究小组正在对生物标志物进行描述,以能进行更为个体化的治疗。
对于fg-SRL来说,SST2的表达是最可靠的反应预测因子,对该生物标志物低表达的患者控制疾病的机会较低。此外,其他生物标志物也得到描述,如MRI 的T2加权序列上的肿瘤信号强度、治疗前IGF-I水平、年龄和体重。其他的分子或病理生物标志物也被提出,但仍缺乏标准化和临床应用的参考价值。
SST2的表达被认为是帕瑞肽反应的预测因子,但SST5似乎是对fg-SRL治疗耐药的患者较好的预测因子。然而,有低SST2表达的患者使用帕瑞肽可能有更好的肿瘤收缩。对于培维索孟,一些预测指标被报道有治疗前的GH和IGF-I水平、年龄和BMI。在一些研究中,外显子3缺失生长受体的表达已经被提出作为对培维索孟反应的预测因子,尽管它尚未在较大的研究系列中得到证实。
尽管已经有针对肢端肥大症不同治疗的生物标志物,但该领域仍有改进的需要,特别是在较大规模的研究中,应用稳健的方法学,使对这些生物标志物的分析标准化,并应用于临床实践。
结论
肢端肥大症是一种危及生命的疾病,当不能实现生化控制时,给个体的生活质量带来严重的负担。目前的药物治疗,虽然有效且相对安全,但并没有在一定比例的患者中实现疾病控制。因此,目前已批准的药物的新配方或组合以及临床开发中的新分子将为这些患者带来新的视野。垂体肿瘤特征(生长模式、基因突变、免疫组化方面)和患者特定方面(并存疾病、GH/IGF-I水平)的科学知识的进步将有助于确定疾病反应的生物标志物,从而能进行个体化治疗,而不是通用的措施方法(universal algorithm approach)。



