作者:张陈诚、王林斌、胡威、王滔、赵轶杰、潘宜新、Leonardo Almeida、Adolfo Ramirez-Zamora、孙伯民、李殿友
通信作者:李殿友
作者单位:上海交通大学医学院附属瑞金医院神经外科、功能神经外科
译者:李洪阳、潘宜新
原文发布于Neurosurgery,2020.12
[REF: Zhang C, Wang L, Hu W, et al. Combined Unilateral Subthalamic Nucleus and Contralateral Globus Pallidus Interna Deep Brain Stimulation for Treatment of Parkinson Disease: A Pilot Study of Symptom-Tailored Stimulation [published online ahead of print, 2020 May 27]. Neurosurgery. 2020;87(6):1139-1147. doi:10.1093/neuros/nyaa201] PMID: 32459849
摘要
背景:
在帕金森病PD的治疗中,丘脑底核STN与内侧苍白球GPI是两个最常见的靶点。然而,基于个体化的靶点选择仍然是一个临床难题。
目的:
鉴于STN和GPI有各自临床治疗优缺点,我们在个别PD患者行联合单侧STN和对侧 GPI DBS 治疗(一侧脑半球STN,对侧脑半球GPI;简称不对称靶点 DBS 治疗),以将两靶点的临床收益最大化,并尽可能减少副作用。
方法:
我们回顾性分析8位进行不对称靶点 DBS 治疗的原发性帕金森病患者的临床资料,并评估患者在基线期、6个月随访、12个月随访时的运动与非运动症状。我们在以下几种状态进行评估:药物分别开期/关期状态下双侧刺激、单侧STN刺激,及关闭双侧刺激。
结果:
在6个月随访和12个月随访时,我们发现患者在药物关期/刺激开机状态下,经 UPDRS-III 和 TUG 量表评定后的运动功能明显改善。同时,12个月随访时,患者主诉左旋多巴服药量减少,生活质量明显提高;同时发现,患者在药物开期/刺激开机时,中轴症状有所改善,步态和跌倒评估有64%的改善率。研究过程中未发现患者出现严重并发症。
结论:
我们的研究发现,对于个别的PD患者,不对称靶点DBS手术是一种行之有效,且易被接纳的治疗。
1
帕金森病(PD)患者晚期,常常出现药物顽固性运动症状,运动波动,左旋多巴诱导的异动症等并发症,此时常考虑脑起搏器(DBS)这一项成熟的治疗手段。1以往临床实践中,我们选择不同部位作为脑起搏器靶点位置,以提高临床疗效并减少副作用。尽管PD患者最佳的DBS靶点仍未知,大量的长期随访研究发现GPI和STN两个靶点对于控制运动症状和维持治疗疗效有行之有效。2DBS治疗结合药物治疗比单纯药物治疗效果更佳。然而,理想的靶点选择仍有争议。
通常来说,靶点的选择基于患者的用药史、疾病进程、主诉等。然而这些因素在不同的患者之间差异较大,尤其是患者的症状发生频率、症状分型、偏侧性、对DBS治疗和药物治疗的反应性等等。3甚至某些晚期PD患者存在认知功能减退和精神症状等问题。鉴于不同靶点有其各自的临床收益和风险,因此对于特定的PD患者,合适靶点的选择显得尤其重要。
具体来讲,STN可以有效减少PD患者术后多巴胺能药物服用量。4尽管没有有效证据表明在震颤控制方面STN效果优于GPI,在临床工作中对于震颤症状的控制,我们常考虑STN靶点治疗。2如果治疗主要目的是提高药物耐受性、减少左旋多巴诱发的异动症,GPI则更为恰当。4除此之外,对于已有认知损害及精神症状或潜在高风险因素的PD患者来说,也常考虑GPI治疗。4,5对于伴有吞咽障碍、步态损害、跌倒、构音困难等其他中轴症状的PD患者,GPI更是常用的靶点。6
因此,在PD患者的DBS治疗中,STN和GPI两个靶点互有利弊,这也意味着不同患者之间靶点的选择无需趋同。至于DBS手术选择单侧电极植入还是双侧,结论亦是如此。对于PD患者的DBS治疗,双侧电极植入比单侧更常用,因为前者能更好的控制PD病程进展。7然而对于运动症状偏侧性明显较为的PD患者,单侧DBS电极植入由于引起更少的副反应,同样可以显著改善PD患者症状。7而初次手术选择单侧DBS电极植入的PD患者多数会考虑二次手术,即在对侧植入电极。8,9总而言之,个体化的、以症状控制为导向的靶点选择方式对于将患者的临床收益最大化和减少副反应来说非常重要。
在本研究中,我们使用不对称靶点DBS手术治疗晚期PD患者,并评估临床疗效。我们回顾性分析8位PD患者在不对称靶点DBS手术后6个月及12个月后随访时的临床疗效,并认为:相较于传统的双侧对称靶点DBS治疗,不对称靶点DBS手术具有相近的临床疗效,并减少了副反应的发生。
方法
医学伦理
本研究由当地伦理委员会批准,并遵守赫尔辛基宣言规定,所有患者签署书面形式的知情同意书。我们承诺科研成果发表过程中不透露患者任何私人信息。
患者
本研究回顾了自2017.8-2019.3在本科室行不对称靶点DBS手术的原发性PD患者的临床转归。共纳入8位PD患者,包含完整的术前及术后1年随访的评估资料。不对称靶点DBS手术的PD患者的筛选标准包括(1)高度不对称性帕金森病(不对称指数>0.25)或(2)明显的运动症状伴有严重的中轴症状,不伴认知功能损害及精神症状。在本队列中,6位患者有明显的症状不对称性,2位患者存在严重的运动症状及中轴症状。患者的人口学信息及临床特征如表1所示。本研究其他入组及排除标准同常规DBS手术。针对单个患者的DBS靶点选择由DBS多学科团队决定。确切地讲,对于其中6位患者(患者1-6),选择STN靶点用于严重一侧的症状的治疗。对于其他2位患者(患者7-8),选择在左侧半球STNDBS,因已有证据表明左侧半球主导四肢运动,而右侧半球主导中轴症状。3,10
表1:
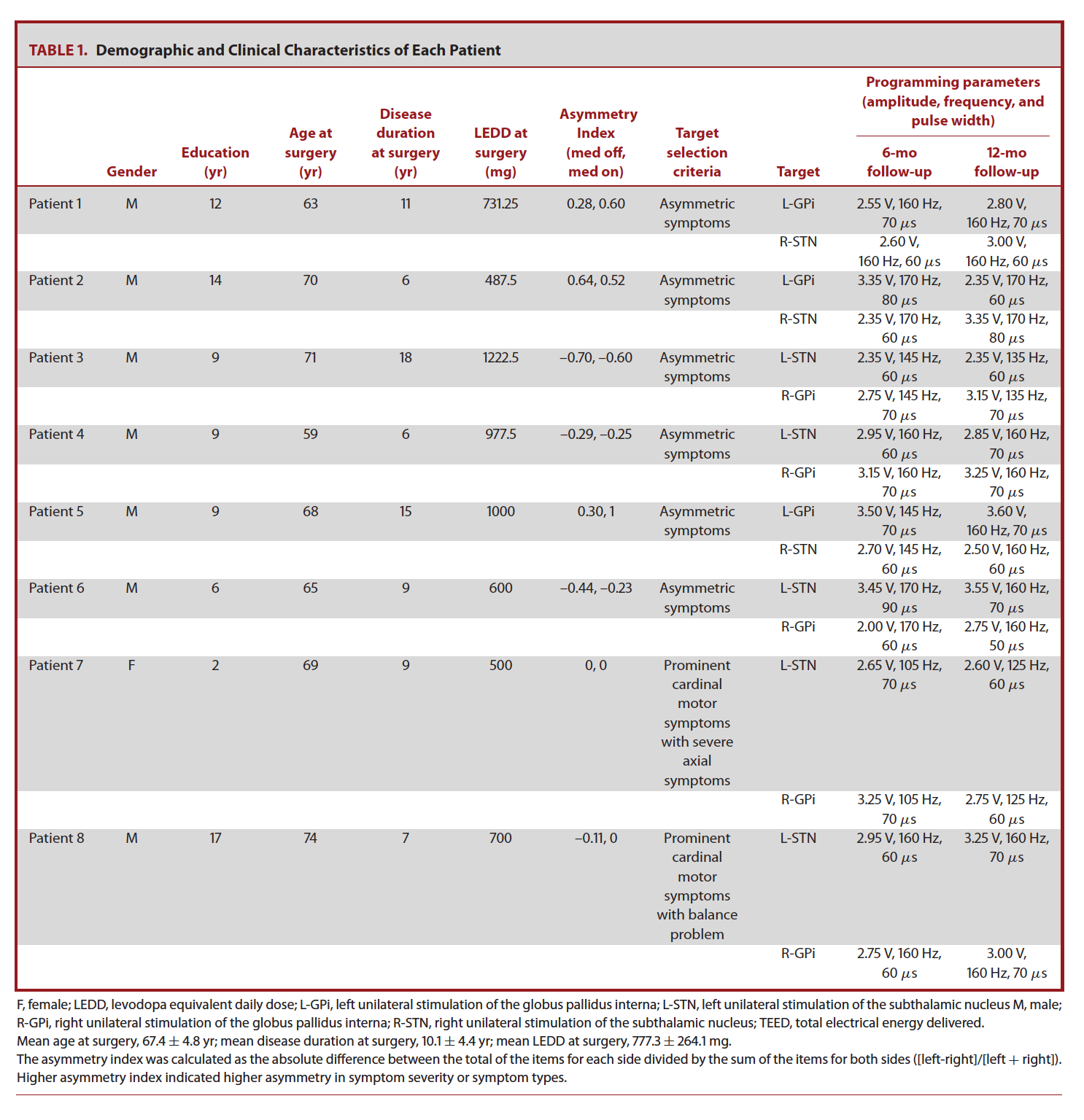
患者评估
主要及次要临床观察指标
在基线期、术后6个月及术后1年时获取主要及次要临床观察指标。主要临床观察指标为UPDRS-III评估后的运动症状严重程度。为了进一步明确不对称靶点手术的疗效,我们将UPDRS-III分为3个子目录:(1)中轴症状,包含言语、表情、站立平衡实验、姿势、步态、步态冻结、姿势稳定性,分数0-28(分数越高,中轴症状越严重);(2)STN刺激后对侧肢体症状;(3)GPI刺激后对侧肢体症状。肢体症状目录包括相应的肢体僵直程度、对指实验、握拳实验、轮替实验、脚趾拍地、腿部灵活性、姿势性震颤、动作性震颤、静止性震颤幅度,分数0-52(分数越高,肢体症状越严重)。静止性震颤持续性及运动迟缓也体现于相应肢体症状严重程度分数。同时,患者对左旋多巴的反应性通过计算药物关期UPDRS-III分数减去药物开期UPDRS-III分数所得。同时,我们评估站立步行实验(TUG)及步态跌倒问卷(GFQ),作为主要运动症状观察指标;GFQ总分0-64,分数越高提示步态及跌倒问题越严重。
我们使用了3个次要的临床观察指标:(1)生活质量,通过PDQ-8,UPDRS-I,UPDRS-II, EQ-5D-5L, BMI反映;(2)非运动症状(NMS),通过NMSQ(含30个条目,覆盖10类症状)、HADS,MMSE(分别对患者的情绪状态及总体认知功能做更加准确的评定)反映;(3)运动并发症,通过UPDRS-III和药物剂量评定,患者每日帕金森药物服用量转换为左旋多巴日等效剂量。11
基线期及术后6个月、12个月随访评估
术前基线期,患者的运动功能在药物关期(药效“隔夜消退”后)和药物开期(服用阈上剂量的左旋多巴1小时后)两状态下评估。同样的,我们在术后6个月、12个月时也评估患者在药物开关期的运动功能。在6个月随访时,我们评估患者在药物关期/刺激开机(GPI+STN+MED-)及药物关期/刺激关机(GPI-STN-MED-)两个状态下的运动功能。在12个月随访时,我们在药物开关/刺激开关四个状态(GPI-STN-DBS-,GPI-STN-MED+, GPI+STN+MED-, GPI+STN+MED+)及药物开关/单侧STN刺激(GPI-STN+MED-,GPI-STN+MED+)共六个状态下评估患者运动功能。
刺激关机状态为DBS设备关闭超过1小时。患者12个月随访时住院2天,第1天完成双侧刺激开和关的四个状态下的评估,当晚停止服用帕金森药物,第2天在GPI-STN+MED-和GPI-STN+MED+两个状态下评估。并记录患者在末次随访时的DBS参数。
手术过程和靶点定位
术前在局麻下安装Leksell立体定向头架(Elekta,Stockholm, Sweden)后行CT扫描,使用Surgiplan软件(Elekta,Stockholm, Sweden)融合CT和3TMRI影像。术中全麻下植入双侧电极(Medtronic3387/3389 [Medtronic, Dublin, Ireland] 或PINSL302, PINS 302 [Beijing PINS Medical Co, Beijing,China]),并通过C臂机确认电极植入深度,测试电阻大小后手术结束。术后行CT或MRI确认电极位置并排除颅内出血或积气。
统计分析
初步数据校验后发现数据分布明显非正态性,使用Kolmogorov-Smirnov检验后排除参数检验。故使用非参数Wilcoxon符号秩和检验对基线期、6月随访和12月随访的数据进行两两比较,并使用 Pearson's 卡方检验分布比较基线期和两次随访期数据。对于个别数据缺失,我们使用相应的组平均值代替。双侧概率p<0.05即为有统计学意义。通过使用软件 SPSS 20.0 (IBM, Armonk, New York)进行统计分析。
结果
首先,我们分析不对称靶点DBS手术后的主要和次要观察指标。其次分析药物关期/单侧STN刺激时的临床疗效。
不对称靶点DBS治疗的临床转归
运动症状
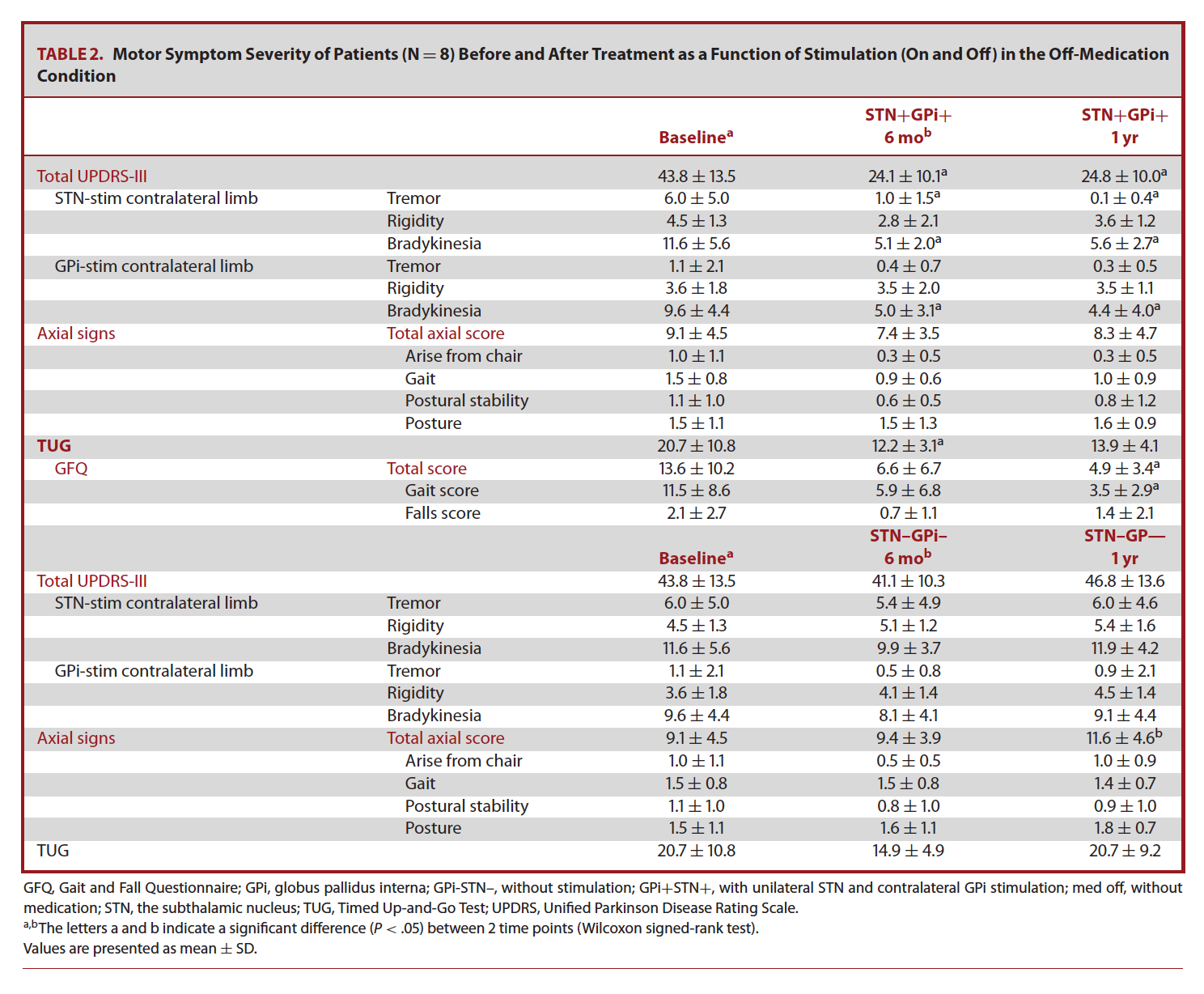
术后发现,患者在刺激开机/药物关期(GPI+STN+MED-)状态下,经UPDRS-III评估后的整体运动功能改善良好。相较于术前,在术后6个月和12个月随访时,患者平均总UPDRS-III分数分别下降45%和43%(表2)。
术后6个月和12个月随访时,患者在刺激开机/药物关期(GPI+STN+MED-)状态下,经UPDRS-III中轴症状总分评估后,发现中轴症状改善较术前未发现统计学差异。相较于基线期,6个月和12个月随访时TUG分数均提高41%(表2)。除此之外,12个月随访时患者步态跌倒问卷(GFQ)分数相较术前提高64%(表2)。在GFQ子目录中,步态一项比跌倒一项改善更加明显。
表2:
生活质量
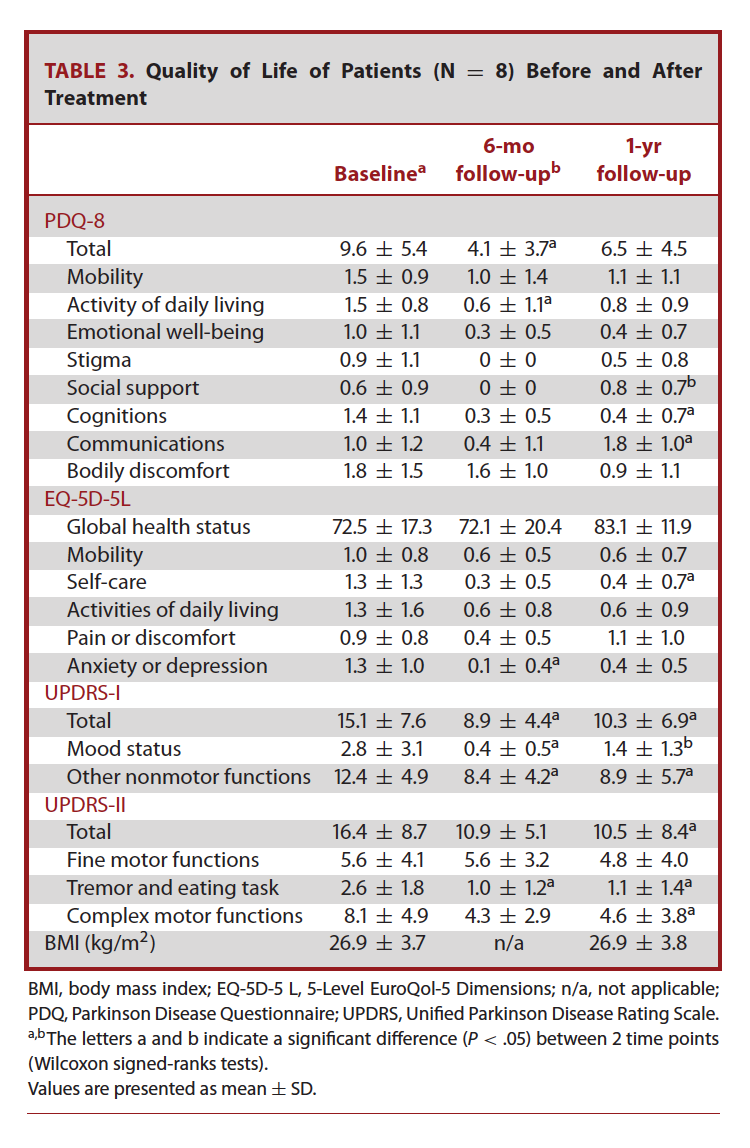
术后6个月随访时,患者的生活质量明显提高(PDQ-8量表总分相较术前有57%改善)、日常生活中非运动症状和运动症状显著改善(UPDRS-I总分下降41%,UPDRS-II总分下降62%)。然而12个月随访时,只有日常生活中的非运动症状改善效果持续,同时未发现患者的BMI明显变化(表3)。
表3:
非运动症状
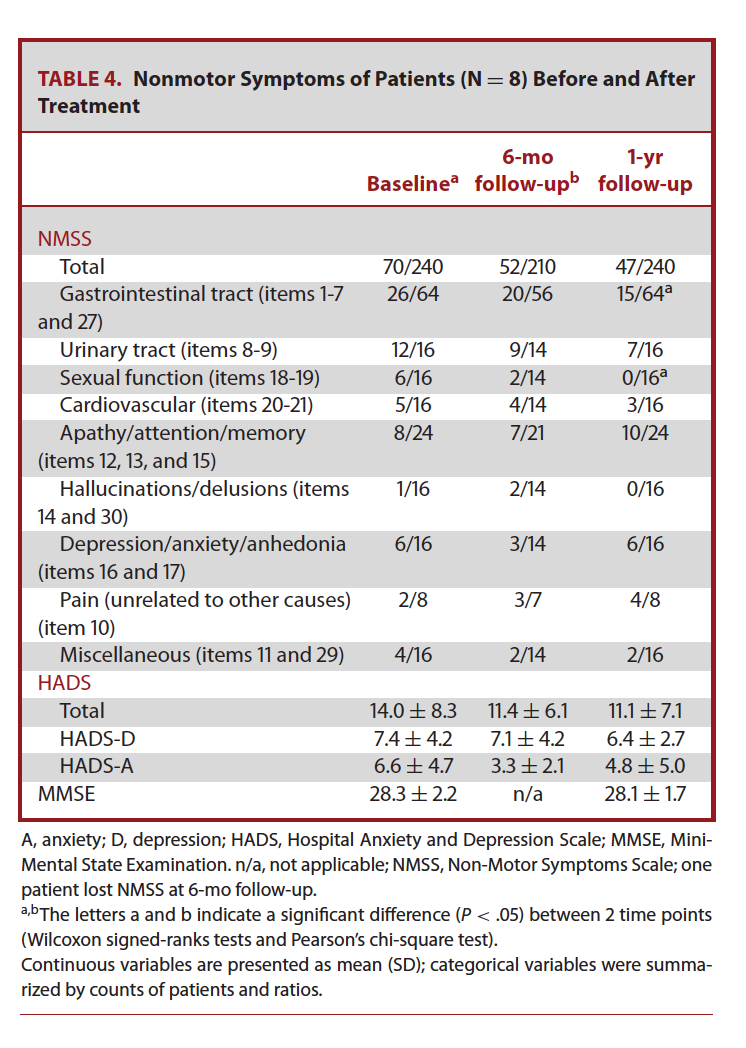
我们使用NMSS量表评估非运动症状改善程度。术前已有非运动症状的患者的数量在术后12个月随访时未发生变化(表4)。除此之外,患者焦虑、抑郁水平(通过HADS量表评估)和总体认知水平(通过MMSE量表评估)在术后12个月随访期间未发现明显变化(表4)。
表4:
运动并发症和药物服用
术后患者的运动并发症和症状波动现象总体减少。除此之外,术后12个月患者服药量LEDD水平降低41%(表5)。值得注意的是,DBS刺激的TEED值在STN在GPI之间无明显区别(表1和表5)。
表5:

药物影响(分别对比基线期MED+和随访期GPI-STN-MED+,基线期MED-和随访期GPI-STN-MED-)
我们进一步评估基线期和术后6个月、12个月时DBS关机状态下,药物开关的影响。在术前MED-和术后6个月、12个月随访时GPI-STN-MED-状态下,UPDRS-III分数无显著差别。另一方面,患者对左旋多巴冲击试验的反应性从术前的48%(对比MED-和MED+)降低到术后12个月时的26%(对比GPI-STN-MED-和GPI-STN-MED+)。最后,药物对中轴症状在基线期有41%的改善,在12个月随访时有15%的改善(表2和表6)。
表6:
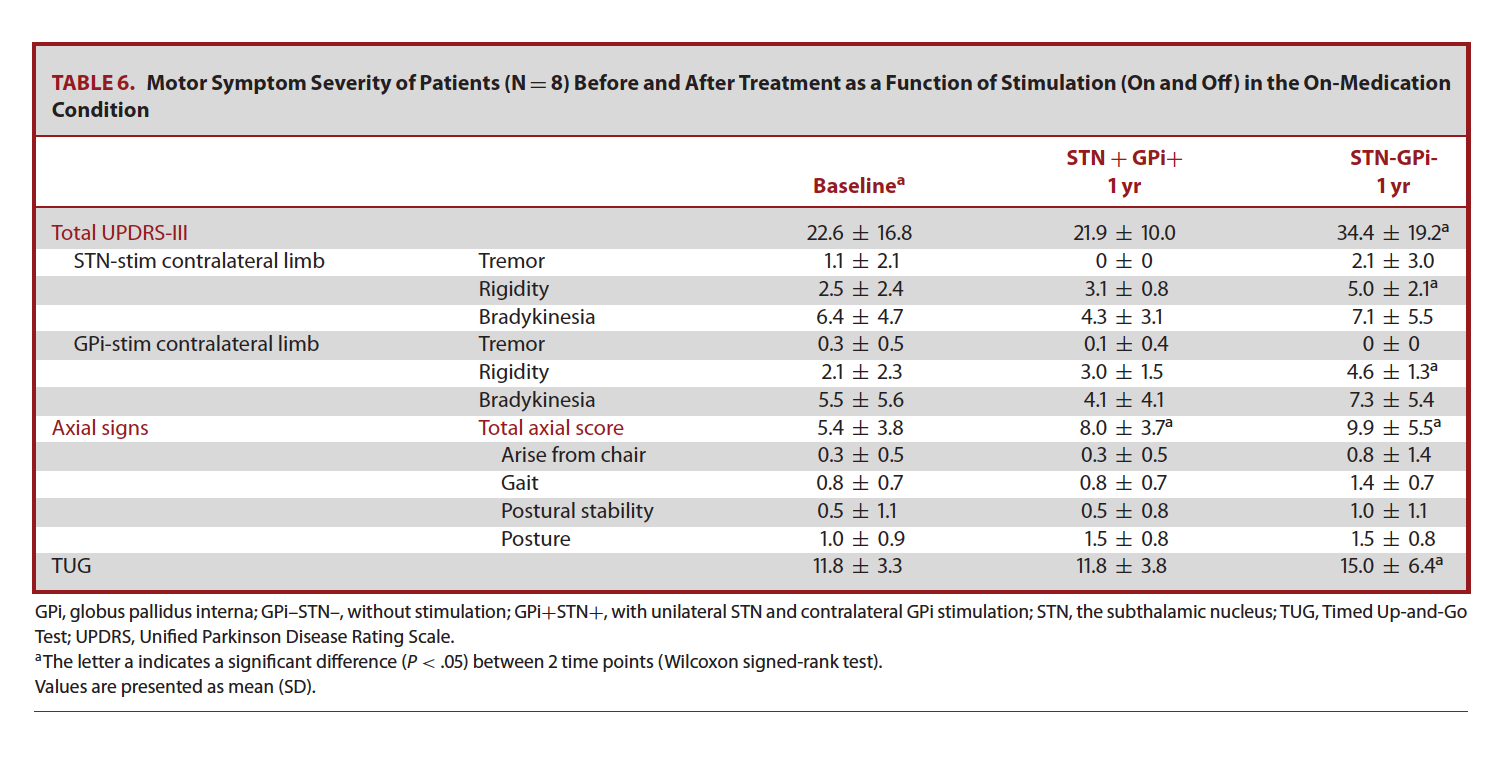
单侧STN刺激(关闭对侧GPI刺激)后症状变化
在12个月随访时,我们在关闭单侧GPI刺激,只有对侧STN刺激后评估患者症状。我们发现相较于双侧刺激打开时,在关闭单侧GPI刺激后,经UPDRS-III量表评估后患者运动症状突然加重,并因药物开期/关期状态步态而恶化程度不同。药物开期时,UPDRS-III恶化幅度37%;药物关期时,UPDRS-III恶化幅度40%;无论是在药物开期还是药物关期时,单侧STN刺激和不对称靶点同时刺激对患者中轴症状影响无差别。
我们进一步评估12个月随访时关闭GPI刺激后对TUG分数的影响。结果显示,相较于单侧STN刺激,不对称靶点双侧同时刺激可以引起更明显的运动功能改善。具体为:药物开期时GPI-STN+MED+和GPI+STN+MED+两种状态下TUG分别为12.8s和11.8s;药物关期时GPI-STN+MED-和GPI+STN+MED-两种状态下TUG分别为10.1s和8.3s(图1)。
图1:
副反应
1位患者(13%)术后出现短暂的昏迷和幻觉。2位患者在随访6个月时出现轻度的构音困难。未发现其他副反应。
结论
主要发现
在此队列中,12个月随访时我们发现,不对称靶点DBS治疗不仅对患者的运动功能改善明显,而且对生活质量和日常生活功能明显提高。同时也发现,患者术后服药剂量和运动并发症,尤其是运动波动明显减少。另一方面,术后患者的中轴症状、体重、非运动症状(包括总体认知水平、焦虑情绪、抑郁情绪)无明显加重。最后,术后未发现明显副反应。
解释
相较于以往报道的双侧 STN DBS 或双侧 GPI DBS 手术后患者术后运动功能改善30%-60%,本研究中的患者总体运动功能改善43%-45%,两者并未发现明显差异。12另外,尽管只在单侧 STN 植入刺激电极,我们仍观察到患者在1年随访时服药量LEDD下降41%,这与既往报道中双侧 STN DBS 术后LEDD50%的下降程度相仿。12由此,本研究提示单侧DBS手术也可以达到减药的目的,这可以用于患者靶点的选择,尤其是那些减药需求强烈、出现对侧躯体异动症、情绪问题、认知损害的PD患者。5研究结果发现不对称靶点DBS治疗后同时出现了STN和GPI两个靶点的临床收益,并且安全性有保障,而这与我们的假设相一致。并且患者在术后很少出现认知障碍和情绪问题。除此之外,STN DBS 引起的特有的副反应,13如异动症、体重增加、抑郁情绪并未在本研究中的患者中出现。
既往发现单侧DBS治疗对于仅在单侧出现的运动症状有良好治疗效果。14本研究中,我们比较了不对称靶点DBS双侧刺激和单侧STN刺激效果。不出意外的发现,双侧刺激的效果要优于单侧STN刺激,因为既往有报道PD患者在单侧DBS手术后对运动症状控制效果不满意,要求二次手术植入对侧DBS电极。 8,9
我们推测,在某些中晚期PD患者中使用不对称靶点DBS治疗可以减少副反应的发生。如果得到证实的话,不对称靶点DBS治疗将会是一个更常用的治疗选择,因为可以同时对更多的症状有明显改善。但仍有某些PD患者对靶点的选择较为局限,比如异动症较为明显时常选择双侧GPI靶点。总而言之,由于某些限制因素的存在,比如如样本量过少,随访时间过短,本研究无法充分验证上述结论。
局限性
本研究存在一些限制因素。首先,本研究是一项观察性研究,因此患者抽样误差或其余混杂因素不能完全排除。其次,本研究样本量较少,随访期较短,本样本量大小可以阐明主要临床疗效变化,但对于细微变化无法确切发现。第三,术后疗效能否长期维持以及1年随访期过后有无出现其他临床变化仍未可知。第四,目前中轴症状的评估只包含步态、跌倒、姿势,而不含言语、吞咽功能。第五,我们并没有设置双侧STN DBS 组和双侧GPI DBS组和单侧GPI刺激对照。最后,我们对于认知功能和精神症状的评估较为粗略。
普遍性
由于本研究包含的患者并非来自随机抽样,并无代表性,所以上述结论并无法适用于所有接受DBS治疗的PD患者,因为不清楚对于其他PD患者,结果是否一致。尽管如此,我们仍期待对于多数适合双侧STN或GPI DBS治疗的PD患者,不对称靶点DBS治疗是同样有效的治疗方法,暂且无论疗效是否更佳。不管是对于既往行双侧DBS手术,但是治疗效果不佳需要更换靶点的患者,还是既往行单侧DBS手术,计划二次手术达到以更好的治疗效果的患者,不对称靶点DBS治疗都是一项行之有效的方案。
结论
本研究率先发现,不对称靶点治疗对于个别中晚期PD患者是一种有效的治疗方法。我们认为在今后的临床实践中,除传统的双侧对称靶点外,不对称靶点治疗同样值得考虑。在PD患者治疗方案选择上,STN和GPI各有优缺点,两者互补,因此在PD患者选择个体化DBS治疗方案时,不对称靶点是一种有效的新方法。当然,还需要样本量更大的、有良好对照的临床试验来进一步验证此结论。
利益冲突
作者与文中提到的药物、材料、设备并无私人或团体利益往来。
参考文献
1. Deep-Brain Stimulation of the Subthalamic Nucleus or the ParsInterna of the Globus Pallidus in Parkinson’s Disease. NEngl J Med.2001;345(13):956-963. doi:10.1056/NEJMoa000827
2. Ramirez-Zamora A, Ostrem JL. Globus Pallidus Interna or SubthalamicNucleus Deep Brain Stimulation for Parkinson Disease: A Review. JAMANeurol. 2018;75(3):367.doi:10.1001/jamaneurol.2017.4321
3. Lizarraga K, Luca C, De Salles A, Gorgulho A, Lang A, Fasano A.Asymmetric neuromodulation of motor circuits in Parkinson’sdisease: The role of subthalamic deep brain stimulation. SurgNeurol Int. 2017;8(1):261.doi:10.4103/sni.sni_292_17
4. Follett KA, Weaver FM, Stern M, et al. Pallidal versus SubthalamicDeep-Brain Stimulation for Parkinson’s Disease. NEngl J Med.2010;362(22):2077-2091. doi:10.1056/NEJMoa0907083
5. Bronstein JM. Neuropsychological outcome after deep brainstimulation for Parkinson disease. Neurology.2015;85(16):1433. doi:10.1212/01.wnl.0000473050.23344.3c
6. Rughani A, Schwalb JM, Sidiropoulos C, et al. Congress ofNeurological Surgeons Systematic Review and Evidence-Based Guidelineon Subthalamic Nucleus and Globus Pallidus Internus Deep BrainStimulation for the Treatment of Patients With Parkinson’s Disease:Executive Summary. Neurosurgery.2018;82(6):753-756. doi:10.1093/neuros/nyy037
7. Petraglia FW, Farber SH, Han JL, et al. Comparison of Bilateral vs.Staged Unilateral Deep Brain Stimulation (DBS) in Parkinson’sDisease in Patients Under 70 Years of Age. Neuromodulation.2016;19(1):31-37. doi:10.1111/ner.12351
8. Ehm G, Kim H-J, Kim J-Y, et al. Effect of unilateral subthalamicdeep brain stimulation in highly asymmetrical Parkinson’s disease:7-year follow-up. J Neurosurg.Published online November 1, 2018:1-6. doi:10.3171/2018.5.JNS172006
9. Taba HA, Wu SS, Foote KD, et al. A closer look at unilateral versusbilateral deep brain stimulation: results of the National Institutesof Health COMPARE cohort. JNeurosurg.2010;113(6):1224-1229. doi:10.3171/2010.8.JNS10312
10. Serrien DJ, Ivry RB, Swinnen SP. Dynamics of hemisphericspecialization and integration in the context of motor control. NatRev Neurosci.2006;7(2):160-166. doi:10.1038/nrn1849
11. Romito LM, Contarino MF, Vanacore N, Bentivoglio AR, Scerrati M,Albanese A. Replacement of dopaminergic medication with subthalamicnucleus stimulation in Parkinson’s disease: long-term observation.Mov Disord.2009;24(4):557-563. doi:10.1002/mds.22390
12. Krack P, Martinez-Fernandez R, Del Alamo M, Obeso JA. Currentapplications and limitations of surgical treatments for movementdisorders. Mov Disord.2017;32(1):36-52. doi:10.1002/mds.26890
13. Okun MS, Gallo BV, Mandybur G, et al. Subthalamic deep brainstimulation with a constant-current device in Parkinson’s disease:an open-label randomised controlled trial. LancetNeurol. 2012;11(2):140-149.doi:10.1016/S1474-4422(11)70308-8
14. Shemisa K, Hass CJ, Foote KD, et al. Unilateral deep brainstimulation surgery in Parkinson’s disease improves ipsilateralsymptoms regardless of laterality. ParkinsonismRelat Disord.2011;17(10):745-748. doi:10.1016/j.parkreldis.2011.07.010
通讯作者简介
李殿友 副主任医师
上海交通大学医学院附属瑞金医院
李殿友,医学博士,上海交通大学医学院附属瑞金医院功能神经外科副主任医师,从事脑深部电刺激治疗帕金森病的临床工作近20年。
擅长脑深部电刺激、脊髓电刺激、骶神经电刺激以及鞘内药物输注系统(吗啡泵,巴氯酚泵)等神经调控技术;以及精神类疾病的立体定向手术治疗:1)帕金森病,特发性震颤,肌张力障碍等运动障碍性疾病的脑深部电刺激(脑起搏器)治疗;2)强迫症,焦虑症,抑郁症,精神分裂症,厌食症,抽动症,酒精成瘾等物质依赖及其他精神类疾病立体定向手术治疗;3)血栓闭塞性脉管炎,顽固性心绞痛等缺血性疾病,以及神经病理性疼痛的脊髓电刺激治疗;4)中枢痛,残肢痛的运动皮层电刺激治疗;5)大便失禁,顽固性便秘,尿失禁,盆底疼痛的骶神经电刺激治疗;6)癌性疼痛,肢体痉挛性疼痛的鞘内药物输注(吗啡泵,巴氯酚泵)治疗。
学术团体任职:中国康复医学会第一届帕金森病与运动障碍康复青年专业委员会副主任委员;中国医师学会第三届神经调控专业委员会常务委员;上海市医学会神经外科分会功能神经外科学组委员;上海市疼痛学会神经病理性疼痛学组委员。
2001年开始从事脑深部电刺激治疗帕金森病的临床工作;2002-2004年在瑞典留学,系统地学习了立体定向手术,脊髓电刺激(SCS),鞘内药物输注等神经调控技术的临床技能。
门诊时间:每周一下午,周三上午







