提示
“浙二神外周刊”不定期接收外院投稿,审核后发表。欢迎各专业同道联系我们,分享精彩病例、研究热点或前沿资讯。投稿请联系:shishi74@163.com
前言
病例介绍
患者女性,63岁,因“头痛头晕伴左侧肢体乏力10天”于2020年2月25日入院。
患者10天前无明显诱因下出现头痛头晕伴左侧肢体乏力,无意识障碍、畏寒发热等不适。去当地医院就诊,行头颅CT检查示:右侧额叶恶性肿瘤,转移瘤或胶质瘤可能大(图1)。为求进一步诊治转来浙大二院。门诊拟“右侧基底节占位”收住入院。
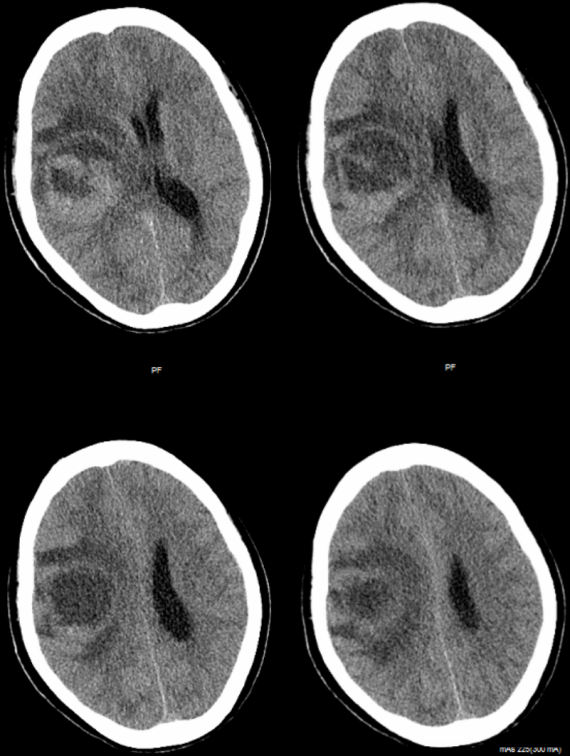
图1.头颅CT检查提示右额肿瘤,伴瘤周水肿。
既往有高血压病史。无发热及其他肿瘤病史。
诊治经过
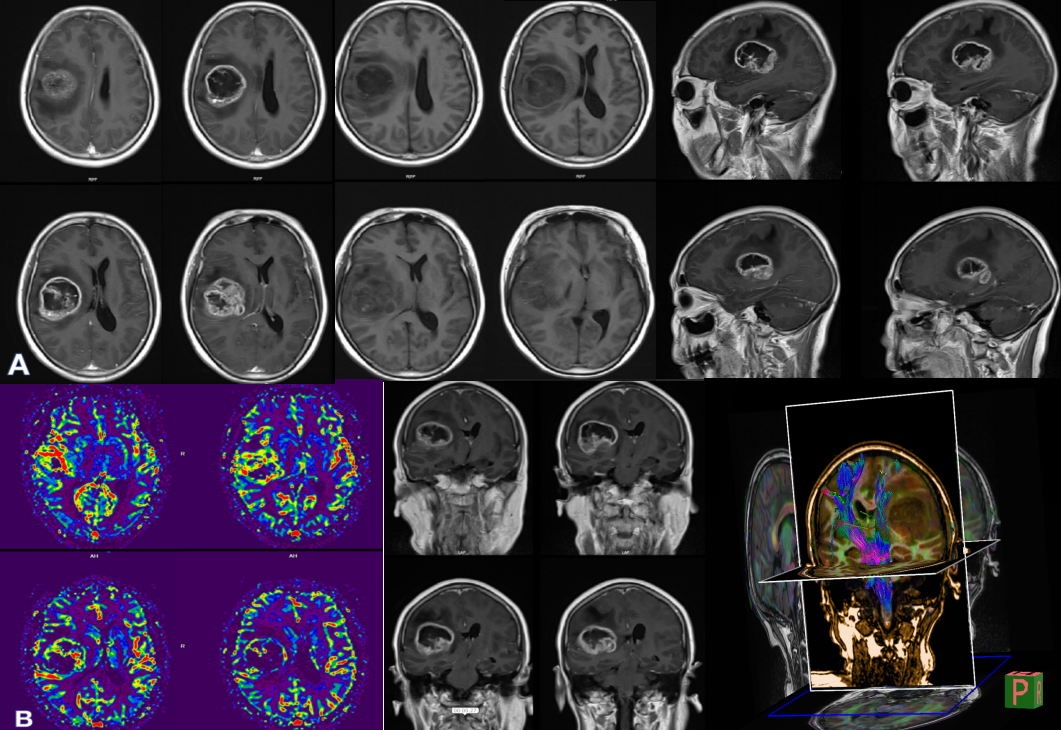

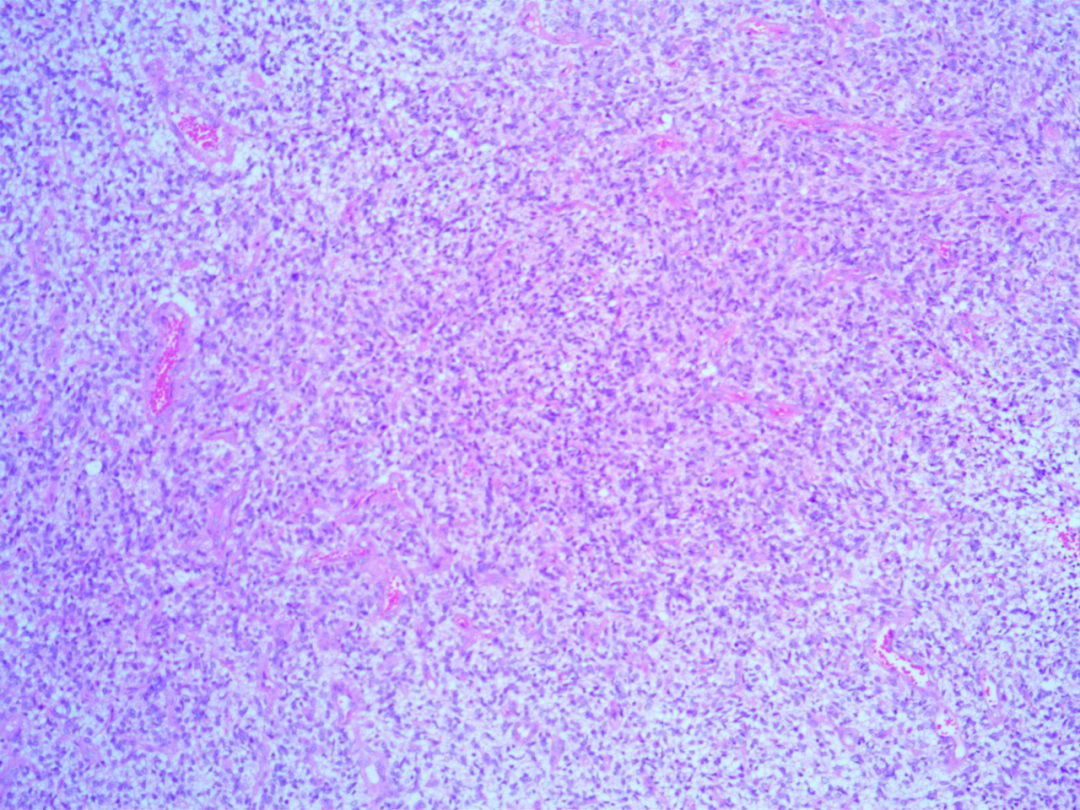
病理结果
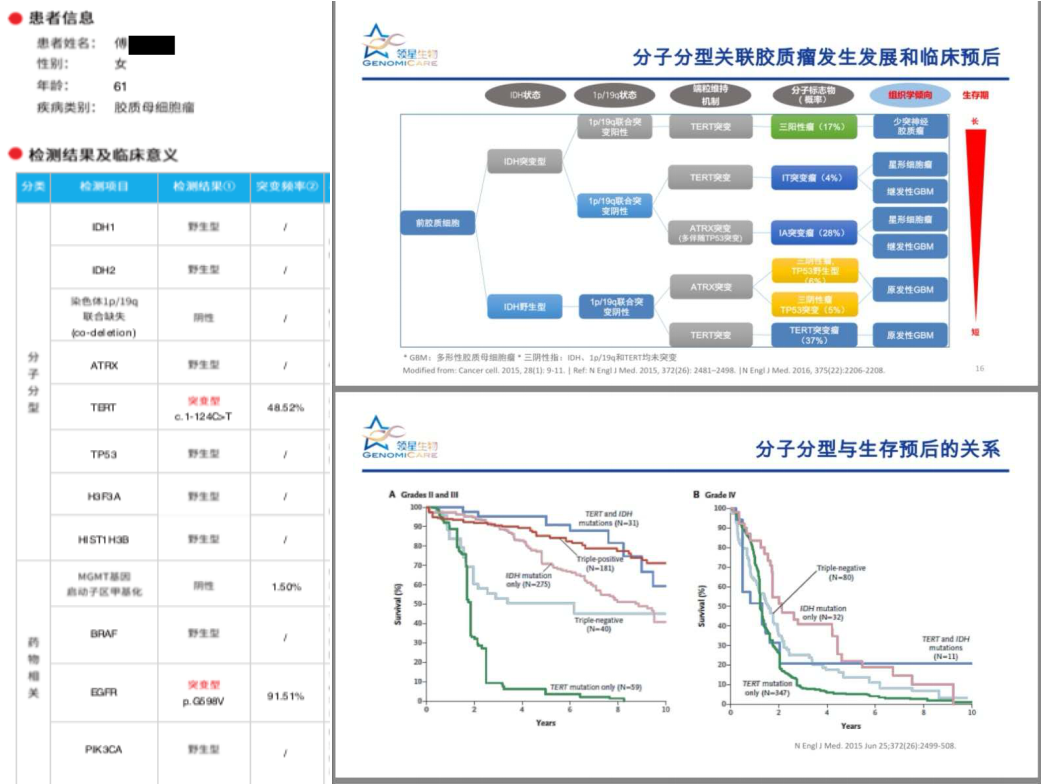
随访结果与MDT讨论
术后一月患者回当地医院放化疗,放疗范围包括原瘤床区DT6000cGY/30f同步 替莫唑胺口服120mg qd,放疗结束辅助替莫唑胺STUPP方案化疗6个周期。
患者术后三个月MDT讨论:
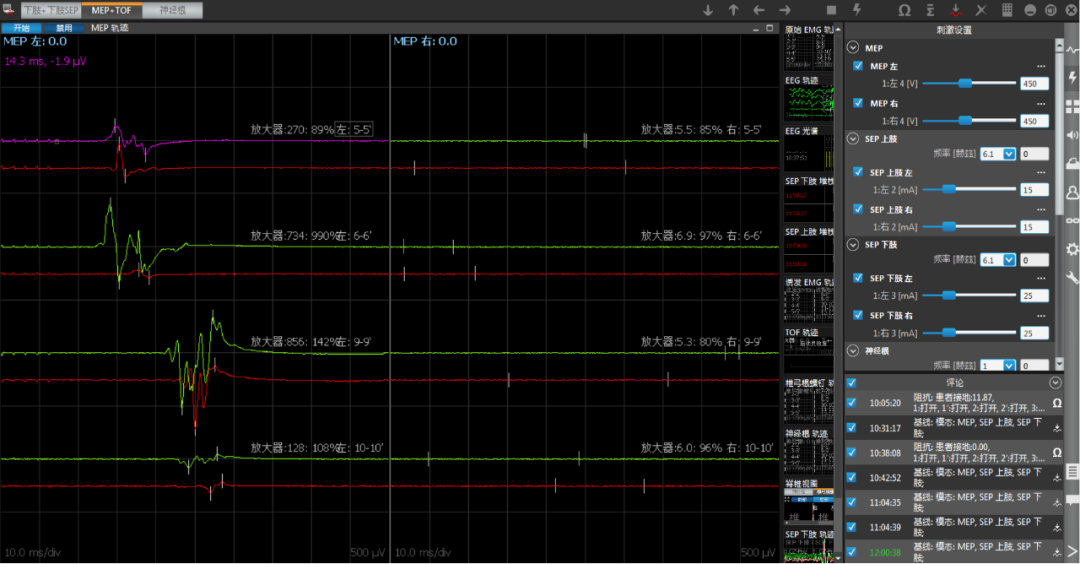
患者术前影像提示强化区域高灌注,提示高级别肿瘤,累及基底节壳核,外囊。手术中应用黄荧光+神经导航确定肿瘤边界,实时神经电生理监测,做到影像全切,术后一过性对侧肌力下降,目前完全恢复,KPS评分90,因MGMT启动子甲基化阴性,化疗建议密度剂量方案,120mg/d,一周on一周off(当地医院使用STUPP方案)。分子病理亚型属于IDH野生TERT突变型胶质母细胞瘤,预后最差,建议每三个月复查强化磁共振。如有明确复发,因患者分子病理提示EGFR阳性,可尝试再手术+化疗+免疫靶向治疗。
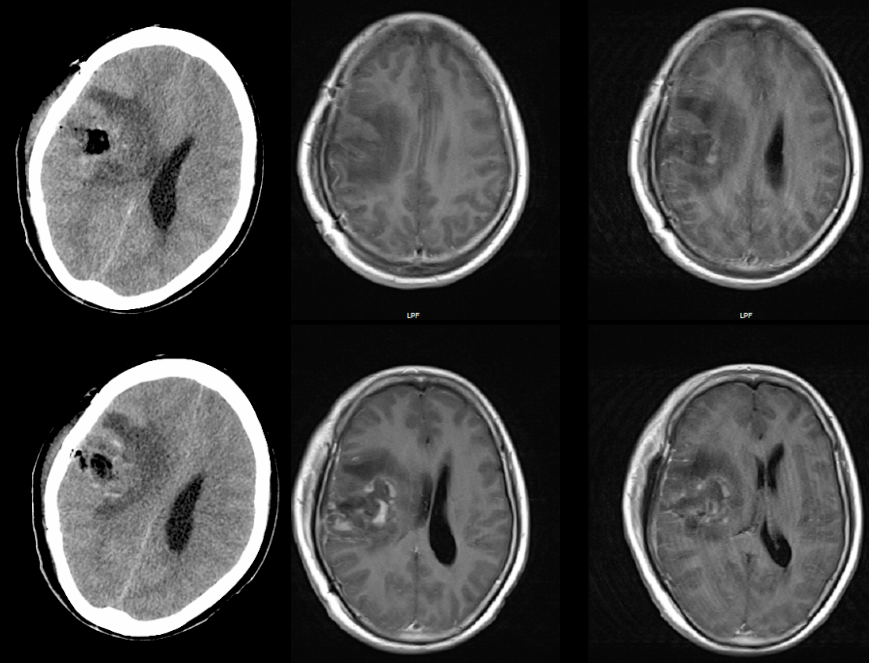
患者随访期11个月磁共振复查(图7),未述特殊不适,KPS评分100。
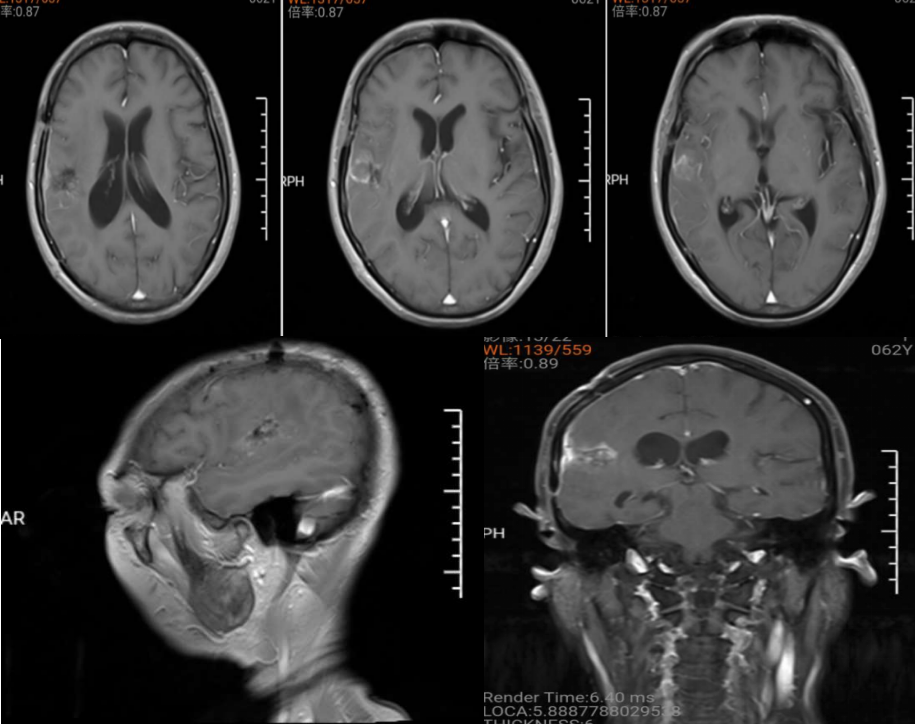
图7. 术后随访11个月,复查磁共振,原病灶区域未见异常强化,右侧受压基底节结构基本正常。
讨论
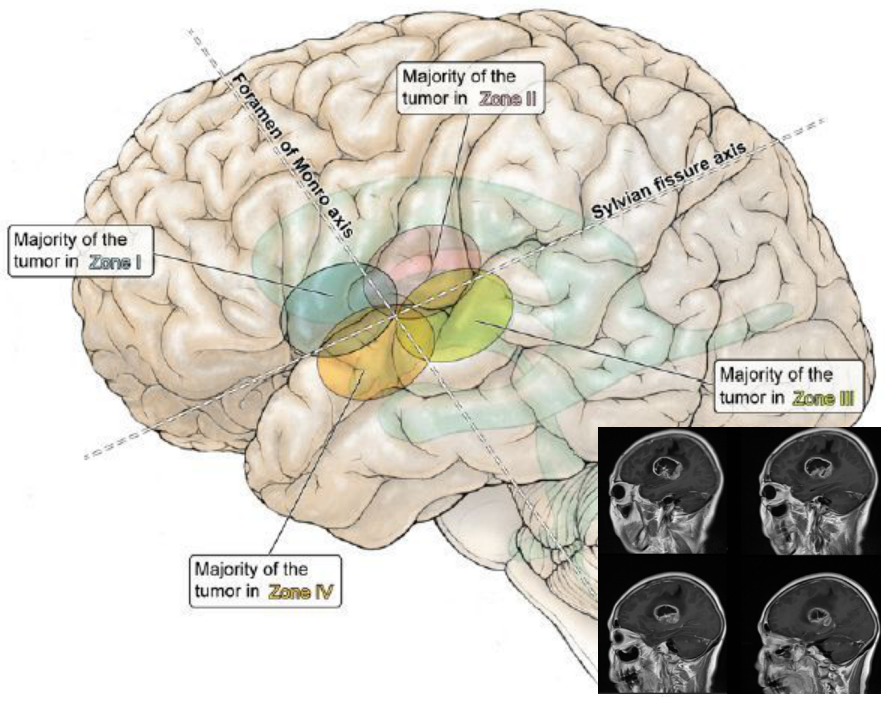
1区:肿瘤在外侧裂上方,室间孔的前方。
2区:肿瘤在外侧裂上方,室间孔后方。
3区:肿瘤在外侧裂的下方,室间孔后方。
4区:肿瘤在外侧裂下方,室间孔前方[31]。
参考文献
1. Yaşargil MG, Reeves JD: Tumours of the limbic and paralimbic system. Acta Neurochir (Wien) 116:147–149, 1992
2. Yaşargil MG, von Ammon K, Cavazos E, Doczi T, Reeves JD, Roth P: Tumours of the limbic and paralimbic systems. Acta Neurochir (Wien) 118:40–52, 1992
3. Simon M, Neuloh G, von Lehe M, Meyer B, Schramm J: Insular gliomas: the case for surgical management. J Neurosurg 110:685–695, 2009
4. Benet A, Hervey-Jumper SL, Sánchez JJ, Lawton MT, Berger MS: Surgical assessment of the insula. Part 1: surgical anatomy and morphometric analysis of the transsylvian and transcortical approaches to the insula. J Neurosurg 124:469–481, 2016
5. Sanai N, Polley MY, Berger MS: Insular glioma resection: assessment of patient morbidity, survival, and tumor progression. J Neurosurg 112:1–9, 2010
6. Hervey-Jumper SL, Li J, Osorio JA, Lau D, Molinaro AM, Benet A, et al: Surgical assessment of the insula. Part 2: validation of the Berger-Sanai zone classification system for predicting extent of glioma resection. J Neurosurg 124:482– 488, 2016
7. Mehrkens JH, Kreth FW, Muacevic A, Ostertag CB: Long term course of WHO grade II astrocytomas of the insula of Reil after I-125 interstitial irradiation. J Neurol 251:1455– 1464, 2004
8. Gravesteijn BY, Keizer ME, Vincent AJPE, Schouten JW, Stolker RJ, Klimek M: Awake craniotomy versus craniotomy under general anesthesia for the surgical treatment of insular glioma: choices and outcomes. Neurol Res 40:87–96, 2018
9. Zhuang DX, Wu JS, Yao CJ, Qiu TM, Lu JF, Zhu FP, et al: Intraoperative multi-information-guided resection of dominant-sided insular gliomas in a 3-T intraoperative magnetic resonance imaging integrated neurosurgical suite. World Neurosurg 89:84–92, 2016
10. Yaşargil MG, Reeves JD: Tumours of the limbic and paralimbic system. Acta Neurochir (Wien) 116:147–149, 1992
11 Daniele Armocida,Alessandro Frati,Maurizio Salvati,et al。Is Ki-67 index overexpression in IDH wild type glioblastoma a predictor of shorter Progression Free survival? A clinical and Molecular analytic investigation. Clinical Neurology and Neurosurgery , 202:106-126 2020
(本文由浙二神外周刊原创,浙江大学医学院附属第二医院神经外科规培医生何家慧医师整理,石键主任医师审校,张建民主任终审)





