神经干细胞(NSCs)在成年哺乳动物脑中存在于两个区域:侧脑室的脑室下区(SVZ)和海马齿状回。
多数研究提示SVZ区的神经干细胞可能是胶质母细胞瘤起源细胞。有研究发现无肿瘤侵袭的SVZ区的神经干细胞存在胶质母细胞瘤的驱动基因突变,而在正常脑组织中未发现这种驱动基因突变。海马区的NSC也有突变,但尚无证据表明与胶质母细胞瘤的发生有关。此外胶质母细胞瘤常侵袭SVZ区,但通常不侵袭海马。因此下文复习SVZ区和海马区NSC及其微环境的区别。

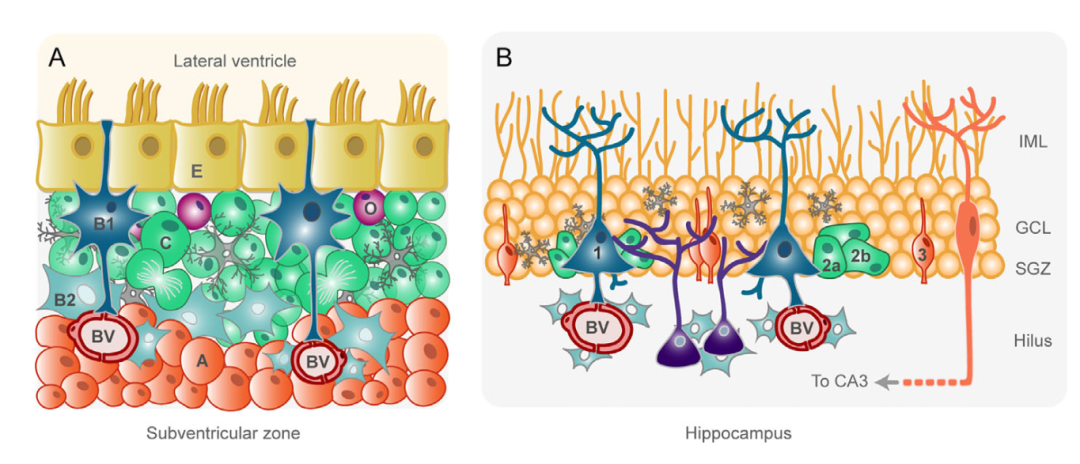
图1:成年啮齿动物脑室下区(A)和海马区(B)的示意图。(相同类型细胞用相同的颜色表示。)
A:室管膜细胞(E,黄色)将侧脑室的脑脊液 (CSF)与脑实质分离。B1细胞(深蓝色)是神经干细胞,基突连接血管(BV),顶突接触脑脊液。B1细胞通过不对称分裂产生C型细胞(绿色。C型细胞是过渡增值的的中间祖细胞,迅速分裂并产生神经细胞(A型,橙色)。神经细胞在由星形胶质细胞包裹中向嗅球迁移,在那里它们分化为成熟的中间神经元。B1 细胞也可产生少突胶质祖细胞(O,呈紫色)。其他胶质细胞,如星形胶质细胞(B2型,天蓝色)和小胶质细胞(灰色)参与控制脑室下区神经发生。
B:神经干细胞(1型,深蓝色),位于海马齿状回粒下区(SGZ),有一个基突连接血管(BV)和多个分支突起伸向内分子层(IML)。1型细胞产生过渡增值的非放射状2型细胞(绿色),可细分为2a型和2b型细胞。 然后,2型细胞产生一个神经元分化方向的中间祖细胞(3型细胞,橙色)。 第3类细胞在颗粒细胞层(GCL)中分化成具有完全功能的颗粒细胞,成熟后,在IML中发生树突状分支,轴突投射到 CA3区。 小胶质细胞(灰色)和星形胶质细胞(天蓝色)在控制神经发生中发挥着不同的作用。
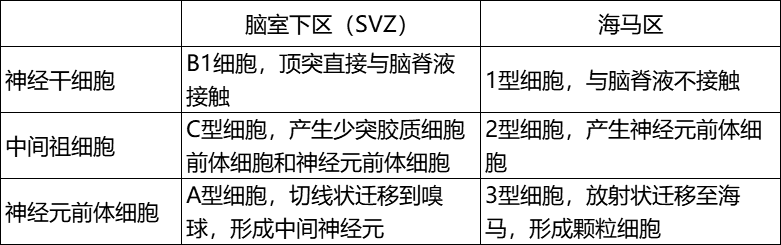
表1:成年啮齿类哺乳动物脑室下区和海马区神经干细胞的主要差异

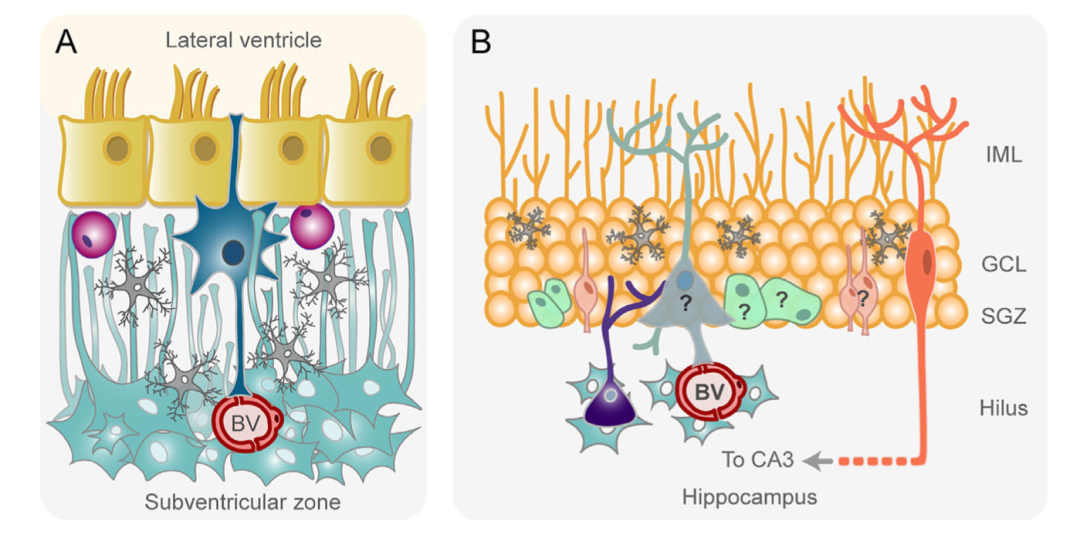
图2:成人脑室下区(A)和海马(B)示意图。
A:星形胶质细胞样神经干细胞(NSCs,深蓝色)位于室管膜细胞层(黄色)的脑室下层,分布在一个缺乏神经细胞和过渡增殖的前体细胞的少细胞层中。该层中的小胶质细胞以灰色表示。推测NSCs产生的少突胶质前体细胞呈紫色。神经干细胞直接接触侧脑室的脑脊液和由一条致密的星形胶质细胞(淡蓝色)带组成的邻近层内的血管 (BV),星形细胞的突起伸向少细胞层。
B:一些研究认为成人类海马齿状回粒下区含有放射状胶质样神经干细胞(淡蓝色),产生增殖的的中间神经元前体细胞(淡绿色)。这些中间前体细胞形成神经元方向的前体细胞(淡橙色),生成成熟的颗粒神经元(橙色)。但也有研究报道成人类粒下区完全没有神经元前体细胞和未成熟神经元。在这些细胞上加一个问号来表示存在争议。微环境中存在其他细胞类型包括小胶质细胞 (灰色)和星形胶质细胞(天蓝色)。GCL:颗粒细胞层; IML:内分子层; SGZ:粒下区。

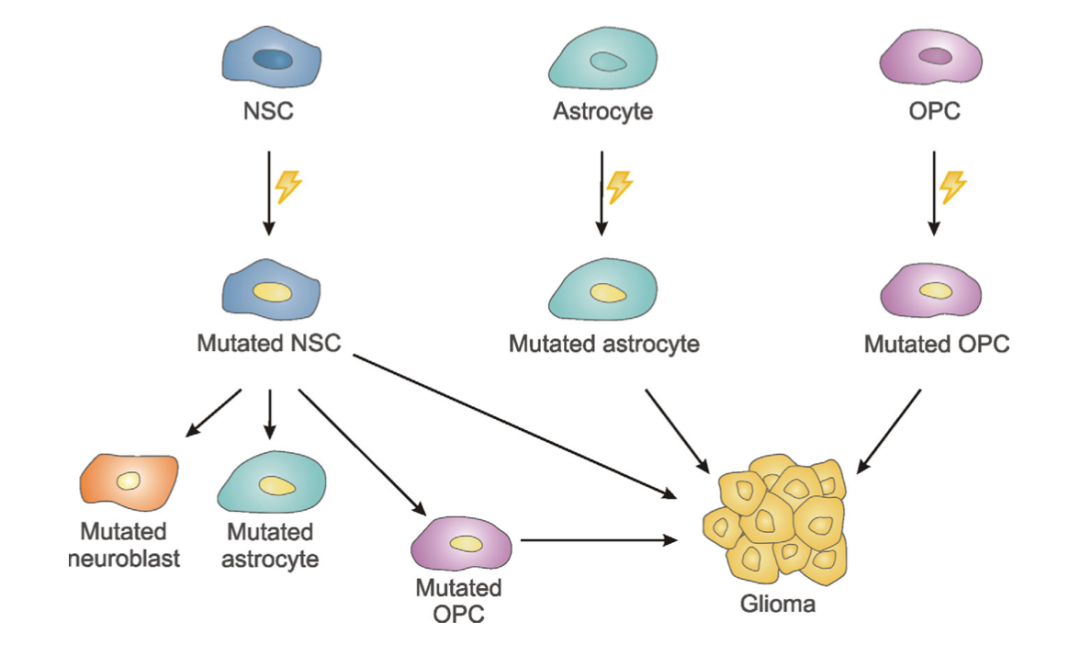
图3:胶质母细胞瘤细胞起源的不同理论的示意图。脑室下区的神经干细胞(NSC)、脑实质内的星形胶质细胞和少突胶质细胞前体细胞(OPCs)的癌症驱动基因突变可能导致胶质瘤的发生。此外,NSC的突变也可以遗传到它们的后代,产生突变的神经细胞和突变的星形胶质细胞,这些细胞不太可能造成肿瘤的形成,产生突变的OPC,就具有异常增值的能力。
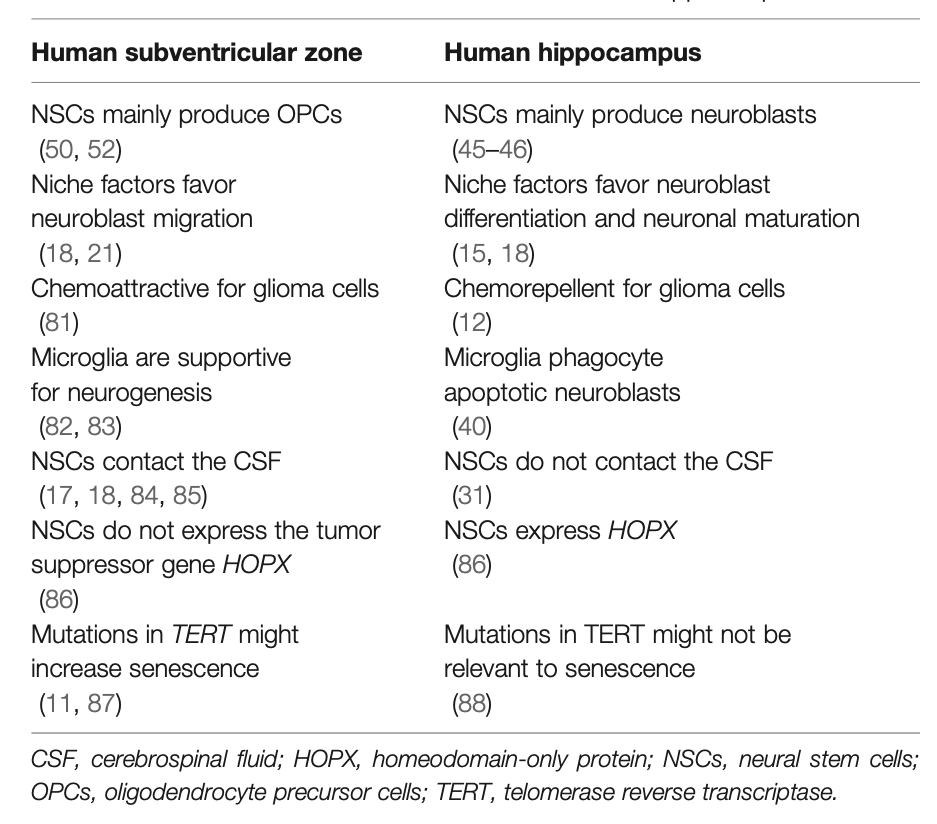
表2:为什么成人脑室下区的神经干细胞比海马区的神经干细胞更容易恶性转化的可能因素。是否产生OPC、微环境倾向神经元迁移、胶质细胞趋化因子,小胶质细胞的作用不同,是否接触脑脊液(微囊),是否表达HOPX基因,以及TERT突变的意义
参考文献:
1.Fontán-Lozano Á, Morcuende S, Davis-López de Carrizosa MA, Benítez-Temiño B, Mejías R, Matarredona ER. To Become or Not to Become Tumorigenic: Subventricular Zone Versus Hippocampal Neural Stem Cells. Front Oncol. 2020;10(November):1-12. doi:10.3389/fonc.2020.602217
2.Lee JH, Lee JE, Kahng JY, Kim SH, Park JS, Yoon SJ, et al. Human glioblastoma arises from subventricular zone cells with low-level driver mutations. Nature (2018) 560:243–7. doi: 10.1038/s41586-018-0389-3





