今天为大家带来的是《Neurosurgery》(中文版)神经损伤与重症分册第三期,由冯华教授翻译并审校的“神经系统功能恢复:转化神经科学原理综述”,欢迎阅读、分享。
原文:
Toward Functional Restoration of the Central Nervous System: A Review of Translational Neuroscience Principles
原文作者:
Stephen C. Harward, MD, PhD1Shivanand P. Lad, MD, PhD1,4,5,7Dennis A. Turner, MA, MD1,3,6,7作者单位:
1.Department of Neurosurgery, Duke University Medical Center, Durham, North Carolina; 2.Department of Neurosurgery, Case Western Reserve University, Cleveland, Ohio; 3.Department of Biomedical Engineering, Duke University, Durham, North Carolina; 4.Department of Mechanical Engineering and Material Sciences, Pratt School of Engineering, Duke University, Durham, North Carolina; 5.Duke Institute for Brain Sciences, Duke University, Durham, North Carolina; 6.Department of Neurobiology, Duke University, Durham, North Carolina; 7.Research and Surgery Services, Durham Veterans Affairs Medical Center, Durham, North Carolina.
编译/审校:
冯华
1
中枢神经系统(central nervous system,CNS)的损伤会使患者产生毁灭性的神经功能障碍,这可能永久性地损害患者的自理能力并降低其生活质量。关于对中枢神经系统如何对损伤作出反应以及如何关键及时的予以干预措施并做出反应的最新研究正在转化为临床应用,这些应用有能力显著改善因脊髓损伤、中风或其他中枢神经系统疾病而导致的永久性神经功能障碍患者的预后。将这些知识转化为实际有效的治疗方法需要涉及神经外科医生、临床医生、治疗师、科学家和工业界之间的战略协作。因此,对关键的神经科学原理共识的理解是至关重要的。从概念上讲,目前中枢神经系统恢复的方法可以按尺度分为宏观(系统回路)和微观(细胞分子)。在这篇论文中,我们回顾了在宏观和微观两个层面上用于促进中枢神经系统恢复的新兴的和成熟的原则,并探讨了神经外科医生在未来发展治疗中的作用。主要原则包括可塑性驱动的功能恢复、轴突出芽的细胞信号机制、损伤后恢复的关键时间以及细胞替代策略的作用机制。然后,我们讨论了旨在跨尺度协同干预的综合方法,并为未来临床试验设计提供依据。最后,我们认为,在功能回路重建的宏观框架内,微观细胞行为的策略调控应为大多数神经修复策略提供基础,神经外科医生的早期介入对临床转化的成功至关重要。
鉴于最近的发展,假设中枢神经系统损伤后功能恢复得到改善,这篇综述文章旨在制定微观和宏观原则,基于最近的数据回顾来指导中枢神经系统的恢复。目标受众包括有兴趣帮助推动这一领域向前发展的神经外科医生。作者总结了不同的“细胞分子原理”,即转录因子、细胞外基质因子和干细胞的影响,以及不同的“系统回路原理”(宏观)如神经元可塑性和脑机接口对中枢神经系统恢复的影响。然后,他们认为,实现功能恢复的最佳和必要方法是协同地将这两种不同尺度的方法结合起来。这一点已被有效诱导损伤后神经元连接性而不是恢复正常功能的研究所证实。他们描述了一些有关免疫治疗和行为干预的最新进展数据。
作者最后分享了一些见解,倡导可能参与该领域临床试验设计的神经外科医生跟上当前的思路。也就是说,细胞再生并不需要恢复正常的回路水平的功能,微观和宏观干预的适当组合和时机的掌控以及患者自觉参与康复努力对他们的康复来说都至关重要。中枢神经系统(central nervous system,CNS)的损伤会使患者出现毁灭性的功能缺陷,这可能会永久性地损害患者的自理能力并降低其生活质量。从社会的角度来看,这仍然是一个巨大而昂贵的负担[1]。尽管中枢神经系统在损伤后的第一年内有一定的恢复能力,但慢性损伤往往是悄无声息的,并且随着时间的推移很难有所改善[2,3]。然而,神经科学的最新进展为以前认为无法治愈的疾病带来了新的希望[4]。例如,历史上首次出现了新的干预措施使慢性和临床完全性脊髓损伤(spinal cord injuries,SCI)的患者能够恢复一定程度的腿部[5-9]和手臂[10]的自主动作控制。此外,通过联合免疫治疗和任务型康复方案,在脊髓损伤动物模型中产生了功能性皮质脊髓束(corticospinal tract,CST)再生[11]和功能性突触形成[12],而在中风动物模型中,前肢活动的完全功能恢复已经得到证实[13]。总的来说,这些进展是建立在一套从实验室转化到临床的新兴神经科学原理的基础上的,这也是为此类患者提供康复的第一个重要切实证据。
从概念上讲,修复中枢神经系统的方法可以按尺度分为系统回路级方法(即宏观)和细胞分子干预方法(即微观)。目前正在研究的宏观方法包括有或无神经接口[5,16]的康复模式[14,15]和电刺激策略[6-10,17-20],目的是提高完整神经元件的兴奋性,并诱导跨损伤的回路可塑性。现代的微观模式大部分都需要手术治疗,包括细胞替代治疗[21-26](如干细胞或胚胎细胞)、通过分子机制[27-33]、光遗传学调节[34]、免疫治疗[13,35-37]和/或增强神经营养指导[38]诱导轴突生长。新的证据表明,策略性地将两种方法结合起来,并利用有意识的意图重新接通受损的回路,对于实现神经系统的完全恢复是至关重要的[4,39]。在本文中,我们回顾了关键的科学原理,讨论了综合方法,并研究了神经外科医生在将这些技术转化为临床现实中的作用。
在中枢神经系统损伤后的急性至亚急性期(如数天至数周),由于水肿减轻、分离解除、残余休眠(或恢复)且完整的功能元件的优化,常出现一定程度的自发性临床改善情况[40,41]。进一步的恢复是通过内在的可塑性机制实现的,如从附近完整神经元的侧支发芽,或通过神经递质、离子梯度、细胞间隙连接和神经胶质细胞的变化带来的现有突触的动态变化[42-49]。在此期间,由于胞外神经环境具有相对疏松的胞外空间、更多的神经营养因子、额外开放的突触位点和探测轴突生长锥,轴突和突触可塑性才得以实现[33,50,51]。另一方面,神经再生对功能的恢复没有明显的帮助[52-54]。6~12个月后,随着环境的稳定,进一步的临床进展减弱[55,56],形成具有抑制性力学性质[57,58]的胶质瘢痕,并重新表达抑制分子,如髓鞘相关蛋白(myelin-associatedproteins,MAPs)和蛋白多糖[59-62]。因此,旨在最大化恢复神经的干预措施倾向于集中在1年前,那时是功能可塑性机制保持活跃时的关键时间段[63]。在此之后的努力方向通常强调加强现有回路、增强耐久性、处理不当塑性(如痉挛和癫痫)的有害影响。然而,最近有证据表明,即使是慢性和完全性脊髓损伤患者,也可能通过以前未开发的可塑性机制,保留一定的功能改善能力。2016年,Donati等人[5]证明,通过使用脑控制外骨骼进行广泛的训练,可以帮慢性和完全性脊髓损伤患者实现一定程度的康复。在此过程中,该小组首次报告了一种治疗策略,该治疗策略能够将患者从慢性完全性脊髓损伤转为不完全性脊髓损伤。最近Rejc等人[9]在2017年发表了一个类似的结果,表明广泛的训练结合硬膜外电刺激(epidural electrical stimulation,EES)对病变远端的脊柱可以达到类似的持久的效果。这些人类试验的结果表明,在某些情况下,可能存在存活但休眠的或亚临床类型的白质束,这些白质束在某些病例中可用于强化和可塑性诱导作用。在大多数通常由钝性创伤性压迫引起的脊髓损伤中,出血倾向于优先发生在中央灰质,因为其质地相对较软和血管形成相对较多(图1)[64]。因此,一些更具机械弹性的周围白质束有可能保持完整(即中央脊髓挫伤)。重要的是,在脊髓损伤大鼠模型中,残余白质束的体积已被证明与脊髓损伤后的运动能力直接相关[65]。同时,临床上完整的人类脊髓损伤也可能显示出残留的亚临床脊髓上连接。这种损伤现在被称为“不完全性损伤”,这表明其对上述干预措施可能有临床反应[66,67]。因此,外骨骼和脊髓刺激策略正在被结合起来,以帮助进一步促进运动完全性或不完全性截瘫患者[8]的康复。
除了内在的脊髓可塑性外,皮质可塑性在促进这种恢复中的相对作用尚不明确。众所周知,在长期不使用或截肢[68-71]以及直接损伤运动皮层[72]后,会发生显著的皮层重组,这种重组往往包括以行为依赖的方式将躯体上相邻的功能扩展到新休眠或受损的区域[72]。此外,有证据表明这种可塑性是可逆的[73,74]。因此,重新参与先前丧失的功能也有可能有助于维持或诱导皮层可塑性,以重新建立或重新生长关键的体感和连接性,从而提高性能(图2)[74,75]。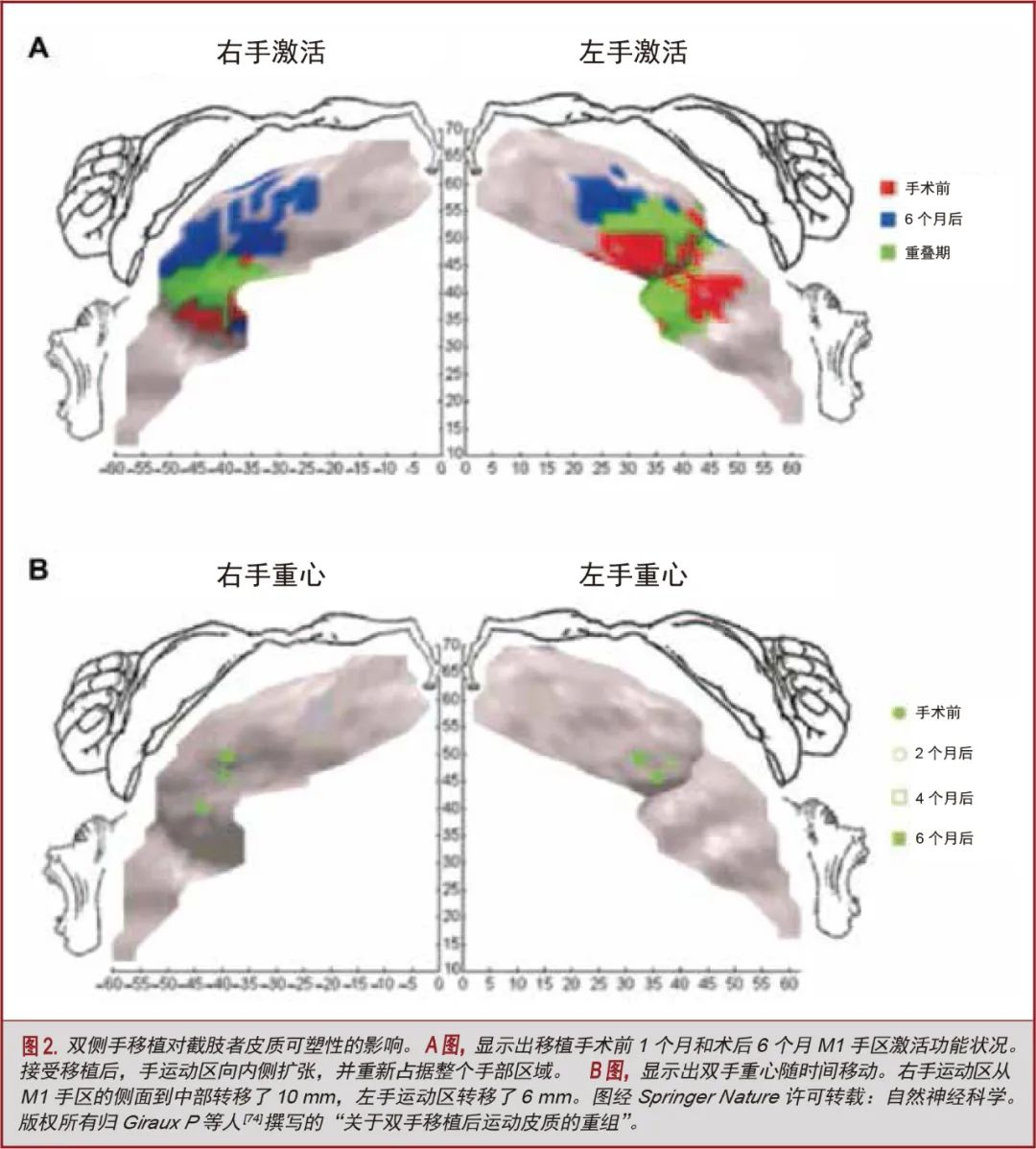
旨在增强脑卒中后皮质可塑性的实验方法包括皮层电刺激[18,76]、迷走神经刺激[77]、成对联想刺激[即成对周围神经和经颅磁刺激(transcranial magnetic stimulation,TMS)][78]以及脑状态依赖性刺激(即成对TMS和神经接口)[79]。虽然皮质刺激模式在动物模型[17,80,81]中的效果很好,但最近的一项III期临床试验显示其最终的结果[19]是阴性的。然而,未来的研究可能会纳入各种新的刺激方案或将各种刺激与本综述后面讨论的大量微观干预措施相结合。但缺乏FDA的批准仍然是此类刺激装置的一个主要问题。然而,一种具有无线传输能力的可完全植入式的大脑皮层电图(electrocorti-cography,ECoG)装置目前正在欧洲进行脑机接口(brain-machine interface,BMI)应用的临床试验,但目前仅用于记录[82]。
也被称为赫布可塑性,放电时序依赖可塑性(spike timing-dependent plasticity,STDP)的原理,突触的强度被重新分配,以支持同时活跃的功能相关回路[83-85]。这一原则是几种新的康复模式的基础,这些模式利用神经界面和侵入性刺激策略,将目标导向的意图与关键时间的反馈相结合,以促进积极的可塑性。最近的几篇综述[4,86,87]探讨了从辅助界面到康复界面的范式转变,图3再现了概述这种方法的概念演变的示意图。前一节探讨的Donati等人[5]和Rejc等人[9]的实验,他们的成功很大程度上也归功于STDP原则的运用。因为这些系统分别将意识意图与外骨骼和EES辅助运动结合了起来。“有意识的参与是长期功能改善的关键”一节也探讨了重叠原则,其中讨论了有意识参与的重要性。
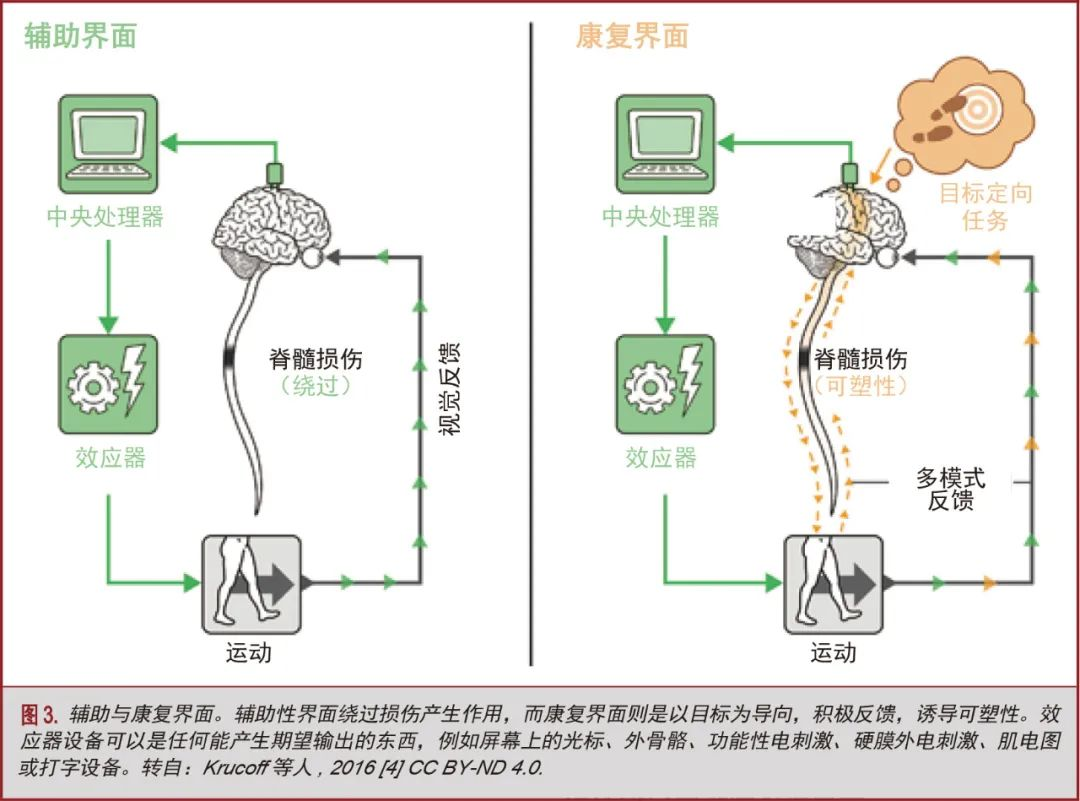
在中枢神经系统病变的远端,完整的神经肌肉部位可以发挥功能
脊髓损伤导致“失联结综合症”,即认知意图不能再与远端神经肌肉解剖联系起来。因此,从理论上讲,间接的重新连接运动神经计划以执行其预定动作可以恢复其功能。这一概念已经导致了旁路(即辅助)BMI的发展,或许是避免损伤恢复关键功能的方法[88]。这些策略[89,90]不一定是为了产生可塑性而设计的;然而,事实证明,通过这种BMI的长期训练得到的改善可能部分归因于重要的神经可塑性[73]。恢复瘫痪肢体的方法包括远端肌肉的功能性电刺激(functional electrical stimulation,FES)[10,91,92]和远端脊柱的EES[6-8,88]。FES包括在神经植入物解码的信号引导下靶肌肉电极的刺激。到目前为止,FES系统已经实现了大脑控制的三维瘫痪肢体关节特异性运动,并帮助四肢瘫痪患者自行进食[10]。另一方面,连续的EES降低了完整的远端神经回路的兴奋阈值,使得任何亚临床的脊髓上连接都能重新发挥其影响,并使远端解剖的意志控制成为可能[66,67,93]。这类技术的示范实现了意志的和非意志的踏步运动、特定于任务的单关节运动,以及1例完全性和慢性脊髓损伤[6-8]患者在停止刺激后[9]能保持持续站立。为了帮助进一步发展和控制EES、FES和本体感觉刺激模式的技术,可逆性截瘫的伦理动物模型也正在开展中[94]。
在成熟的中枢神经系统中,神经元不能自发再生,且由于缺乏适当的细胞外引导,轴突再生的尝试通常都以失败告终[95-97]。因此,改变内源性转录因子和再生相关基因可能为促进再生、引导和神经再支配提供药理学解决方案[50,98-100]。迄今为止,已鉴定出几个重要的靶点,如磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)[101,102]和细胞因子信号转导抑制分子3[103]。此外,已知原癌基因bcl-2在防止损伤后的细胞死亡方面起着关键作用[104,105]。此外,生长分化因子10和生长相关蛋白43(growth-associated protein43,GAP43)在大鼠中风后的亚急性期释放,能促进轴突生长[31,32]。此外,嘌呤核苷肌苷在脊髓损伤和中风动物模型中的应用已被证明可恢复GAP43水平并改善其行为结果[27-29,101,106,107]。此外,外源性因素如髓鞘相关蛋白和蛋白多糖也可以阻止轴突再生,尤其是损伤后形成的胶质瘢痕[59-62]。然而,最近的证据表明,胶质瘢痕本身可能为成功的医源性诱导再生提供了必要的重要基础[108]。单靠清除或阻断细胞外抑制因子通常无法实现有效的轴突再生[109,110]。有一个例外是勿动蛋白的中和作用,它是一种负性的生长调节因子[111]。在大鼠[35,112,113]和灵长类[36]脊髓损伤和中风[13]模型中,抗勿动蛋白免疫疗法成功地证明了与功能恢复相关的出芽增加。可能需要外科干预才能在医学上向关键靶点提供此类治疗。
一些炎症成分会导致组织损伤和凋亡/坏死,另一些则会促进吞噬、碎屑清除、细胞存活和轴突出芽,这取决于损伤后的时间[101,114-118]。癌调蛋白(一种巨噬细胞衍生的生长因子)和损伤诱导的细胞因子释放似乎在炎症诱导的轴突再生中发挥着作用[116,119,120]。传统的抗炎疗法(如非甾体抗炎药)可能会抑制免疫应答的有益和有害成分[59,115,121]。例如,当PTEN缺失和环磷酸腺苷升高结合时,眼内炎症已被证明能使一些视网膜神经节细胞从眼睛到大脑再生受损轴突,恢复简单的视觉反应[61]。因此,治疗方法可能旨在损伤微环境中平衡细胞表型,由于小神经胶质细胞、巨噬细胞和星形胶质细胞显现出一系列正在被积极研究中的状态[122,123]。中枢神经系统损伤患者的康复率和程度可能存在很大差异。现在人们认识到,这种差异可能是由于大量的细胞过程,如(1)存活神经元、突触和电路的数量和神经可塑性;(2)重组程度与神经支配;(3)树突树状结构、突触形成和再髓鞘化程度;(4)营养因子的释放;(5)免疫细胞的活性;(6)从内源性干细胞中产生的新的神经元、胶质细胞和内皮细胞,并将这些细胞整合到受损的神经元网络中[124]。因此,虽然传统的神经移植强调了神经元通过突触连接在重建神经回路中的作用[125,126],但许多新的方法强调一旦实现移植,细胞来源和作用的范围要广泛得多(图4)[127-130]。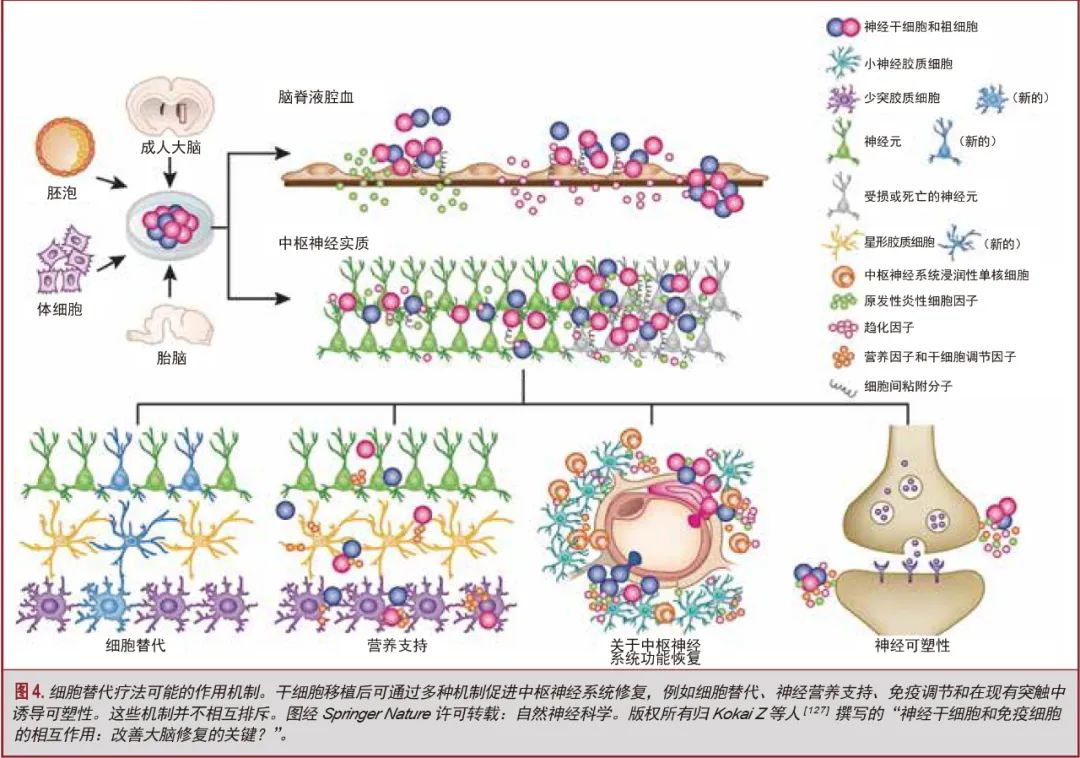
虽然细胞移植在动物模型[12,131,132]中很成功,但是在人类研究中神经系统转化的改善表明仍是困难的,因为我们对行为的基本机制仍知之甚少,并且仍有可能会发生意外的毒性[133]。在亨廷顿舞蹈病[131]和缺血性中风的动物模型中,直接注射胚胎细胞已被证明可以改善缺陷[132],而一例人类胚胎脑源性永生化神经干细胞治疗脑卒中的Ⅰ期临床试验证明了安全性,并提出了一些改善神经功能的建议[134]。最近,Kodoya等人[12]在大鼠损伤部位移植同源多能干神经前体细胞后,证明了脊髓损伤在脊髓尾端有富有活力的皮质脊髓束再生和突触形成。类似地,从胚胎癌细胞系[135]中培养的人类神经元在一项开放标记性的Ⅰ期临床试验中进行了研究,该试验显示通过荧光脱氧葡萄糖正电子发射断层扫描[136]可以改善欧洲卒中量表(European Stroke Scale,ESS)和代谢。然而,随后的一项Ⅱ期随机临床研究显示,尽管在Fugl-Meyer评定量表和认知功能[137]方面有所改善,但在ESS或整体运动结果方面没有统计学上的显著差异。除了胚胎干细胞或癌源性干细胞外,还可以通过基因重组分化成熟体细胞,如成纤维细胞转化为具有胚胎干细胞形态和生长特性的多能干细胞[138]。使用自体诱导的多能干细胞有可能避免与使用人类胚胎细胞相关的免疫抑制和伦理问题。将这些细胞立体定向注射到先前缺血性卒中区域的开放性Ⅰ/2a期研究显示,卒中量表和运动评分均有所显著改善,此实验为随机对照试验[25]。因此,除了有效性之外,未来研究的关键问题还包括定义可行的细胞来源、理解安全性问题、描述对内源性细胞种群的影响以及了解不同细胞系的作用机制。
仅靠强大的轴突再生和适当的连接能力并不一定能保证功能的恢复[139]。在一个例子中,Bei等人[140]能够诱导成年小鼠视网膜轴突再生,并在上丘形成突触;然而,这些连接并不能自行恢复视觉功能,因为新再生的轴突没有正常的髓鞘化,所以还需要一种电压门控钾通道阻滞剂来使动作电位正常传导。对于更复杂的功能,几乎肯定需要有针对性的行为训练来配合解剖学调整,以确保建立适当的功能连接[72],因为并不是所有的可塑性都是有益的(如痉挛、创伤后癫痫发作和病理性疼痛)。研究小组仍然非常重视理解不同神经元群体在修复中的确切作用,以及将从结构修复到功能修复的过渡与连接。
虽然微观干预可以改变细胞数量,改善细胞信号传导,诱导轴突出芽和突触形成,而宏观干预则可以加强和稳定功能回路,以提高性能。每个范围程度的治疗都会以关键的方式影响对方。Wahl等人[13]可能最清楚地证明了这一原理,他们将抗勿动蛋白抗体注射到患有严重中风的大鼠鞘内,然后进行强化的任务特异性训练并进行跟进(图5)。当免疫治疗和训练同时进行时,可以看到更大的轴突出芽,但纤维分支混乱,功能状况比不治疗的时候更差(Maier等人[35]也认为如此)。这一示范说明了单纯再生和功能恢复之间的区别,以及在不同尺度的干预之间进行时间安排以稳定基本回路的重要性。总的来说,微观和宏观相互作用的原理直到最近才得到严格的研究。这些实验可能很难设计、执行和解释,因为它们需要多学科的专业知识。然而,更好地理解和欣赏这种相互作用似乎对实现积极临床影响的治疗策略至关重要。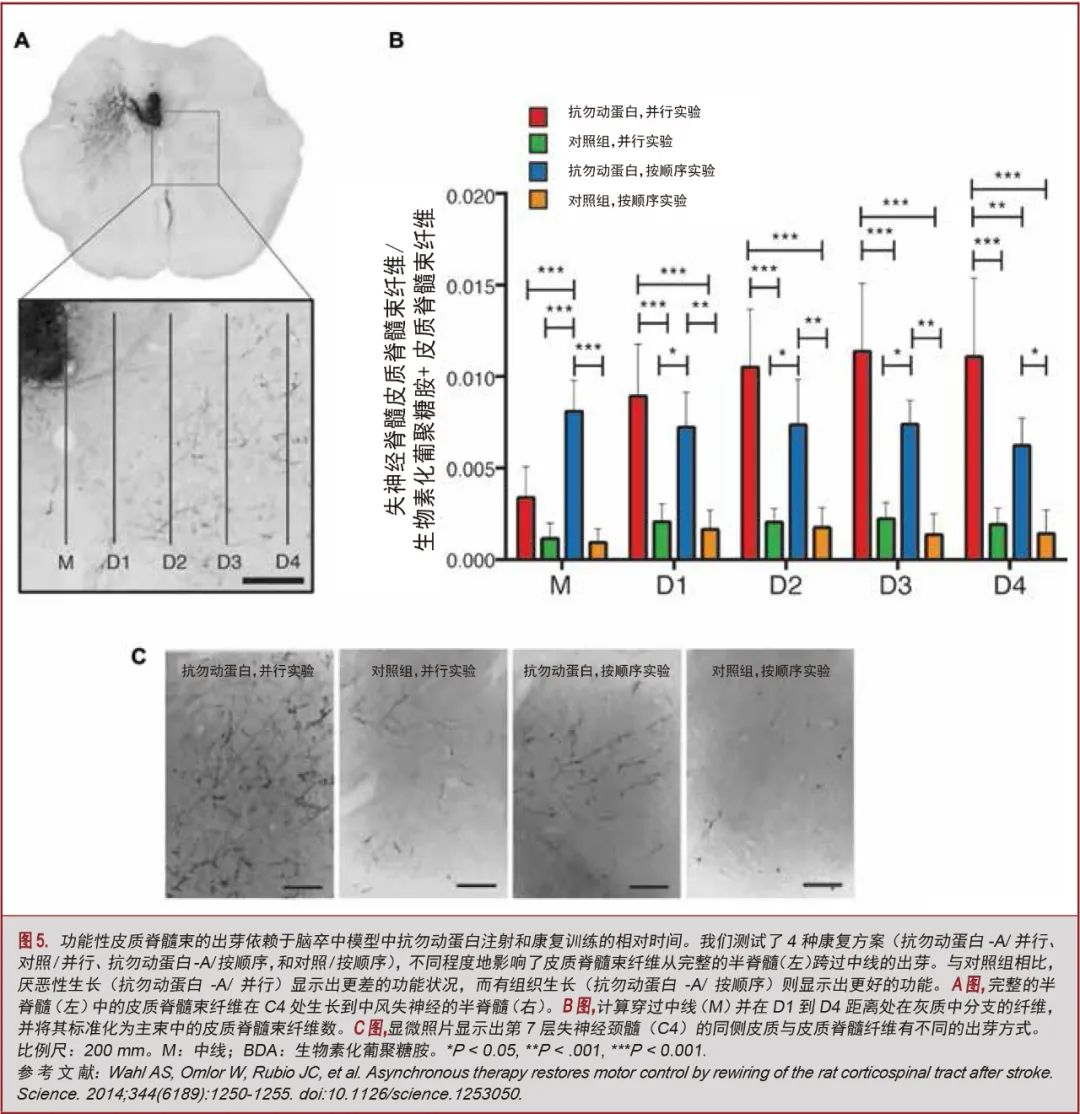
在脊髓损伤大鼠模型中,首次证实了脊髓上步态控制恢复的研究之一,也证实了有意识参与神经束再生的重要性[11]。在本研究中,所有大鼠都进行了EES训练。然而,接受被动跑步机康复训练的大鼠并没有恢复意志运动控制,接受目标定向任务训练的大鼠既恢复了意志运动控制,又显示了功能性长束再生的状况。另外,在一项偏瘫中风后康复的人类临床试验中,使用被动辅助机械臂运动与无辅助病人直接运动相比,改善较少[141]。意识层面究竟如何与回路和引导的神经解剖学原理相联系仍然是一个谜,但它们之间有着密切的联系[142-144]。从临床角度来看,这意味着患有意识障碍的患者(如昏迷或植物人患者)可能需要完全不同的治疗策略,而这些策略远未实现。这也表明,当整合到包括有意识的意图和目标导向治疗的框架中时,体外失败的实验也仍然可能是可行的治疗方法,因此不应明确地将其排除在临床试验设计之外[4]。
神经外科医生有一个独特的机会,可以旨在恢复中枢神经系统功能的治疗方法的发展中发挥关键作用。虽然大多数神经外科医生每天都与患有脑肿瘤、中风、创伤性脑损伤或脊髓损伤等神经功能缺陷的患者互动,但在患者病情稳定后能够帮助这些患者恢复功能的工具很有限。在这点上,相对于其他提供此种治疗的机构,如身体上的、职业上的和语言治疗师,神经外科医生一般就要退居次要地位了。为了提高诸如BMI、FES、EES、干细胞治疗、免疫治疗、药物治疗、光遗传学和基因治疗等干预措施的效用,神经外科医生、临床医生、治疗师、基础科学家、资助机构和工业界之间的合作将是必不可少的。神经外科医生已经在“大脑之门”[10,145]和北极星神经系统科学(珠穆朗玛峰级别的)试验[19]中发挥了重要作用,这些技术进入中枢神经系统修复领域的进展可能为神经外科医生提供了机会,使他们在植入稳定期之外扩大他们对这些病人的护理能力。此外,这种BMI和皮层刺激策略可能在未来的宏观框架中继续发挥重要作用,在这个框架中,微观进展将得到检验。神经外科医生早期参与到中枢神经系统修复策略的制定中是至关重要的,这不仅是因为神经外科医生对中枢神经系统损伤患者有着重要的接触机会,有能力进行侵入性中枢神经系统手术,还因为神经外科医生对中枢神经系统的结构和功能解剖及其对损伤和干预的反应之间的关系也有着丰富的临床经验。此外,由于目前提出的任何治疗方案在实现大规模实施之前都需要通过曲折的途径获得FDA的批准,因此神经外科医生应尽早参与,以帮助避免人类转化和临床试验设计的潜在陷阱。因此,有必要对本文中概述的转化原则有一个基本的了解,并对治疗进展的方向有一定的认识。
尽管已经有了许多科学进展,但是许多患者在脊髓损伤、中风和其他中枢神经系统疾病方面仍遭受着持续性功能缺陷。正如这篇综述所探讨的,新的干预措施正在为更好的结果提供希望,同时利用微观和宏观干预措施的战略方法将最有可能产生重大的临床影响。虽然诸如神经界面、FES和EES等宏观(即系统回路)技术已开始在人类患者中作出积极的作用,但大多数微观(即细胞分子)治疗,如细胞治疗、免疫治疗、分子干预和光遗传学仍处于体外实验或动物模型阶段,并且在临床相关转化方面遇到了重大障碍。为了实现这一飞跃,3个战略性和协调性的整合原则对于未来的转化性临床试验设计非常重要:(1)轴突再生本身并不能保证功能的恢复,(2)细胞和系统水平(即行为)干预之间的时间安排至关重要,(3)意识参与在神经功能恢复中起着至关重要的作用。神经外科医生将有机会发挥各种作用,使这种疗法适应主流临床实践,范围可以包括从被动的观察者到专家技术人员或知识领袖。发挥什么样的作用在很大程度上取决于是否积极和早期的参与,对重要的转化神经科学原理的理解,以及是否有合作和帮助促进临床试验设计的意愿。

















声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。


![]()




























