《Neurosurgery Clinics of North America》杂志2020年10月[Oct;31(4):549-564.]刊载美国 National Cancer Institute的Saber Tadros,和Abhik Ray-Chaudhury撰写的综述《脑转移瘤的病理学特征。Pathological Features of Brain Metastases》(doi:10.1016/j.nec.2020.06.005. )。


转移瘤是成人最常见的颅内肿瘤。肺癌、黑色素瘤、肾细胞癌和乳腺癌是最常见的转移到大脑的原发肿瘤。借助MRI可提高对小转移灶的检测,以及改善对原发肿瘤的系统性治疗,导致了脑转移瘤发生率的增加。神经麻醉和神经外科的进展显著提高了脑转移瘤手术切除的安全性。手术入路和积极管理已成为许多患者的能应用的方法。因此,脑转移瘤的诊断不再等同于姑息性治疗。此外,脑部肿块的诊断需求也随着相关挑战的增加而增加。
重点
转移瘤是成人最常见的颅内肿瘤,通过血行途径扩散至中枢神经系统(CNS)。脑内淋巴管的发现可能为转移瘤的发病机制提供新的见解。大脑微环境和内在的癌症特性(intrinsic cancer properties )在这一过程中发挥着不同的作用。
转移瘤通常是在灰白质交界处附近被发现,于大脑的某个部位发病。一些原发部位对特定的部部分有偏好。它们通常表现为多发性肿块,但乳腺采、结肠癌和肾细胞癌的转移瘤多为单发的。
软脑膜癌和粟粒性(miliary)脑转移瘤是罕见的脑转移瘤,脑脊液(CSF)是诊断的必要条件(the sine qua non)。
鉴别原发性脑瘤与转移瘤并不总是一个简单明确的诊断(a straightforward diagnosis)。
介绍
Hanahan和Weinberg1定义的8个癌症的功能特征( hallmarks of cancer)之一是激活侵袭和转移(activating invasion and metastasis)。许多类型的实体瘤的常见转移部位是大脑。据统计,脑转移瘤是成人最常见的颅内肿瘤。尸检和人口统计学研究表明,在全身恶性肿瘤患者中,脑转移瘤发生在10%至30%的成人和6%至10%的儿童中。值得注意的是,大多数尸检系列都已经过时了。可能是由于对小转移瘤的检测水平提高,以及对实体肿瘤的系统治疗水平改善,使得大脑成为躲避不能跨越血脑屏障(BBB)的化疗的安全避风港(a safe haven from chemotherapies),近年来,肿瘤的发病率呈上升趋势,另一方面,无论是在开颅手术或分流术后或没有既往手术史的情况下,原发性脑肿瘤很少转移到神经系统外部位。脑内缺乏淋巴系统、存在血脑屏障,以及蛛网膜下腔与血液或淋巴管之间缺乏直接连接可能是罕见胶质瘤转移的原因。
发病机理
世界卫生组织(WHO)2016年肿瘤分类将中枢神经系统(CNS)转移性肿瘤定义为起源于中枢神经系统外,通过血行途径扩散或从邻近解剖结构侵袭中枢神经系统的肿瘤。最近,人们首次描述脑内存在淋巴管,随后的研究表明,脑淋巴管在衰老和阿尔茨海默病(Alzheimer disease)中发挥着重要作用。这些发现可能引起对各种中枢神经系统疾病,包括转移性疾病,的新的研究。鉴于这些最新的发现,我们可以推测,硬膜淋巴管系统(the dural lymphatic vascular system)可能包含免疫细胞的运输(encompass immune cell trafficking),这就解释了为什么原发性脑肿瘤很少转移到颈部淋巴结。
Paget在1889年提出了一种理论,认为转移瘤依赖于“种子”(或癌细胞)和“土壤”(或宿主微环境)之间的相互作用。以后,Fidler描述成功的转移性定植(metastatic colonization)只能发生在特定的器官部位。Fidler的发现重新激起了人们对Paget的关于为什么肿瘤细胞会出现在特定器官中的问题的兴趣。虽然在转移中观察到的器官特异性(称为亲器官性[organotropism])仍然是癌症研究中最引发兴趣的未解问题之一,但有一些特征使大脑成为转移瘤有吸引力的领域(an attractive territory)。首先,血脑屏障(BBB)提供的大脑隔离(brain isolation)的保护性优势使它在面对转移性疾病时更易受攻击(vulnerable)。很少有研究对癌症转移期间血脑屏障血管通透性的演变提供一些见解。其次,肿瘤在远处器官中诱导形成微环境,有利于肿瘤细胞在到达这些部位之前的生存和生长(转移前生态位[premetastatic niches])。虽然对脑转移瘤微环境的探索还不够多,但有证据表明乳腺癌脑转移过程中基质细胞发生了代谢重编程(metabolic reprogramming of stromal cells)。
说到癌症的功能特征,诱导血管生成是癌症的另一个功能特征,因为肿瘤需要营养物质和氧气,以及排泄代谢废物和二氧化碳的途径。然而,自最早期的对肿瘤描述以来,文献报道肿瘤生长时没有形成新的血管。1996年,肺部的非血管生成性肿瘤首次被描述。非血管生成性肿瘤是指只有来自正常组织的存在血管的肿瘤。,无论是原发性肿瘤还是转移性病变,最常被描述为非血管生成性肿瘤的器官是肺、肝和脑。Pezzella和他的同事们总结了原发和转移性脑肿瘤中4种不同的生长模式。一种模式是单个细胞或小簇细胞扩散到脑实质,而没有与原有的血管接触,也没有诱导新血管的形成。另一种模式是“同化(cooptive)”模式,即癌细胞通过同化正常血管(血管周围袖套perivascular cuffing)而增长(advance)(图1D)。在假定的血管生成模式中,肿瘤细胞诱导新的血管形成。虽然少数肿瘤是纯粹的非血管生成,但许多肿瘤同时包含血管生成和非血管生成区域。看来大脑会影响肿瘤的非血管生成生长。有趣的是,也有报道淋巴结的非血管生成转移。
除了微环境的作用外,,在“土壤”这个转移性病理条件下,对作为“种子”的癌细胞,有促进其植入的内在特征。今天,通过强调通过癌症进化的原发性肿瘤的遗传异质性,下一代测序(NGS)幸运地为恶性肿瘤的遗传景观提供了一个巨大的深刻洞察。存在的克隆多样性有望提供丰富的改变库(repertoire of alterations),可以适应肿瘤环境的改变或转移性的远处定植。对肿瘤异质性和肿瘤演化的最近的研究表明,转移瘤以最小异质性分享驱动基因突变,可以用对如中性进化,肿瘤生长动力学,或因为转移瘤的宿主器官有可利用的资源,就像在细菌演化中观察到的现象等许多因素解释这个观察。
我们还研究了癌细胞的其他内在特性,数据表明不同的基因和途径在调节转移瘤定植和指导亲器官性方面的作用。此外,来自肿瘤细胞的外泌体,即外泌体整合素α6β4和α6β1,整合素αvβ5和整合素β3,优先分别与肺成纤维细胞和上皮细胞,肝Kupffer细胞、脑内皮细胞融合。
一般特点
由于大多数脑转移瘤是血源性的(hematogenous origin),因此转移灶的分布与脑的血供有关。大脑中动脉是最大、最复杂的脑血管,其远处部分有一系列分支。这种复杂的解剖结构为可改变状态的继发性病变(the moving secondaries)提供了力学上的不利条件(resulting in lodging at one of its territories),导致其寄宿在最常受影响的区域之一(resulting in lodging at one of its territories that is the most commonly afflicted),尤其是与大脑后动脉交界的区域(especially at the border zones with the posterior cerebral artery)。根据事实上通常在灰白质交界处附近的皮层发现与有高代谢需求的神经组织和转移瘤耦合的脑血管循环的调节,对神经血管单元理解的新的视角可能会发现代谢变化与在某些脑的部位转移瘤患病率之间的相关性。
导致脑转移瘤的最常见的原发肿瘤是包括肺癌、乳腺癌、肾癌、结直肠癌和黑色素瘤等癌症,而Hodgkin淋巴瘤、前列腺癌、卵巢癌、食道癌、口咽癌和非黑色素瘤皮肤癌很少转移到大脑。此外,一些主要部位对特定的部分有偏好。乳腺癌常发生硬脑膜和软脑膜转移,而不侵犯脑实质。肾细胞癌(RCC)最常见会转移到脉络丛。儿童的脑转移瘤最常见的来源是肉瘤、神经母细胞瘤和生殖细胞肿瘤。
虽然脑转移瘤通常表现为多发性肿块,但20%至30%的患者为单发。乳腺、结肠和肾细胞瘤的转移癌往往是单发的,而肺癌和恶性黑色素瘤更容易发生多发性转移瘤。
一般来说,80%的黑色素瘤脑转移发生在幕上,15%发生在幕下或软脑膜,5%发生在脑干。在一项对来自中国的335例患者的共2046个转移性病灶的研究中,脑转移瘤发生率最高的区域为小脑(56%)、右顶叶(54%)、右额叶(47%)和左额叶(45%)。不同的病理类型有不同的分布。
当对脑转移瘤的诊断有疑问时,应进行活检。活检对有单发病灶的患者特别重要。活检的重要性在一项研究中得到了证实,在54例有单发病灶的患者中有6例被证实有第二原发肿瘤或炎症或感染的过程。
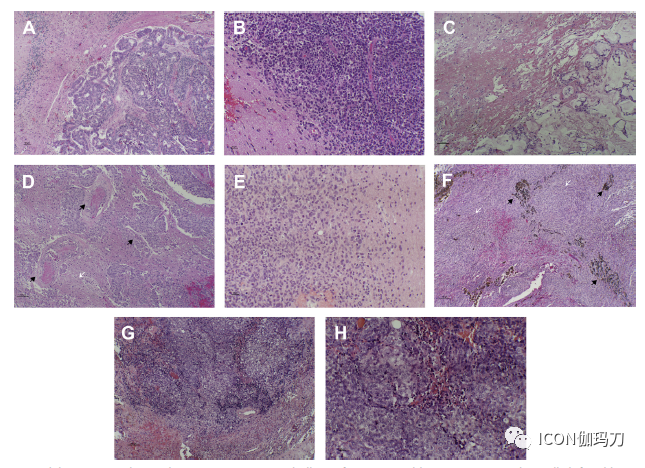
图1.(A) 37岁女性肺腺癌转移至小脑。注意有很清楚的脑-瘤界面。肿瘤呈腺分化,提示上皮样肿瘤。肿瘤呈AE1/AE3阳性。然后,染色CK71 / CK20-提示肺部起源,其显示TTF1染色证实肺起源。随后胸部/腹部/骨盆CT扫描显示肺部肿块。(B) 67岁男性右侧额叶小细胞肺癌转移。注意有很清楚的脑-肿瘤界面。小细胞癌的肿瘤细胞显示局灶性核造型特征。肿瘤染色显示CAM5.2阳性,提示有癌变过程。突触素阳性表明病变具有神经内分泌性质。CK7+/CK20-指向肺部起源,TTF1证实。(C) 73岁女性左颞叶结直肠癌转移。肿瘤压迫周围的脑组织,形成假包膜。肿瘤显示产生黏液的腺体,提示为腺癌。患者既往有肺癌和结直肠癌的病史。CK20和CDX2阳性的肿瘤倾向于结直肠起源,而不是肺部起源。(D)一名47岁妇女的左额叶乳腺导管癌转移。肿瘤是由鳞片状的恶性上皮样细胞形成的,小管状细胞形成的可能性很小。可见肿瘤细胞以血管为中心的生长(黑色箭头),其间脑实质未受累(白色箭头)。由于形态学上怀疑是乳腺癌,ER、PR、HER2阳性以及GATA3染色证实乳腺起源。(E) 79岁男性枕叶低分化肿瘤。该肿瘤显示模糊的肿瘤-脑界面,提示转移。未见腺状或乳头状形成,提示为腺癌,但有一些有利于小细胞癌的核造型。突触素(Synaptophysin)和TTF1阳性,倾向于小细胞肺癌。然而,肿瘤表现为异质性的形态,伴小细胞表型和大的多形性区域,所以我们尝试了更多的免疫组化。GFAP、S100(胶质瘤标志物)和角蛋白(癌标志物)都呈阴性。(黑色素瘤)BRAF V600E突变分析为阴性。最后,甲基化分类更倾向于胶质母细胞瘤。TTF1在胶质母细胞瘤中可能呈阳性。(F)一名13岁女孩的右侧幕下转移性黑色素瘤。病人有葡萄膜黑色素瘤病史。肿瘤呈梭形细胞形态(白色箭头),伴有着色重的区域(黑色箭头)。(G, H) 4岁男童左顶叶CPC。可见片状的上皮样细胞的界限模糊不清的肿块。在这个病例中,患者的年龄非常重要(H&E染色)。
特殊的方面
软脑膜癌
软脑膜癌是一种罕见的并发症,约有5%的转移性癌症患者被诊断为软脑膜癌。50%至80%的患者同时存在脑转移瘤。脑膜癌病是由癌细胞扩散到软脑膜引起的。扩散到脑脊液(CSF),迅速扩散到整个中枢神经系统。软脑膜癌病的分子机制尚不清楚,但最近的一项研究表明,补体成分3 (C3)在4种软脑膜转移模型中上调,C3在这一过程中至关重要。此外,研究表明,中断C3a受体信号可以阻断小鼠的软脑膜转移。
经神经周途径转移
神经周围肿瘤的侵袭是癌细胞超越其原发部位发展的机制之一。它可以是顺行性的,也可以是逆行性的,大多数情况下,没有跳跃病变。在一项实验研究中,将骨髓瘤和肉瘤肿瘤细胞接种到BALB/c小鼠的皮下组织中,导致肿瘤细胞沉积附近的神经周围产生神经周围血管。研究表明,雪旺细胞(Schwann cells)通过癌细胞扩散有助于(facilitate)肿瘤进展,促进上皮间叶细胞转化。在胰腺癌中,CX3CR1的表达涉及沿胰腺神经的神经周浸润和扩散的肿瘤细胞。
头颈部肿瘤的一个显著特征是神经周围肿瘤的扩散和神经周围侵袭。向颅底及中枢神经系统扩散的头颈部癌的发生率低于5%。头颈部扩散的神经周围肿瘤最常由鳞状细胞癌引起,颅内神经周围扩散的发生率为3%至14%。最常受累的神经是三叉神经和面神经。其他常见的神经周围扩散的恶性肿瘤包括腺样囊性癌和鼻咽癌。
肿瘤-至-肿瘤的转移
1930年,Fried发表了尸检结果,显示了支气管肺癌引起的脑膜瘤的转移性接种(metastatic inoculation)。这种肿瘤至肿瘤转移(tumor-to-tumor)的现象涉及恶性肿瘤的血行扩散到解剖上远处肿瘤的脑实质,而碰撞性肿瘤代表两种不同的恶性肿瘤在同一器官内发生并生长到另一器官。最常见的转移性宿主“受体(recipient)”肿瘤是垂体腺瘤或脑膜瘤,常见的转移性“供体(donors)”是乳腺和肺部恶性肿瘤。原发性和受体肿瘤罕见的合并,如黑色素瘤转移瘤至中枢神经细胞瘤,造血肿瘤转移瘤至脑膜瘤。在von Hippel - Lindau病中,肾细胞癌(RCC)可转移为血管母细胞瘤(图2)。
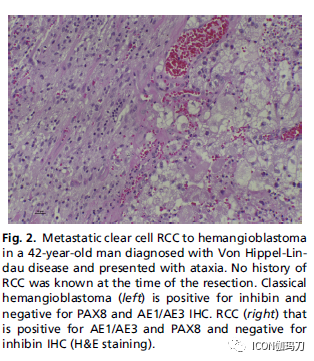
图2。42岁男性,诊断为Von Hipel - Lindau病,表现为共济失调,透明细胞肾细胞癌转移为血管母细胞瘤。切除时无RCC病史。典型的血管母细胞瘤(左),抑制素阳性,PAX8和AE1/AE3免疫组化阴性。RCC(右),AE1/AE3和PAX8阳性,抑制素免疫组化阴性(H&E染色)。
眼科肿瘤转移
黑色素细胞瘤是葡萄膜最常见的原发肿瘤,与葡萄膜黑色素瘤转移到皮肤的黑色素瘤不同,首先发生在肝脏。
视网膜母细胞瘤是儿童最常见的原发性眼内肿瘤,起源于视网膜。视网膜母细胞瘤扩散到脑脊液,然后通过视盘侵入大脑和脊髓进入视神经。视网膜母细胞瘤也可以通过血行播散扩散到大脑。观察到的一个主要相关疾病是三侧性视网膜母细胞瘤(trilateral retinoblastoma)。这是种罕见的儿童生殖系RB1基因突变,表现为单侧或双侧视网膜母细胞瘤和颅内中线神经母细胞瘤,通常在松果体或鞍上/鞍下区域。
颅内逆行播散
颅内逆行播散是脊柱肿瘤向大脑扩散的途径之一。有一些黏液乳头状室管膜瘤(myxopapillary ependymomas)转移到脑部的报告(图3)。高级别室管膜瘤也有报告从脊髓转移到脑部的。
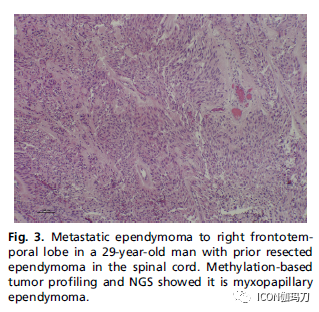
图3。29岁男性,转移至右侧额颞叶室管膜瘤,既往有脊髓室管膜瘤切除术史。甲基化肿瘤分析和NGS显示为黏液乳头状室管膜瘤。
特殊的临床病理情况
肺癌是最常见的原发性转移到大脑的肿瘤。通常大多数非肺癌首先转移到肺部,然后在大脑中形成继发性转移。虽然这些肺转移瘤在临床上可以保持无症状,但脑部肿块通常会引起需要就医的症状。一般,转移到中枢神经系统的肿瘤会绕过肺部,特别是那些到达后颅窝的肿瘤。
由于治疗方法的进步,有非小细胞肺癌(NSCLC)临床病史的患者可以活几年,这使得脑转移瘤的发展和先前脑转移瘤治疗的副作用有更多的时间出现。因为针对表皮生长因子受体(EGFR)和间变性淋巴瘤激酶(ALK)的新靶向治疗已经证明了更大的颅内疗效,如果最终诊断为腺癌,就需要对脑的切除标本进行这些标志物的最终评估。值得注意的是,一些数据表明c-ROS癌基因1阳性NSCLC患者的脑转移率低于ALK重排患者的。
在美国,乳腺癌是仅次于肺癌的第二常见的与脑转移瘤相关的癌症。在接受曲妥珠单抗(trastuzumab)治疗的人表皮生长因子受体2 (HER2)-阳性乳腺癌女性患者中,脑部经常被报道为第一个旧病复发(relapse)的部位。HER2阳性或雌激素受体(ER)阳性的患者似乎有延长的生存期。由于这些病人的预后和治疗的不同,病理学家有责任向肿瘤学家提供这些信息。
过去,转移到大脑的黑色素瘤导致了大多数患者的死亡。最近,由于神经影像学的重大进展,以及脑转移瘤的神经外科和放射治疗治疗选择的改进,这些患者的预后得到了显著改善。评估BRAF V600突变、PD-L1表达对指导BRAF或MEK抑制剂治疗和免疫治疗是必要的。
经过完整的分期评估后,偶见患者有原发灶不明的脑部腺癌。在大多数这些患者中,其他转移部位会在相对较短的时间内出现。如果没有其他转移的证据,目前的方法是切除孤立性病变。生殖细胞瘤是一种原发原因不明的脑转移瘤,虽然相当罕见,但它与大脑有很高的亲和力。它们对化疗反应灵敏,对它们的识别具有重要的价值。最近的怀孕史可能是一个线索,特别是转移性绒毛膜癌的妇女。
海马转移
全脑放疗(WBRT)是多发性脑转移瘤患者最常用的照射治疗方法之一。几项对接受WBRT的患者的回顾性研究表明海马辐射剂量与神经认知能力下降之间存在关系。因此,提出回避海马- WBRT方法。回避海马-WBRT方法可部分减轻神经认知功能损害,但对小细胞肺癌发生海马转移可能有风险。有意思的是,它似乎并不会增加乳腺癌中海马转移的风险。

转移的形态
大体表现
脑转移瘤通常表现为圆形、边界清楚的肿块。浅表皮层转移可侵犯软脑膜并形成斑块。室管膜下病变可沿脑室内衬(the ventricular lining)扩散。“粟粒性脑转移瘤”,也称为“癌性脑炎(carcinomatous encephalitis)”,是一种极其罕见的脑转移瘤形式。
涉及软脑膜癌症通常可见弥漫性不透明(diffuse opacification)和软脑膜增厚(thickening of the leptomeninges),如微小的白色结节(minute whitish nodules)特别是在大脑的底部(基底池或颅后窝)、大脑侧裂(the sylvian fissures),随着体积庞大的肿瘤(bulky tumor)接下来对软脑膜的肿瘤性侵袭伴相关炎症,随着阻塞脑脊液循环引起脑积水、侵袭颅神经,或在某些情况下,大脑大体上有正常的外观。可发生沿脑室的播散。脑脊液细胞学检查是诊断软脑膜癌病的必要条件。
转移瘤在切面上通常很软。坏死呈局灶性或弥漫性。出血区域在临床上常表现为颅内出血。有些肿瘤在大体外观上具有特征性。黑色素瘤可表现为染色性病变,分泌粘液的腺癌表现为粘液样外观。绒毛膜癌、肺癌和肾癌细胞癌(RCCs)有出血的倾向。
显微镜下
转移瘤的组织学特征通常与原发病灶相似,但分化可能较少。首先,在正常的中枢神经系统(脉络丛、垂体腺前叶和中间叶)上皮结构稀少,因此任何上皮样病变都应引起对转移性癌的怀疑。第二,虽然浸润模式通常有助于区分转移性肿瘤与原发性中枢神经系统肿瘤(如弥漫性胶质瘤),但偶尔发生的胶质母细胞瘤(GBM)可以表现出推挤边缘和/或通过Virchowo - Robin间隙浸润,而不是单细胞浸润模式,以此定义浸润性胶质瘤。在小细胞肺癌和黑色素瘤的转移中,常见有Virchow- Robin间隙的局部侵袭。另一方面,转移瘤表现为浸润性“假性胶质瘤(pseudogliomatous)”生长模式。
脑转移瘤引起脑实质的几种反应性改变。星形细胞增生(Astrocytosis)常出现在转移性结节周围。小胶质细胞活化(Microglial activation)可发生在坏死区域周围。可见血管新生并有一定程度的血管内皮“肾小球样(glomeruloid)”增生,但未达到在GBM中所见的程度。
辅助测试
确立了许多免疫组织化学标志物(IHC)的全套(panels)以识别原发灶,总结在图1、5、6中。虽然免疫组化(IHC)通常对在转移瘤和原发性中枢神经系统肿瘤之间的鉴别能提供有用信息,重要的是要记住,细胞角蛋白(AE1 / AE3)与神经胶质原纤维酸性蛋白(GFAP)有交叉作用。此外,S100在转移性黑色素瘤和胶质瘤中通常呈阳性。一些免疫染色在先前冷冻的组织上丢失或显著减少,这些免疫组化结果在识别原发部位的准确性方面没有进行过前瞻性评估。
无论如何,当免疫组化分析不能提示原发部位时,可以使用分子癌症分类检测分析(molecular cancer classifier assays)对肿瘤进行分类。在这个分子时代,已越来越多地使用基于基因表达特征(gene expression–based signatures)的起源肿瘤组织分类。最近,与标准方法相比,中枢神经系统肿瘤的甲基化分类被证明对诊断精度有实质性影响(图4), DNA甲基化检测分析被证明是一种有效的方法来揭示未知原发病灶患者的原发肿瘤起源部位。
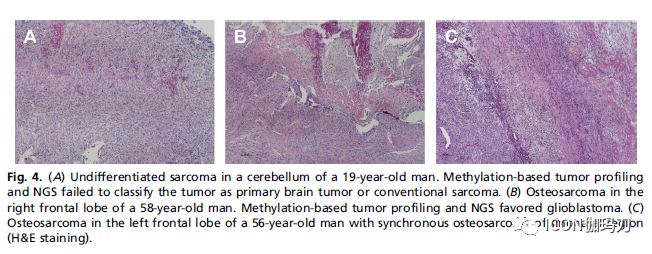
图4。(A) 19岁男性小脑未分化肉瘤。甲基化肿瘤分析和NGS未能将肿瘤分类为原发性脑肿瘤或常见的肉瘤。(B)58岁男性的右额叶骨肉瘤。甲基化肿瘤分析和NGS倾向于胶质母细胞瘤。(C)56岁左额叶骨肉瘤,,伴鼻窦区同期骨肉瘤(H&E染色)。
成像
对于脑部病变的诊断来说,特别是对肿瘤的过程有疑问时,确定病变的位置是非常重要的。第一个标准(denominator)是病灶是基于硬膜的还是轴内的,然后根据特定部位进行鉴别诊断。许多区域中枢神经系统对特定肿瘤类型的脆弱性是明显的。例如,转移性癌倾向于大脑半球的轴内位置,而成人室管膜瘤经常影响脊髓。
磁共振对比增强成像是诊断脑转移瘤的首选影像学研究,被证明优于双剂量延迟计算机断层扫描(CT)。脑转移瘤在T1和T2加权图像上呈低信号、等信号或高信号。对比增强几乎是普遍的。有时,非常薄壁的囊性转移瘤不会增强或只会轻微增强。存在多发性病灶、位置在灰质和白质交界处、边界限定、与病灶大小相比有大量血管源性水肿,有助于鉴别脑转移瘤与其他中枢神经系统病变。
较新的方式,如平面回波成像(echo planar imaging)、波谱(spectroscopy)、PET和单光子发射计算机断层扫描也可能被证明是有用的。
鉴别诊断
如前所述,虽然有许多特征有助于鉴别脑转移瘤与原发性脑瘤,但有一些鉴别诊断值得强调。
在Von Hipel -Lindau综合征中,患者易患血管母细胞瘤和可转移到大脑的透明细胞肾细胞癌(RCC)。两种肿瘤均具有清晰的细胞质组织学。PAX8和抑制素蛋白的免疫染色有助于分离它们,因为肾细胞癌(RCC)的PAX8阳性,血管母细胞瘤的抑制素蛋白(inhibin proteins)阳性(见图2)。少突胶质细胞瘤可以显示清晰的细胞质,可能在鉴别诊断中被考虑。细胞角蛋白(cytokeratin)阴性的Olig-2(兔抗人少突胶质细胞转录因子2多克隆抗体)阳性细胞将支持少突胶质细胞瘤的诊断。
脉络丛癌(Choroid plexus carcinoma,CPC)起源于脉络丛上皮(the choroid plexus epithelium),具有典型的癌的特征。它通常局限于年幼的儿童,在成人中极为罕见(见图1G)。遗憾的是,大多数可用的脉络丛癌(CPC)标志物都是非特定的。松果体乳头状肿瘤(papillary tumor of the pineal region)是另一种罕见的肿瘤,其特征为乳头状和实性区域,角蛋白染色阳性。
间变室管膜瘤总是局限的肿块,很少侵袭相邻的脑组织,可类似胚胎瘤(embryonal tumors)或小圆形蓝色细胞瘤(small round blue cell tumors)。与转移瘤相比,室管膜瘤的GFAP呈强阳性,且细胞角蛋白呈阴性。
髓母细胞瘤有多种形态学变异,包括伴有广泛结节(extensive nodularity)的促结缔组织增生性髓母细胞瘤(desmoplastic medulloblastoma)和大细胞/间变性髓母细胞瘤。年龄和后颅窝位置是考虑中枢神经系统小圆蓝色细胞肿瘤诊断范围的关键因素。除非在特殊的临床情况下,转移性神经母细胞瘤、视网膜母细胞瘤或淋巴瘤不会进入鉴别诊断。造血标志物(Hematopoietic markers)可以识别淋巴瘤。
脑膜瘤表现出大范围的组织学变异,这可能给诊断带来一些挑战。脑膜上皮/移行性、透明细胞、分泌性和乳头状变异可以类似转移性癌。EMA(上皮膜抗原)和生长抑素受体通常有助于脑膜瘤的诊断。
在诊断任何原发性中枢神经系统黑色素细胞瘤之前,必须排除转移性黑色素瘤(见图6)。在这种情况下,临床相关性是非常必要的。其他一些原发肿瘤也有黑化(melanization)现象。这些病变包括神经鞘瘤、副神经节瘤、髓母细胞瘤和少数胶质瘤(图5)。
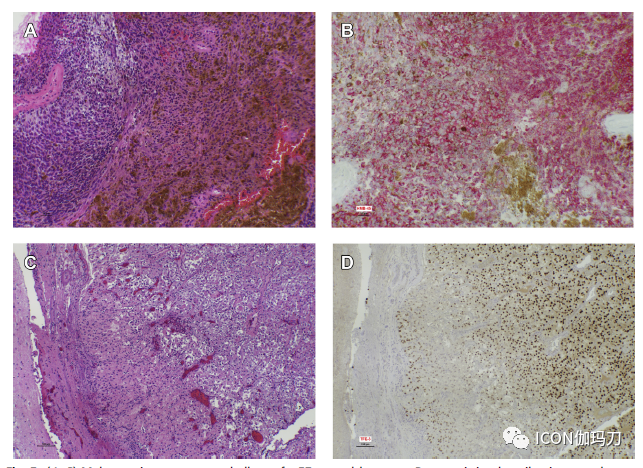
图5。(A, B) 57岁女性小脑黑色素细胞瘤。因为它是一个重度色素沉着的肿瘤(HMB-45阳性),鉴别诊断包括来自皮肤的转移性色素沉着上皮样黑色素细胞瘤、转移性黑色素瘤和脑黑色素细胞瘤。CT示肝脏结节。未发现眼黑色素瘤。虽然患者无皮肤黑色素瘤病史,但不能排除转移性黑色素瘤的可能性。BRAF V600E阴性和比较基因组杂交有助于排除转移性黑色素瘤,确立黑色素细胞瘤的诊断[A: H&;E染色,B: HMB-45 IHC]。(C,D) 66岁男性左额叶转移性肺泡软部肉瘤。肿瘤细胞TFE-3染色阳性。患者5年前右大腿肿块切除,证实为肺泡软部肉瘤[C: H&E染色,D:TFE -3 IHC]。
中枢神经系统的生殖细胞瘤可能是多中心生殖细胞瘤的一部分,具有独立的颅内、性腺或纵隔原发灶。对克隆性起源的研究将有助于确定颅内畸胎瘤的起源是原发性、同时性和异时性(primary, synchronous, and metachronous)肿瘤。准确地说,报道过一例胎儿的原发性颅内畸胎瘤(primary intracranialteratoma in a fetus),其母亲被诊断为单独的卵巢畸胎瘤(independent ovarian teratoma)。
脑脊液细胞学
1904年,一位法国神经病学家描述了脑脊液中的恶性细胞,脑脊液检查成为诊断脑转移瘤的重要组成部分。
脑脊液中很容易发现恶性细胞,且在大多数患者中,患者已知患有恶性肿瘤。然而,在10%脑脊液阳性的恶性肿瘤患者中,没有已知的原发肿瘤。在无癌史的脑脊液阳性恶性肿瘤患者中,可能原发肿瘤为肺癌、胃癌、黑色素瘤和淋巴瘤。
血清肿瘤标志物
典型的血清肿瘤标志物,如癌胚抗原、癌胚抗原CA 19-9、癌胚抗原CA 15-3和癌胚抗原CA 125,对于诊断或预后测试都没有帮助。然而,它们在腺癌患者的血清中经常升高,目前它们唯一的用途是通过一系列的测量来跟踪个体肿瘤的治疗反应。其他一些血清标志物更为特异,如降钙素,可用于筛查甲状腺髓样癌的复发和评估预后。前列腺特异性抗原(PSA)的应用很普遍,但其价值存在争议。一些新的概念,包括PSA密度和速度(density and velocity),已经出现,以完善测试解释,尽管这些还没有被广泛采用。生殖细胞肿瘤分泌的一些蛋白质对肿瘤中某些组织学成分的存在具有很高的敏感性。人绒毛膜促性腺激素水平在胚胎癌、绒毛膜癌、混合生殖细胞瘤、精原细胞瘤和一些未分化胚细胞瘤(dysgerminomas)中升高。在卵黄囊瘤、胚胎细胞癌、混合生殖细胞瘤和一些未成熟畸胎瘤中存在甲胎蛋白(Alpha-fetoprotein)。然而,它们的用途是监测治疗反应和检测复发,而不是用于初始诊断。
在现代,血浆中的液体活组织检查,与组织活组织检查是癌症诊断的黄金标准不同,正在成为筛查和分期工具。血浆细胞游离DNA (cfDNA)测序是最有前途的工具之一,可能有助于作为低侵袭性循环肿瘤标志物(less invasive circulating tumor markers)。
1948年,人类血液中发现了游离核酸碎片,几十年后,有报道称癌症患者血清中血浆细胞游离DNA (cfDNA)水平升高。后来,研究证明了癌症患者血浆中的一些cfDNA起源于癌细胞,它们携带原发肿瘤的类似突变。cfDNA突变是癌症的特异性标志物,因此创造出“循环肿瘤DNA(circulating tumor DNA)”这个术语。总的来说,大多数cfDNA分子都高度分裂(heavily fragmented);然而,正如最近的研究显示的那样,这种分裂并不是随机的。
在类似的情况下,检测循环肿瘤细胞(CTCs)开始作为肿瘤标记物进入临床实践。循环肿瘤细胞(CTCs)/循环肿瘤微栓子(CTMs)是从癌变部位脱落,进入血流的恶性细胞。对循环肿瘤细胞(CTCs)的信使RNA和长链非编码RNA的分析可用于无创液体活检。在转移性乳腺癌患者的血液样本中检测循环肿瘤细胞(CTCs)已被证明是无进展生存期和总体生存期的预测因子,但将其用于患者监测仍存在争议。随后的数据显示,循环肿瘤细胞(CTCs)检测对如黑色素瘤、前列腺癌、结肠癌和肉瘤等其他癌症类型的潜在益处。此外,分析肿瘤来源的外泌体是一个新的活跃的研究领域,有助于诊断和随访肿瘤进展,尽管还需要更多的工作来验证其用途。
病理学家与外科医生的相互作用
为了完成确立脑转移瘤诊断的任务,病理学家评估某些病变的多个方面,以达到最终的诊断。关于肿瘤位置的临床信息是很有价值的。多灶性肿块比原发肿瘤更容易转移。弥漫性软脑膜MRI强化是一种非常罕见的神经胶质肿瘤的表现,并且越来越多见于转移瘤。在诊断第二肿瘤之前(diagnosing a second tumor),总是需要仔细检查其他部位的恶性肿瘤病史,除非患者有已知的可引起多发性肿瘤的综合征。
第一次解释(first interpretation)通常是在(术中会诊)冰冻切片的染色载玻片上进行的。在成人,具有上皮样、乳头状或腺分化(epithelioid, papillary, or glandular differentiation)的病变总是指向转移性上皮样肿瘤。除了癌的小细胞变异外,癌细胞相对较大,核大小尺寸增大(是红细胞大小的3 - 5倍),细胞核多形性(pleomorphic nuclei),核染色质粗糙成群(coarsely clumped chromatin),核仁常明显(prominent nucleoli)。常见核分裂象(Mitotic figures)和肿瘤细胞坏死。对肿瘤/脑实质界面进行取样对于评估肿瘤浸润是必要的,因为肿瘤与正常脑实质的尖锐边界提示是转移瘤,而不是胶质母细胞瘤或淋巴瘤。转移性肿瘤可能失去癌的结构模式,形成片状肿瘤上皮样细胞。在这种情况下,鉴别诊断包括黑色素瘤、淋巴瘤和胶质母细胞瘤。有时,在术中会诊时是不可能鉴别黑色素瘤和癌症的。更可靠的诊断通常是基于福尔马林固定,石蜡包埋(formalin-fixed,paraffin-embedded,FFPE)切片。
FFPE切片用于更多的辅助检测,以确定诊断和研究治疗的特定靶点。免疫组化提供了有关病变性质的宝贵信息。当免疫组化分析用于统计分析时,有很多方法来对其作解释。综合PubMed检索显示至少有7种不同的IHC数据解释方法,如定性评分和联合半定量评分(qualitative scoring and combinative semiquantitative scoring)。然而,在临床环境中使用免疫组化与其说是一门科学,不如说是一门艺术。
病理学家不能依赖免疫组化结果
病理学家不能不管对苏木精和伊红染色玻片的组织学印象而依赖免疫组化结果。肿瘤的免疫表型非常复杂,但有一些常用的标记物可以对肿瘤进行全面分层。细胞角蛋白鸡尾酒(AE1/ AE3, CAM5.2)和GFAP(胶质纤维酸性蛋白)联合应用有助于鉴别原发性胶质肿瘤和转移性肿瘤。S100和SOX10是很好的标志物,可以突出黑色素瘤等黑色素细胞病变。在大多数造血肿瘤中,CD(白细胞分化抗原)43、CD45和TdT(末端脱氧核苷酸转移酶)呈阳性。一般来说,当最初的印象是癌性病变时,CK(细胞角蛋白)7和CK20的组合已被证明有助于提示广泛范围的癌的原发部位。然后,在CK7/CK20初步评估后,还有许多其他标志物支持某些起源部位(如图6所示),但是,如果最初的印象是肉瘤性病变,一组desmin(肌间线蛋白)、CD34、平滑肌肌动蛋白(smooth muscle actin)和S100通常有助于指导间叶细胞肿瘤的诊断。最后,最终的诊断需要结合病变的解剖学、组织学和免疫表型特征,有时还需要结合分子表现。
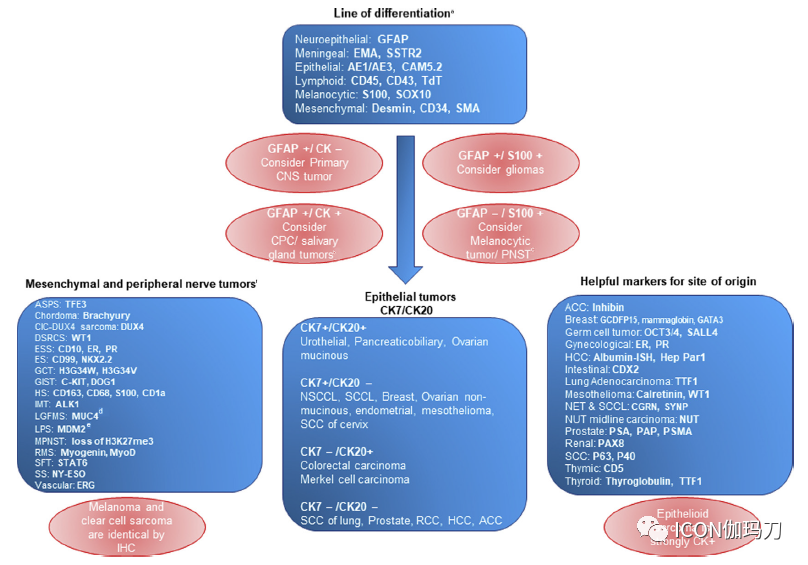
图6所示。脑转移瘤免疫表型逐步分析。a建议每个鉴别行使用2个标志物。b 脉络膜丛癌(CPC)的GFAP的焦点阳性。有导管成分的唾液腺癌GFAP阳性。C 恶性外周神经鞘瘤(MPNST)通常失去S100的表达。d 在20%的脑膜瘤中MUC4(黏蛋白4)呈阳性。e 在许多肉瘤中MDM2(鼠双微体基因2)表达且非特异性。f一些列出的肿瘤需要基因融合检测来确认(CIC-DUX4肉瘤,DSRCS, ES, IMT,透明细胞肉瘤)。ACC,肾上腺皮质癌;ASPS,肺泡软部肉瘤;CPC,脉络膜丛癌;DSRCS,促结缔组织小圆细胞肉瘤;ES,尤因肉瘤;ESS:子宫内膜间质肉瘤;GCT,巨细胞瘤;GIST,胃肠道间质瘤;HCC,肝细胞癌;HS,组织细胞的肉瘤;IMT:炎性肌纤维母细胞瘤;LGFMS,低级别纤维黏液样肉瘤;LPS,脂肪肉瘤;MPNST,恶性外周神经鞘瘤;NET,神经内分泌肿瘤;NSCCL非小细胞肺癌;RCC,肾细胞癌;RMS: 横纹肌肉瘤;SCC,鳞状细胞癌;SCCL,小细胞肺癌;SFT,孤立性纤维瘤;SS,滑膜肉瘤。
总结
脑转移瘤历来被认为是终末期疾病,无论何种原发肿瘤类型,都有相同的很差的临床预后。然而,随着精准医学的出现和各种治疗手段的可行性,不仅要根据形态学特征,还要根据分子和免疫特征对转移瘤进行精确的分类变得势在必行。此外,新的疾病特异性预后因素,如转移性肺癌的EGFR突变和ALK重排,已经纳入现代决策制定。此外,通过对转移灶的如活检术或切除术获取材料,可能揭示原发肿瘤中由于肿瘤异质性而隐藏的重要的靶向分子异常。最后,仅仅是基于影像学及其遗传学的局限性确定的反应,可能需要在未来的病理评估作为更明确的方法。



