今天为大家带来的是《Neurosurgery》(中文版)神经损伤与重症分册第一期,由林清松、陈越、许雅纹教授翻译,康德智教授审校的“血凝块溶解中症状性出血并发症:评价脑室出血加速解决的III期临床试验(CLEAR III):一项事后根本原因分析研究”,欢迎阅读、分享。
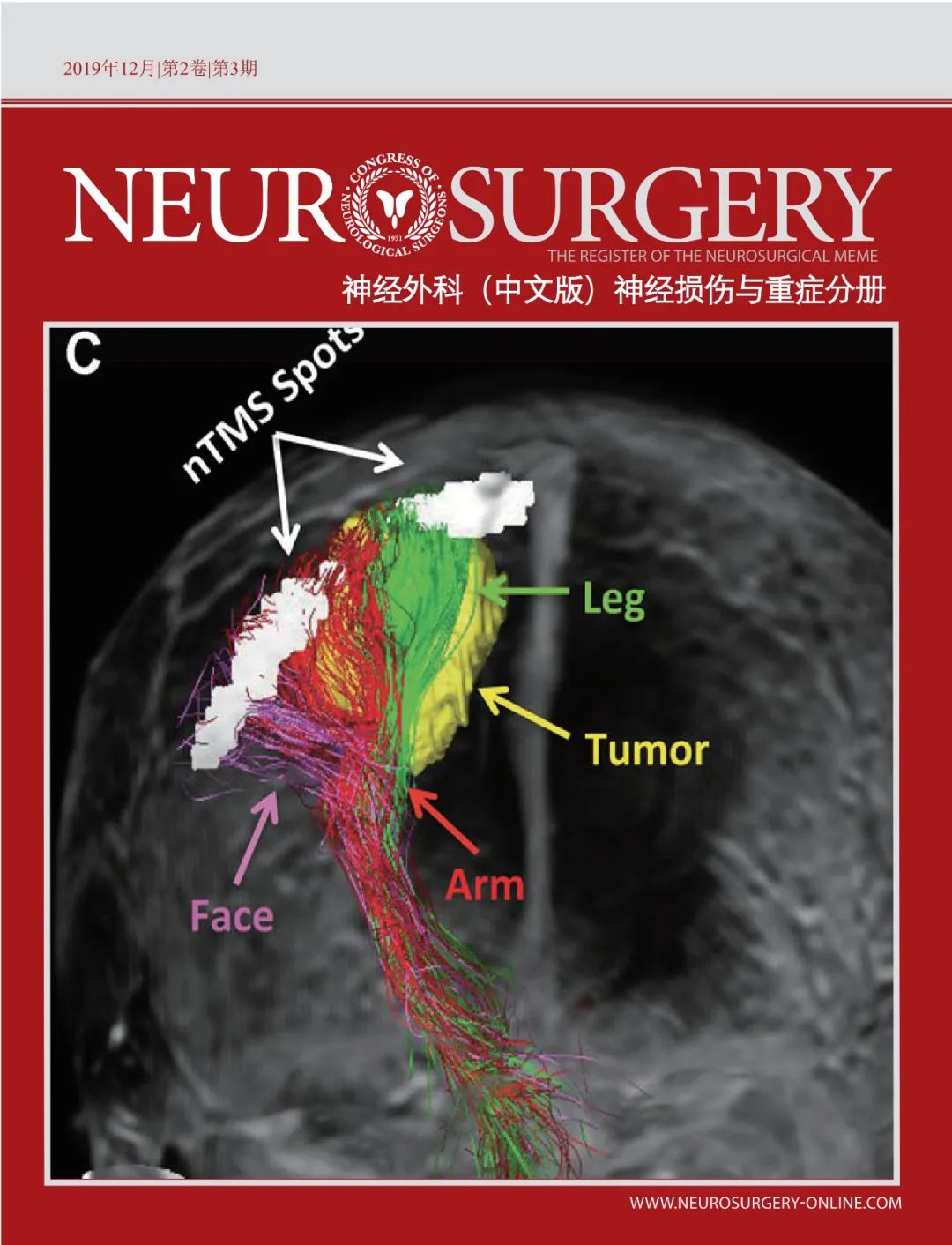
原文:
Symptomatic Hemorrhagic Complications in Clot Lysis: Evaluation of Accelerated Resolution of Intraventricular Hemorrhage Phase III Clinical Trial (CLEAR III): A Posthoc Root-Cause Analysis
原文作者:
Hussein A. Zeineddine, MD*作者单位:
* Neurovascular Surgery Program, Section of Neurosurgery, The University of Chicago Medicine, Chicago, Illinois; ‡ Emissary International, LLC, Austin, Texas; § Brain Injury Outcomes Unit, Johns Hopkins University, Baltimore, Maryland.编译:
林清松、陈越、许雅纹
审校:
康德智
1
脑室出血(intraventricular hemorrhage,IVH)的溶栓治疗已经有近20年的发展历史,尽管在“评估加速解决脑室出血III期(CLEAR-IVH)研究”的凝血块溶解对照研究中验证了溶栓治疗的安全性,但是出血性并发症仍然是一个需要考虑的问题。结合最近完成的CLEAR III期试验,分析有或无溶栓的脑室出血后发生症状性出血的相关因素。我们回顾了CLEAR III期试验中入组的受试者在随机入组后第1年内出现症状性出血事件的安全性报告。作为持续质量和安全监测的组成部分,我们通过试验数据库回顾了临床和影像数据。进行了一项事后根本原因分析以确定每种情况下发生再出血的潜在因素。根据再出血的发作时间(给药期间,给药后早期和晚期)、出血模式和治疗方式(阿替普酶与生理盐水)对病例进行分类分析。20名受试者发生了继发性症状性颅内出血,占受试者的4%。他们分别于给药期间(n=9,67%阿替普酶),给药后早期(n=5,40%阿替普酶)和给药后期(n=6,0%阿替普酶)发生了症状性再出血事件。导管相关的出血是最常见的(n=7,35%),其次是脑出血扩大或新的脑室出血(n=6,30%)和脑实质出血(n=5,25%)。治疗期间出现症状性出血的原因应综合考虑和患者相关的因素,大部分归因于阿替普酶。给药后再出血主要反映患者相关的危险因素。脑室内溶栓治疗可以轻度增加脑室出血后症状性出血并发症的总体风险,并且仅发生在用药治疗期间。在这项研究中,作者对最近发表的CLEAR III试验进行了一个仔细的事后评估[1],其中特别分析了经脑室内给予阿替普酶治疗后出现症状性再出血的特点。作者在根本原因分析中说明了几个重要的观察结果。
首先,在给药期间,接受阿替普酶的受试者出现再出血发生率高于对照组。而迟发性再出血则在接受生理盐水的受试者中居多。此外,无论是出血时间还是出血部位,这些迟发性再出血似乎与最初出血不存在相关性。因此,正如研究中得出的结论,迟发性症状性再出血很可能与潜在的病理生理有关,而与阿替普酶的治疗无关。其次,在研究给药期间出现症状性再出血的患者中,方案偏差似乎与不良事件相关(在该亚组9名患者中有5名出现方案偏离)。重要的是,这个特殊的原因可以在以后的研究中通过对研究方案的进一步说明来直接解决。正如研究者所说,CLEAR III试验的总体症状性再出血率较低,这使得统计分析变得困难。在这种情况下,事后的根本原因分析是恰当的;然而,由于缺乏统计分析,这使得观察结果的结论性较差,这在本研究中应予以注意。Kurt Yaeger
J. Mocco
New York, New York
在这项研究中,作者对CLEARIII数据进行了亚组研究,并进行了根本原因分析,以探讨阿替普酶治疗对IVH症状性再出血的影响。该研究有两个关键因素:阿替普酶治疗对IVH症状性再出血发生率的影响以及此类再出血发生的时机(阿替普酶治疗期间出血,治疗后早期出血或治疗后晚期出血)。他们的研究发现大多数再出血发生在治疗期间,并且出血的发生与是否接受阿替普酶治疗没有显著关系。此外,大多数阿替普酶治疗组的出血事件与方案偏离有关(给予双倍剂量的药物,每日的影像学复查资料缺失等)。- 作为大型判定性临床试验的亚组研究,该研究以前瞻性方式进行了专门的出血筛查,并事先定义了症状性出血的标准,减少了选择偏倚。- 研究结果证实阿替普酶治疗组中大多数症状性出血的原因是因为方案偏离,这使得CLEARIII试验的安全性足以让临床医生放心。研究还提示将试验方案付诸实践时需要严格的执行。- 所有合并IPH患者均发生再出血,提示临床中对于该类患者的处理需要更加小心谨慎。尽管在事后分析上存在不足,但是这项研究为IVH自然病程发展、再出血相关问题以及脑室内阿替普酶治疗安全性等问题的决策分析做出了重要贡献。
Boston, Massachusetts
脑室出血(intraventricular hemorrhage,IVH)主要源于脑室血肿破入脑室,较少直接起源于脑室系统[1],脑室出血常伴高死亡率和不良神经功能预后[2-4]。脑室出血的病理生理涉及多个复杂的机制,如脑脊液(cerebrospinal fluid,CSF)循环的破坏、紊乱、占位效应和移位以及血栓毒性[1,5]。在血肿吸收的过程中,脑室外引流(external ventricular drains,EVD)是常用的治疗IVH的方法,目的在于解除早期梗阻性脑积水[6-8]。EVD长期以来都存在一系列的并发症,比如穿刺道血肿、感染、因血块堵塞需反复操作或更换引流管等[9]。脑室内溶栓作为一种新的治疗手段,可用来加速血栓的清理而减小IVH继发的病理损伤。但脑室内溶栓治疗仍然存在出血风险[10]。症状性出血并发症和迟发性溶栓后出血的危险因素仍缺少正规的研究。“血栓溶解:加速脑室血肿溶解的III期临床试验(CLEAR III)”是一项国际多中心、随机、双盲的III期临床试验,用来评估脑室内给予重组组织型纤维蛋白酶原激活剂(阿替普酶)对IVH患者预后的影响。在2009年4月至2015年1月期间,共有来自美国、欧洲、以色列和巴西的73家研究中心,参与入组500例受试者。该研究的方法学和主要结果已发表[11]。CLEAR III期试验中有一小部分症状性出血患者因为致病原因被剔除。我们开展这项观察性研究,目的在于描述症状性出血事件,并采用手术并发症根本原因分析方法对其进行评估。
每个参与CLEAR III试验的研究中心均通过了当地伦理审查委员会的批准,并在确定了各研究中心的首席研究员后,根据当地机构审查委员会的要求,获得标准化书面知情同意。
共筛选出10538例IVH患者,最终纳入了500例受试者。潜在的受试者接受了一次详细的筛选,以排除因结构性血管病变而导致出血的患者[12]。作为临床治疗的一部分,所有病例在随机分组前均恰当地放置EVD。所有纳入的受试者均纠正凝血功能障碍并且在相隔至少6小时的时间段里行2次头颅扫描,以记录出血稳定情况(包括最初放置EVD引起的出血)。然后,受试者被随机分配到两组,通过EVD给予阿替普酶或者生理盐水(每8小时给药一次,给药后1小时保持引流管夹闭)。持续给药至第三和第四脑室血肿清除,和/或清除了80%的脑室血肿或给药达到12次为止。试验方案预先说明了不良事件和严重不良事件,由各研究中心报告并由试验安全委员会裁决,包括症状性出血。给药期间的症状性出血扩大或再出血被定义为安全终点,其具有试验方案预先规定的研究停止阈值,此外还包括30天内的死亡和颅内感染[11]。这些由试验的外科委员会在该试验中审查,并定期提交给试验的执行委员会。考虑到症状性出血的数量有限,排除了相关性或因果关系的统计分析,最终采用了观察法进行分析。
我们在此报告了一份针对20名受试者在参加CLEAR III试验并随访至少12个月后,诊断和判定有21例次症状性出血事件的根本原因分析的事后汇编。在记录出血稳定情况和随机分组之前出现由最初放置EVD引起的血肿扩大和出血,不在本文的考虑范围之内,这在其他报告中也没有涉及[13]。虽然记录了随访时计算机断层扫描(computed tomography,CT)发现的所有出血事件,但无症状出血不包括在我们的分析中。症状性再出血在试验方案中被预先定义为CT检查发现新的颅内出血或原始出血扩大的证据,并出现新对应的局灶性神经功能缺损或格拉斯哥昏迷量表(Glasgow Coma Scale,GCS)运动评分持续下降2分或以上(在至少8小时内测量2次以上)或其他严重程度相似的神经症状和体征。参与治疗的研究中心诊断并报告在纳入到发生IVH后1年的最后一次随访中所有症状性出血事件或迟发性再出血的发生率。在所有事件中,试验安全委员会审查病案记录,并由其核实出血扩大,并判定相关症状。在1例报告和判决的病例中,新出血仅发生在头皮,并将其排除。
数据从试验数据库(VISION EDC系统,德克萨斯州奥斯汀Prelude Dynamics公司的软件;德克萨斯州奥斯汀Emissary International LLC开发的研究专用工具)中检索。我们查询了可能导致再出血的患者相关危险因素。我们提取了基本资料(年龄、性别、种族)、临床资料(合并症、抗血小板或抗凝剂使用及GCS评分)、凝血情况和抗凝逆转(如适用)以及引流IVH的影像学特征。我们还系统地评估了与治疗相关的因素,这些因素有导致出血并发症或迟发性再出血的可能。我们收集了试验完成和揭盲后的治疗分配(阿替普酶或生理盐水)、放置EVD的详细信息(导管数量、偏侧、通过次数、放置质量和给药次数)、继发事件的出血方式和当时的凝血情况,以及在出血时预防性或治疗性抗凝剂的使用。此外,我们还收集了监察组为每一个纳入病例登记的所有方案偏差的性质(例如,技术事故如导管拉出、未能遵守给药或成像方案等)。试验的共同主要调查员(D.H.和I.A.A.)进一步评估每一方案的偏差是否有可能导致出血性并发症,以及偏差与同一患者再出血事件的临床和时间顺序关系。
根据试验安全委员会和执行委员会的意见,出于实际临床考虑,将再出血发生时间回顾性分为“给药”(从随机分组到最后一次给药后72小时)、“早期”(最后一次给药后72小时到30天)、“迟发”(30天后)。根据急性出血分布与EVD的关系及引流情况,为了方便分析我们将再出血分为导管相关性出血、IVH(新发或者引流部位IVH进展)、新发脑叶血肿(intracerebral hematoma,ICH)、新发深部ICH、或其他分类(硬膜下等)。
试验单位在20名受试者中记录到21例脑血管事件,并由试验安全委员会判定为症状性出血(见表1)。其中1名受试者,由于症状性硬膜下血肿早期行钻孔引流后再出血,使得病情更加复杂。随机抽取8名受试者接受阿替普酶治疗(阿替普酶组),剩余12名随机入组的受试者通过脑室外引流管EVD输注生理盐水(安慰剂组)。受试者的平均年龄为61.45岁(年龄范围:40-81岁)。这些病例的人口学和基线特征见表1。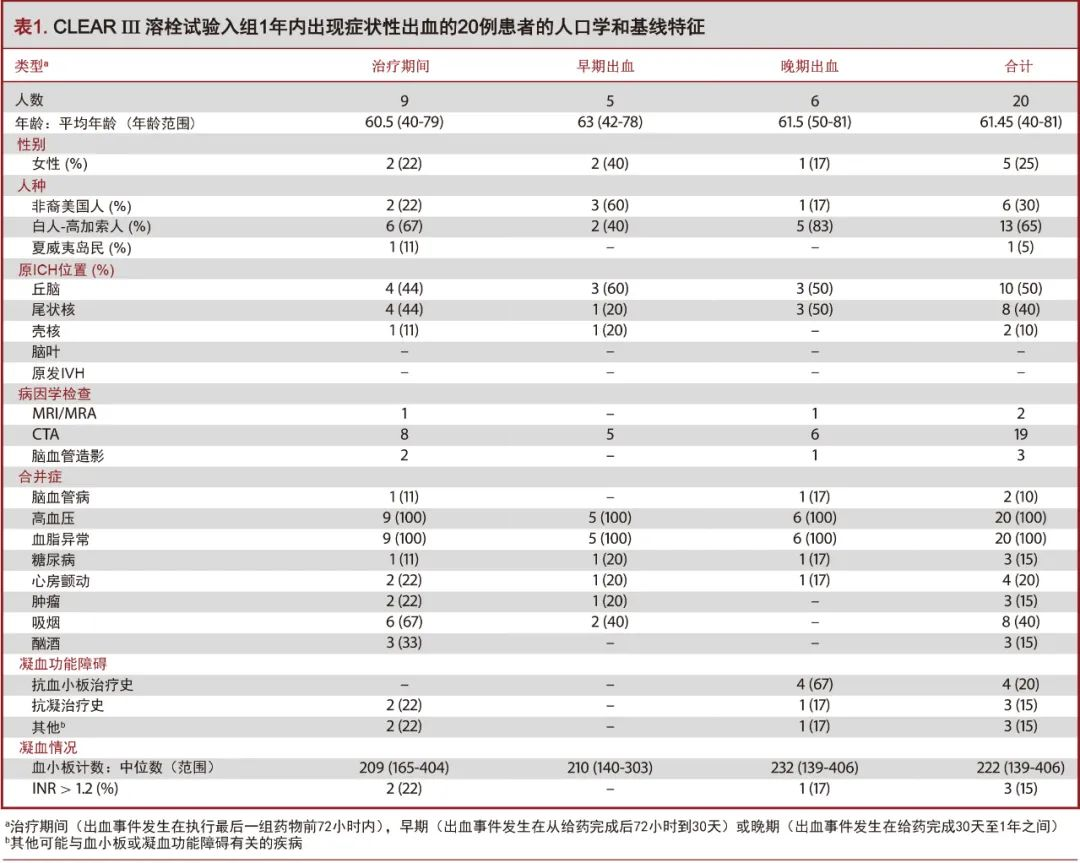
在所有继发于深部ICH的IVH病例中,没有症状性再出血的情况,这与原出血脑叶或原发性IVH有关。除1例外,所有病例均在随机分组之前通过CT血管造影(CT angiography,CTA)或常规血管造影检查,进行潜在的脑血管病因学筛查。对于肾功能异常患者,上述血管造影检查存在禁忌,故使用磁共振成像(magnetic resonance imaging,MRI/MRA)替代。所有受试者既往均有高血压和血脂异常病史。其他不常见的合并症包括心房颤动(20%)、糖尿病(15%)、脑血管病史(10%)及肿瘤(15%)。在20名受试者中,吸烟者8名(40%),有酗酒史者3名(15%)。根据入院前是否接受抗血小板治疗(n=4,20%),口服抗凝药(n=3,15%)或是否存在其他可能与血小板或凝血功能异常相关的疾病(如肝功能衰竭、多发性骨髓瘤病史等;n=3,15%),有10名受试者在初诊时即被归为是潜在的凝血异常患者。两组间EVD导管的数量、EVD放置过程的“穿刺”次数以及给药剂量等指标无统计学差异[11]。凝血功能评估中,血小板数中位数值为222×1000(范围:139-406)。3名受试者(15%)的INR(国际标准化比率>1.2)有所增加。上述偏差在随机化分组前均经过校正,以满足试验登记标准:血小板计数>100000和INR<1.4的,并在给药期间和EVD引流期间维持。在入组时接受氯吡格雷(波立维;必治妥施贵宝公司,纽约)的所有病例均给予血小板输注,接受阿司匹林治疗的患者由现场研究者自行决定是否给予血小板输注。根据当地的诊疗规范,在入组72小时后允许进行低剂量预防性抗血栓治疗,但每个病例均在入组30天后重新开始抗血小板和抗凝治疗。表2总结了症状性出血事件的相关因素,表3概述了出现症状性出血并发症的安慰剂组和阿替普酶组之间的人口学和治疗差异。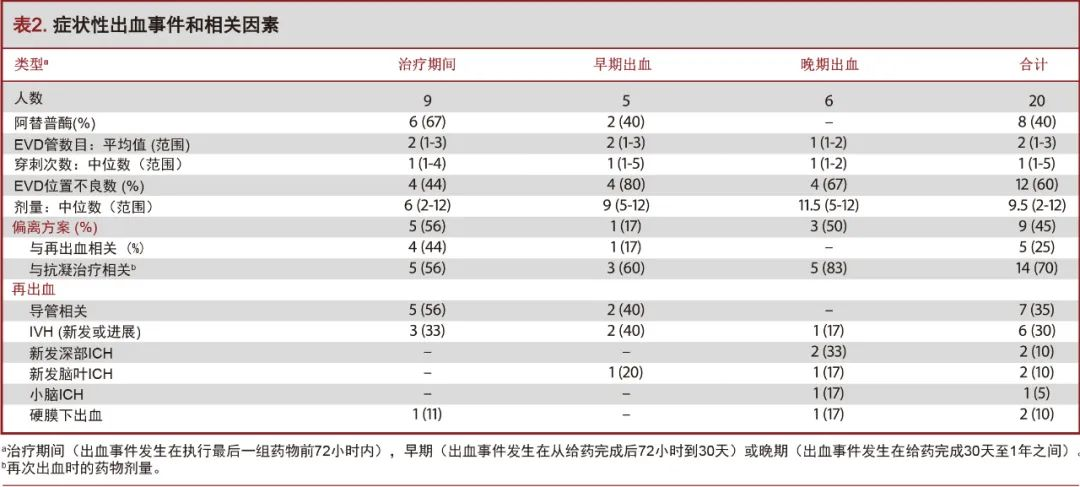
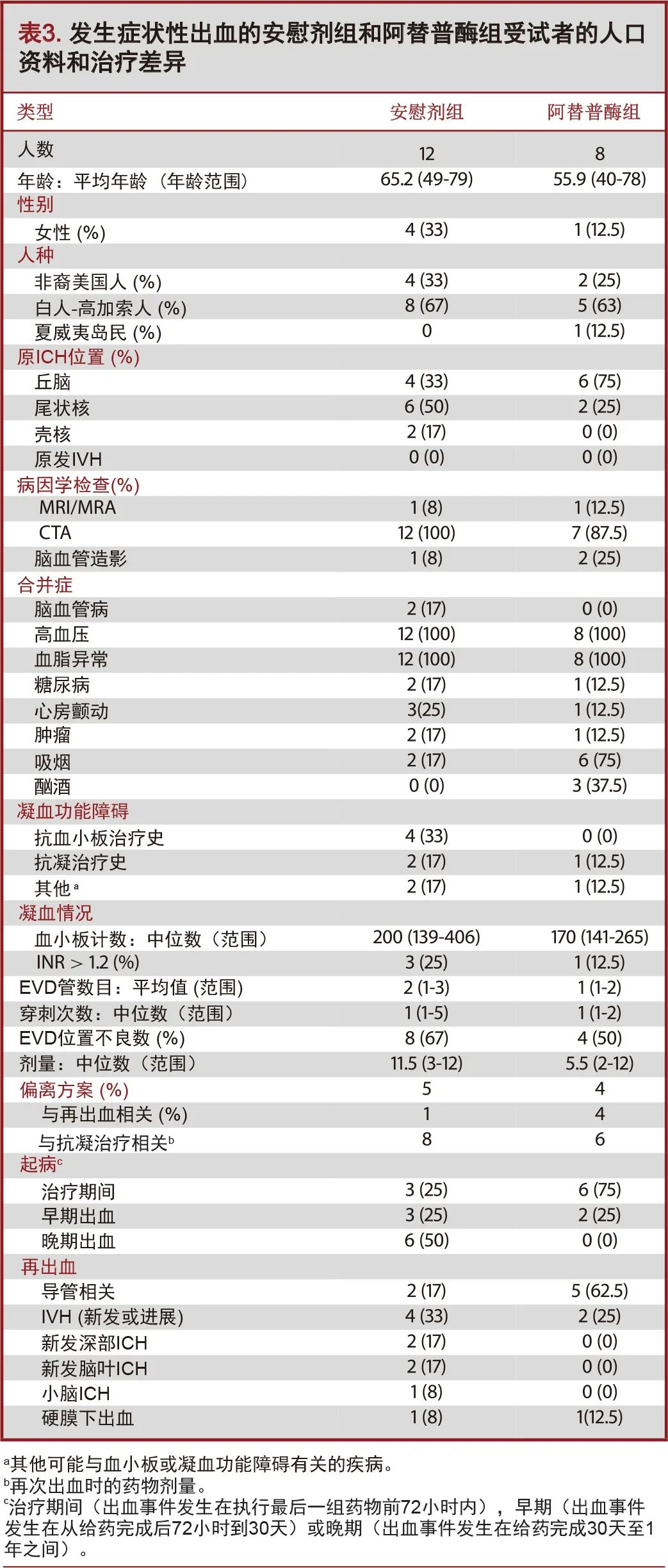
9名受试者在随机分组后和接受最后一组被试药物(经EVD推注溶栓剂或安慰剂)之前的72小时内出现症状性再出血。其中6例接受阿替普酶治疗(67%),3例通过EVD推注生理盐水(33%)。9名受试者中有2名(22%)在缓解期发现恶性肿瘤;另有2例房颤患者,其在随机分组之前进行了INR校正,其后根据房颤治疗标准推荐的INR区间进行长期抗凝治疗(表1)。在发生出血性事件时,5名受试者(56%)已经接受了预防剂量的抗血栓治疗,但凝血试验未发现异常。该组再出血发生的模式有:导管相关性出血(n=5,56%),IVH扩张(n=3,33%)和硬膜下血肿(n=1,11%)。9个受试者中的5名,在试验管理中出现了显著的方案偏离。这些方案偏离行为包括:包括给予双倍剂量的药物,给药时间过长和每日的影像学复查资料缺失。其中4例病例方案偏离被认为是出血的潜在原因之一(表2)。患者女,67岁,既往吸烟史,诊断尾状核ICH合并IVH,行双侧EVD,随机归入脑室内溶栓治疗组。第三组溶栓剂治疗和预防性抗血栓治疗同时进行,患者出现导管相关性出血伴神经功能障碍。出血可能是由于预防性抗血栓治疗和阿替普酶的联合作用,而非方案偏离(图1)。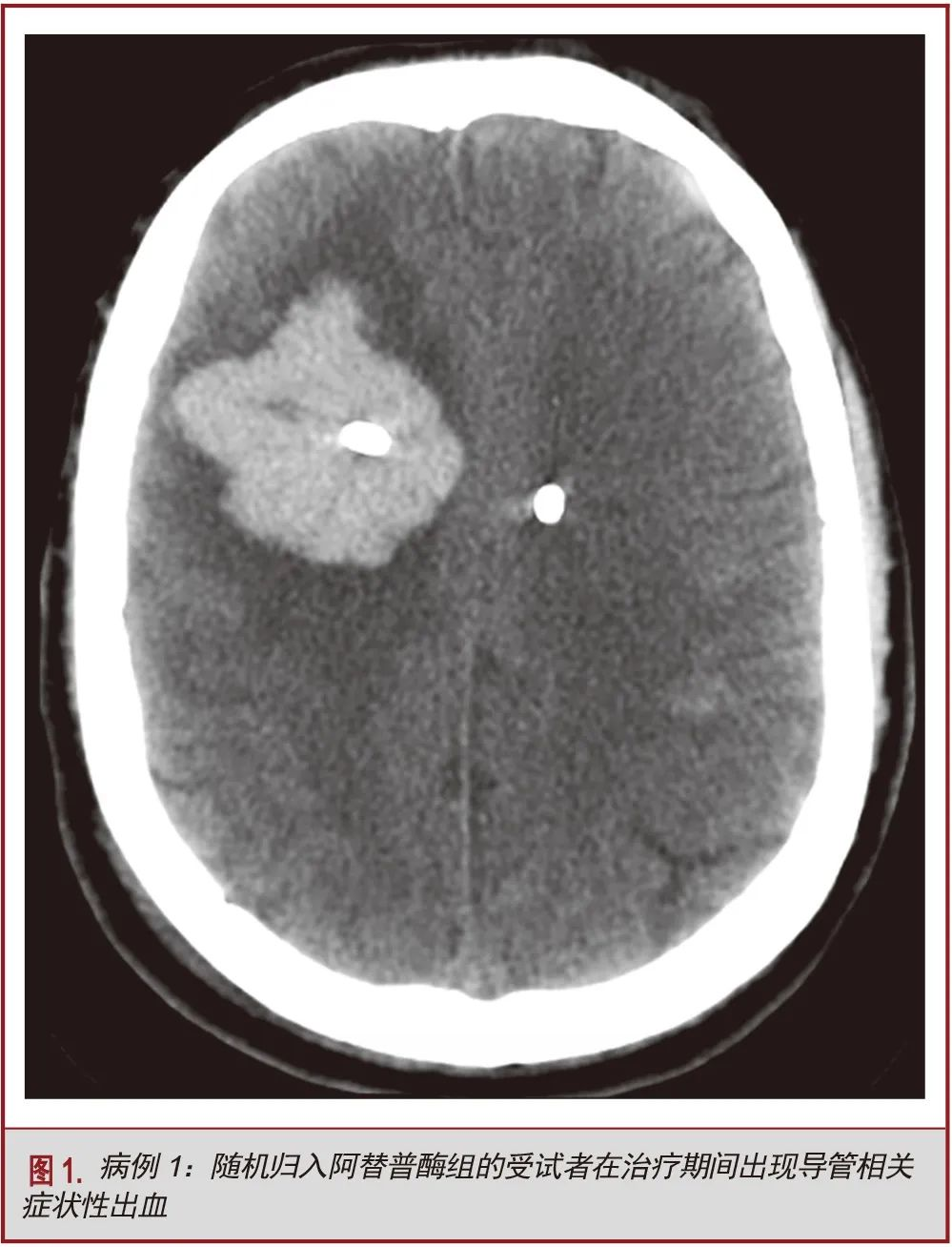
5名受试者在给药72小时后和前30天出现症状性再出血。该组中仅2名受试者在给药期间接受阿替普酶治疗(40%)。该组中出现的症状性再出血事件为:导管相关性出血(n=2,40%),IVH扩张(n=2,40%)和新发脑叶ICH(n=1,20%)。在出血时,2名受试者(40%)已接受预防性抗血栓治疗。1例(20%)接受了治疗量的抗凝治疗,属于方案偏离。另一例严重的方案偏离行为是:为INR升高的患者进行阿替普酶治疗;尽管是在出血前5天进行这一操作,但它仍可能是导致出血的原因(表2)。患者女,66岁,非洲裔,诊断丘脑ICH合并IVH,行双侧EVD,随机归入安慰剂组。在进行12次生理盐水推注后到达治疗终点。在最后一组盐水推注后的23天,病人再次出现IVH,予置入EVD治疗脑积水,同时继续预防性抗血栓治疗。出血可能是由于重复或多次置管及预防性抗凝治疗(图2)。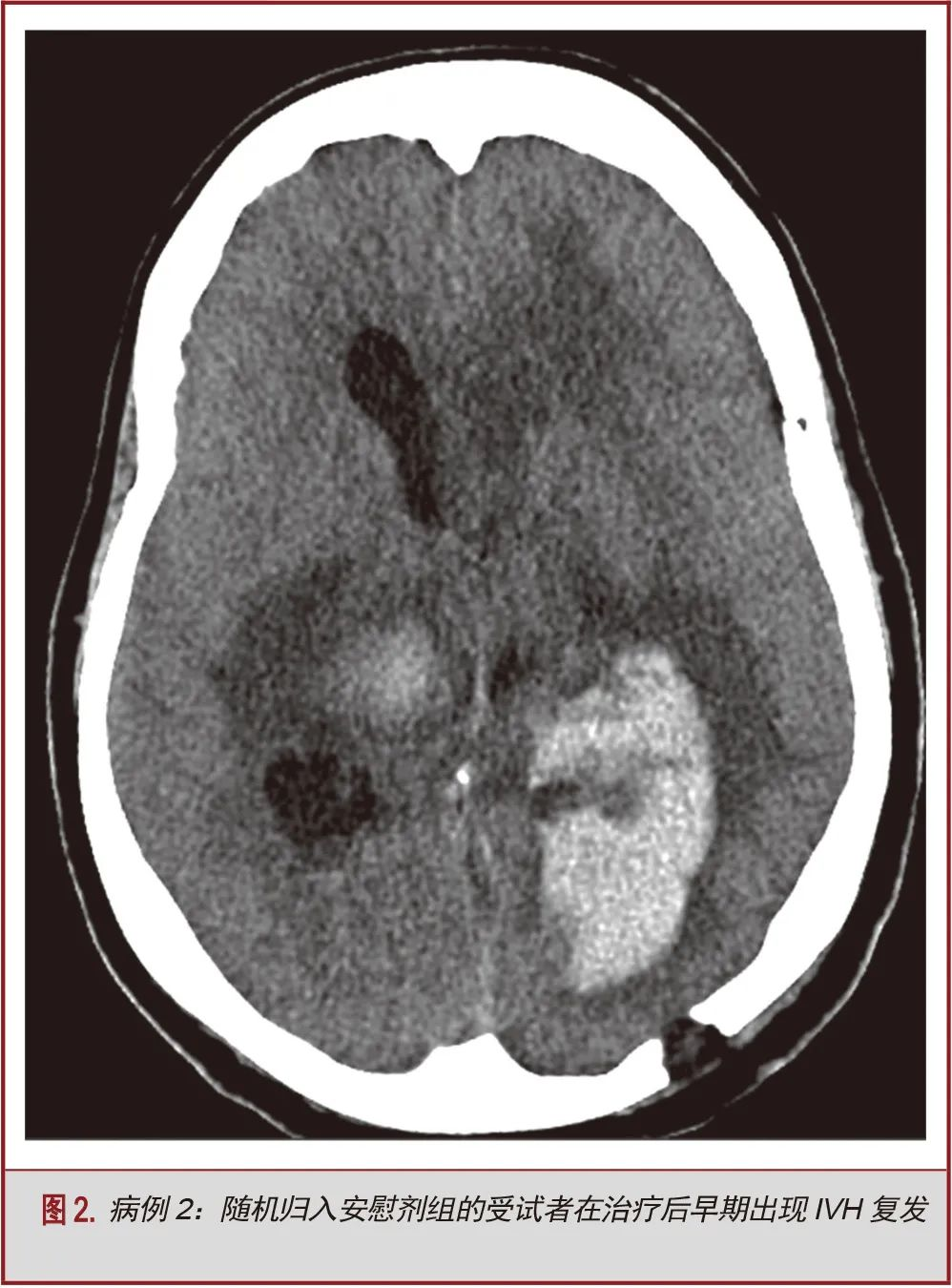
6名受试者在最后一次给药后超过1个月发生症状性出血。尽管他们经校正后都符合试验纳入标准,但该组中的大多数受试者(6名受试者中的5名)在初诊时即被判定存在上述的抗血小板或抗凝治疗的情况和/或患有其他凝血系统疾病。该组所有的受试者均被随机分入安慰组。本组发生的症状性再出血事件为新发IVH(n=1,17%),深部ICH(n=2,33%),脑叶ICH(n=1,17%),小脑出血(n=1,17%)和硬脑膜下血肿(n=1,17%)。出血发生时,5名受试者(83%)正在接受抗凝治疗(预防或治疗剂量的抗血栓治疗)。在6名受试者中的3名出现了方案偏离,所有的方案偏离情况在治疗早期未能进行CT复查。这些晚期症状性出血均发生在安慰剂组的受试者中,并且在时间顺序上远离出血事件,因此,阿替普酶治疗对出血没有贡献。患者男,71岁,高加索白人,既往高血压,血脂异常和甲状腺功能减退,诊断尾状核ICH合并IVH,行单次单侧EVD,随机归入安慰剂组,并接受12次生理盐水推注。受试者在最后一组盐水推注后近4个月出现新发脑叶ICH。出血可能由于潜在的脑血管淀粉样变(图3)。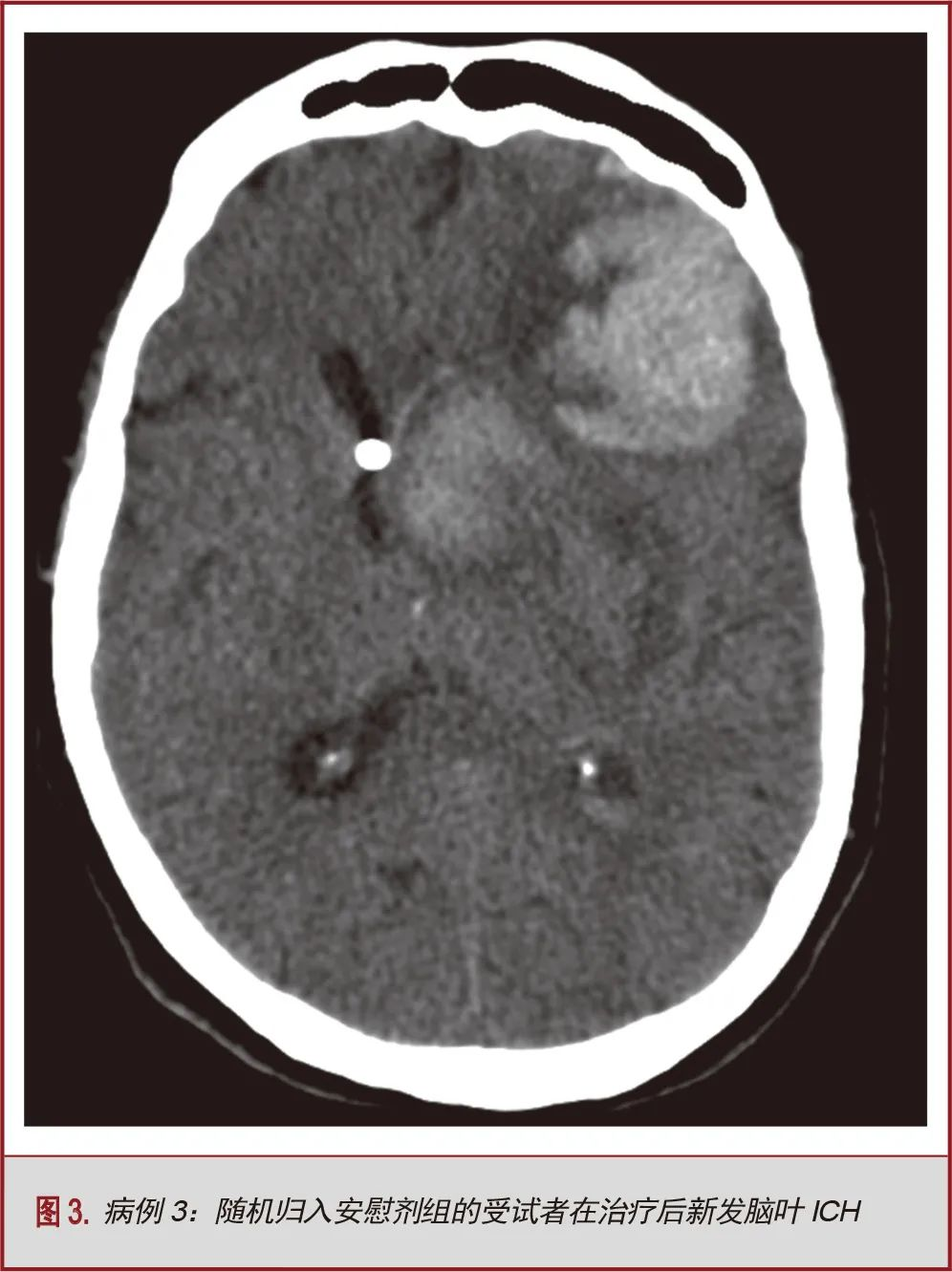
CLEAR III试验结果显示脑室内溶栓治疗有利于降低死亡率,但对预先设定的以良好改良mRS评分(modified Rankin Scor,mRS)为主要预后的指标没有影响。mRS为0-3分在病例亚组中有显著的获益,包括近一半的病例,脑室出血体积较大(>20mL),以及其他预后参数(如扩展版格拉斯哥预后评分)。并且该试验证实了干预的安全性,严重不良事件的发生率较低,并且症状性出血的发生率相似[11]。这些结论没有分析给药期或给药后症状性出血的模式或特定关联性,而这是临床医生感兴趣的。复发的出血性卒中主要取决于原发疾病的病因。虽然在之前未对脑室出血的复发率进行具体研究,但脑出血的纵向随访显示继发的出血并不少见。Passero等[14]的一项研究发现,在初次出血平均随访84个月后,24%的受试者在初次出血后再次出血,而其中有30%再出血发生在首次发病后第一年内。随着医疗实践的进步和对指南的理解与管理的改进,最近的一系列报告显示脑出血的复发率大幅下降,这主要是通过严格控制血压来预防深部脑出血的复发[15]。脑叶出血后再发出血的发生率比深部脑出血的发生率高(累积2年复发率15.7% vs 3.4%,P=0.011)[16]。这归因于淀粉样血管病缺乏二级预防策略以及在这种情况下恢复抗凝治疗的循证依据级别低、类别差和做法不同[17]。复发的脑室出血最常发生在初次出血后的2年内[18,19]。IVH后继发无症状性出血并发症的发生率差异显著,报道中高达30%[19,20]。报告中有临床相关的症状性并发症较为少见,介于0%-2.5%之间[21-24]。我们团队进行了系统评价,共纳入18项研究,包括2829例脑室外引流管置入病例。共有8.4%病例出现CT证实的出血和0.7%病例出现症状性出血[10]。除了CLEAR-IVH第二阶段试验和最近的CLEAR III试验外,所有的试验都没有设定标准的出血标准和症状性出血标准,出血调查不规范,既没有由影像中心判定的出血,也没有手术或安全委员会评判。在深入研究药物的药代动力学和脑室内给药剂量优化之前,有一些病案研究报告高剂量溶栓治疗(4mg阿替普酶)后出血性并发症的风险[25]。在Naff等[21]的血栓溶栓剂量递增研究报告中发现:当给予3mg剂量的阿替普酶时症状性出血的发生率为23%。这也对后续的研究剂量优化到每8小时不超过1mg起到指导作用[21]。该研究有助于确定脑室内给予阿替普酶的近似半衰期为6-8小时,这是基于随后给药时脑脊液中阿替普酶抗原检测确定的。接收脑室内纤维蛋白溶解治疗的患者的回顾性研究表明最佳EVD放置下溶栓的相对安全性[26],这包括对24项IVH纤维蛋白溶解研究的汇总分析[27]。直观地预测给药期间具有最高剂量治疗相关并发症的风险,特别是脑室内给予阿替普酶的半衰期短[21]。在我们的研究中,在给药期间接受阿替普酶的受试者出血性并发症的发生率比对照组高两倍。然而,在治疗期间用生理盐水治疗的受试者也发生出血性并发症,表明其他危险因素也参与其中。患者相关的因素包括既往凝血功能障碍的病史(包括与既往的恶性肿瘤或肝脏疾病相关病史),即便已按指南要求进行了明显的纠正。治疗相关的导致出血性并发症的因素包括EVD处理的偏差和药物应用的偏差(如双剂量给药,导管操作/拔除未加用抗凝药等)。这些和9例中有5例使用血栓预防性抗凝治疗可能与用药期间出现症状性出血相关。服药后出现症状性出血的病例主要为对照组患者。因此,阿替普酶似乎并没有增加给药后出血的风险。大多数迟发症状性出血的患者伴随有抗血小板的凝血病、抗凝治疗或其他系统性疾病。我们没有遇到因血管病变而发生的再出血,这可能归因于在入组病例时进行了严格的血管影像病因学筛查[12]。然而,筛查隐匿性淀粉样血管病,其中需要MRI特殊序列(梯度回波或易感性系列),这不是CLEARIII期试验中常规进行的。一个有症状的新发脑叶ICH,按时间顺序和解剖学上远离初次出血部位,提示淀粉样变性为其病因,这发生在2例对照组病例中。
我们的研究中症状性出血的发生率太低以至于无法进行统计学分析,判定潜在的致病危险因素。类似的给药方案偏差也有发生,整个CLEAR III试验,在没有症状性出血的情况下均常规使用了血栓预防治疗。样本量偏小也排除了研究各种预防血栓的给药方式的相关性(皮下注射肝素,LOVENOX和不同剂量)。因为我们的分析局限在症状性出血病例,我们没有对更常见的无症状性出血的相关因素进行分析。不同的血栓预防方案及其对症状性和非症状性出血的影响、静脉血栓形成和肺栓塞将在将来的报告中进行单独分析。我们的根本原因分析也在获取CLEAR III实验之外的受试者随访资料的过程中受到不一致的限制。尽管存在这些不足,但观察性数据对积累临床模式以及对将来的研究形成假设基础是非常有用的。我们的结果表明:反复发作的症状性出血在IVH后1年内通常不常见,只占4%的病例,这些出血具有不同的模式,早期和晚期出血存在关联。脑室内溶栓只轻微而不显著地增加症状性出血的总体风险,并仅在给药期间发生。在这些病例中,出血不能直接归因于单独一个因素,而更可能是由一系列与治疗和患者相关的因素引起的。症状性出血在给药后的发生率是相似的,与使用溶栓药物无关。这强调了二级预防策略的重要性,包括IVH后一年内的血压控制、合适的抗凝治疗和抗血小板治疗。



声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。


![]()

















