成人脑胶质瘤多为高度恶性,而儿童胶质瘤以低度恶性为主。成人低级别胶质瘤大多向高级别演变,而儿童胶质瘤的恶性发生率较低,这是成人与儿童胶质瘤基因突变不同有关。
——摘自文章章节
【Ref: Collins KL & Pollack IF. Cancers (Basel). 2020 May 4;12(5):1152. doi: 10.3390/cancers12051152.】
低级别胶质瘤是儿童中枢神经系统常见的肿瘤。美国匹兹堡大学小儿神经外科的Kelly L. Collins和Ian F. Pollack综述小儿低级别胶质瘤的分类、病理学和影像学表现、外科手术和辅助治疗的新进展、新疗法,发表于2020年5月的《Cancers》在线。
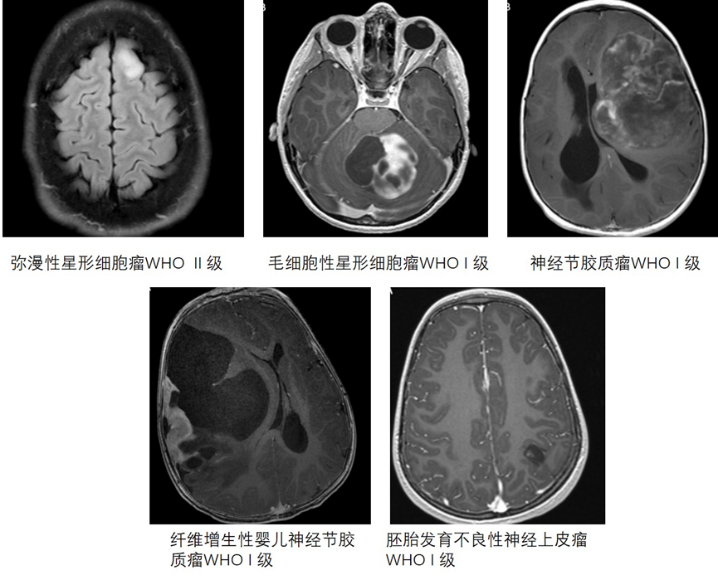
成人脑胶质瘤多为高度恶性,而儿童胶质瘤以低度恶性为主。成人低级别胶质瘤大多向高级别演变,而儿童胶质瘤的恶性发生率较低,这是成人与儿童胶质瘤基因突变不同有关。成人胶质瘤IDH突变型和TP53突变型常见,而儿童胶质瘤这两种突变少见,ATRX和1p19q编码缺失常见。对儿童胶质瘤的分子和遗传学特征的深入了解,进一步完善肿瘤分类和治疗方案,如确定儿童胶质瘤的主要病因是丝裂原激活蛋白激酶(MAPK)信号通路的基因突变,即可把BRAF基因作为治疗靶点。根据WHO《中枢神经系统肿瘤分类》2016版,儿童脑胶质瘤分为以下几类:1. 弥漫性星形细胞瘤(diffuse astrocytoma):属WHO Ⅱ级;其特征是分化良好的肿瘤性星形胶质细胞弥漫性浸润正常脑实质,可见MYB/MYBL1的扩增或重排。
2. 毛细胞性星形细胞瘤(pilocytic astrocytoma):属WHO Ⅰ级;其特征是在致密双极性星形胶质细胞区存在GFAP阳性突变,与边界清楚的细胞稀疏囊性区域交替出现,可见BRAF基因或MAPK信号通路的其它基因突变。
3. 多形性黄色细胞瘤(pleomorphic xanthoastrocytoma):属WHO Ⅱ级;病变通常有囊性变,其组织学特征是致密的细胞和核异型,具有多形性和多核性,可能出现BRAFV600E突变和9p21(CDKN2A/B)缺失。
4. 室管膜下巨细胞性星形细胞瘤(subependymal giant cell astrocytoma):属WHO Ⅰ级;发生于Monro孔附近,与结节性硬化症密切相关。组织学上,这类肿瘤包含大肥胖细胞、梭形细胞和神经节细胞样星形胶质细胞,镜下可见血管周围假栅栏结构,但没有有丝分裂。其发生可能与mTOR信号的失调有关。
5. 神经节胶质细胞瘤(Ganglioglioma):属WHO Ⅰ级;在星形胶质细胞或偶尔少突胶质细胞背景下,由高分化双核神经节细胞组成。可见BRAF基因突变,尤其是BRAFV600E突变。
6. 纤维增生性婴儿星形细胞瘤和神经节胶质细胞瘤(desmoplastic infantile astrocytoma and ganglioglioma):属WHO Ⅰ级;通常是位于皮质的囊性肿瘤;在组织学上,表现为致密的纤维状间质,含有由神经上皮细胞和星形细胞分化的混合细胞;常有BRAFV600E突变。
7. 胚胎发育不良性神经上皮瘤(dysembryoplastic neuroepithelial tumor):属WHO Ⅰ级;常发生在儿童和青年人的颞叶,以癫痫为主要症状;组织学上由少突胶质样细胞结节或局灶性皮质发育不良和黏液基质中含有“浮动神经元”的松散结构成分混合组成;常见FGFR1改变和MAPK通路激活突变。低级别胶质瘤常见症状为癫痫发作或局灶性神经功能缺损,如无力、感觉丧失、语言困难、视觉障碍、认知困难、人格改变或学习或运动成绩下降等;症状可因肿瘤侵犯的部位不同而不同。症状缓慢进展或隐匿。颅内压增高征可出现在脑积水发生后。CT扫描肿瘤呈等密度或低密度,常无强化。MRI-T1加权成像为等或低信号,T2加权为高信号和FLAIR成像为受抑制信号。有的肿瘤呈囊实性,有的为实性(图1)。功能磁共振成像(fMRI)、弥散张量成像、体感诱发电位(SSEP)以及术前硬膜下栅格电极或立体定向脑电图(sEEG)等有助于功能区定位和设计手术路径及手术方式。
手术时机取决于肿瘤影像学特征和患儿临床情况。无占位效应的小病灶可选择手术或随访。无症状的大病灶可择期手术。肿瘤引起脑积水时可作脑室外引流和肿瘤切除;在许多情况下,可以同时进行肿瘤切除和脑室外引流。因占位效应出现严重症状时,应紧急切除肿瘤。原则上,幕上脑实质胶质瘤术前使用抗惊厥药,如左乙拉西坦,预防癫痫发作。严重脑水肿的患儿术前和术后酌情给予一定量的皮质类固醇。外科手术的目标是获取肿瘤组织,明确病理学诊断,尽可能多地切除肿瘤,同时不造成新的神经功能缺损。85%以上的儿童低级别胶质瘤在全切除后可达到10年无进展生存(PFS);而肿瘤次全切除后,50%以下的患儿达到10年PFS,因此要求尽可能做到全切除。但是,未完全切除的低级别胶质瘤患儿的5年生存率也可达到90%;不同于成人,儿童肿瘤可长期保持静止状态。对于边界不清,浸润深部核团或其它重要区域或跨中线的非毛细胞型胶质瘤,则不适合全切除,应立体定向活检或开颅部分切除。儿童低级别胶质瘤全切除后预后良好;深部浸润性肿瘤或浅部未全切除的肿瘤,可采用重复切除和辅助治疗,如分子靶向药物、传统化疗和放射治疗。但是,目前对残留胶质瘤的放射治疗,总体效益和最佳时机尚不清楚。放射治疗似乎增加残留胶质瘤的恶性变发生率,还可导致儿童认知功能发育迟钝、内分泌疾病和血管性病变。目前的放疗技术可以让10-12岁以上、有体积较大不可切除胶质瘤的儿童安全地使用常规放疗。对于年幼儿童,使用先进的放疗计划可降低放疗并发症的发病率。在年幼儿童需避免使用放疗时,可采用常规化疗,如卡铂、长春新碱、6-硫鸟嘌呤、普鲁卡巴嗪或洛莫司汀等,但现在没有一种化疗方案能够可持续的长期控制肿瘤。毛细胞性星形细胞瘤常表现为BRAF基因的易位或激活突变,或丝裂原激活蛋白激酶(MAPK)信号通路改变。目前,正在开发抑制MAPK信号通路的生物制剂,如塞来美替尼、达布拉非尼、曲美替尼,单用或与卡铂和长春新碱联合治疗儿童新诊断BRAFV600E突变的低级别胶质瘤。抗血管生成药物,贝伐珠单抗和来那度胺也已在临床试用。临床试验发现,MAPK抑制剂对弥漫性星形细胞瘤、多形性黄色星形细胞瘤有一定疗效。靶向失调的mTOR信号分子制剂,如依维莫司有良好的短期控制肿瘤的效果。但上述治疗方案目前处于临床Ⅰ期或Ⅱ期试验阶段。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。






