《Radiologic Clinics of North America 》 2020年11月刊载[58(6):1115-1133. ]美国University of Alabama Birmingham的Philip R Chapman, Aparna Singhal, Siddhartha Gaddamanugu , Veeranjaneyulu Prattipati撰写的综述《垂体腺的神经影像:实用解剖学与病理学。Neuroimaging of the Pituitary Gland: Practical Anatomy and Pathology 》(doi: 10.1016/j.rcl.2020.07.009.)。
经典的情况,大腺瘤沿着力最小的路径生长:肿瘤通过鞍膈的中央开口进入鞍上池。鞍膈环侧小叶(The circumlateral leaflets of the diaphragma sellae)最初向上移位,能在水平面上限制肿瘤的生长,导致典型的冠状面双叶状(the typical bilobed appearance in the coronal plane),肿瘤的鞍下成分与鞍上部分部分分离。经典的外观被比作雪人(图4)。当肿瘤向上延伸时,显微镜下经常会侵袭鞍隔本身。
随着肿瘤的增大和垂直伸长,可接触、消除、移位或压迫视交叉。压迫视交叉可产生多种视觉缺陷,包括视交叉综合征。垂体腺瘤是引起视交叉综合征的最常见病变,其次是引起对视交叉外源性压迫(extrinsic optic chiasm compression)的其他病变,如脑膜瘤或颅咽管瘤。虽然双颞侧偏盲(bitemporal hemianopsia),即每只眼睛视野的颞(外侧)一半部分周围视力受损,常被认为是与垂体腺瘤相关的典型发现,但实际上它是罕见的。相反,患者更常表现为不完全性双颞侧视觉缺陷或混合缺陷。
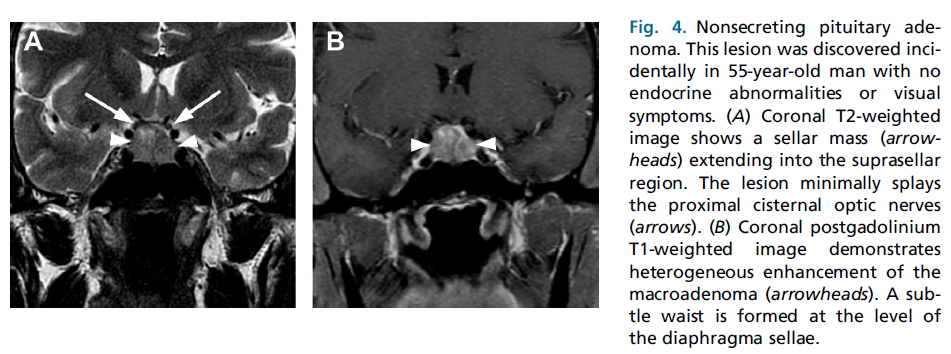
图4.无分泌性垂体腺瘤。这个病变是偶然发现的,患者为55岁男性,没有内分泌异常或视觉症状。(A)冠状T2加权图像显示鞍区团块(箭头)延伸至鞍上区域。病灶最小限度地展开接近脑池段视神经(箭头)。(B)冠状位钆剂后T1加权图像显示大腺瘤的不均匀增强(箭头)。在鞍膈处形成了一个细腰。
对于如何最好地测量鞍上伸展的程度或视交叉移位或压迫的程度,目前尚无共识。然而,一般来说,肿瘤越大,视交叉受压越大,患者越有可能有更明显的视觉缺陷。
虽然没有统一的共识,但在过去的一些放射影像学报告中已经使用了“巨大腺瘤(giant macroadenoma)”这个术语来描述最大尺寸超过40mm的肿块。Symon和同事将巨大腺瘤定义为从蝶骨平面中线向任何方向延伸超过40mm,或向蝶鞍上方延伸到Monro孔的6mm范围内。其他作者将此术语保留针对上缘超过蝶骨平面20毫米的肿瘤。巨大腺瘤通常被认为更具进袭性,更难以切除,更容易复发(图5)。
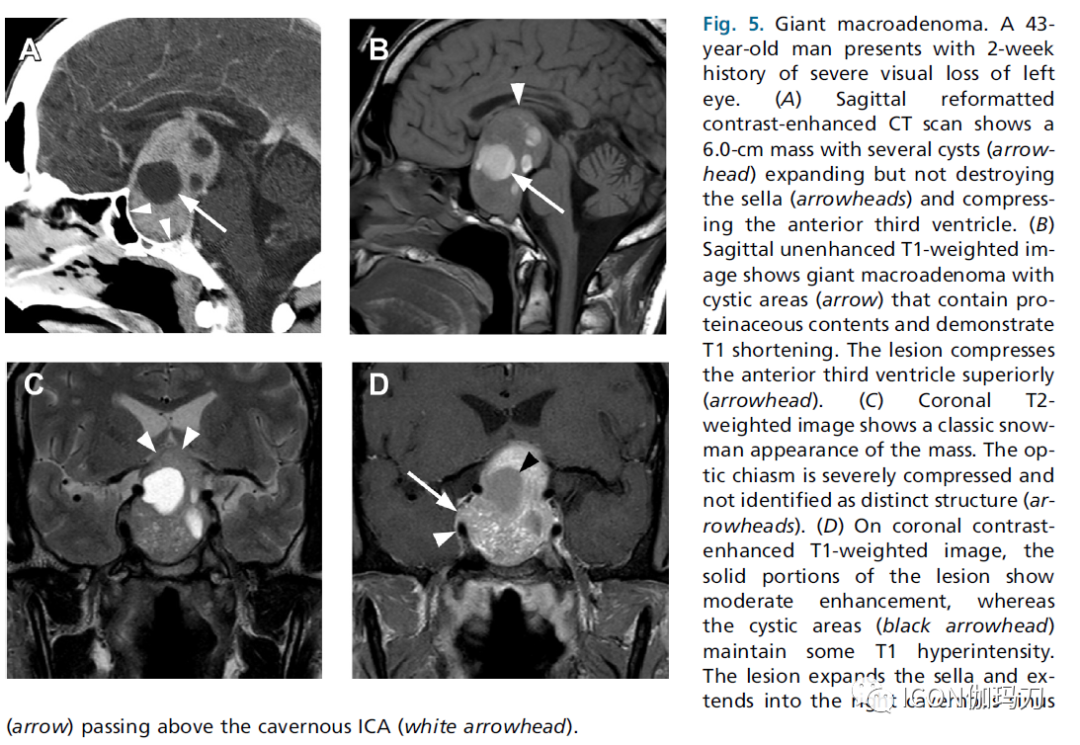
图5.巨大腺瘤。一位43岁男性,有严重左眼视力丧失2周的病史。(A)矢状面重建对比增强CT扫描显示一个6厘米大小的肿块,伴有几个囊肿(箭头),囊肿扩张但未破坏蝶鞍(箭头),压迫前第三脑室。(B)矢状面未增强的T1加权像显示巨大腺瘤含有似蛋白质的囊性区域(箭头),显示T1缩短。病变向上挤压第三脑室前部(箭头)。(C)冠状面T2加权图像显示肿块的典型的雪人外观。视交叉严重受压,没有明显的结构(箭头)。(D)在冠状位T1加权像上,病灶实性部分显示中度强化,而囊性区域(黑色箭头)保持一定的T1高信号。病变扩大蝶鞍并延伸至右侧海绵窦(箭头),经过海绵窦ICA上方(白色箭头)。
大约5% - 10%的所有垂体腺瘤向外扩展,超过腺垂体和蝶鞍边缘,侵袭邻近的海绵状窦。对海绵窦的侵袭增加了手术的复杂性,导致肿瘤的高残留/复发率,并与持续的内分泌功能障碍有关。对海绵状窦侵袭的定义因放射影像学、外科、内窥镜和显微镜的标准而异。
垂体和海绵窦之间的显微界面已经通过组织学和显微解剖技术进行了评估。漆松涛和同事们认为垂体外壁有一层双层膜:内面是附着于垂体组织的固有层(inner lamina propria);还有一个较为宽松的垂体外包膜(outer pituitary capsule)。外层也是海绵窦内侧壁的一部分。在他们的描述中,海绵窦的内侧壁除了垂体包膜外还有个纤维层。当肿瘤从蝶鞍向外侧扩展时,它穿过海绵窦的固有层、垂体包膜、纤维层(the lamina propria, the pituitary capsule, the fibrous layer of the cavernous sinus),最后到达静脉隔腔的内皮内层(the endothelial lining of the venous compartment)。作者发现上缘较薄,这可能解释了为什么腺瘤更常延伸到海绵窦的上部隔腔。
MR成像在鉴别这些将外侧凸出的垂体腺与内侧海绵窦分隔开的显微层时并不可靠。MR影像对肿瘤侵袭的评估依赖于宏观表现,如肿瘤与海绵窦段颈内动脉的关系及海绵窦受累的程度。1993年,Knosp和同事介绍了一种基于磁共振成像的分类系统来预测海绵窦侵袭。该系统基于外侧肿瘤的伸展范围与冠状位磁共振图像中所见的海绵窦内和海绵窦上部之间的一系列切线的关系。该分类系统定义了5级侵袭,范围从0级到4级(图6)。数据显示,冠状面磁共振成像上肿瘤越过颈动脉间线上(2级及以上)具有在手术中发现海绵窦侵袭很高的预测价值。相反,0级或1级的患者不太可能有明确的侵袭。他们的结果还表明,海绵体的侵袭程度与肿瘤大小直接相关。
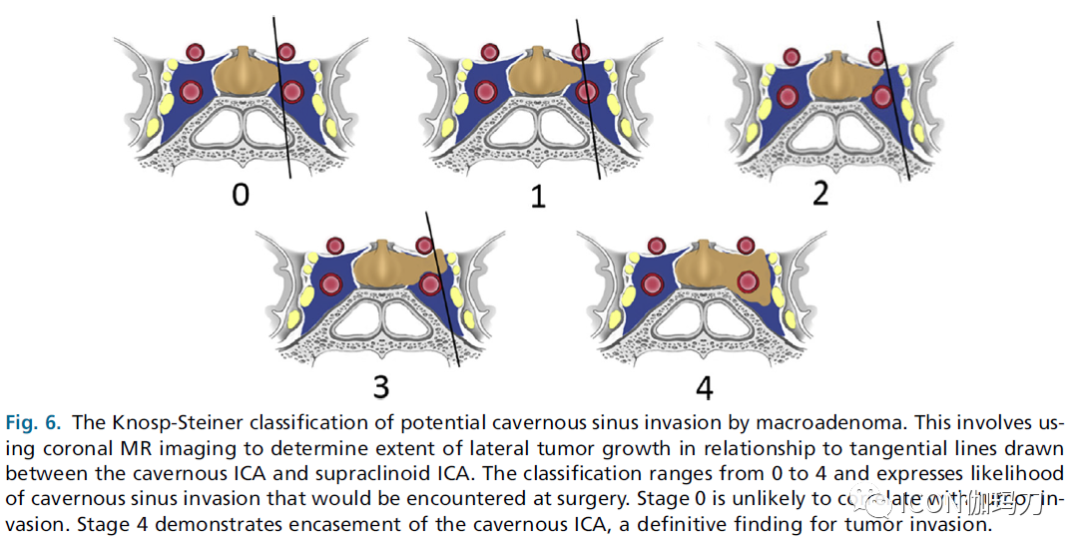
图6.大腺瘤侵袭海绵状窦可能性的Knosp-Steiner分级。这涉及到使用冠状位磁共振成像来确定向外侧生长的肿瘤范围,并与海绵窦颈内动脉(ICA)和床突上段ICA之间的切线相联系。分级范围从0到4级,表示在手术中可能遇到的海绵窦侵袭的可能性。0级不太可能与肿瘤侵袭有关。4级显示海绵窦段颈内动脉被包绕,这是肿瘤侵袭的明确表现。
对大腺瘤可能侵袭海绵窦的Knosp-Steiner分级(见图6)涉及采用冠状位磁共振成像,根据海绵窦颈内动脉(ICA)和床突上段颈内动脉(ICA)之间的切向线确定向外侧生长的肿瘤范围。
其他人已经评估了Knops - Steiner大腺瘤的分级和其他可能预测存在海绵状窦侵袭的MR成像发现。Cottier和同事发现海绵窦侵袭最具体的征象是海绵窦内部的颈内动脉部分被肿瘤包绕,定义为周长的67%受累(阳性预测值为100%)。对Knosp-Steiner分级为3级的大腺瘤阳性预测值为85%。如果颈动脉沟静脉隔腔(冠状位磁共振成像海绵窦颈内动脉下方的内侧静脉隔腔)闭塞,侵袭的可能性很高(阳性预测值为95%)。如果海绵窦内颈内动脉周长被包绕的百分比低于25%或Knosp-Steiner分级为0或1级,则可排除海绵窦侵袭,其阴性预测值为100%(图7)。
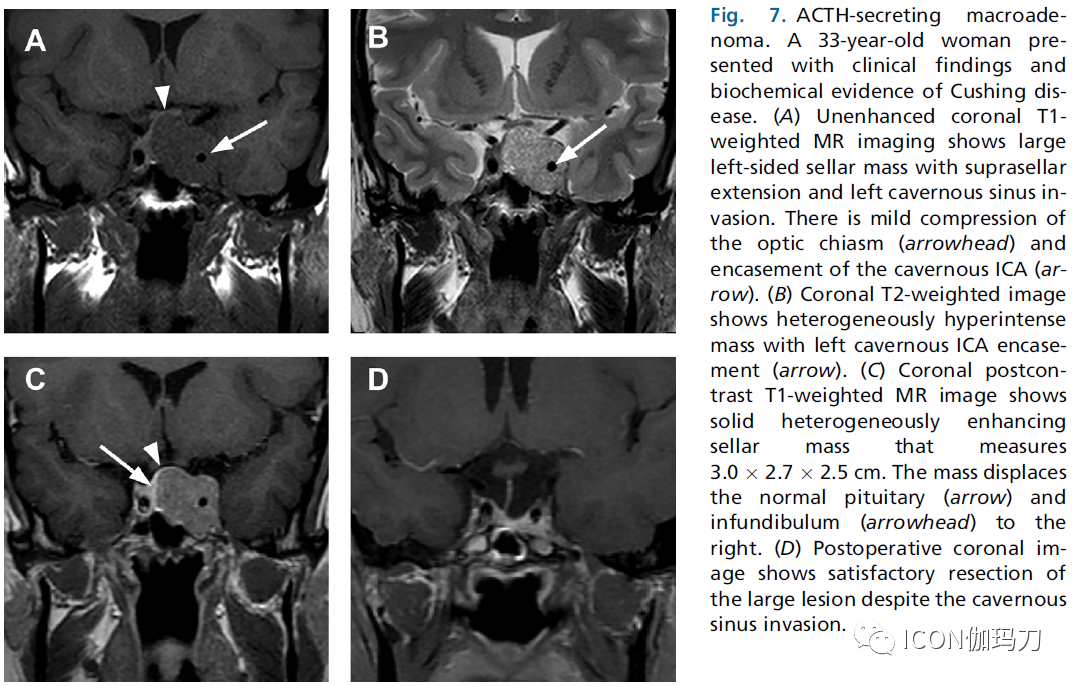
图7.分泌ACTH的大腺瘤。一位33岁女性,有库欣病的临床表现和生化证据。(A)平扫冠状面T1加权MR显示左侧大的鞍区肿块,并延伸至鞍上,伴左侧海绵窦侵袭。轻微压迫视交叉(箭头),海绵窦颈内动脉被包绕(箭头)。(B)冠状面T2加权成像显示左侧海绵窦不均匀高信号肿块包绕颈内动脉(箭头)。(C)冠状位对比T1加权MR图像显示实质性不均匀强化鞍区肿块,尺寸为3.0x2.7x2.5 cm。肿块将正常垂体(箭头)和漏斗部(箭头)向右侧移位。(D)术后冠状位图像显示,虽然大病变侵袭海绵窦,但仍能令人满意地将其切除。
起源于或累及腺体和蝶鞍下方的腺瘤可累及在下面的硬脑膜和中央颅底骨质。Selman和同事们对65例垂体腺瘤进行经鼻蝶窦手术,报告51例(85%)经显微镜检查发现鞍底硬膜侵袭。这些作者证明肿瘤整体大小与硬膜侵袭之间存在直接相关。95%的大腺瘤(>10毫米)患者有硬膜侵袭。作者也注意到,显微镜下甚至在一些微腺瘤发生硬膜侵袭。在对354例患者的一项较大规模的研究中,Meij和他的同事发现,45%的所有患者中,存在硬膜侵袭,并证实肿瘤大小和硬膜侵袭之间的相关性。
当大腺瘤浸润腺体时,可发生蝶鞍的广泛扩张,通常保留骨蝶鞍光滑的皮质边缘。随着进展性增大,在下面的骨骨皮质变薄,最常见于蝶窦顶部。可见蝶窦顶局灶性开裂,肿瘤可直接浸润侵入蝶窦(图8),也可浸润到斜坡的骨小梁和骨髓间隙。在少数情况下,以向下的生长模式为主(图9)。斜坡的骨质改变可包括局灶性不规则(focal irregularity)、渗透性改变(permeative change)、混合性硬化-渗透性改变(mixed sclerotic-permeative change)或明显的溶解(frank lysis)。大的肿瘤会扩张并破坏斜坡,类似于脊索瘤、骨髓瘤或转移性疾病。向鞍区下方侵袭的报道多为小的病例系列或病例报告。Luo和同事报告,28%的鞍区下方延伸并累及鞍底和蝶窦。
Chen和同事最近用CT评估390例垂体大腺瘤的斜坡侵袭。32例(8.21%)患者经CT检查发现斜坡侵袭并经手术证实。在这项研究中,作者发现女性是侵袭斜坡的最大危险因素。这一发现与之前的研究相矛盾,即男性有较大的斜坡侵袭倾向。与海绵窦侵袭一样,肿瘤体积较大是斜坡侵袭的强烈危险因素。在本报告中,零细胞腺瘤即使在校正了较大的平均肿瘤体积后,斜坡侵袭更为常见。一些大腺瘤优先(have a preferential)侵袭颅底中央。肿瘤被误认为原发性蝶骨病变侵袭鞍底。在这些患者中,识别肿瘤与下方的垂体腺毗邻是垂体起源的最好线索。
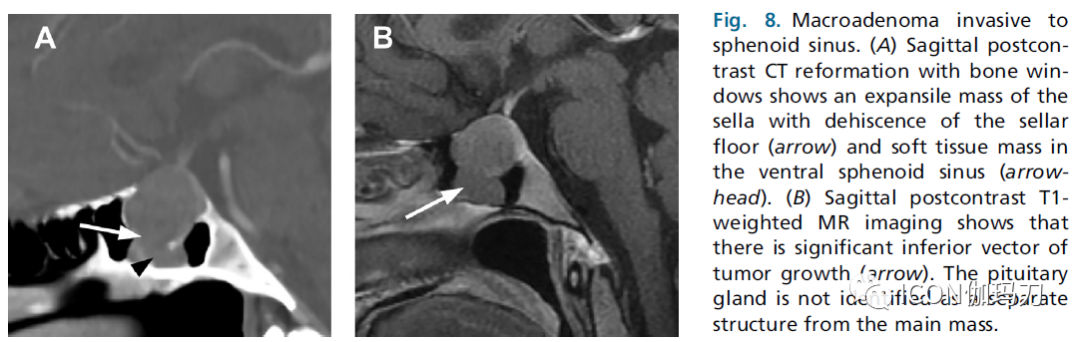
图8.大腺瘤侵袭蝶窦。(A)矢状位CT对比增强后骨窗重建显示鞍区肿块扩张(箭头)和蝶窦腹侧软组织肿块(箭头)。(B)矢状位对比增强后T1加权MR显示有明显的肿瘤生长的向下向量(箭头)。垂体腺未被认为是与肿块主体分离的一个单独的结构。
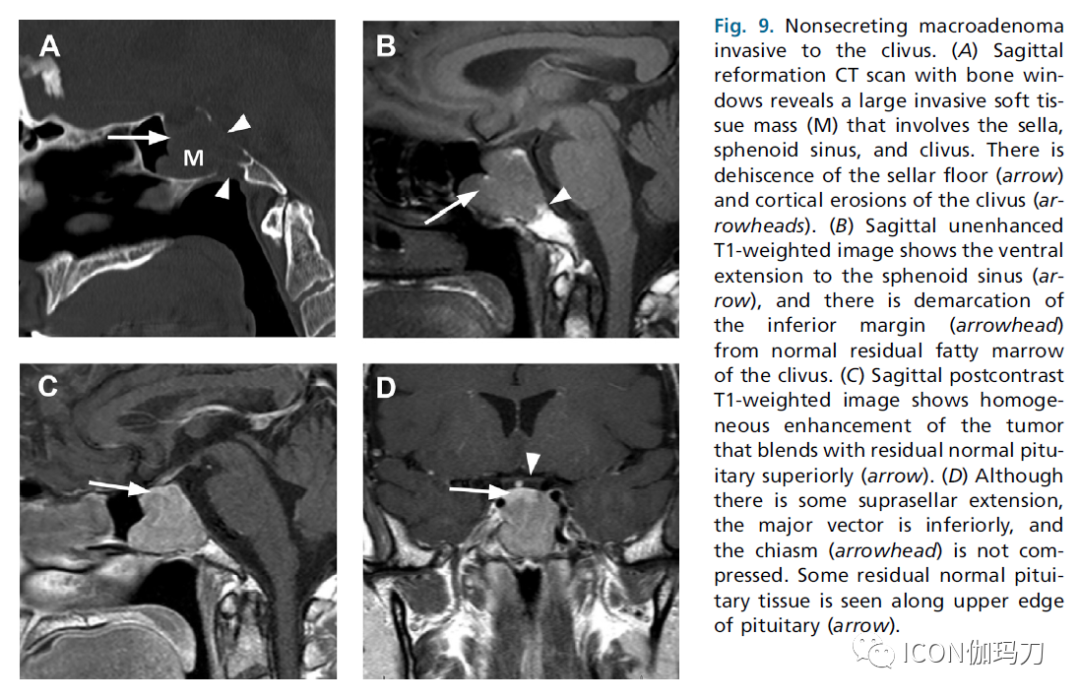
图9.无分泌性大腺瘤侵袭斜坡。(A)骨窗CT矢状面重建显示一个大肿块侵袭性软组织肿块(M),累及蝶鞍、蝶窦、和斜坡。有鞍底开裂(箭头)和斜坡皮质侵蚀(箭头)。(B)矢状面平扫T1加权图像示向蝶窦腹侧延伸(箭头),下缘与正常斜坡残留脂肪骨髓分界(箭头)。(C)矢状面对比强化后T1加权图像显示肿瘤均匀强化,与残留的正常垂体向上混杂(箭头)。(D)虽然有一些会向鞍上的伸展,但主要的向量是向下的,并且视交叉(箭头)没有被压迫。垂体上缘可见正常垂体组织残留(箭头)。
垂体瘤卒中是一种临床综合征,在已有的垂体腺瘤发生急性出血或梗塞,或两者兼有时发生。大多数患者发生在50或60岁的男性,并且通常发生在以前未确诊的无功能垂体腺瘤或催乳素瘤。患者的典型表现为突然发作的严重头痛、多变的视力障碍(包括视力丧失、视野缺损和眼肌麻痹)和急性垂体功能低下。放射影像学检查作为临床表现的辅助检查以排除其他病因并确认垂体出血性病变的存在。在急性情况下,通常首先进行CT平扫检查,可显示鞍区和鞍上区域的多样的高密度肿块。磁共振成像灵敏度大于90%,是首选的研究选择,可以识别腺瘤、内源性出血和坏死,评估对邻近结构的影响。
磁共振成像通常显示鞍状肿块,在T1和t2加权图像上显示可变和复杂信号。影像学表现取决于几个因素,包括肿瘤的大小、出血或坏死的程度和检查的时机。与大脑其他部位的出血一样,磁共振成像的表现也因出血的横进(sequence)和(血红蛋白降解)阶段而不同。典型的情况,鞍区和鞍上肿块表现为明显的T1高信号,T2低信号和中央未强化的坏死组织(图10)。识别一些周围的结节性强化组织,以确认存在潜在的腺瘤。
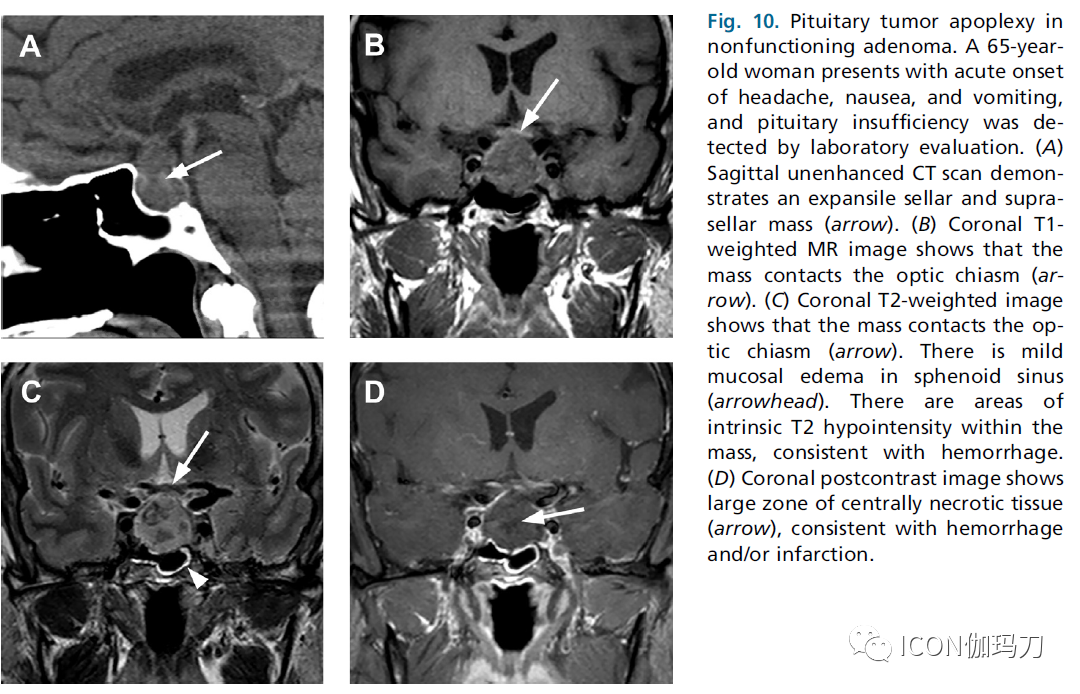
图10.无功能腺瘤的垂体瘤卒中。一例65岁妇女头痛急性发作、恶心和呕吐,实验室评估发现垂体功能不全。(A) 平扫CT矢状面显示一膨大的鞍区和鞍上肿块(箭头)。(B)冠状面T1加权MR图像显示肿块接触视交叉(箭头)。(C)冠状面T2加权图像显示肿块接触视交叉(箭头)。蝶窦粘膜轻度水肿(箭头三角)。肿块内有T2内在的低信号区域,符合出血。(D)冠状位对比增强后图像显示大片中央坏死组织(箭头),复合出血和/或梗死。
垂体腺瘤是良性肿瘤,但具有进袭性或侵袭性特征。如果肿瘤的生长速度比正常情况下要快,或者即使经过满意的治疗,肿瘤仍然进展,则认为肿瘤是进袭性的。垂体癌罕见,占垂体瘤的0.1%。与许多其他情况不同的是,在这种情况下,当腺瘤表现出进袭性的生物学行为和转移性疾病的证据时,使用垂体癌这个术语。这种鉴别不是基于组织学标准。更确切地说,垂体起源的肿瘤在有证据表明非连续软脑膜播散转移到颅内隔腔或脊柱,或有证据表明通过血行或淋巴扩散的远处转移(图11)。在原发病灶的初始检查中发现这样的病灶,或在原病灶治疗后观察到进展或复发。
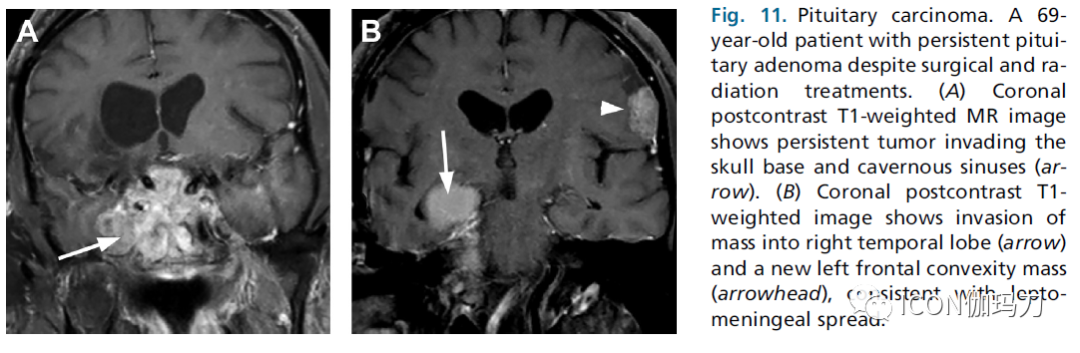
图11.垂体癌。一位69岁的患者,尽管手术和放射治疗,仍有持续性垂体腺瘤。(A)冠状位对比增强后T1加权MR图像显示持续肿瘤侵袭颅底和海绵窦(箭头)。(B)冠状位动脉对比增强后T1加权图像显示肿块侵袭右侧颞叶(箭头)和新的左侧额叶凸面肿块(箭头),与软脑膜播散相一致。
在典型的神经放射影像学实践中,转移到垂体腺是一种罕见的发现。在某些手术系列中,垂体转移性病灶的发生率可能低至1%。在广泛转移性疾病背景下进行的尸检表明有较高的发病率,从3%到27%不等。垂体丰富的血管可能促进微转移瘤的血行运输、种植和生长。乳腺癌和肺癌是与垂体转移相关的最常见的原发性恶性肿瘤,分别占37%和25%。虽然大多数垂体转移瘤无症状,但可出现临床症状,最常见的是全垂体功能减退或尿崩症。偶尔,垂体腺的转移可能是转移性疾病的最初表现。在一份报道中,半数以上以垂体转移瘤为主要表现的患者,伴有多种症状,包括尿崩症、视野缺损、颅神经异常或头痛。
垂体转移性疾病的MR影像和CT特征大多是非特异性的。通常,转移性疾病可能出现类似于大腺瘤,造成诊断困境。提示垂体转移瘤的线索包括在转移瘤监测中出现新的垂体肿块,存在其他转移病灶,或癌症患者有可疑的偶发腺瘤快速生长并出现症状。CT可显示等信号或高信号的鞍区肿块,并伴有不均匀强化。床突段或鞍底骨质可能被侵蚀。此外,肿瘤可延伸至鞍上间隙或向外侧延伸至海绵窦。MR成像的表现与腺瘤难以区分(图12)。病变可表现出与内源性坏死或出血相关的不均匀信号,多样性的强化,病变边缘可能与大腺瘤相比稍有不规则。
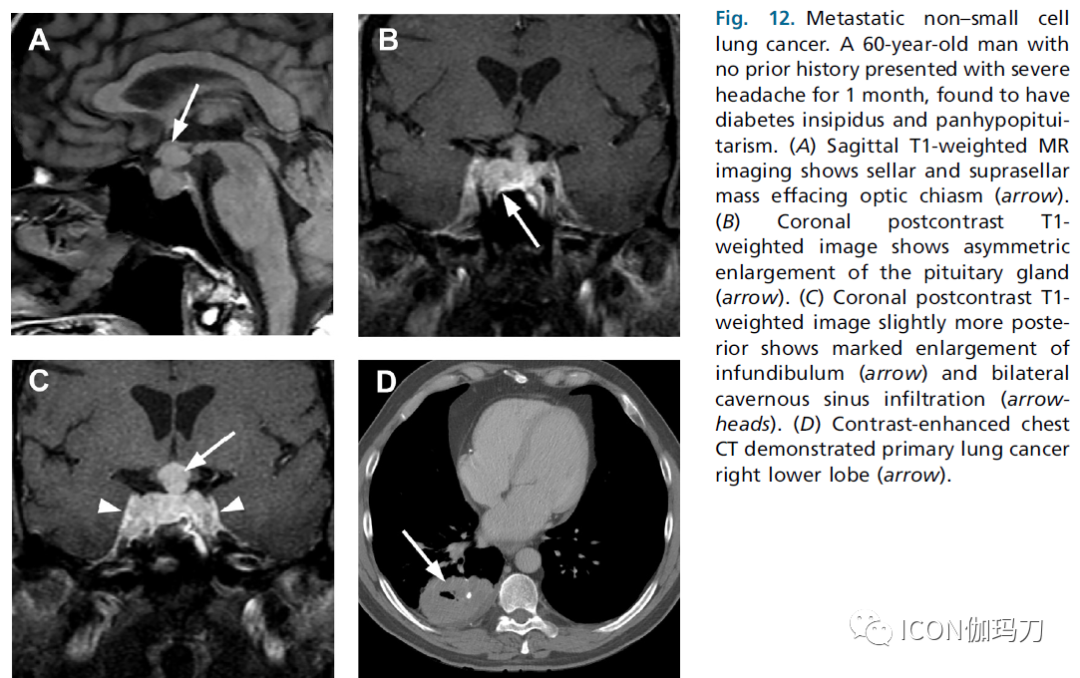
图12.非小细胞肺癌转移瘤。一例60岁男性,既往无病史,表现为严重头痛1个月,发现有尿崩症和全垂体功能减退。(A)矢状位T1加权MR成像显示鞍区和鞍上肿块累及视交叉(箭头)。(B)冠状位对比增强后T1加权图像显示垂体不对称增大(箭头)。(C)对比增强后的冠状位T1加权像显示漏斗部明显增大(箭头)和双侧海绵状窦浸润(箭头三角)。(D)胸部CT增强显示右下叶原发性肺癌(箭头)。




