
美国宾夕法尼亚大学佩雷尔曼医学院神经病理学科的Mac Lean P Nasrallah等报道1例术前影像提示存在两种单独的肿瘤基因型病例中,确实存在真正的少突星形细胞瘤。相关结果发表在2020年7月的《Acta Neuropathologica Communications》在线。
——摘自文章章节
研究背景
研究结果
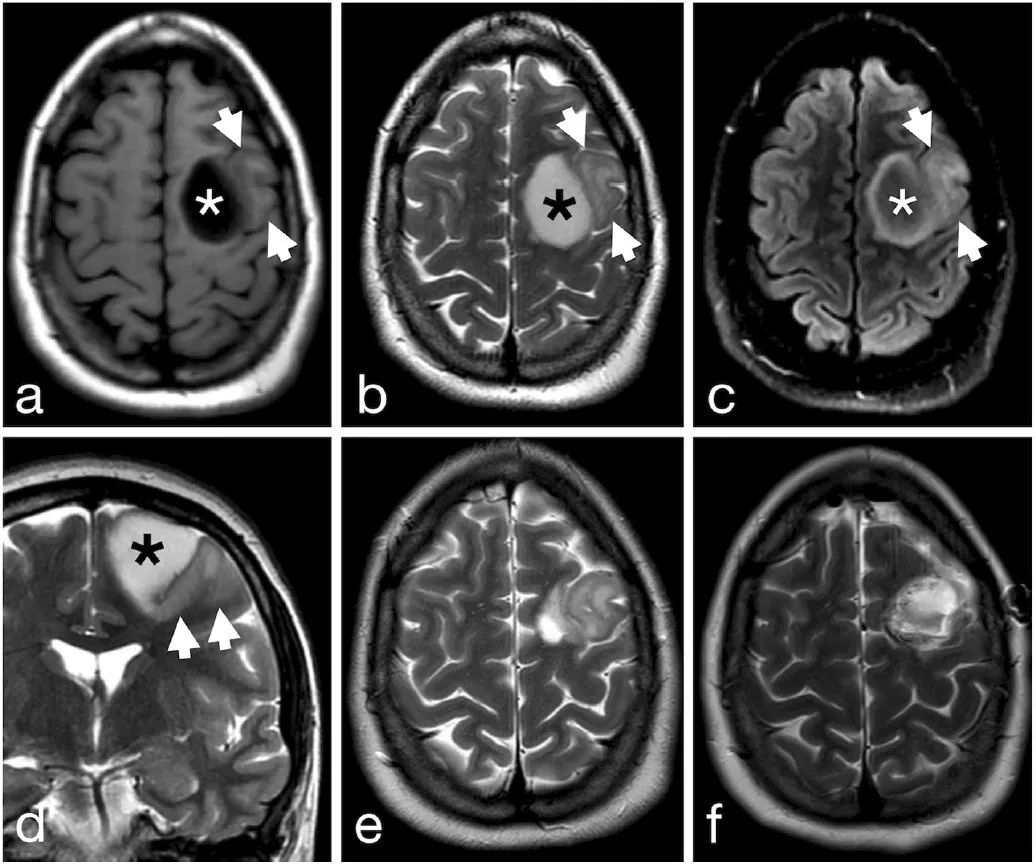
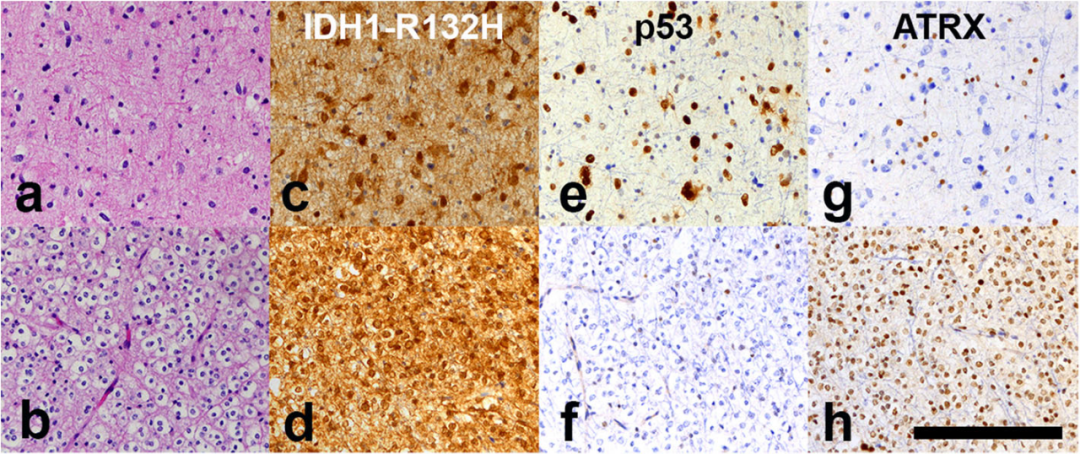
结论
总之,该病例显示,一个常见的IDH1突变型前体发育成两个不同的亚克隆。于是,预后、驱动因素和最佳治疗方法均不确定。然而,该患者临床过程进展缓慢,表明其中的星形细胞成分决定患者的预后。





