
开篇动图为右椎动脉造影(感谢河北医科大学第一医院李聪慧主任提供素材),显示V4段夹层动脉瘤,上一秒还是涓涓细流,下一秒顿成浊浪滔天。确切讲这属于术前造影时破裂,不是严格意义上的术中破裂(Intraprocedural rupture, IPR),但也更加证明了动脉瘤破裂的特点:猝不及防,险象环生。瘤顶破裂相对容易止血,瘤颈破裂处理起来非常棘手。本回书先讲瘤顶破裂的案例。
6月2日行DSA,右颈内动脉造影三维重建示右大脑中动脉分叉部动脉瘤,大小4.8 mm×6.9 mm: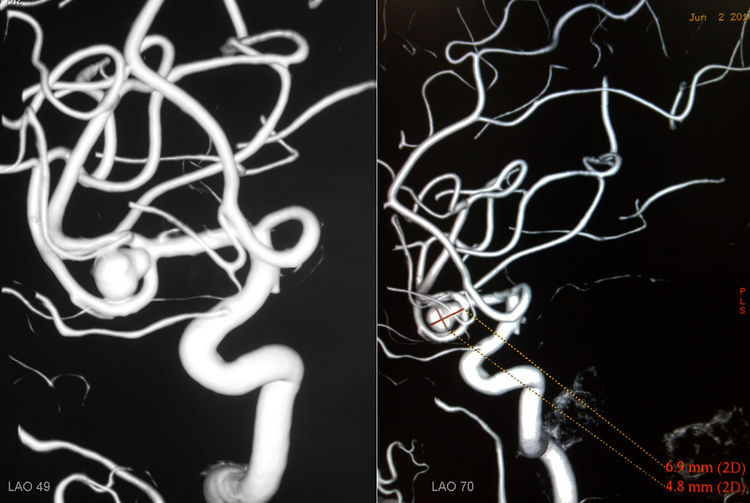
6月4日行介入治疗,拟采用球囊再塑形技术栓塞。6F导引导管进入右颈内动脉,工作位(左斜70°)造影: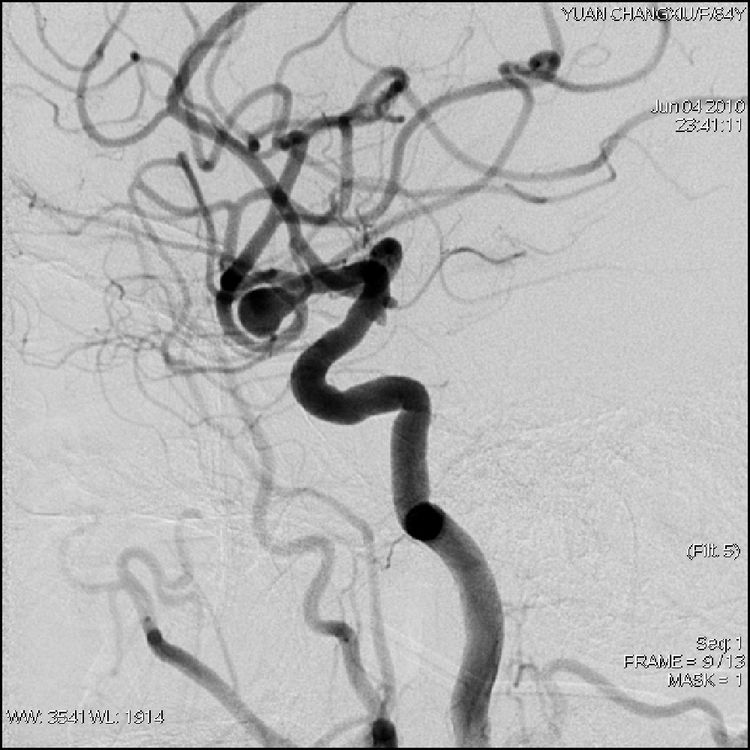
工作位路图指示下,HyperForm球囊(4 mm-7 mm)系统在X-pedion-10微导丝引导下进入右中动脉分叉后下干,球囊跨瘤颈放置;Echelon-10微导管(直头)在SilverSpeed-14微导丝引导下超选入瘤腔;充盈球囊覆盖瘤颈,经Echelon-10送入第1枚弹簧圈(X-5-15-T10-MC);排空球囊见首枚弹簧圈成篮稳定,但造影显示造影剂外溢,破裂点似乎位于瘤顶上部(红箭):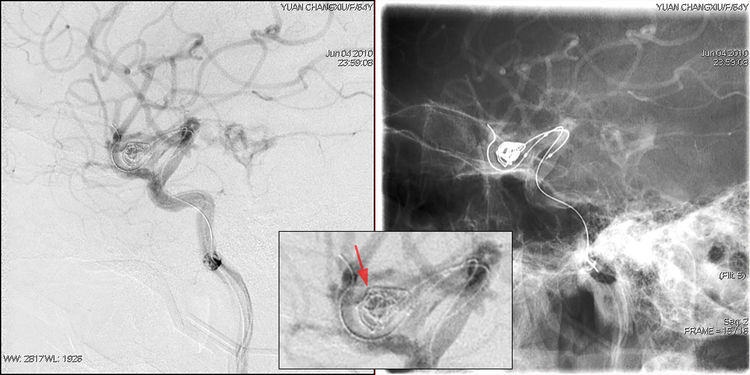
迅速充盈球囊封堵瘤颈,送入第2枚弹簧圈(N-4-10-T10-SO),排空球囊见弹簧圈稳定,造影示无造影剂外溢,但球囊导丝所在的中动脉分叉后下干痉挛,血流变慢: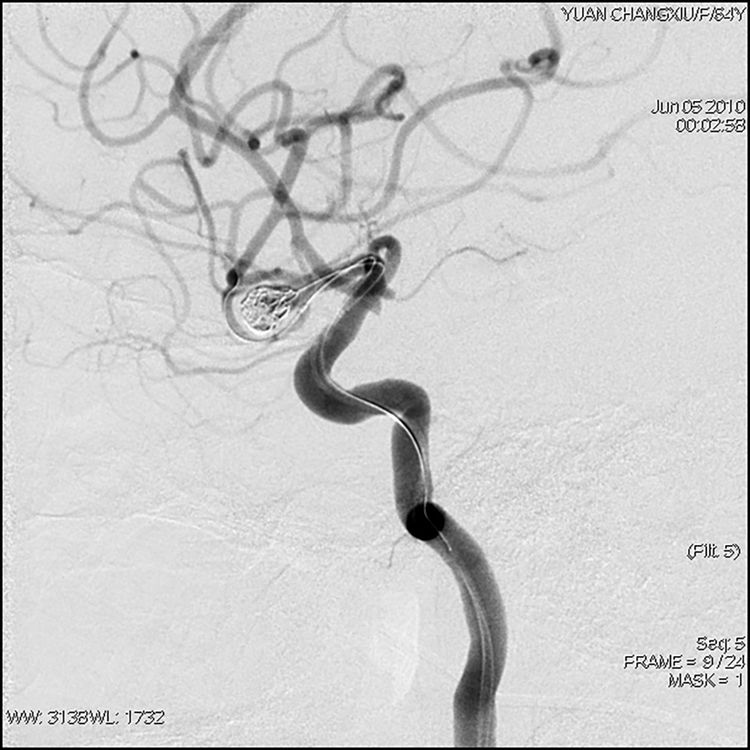
继续在球囊再塑形保护下依次送入4枚弹簧圈(X-3-4-T10-TC, QC-2-4-3D, QC-2-6-3D, QC-2-2-3D),此时造影示瘤颈残留: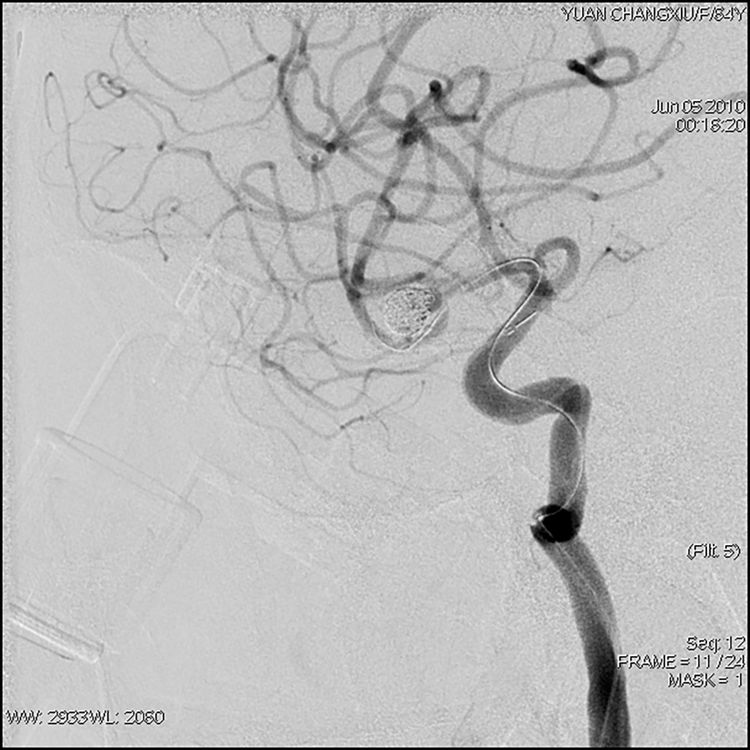
第7枚也是最后1枚弹簧圈(N-2-6-T10-SO)在球囊辅助下勉强送入瘤颈,撤离微导管和球囊系统,造影显示动脉瘤完全栓塞,分叉后下干痉挛缓解;蒙片见收尾弹簧圈有一环凸至中动脉分叉部(红箭),但不随血流漂动,未影响分叉后两干血流: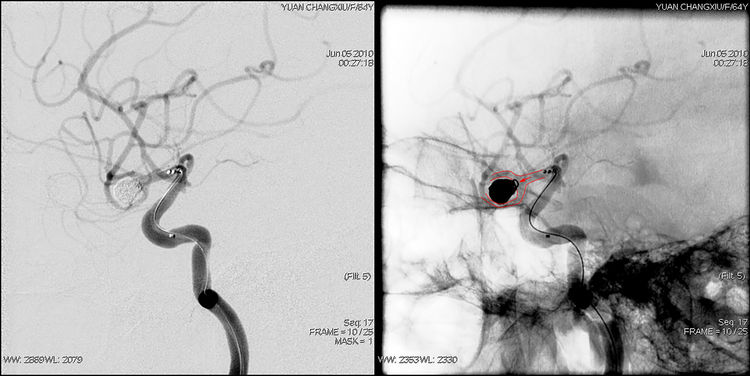
术后右颈内动脉工作位、正侧位缩小造影显示动脉瘤完全栓塞,中动脉及其分支畅通: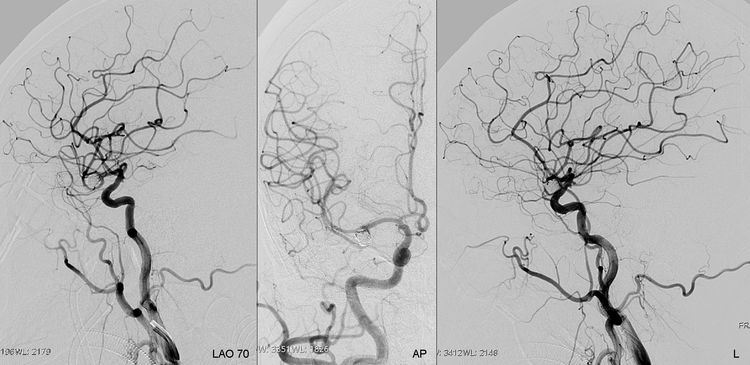
材料清单如图: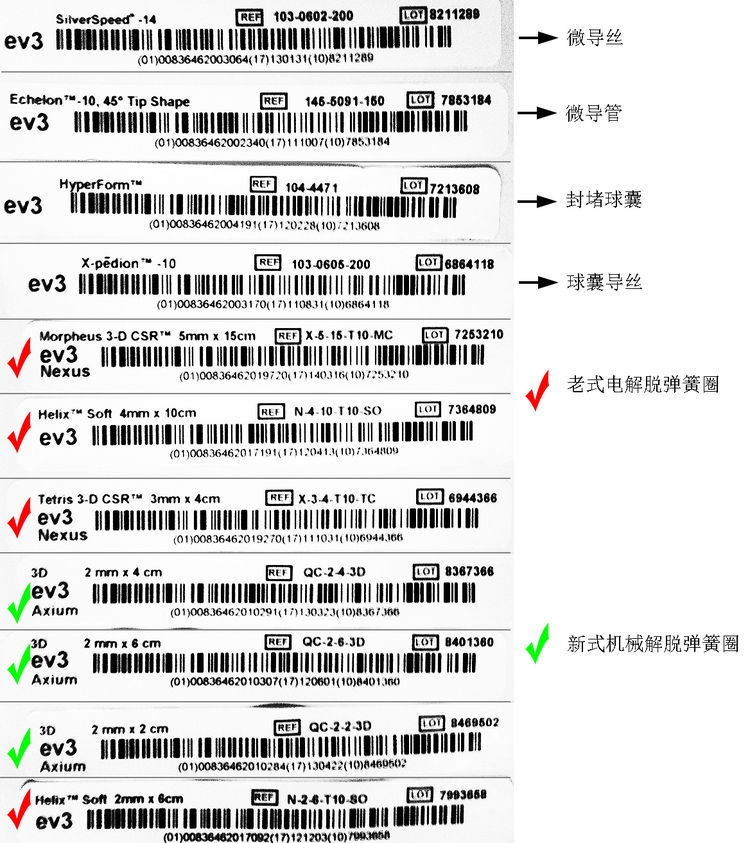
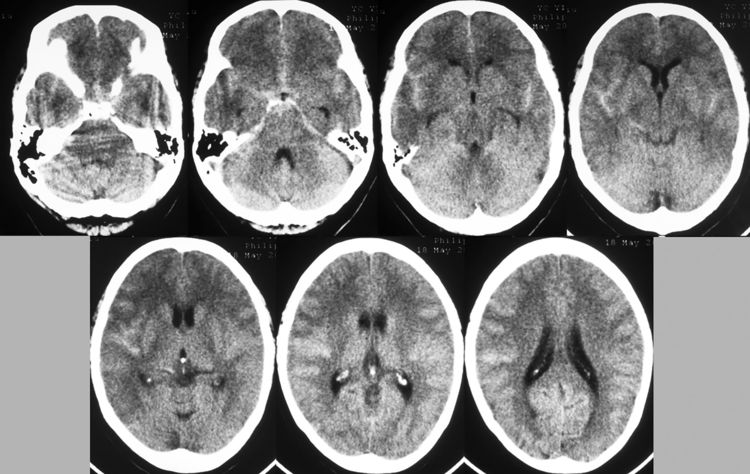
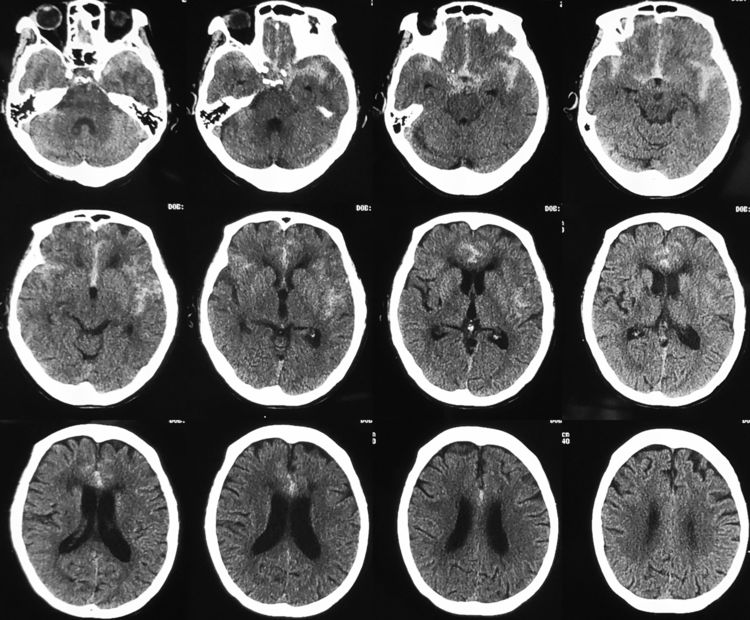
术后麻醉复苏顺利,患者神清语利,四肢活动好,述无头痛。术后20小时复查脑CT示再出血量不多: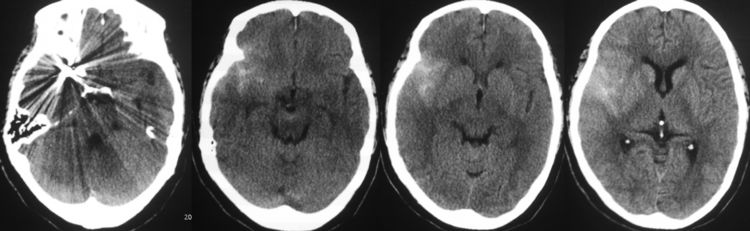
讨论
这是个十年前的案例了,彼时ev3公司的一代带导线电解脱弹簧圈还未退市,二代机械解脱弹簧圈刚进入国内,型号严重不全。印象里电解脱弹簧圈的解脱时间长达半分钟之久,设若该例手术没有球囊的严密掩护,患者怕是凶多吉少哉。该例IPR发生于首枚弹簧圈完成成篮后,弹簧圈并无突出瘤壁的表现,瘤体轮廓亦无扩大,考虑脆弱的瘤壁很可能在原发破裂点被弹簧圈“碰”破,而非“撑”或“挤”破,且破口位于瘤顶,故第2枚弹簧圈就轻易达成止血。再加球囊的及时封堵,术中出血量很少,甚至术后患者都没有头痛反应。
12月18日行DSA,右颈内动脉造影示右大脑前动脉A1段起始部动脉瘤(红箭),母瘤顶部有子瘤,呈葫芦状;A2段双干: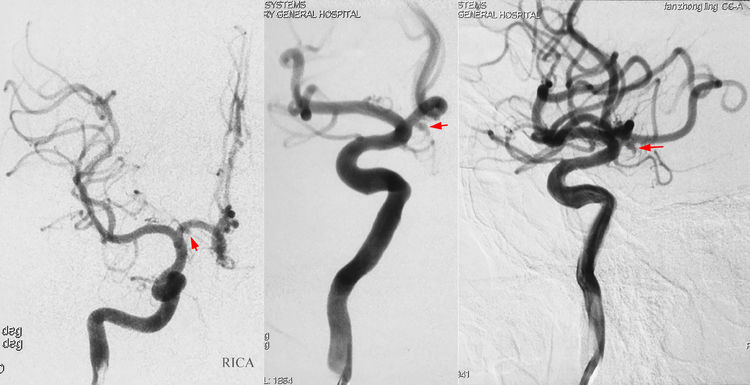
左颈内动脉造影示左A1段发育稍细,有一环形迂曲(红箭):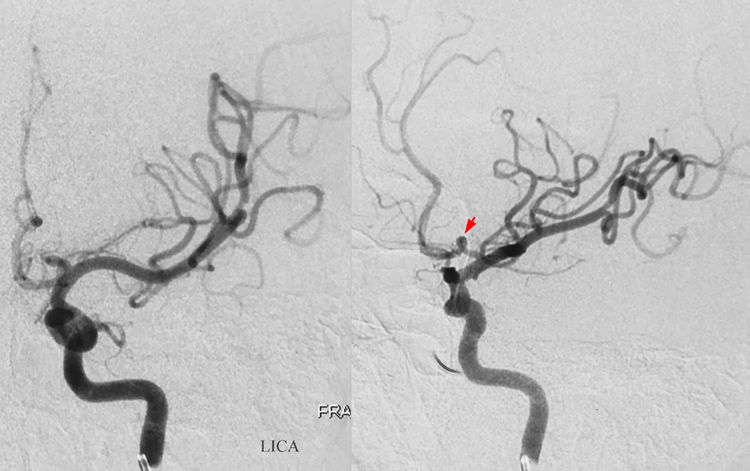
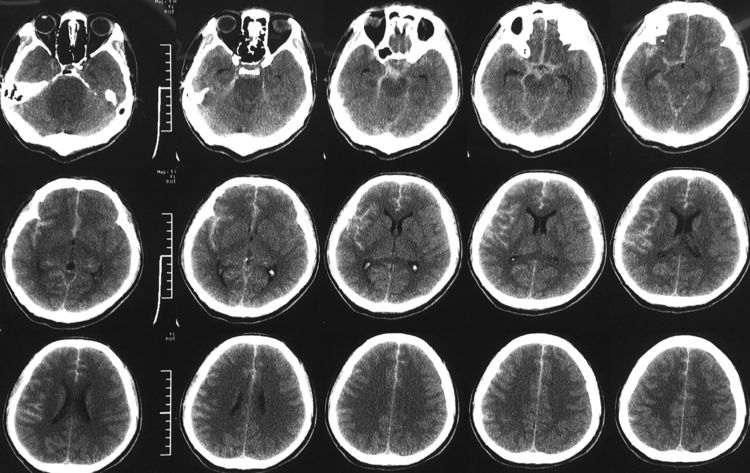
12月21日复查脑CT示出血明显吸收,双侧小脑半球新发梗死灶,考虑跟脑血管痉挛有关: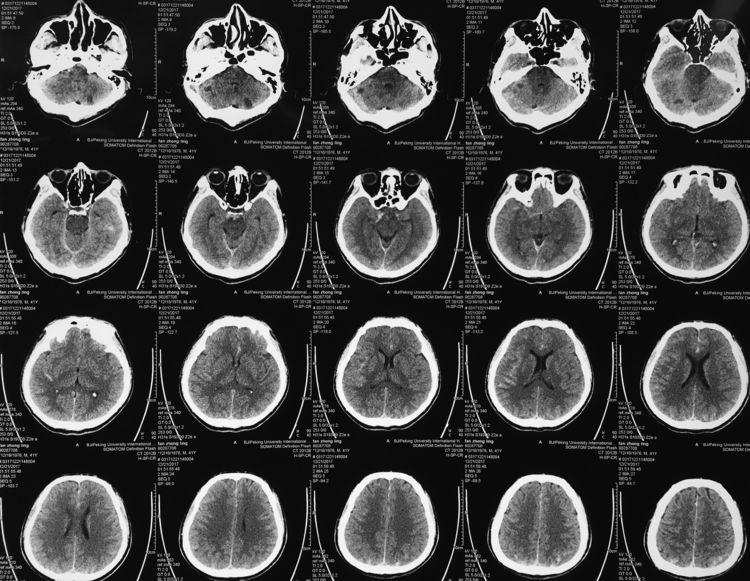
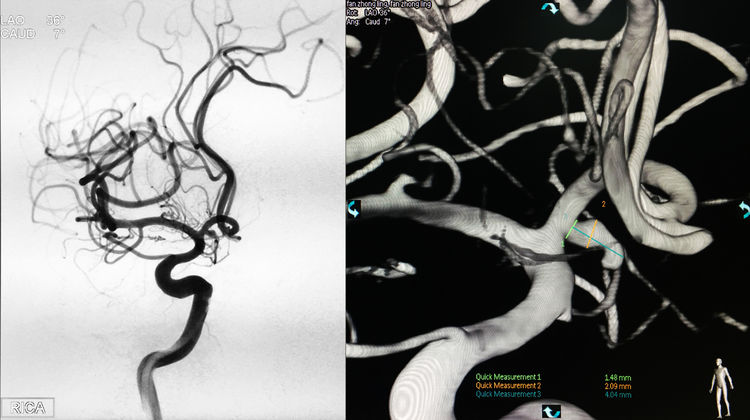
当日行介入治疗,拟采用支架辅助弹簧圈技术栓塞。术前右颈内动脉造影三维重建显示动脉瘤起自右A1段起始部,生长方向朝向后、下、内;工作位(左斜36°+瓦7°)测量瘤体2.09 mm×4.04 mm(含子瘤),颈宽1.48 mm: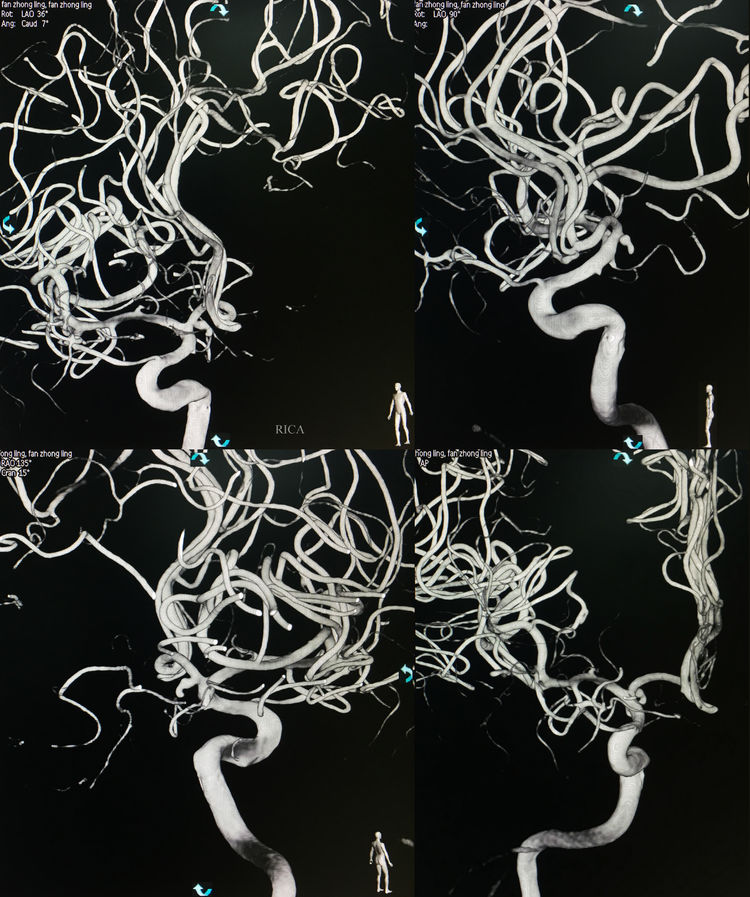
右侧股动脉穿刺置入8F鞘,8F导引导管+072 Navien中间导管同轴送入右颈内动脉;工作位路图下,Traxcess-14微导丝携Rebar-18支架导管经Navien送入,超选入右A1段末端,备放支架;同一根微导丝再携Echelon-10微导管拟超选入瘤腔,但反复塑形和尝试,管头仍无法进入瘤腔:
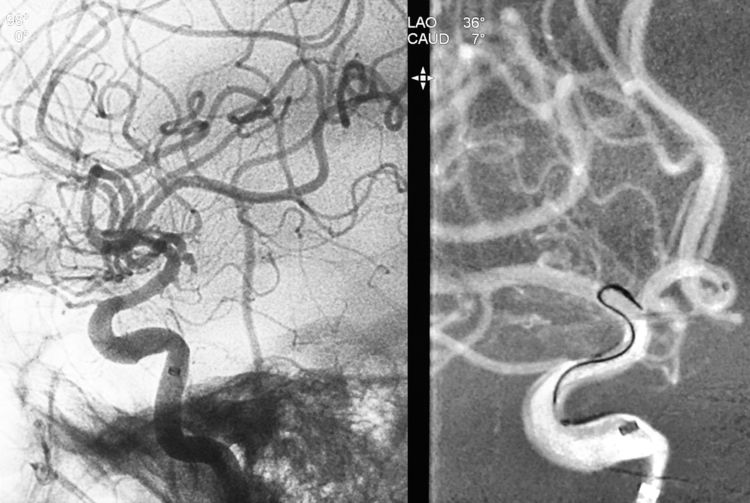
遂决定经对侧颈内动脉-前交通动脉入路超选动脉瘤。左侧股动脉穿刺置入6F鞘,6F ENVOY导引导管送入左颈内动脉;工作位路图下,Synchro-14微导丝携Echelon-10微导管(头端塑成猪尾形)经6F导引导管送入,超选入左A1段,将此处的环形迂曲撑直: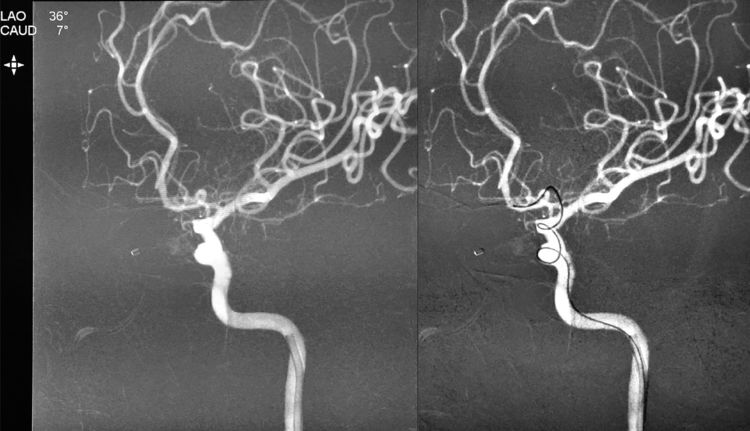
换用Traxcess-14微导丝成功超选入前交通动脉进而抵达右A1段: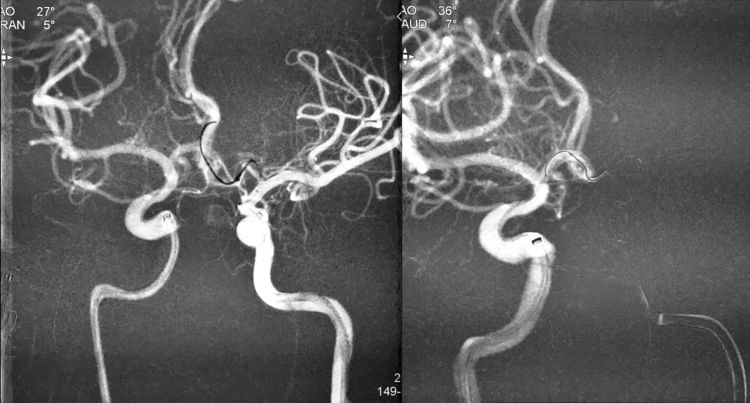
Echelon-10微导管头端的塑弯在超选过程中回弹变直,无法跟随Traxcess-14微导丝超选入动脉瘤;遂将Transend.014 FLOPPY 300 cm交换型微导丝置入Echelon-10微导管,将Echelon-10微导管交换出体外: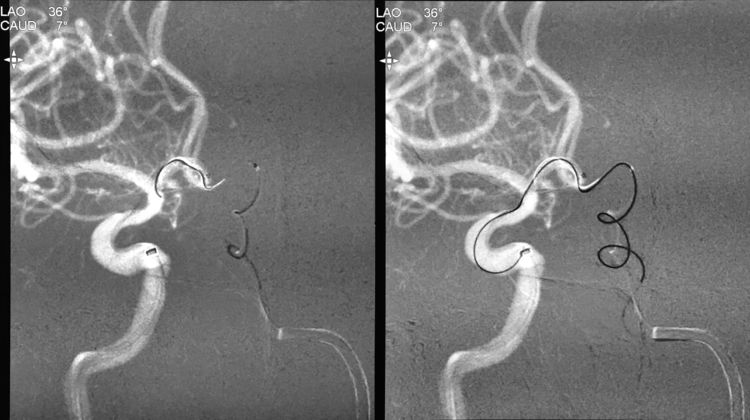
将Echelon-10头端重新塑成猪尾形后,再经Transend微导丝交换入左颈内动脉-左A1段-前交通动脉-右A1段,回撤Transend微导丝后管头自动进入瘤腔;经预置的Rebar-18支架导管送入Solitaire支架(4-15),跨瘤颈释放于右A1段-右颈内动脉床突上段: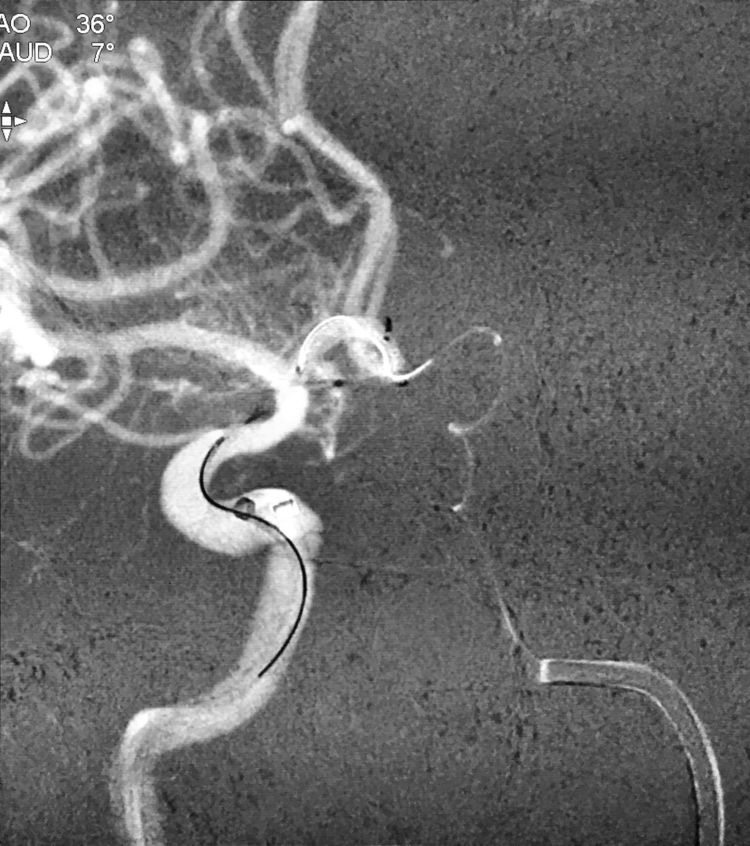
经Echelon-10微导管向瘤腔内依次送入2枚弹簧圈(MicroPlex 10-2.5-4-Cosmos Complex,QC-2-4-3D),此时工作位造影发现动脉瘤破裂,缓慢渗血,破裂点似在母瘤和子瘤交界处: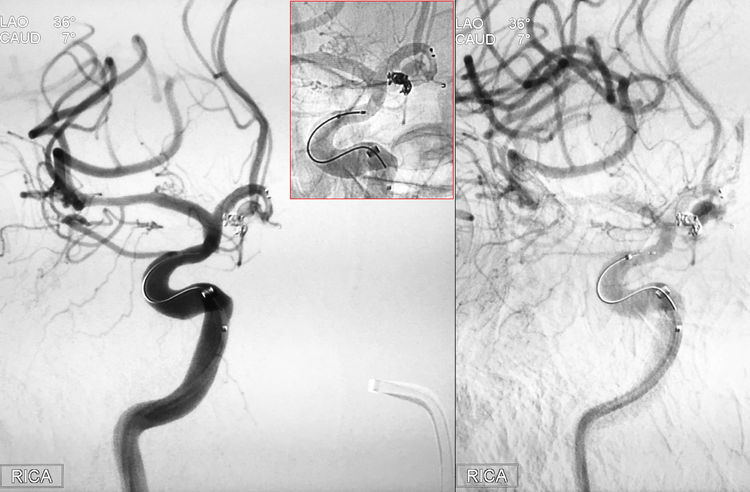
迅速再填入第3枚弹簧圈(QC-1.5-2-HELIX),大部分弹簧圈逸至载瘤动脉内被支架压住,微导管头被顶出瘤腔,此时造影显示成功止血: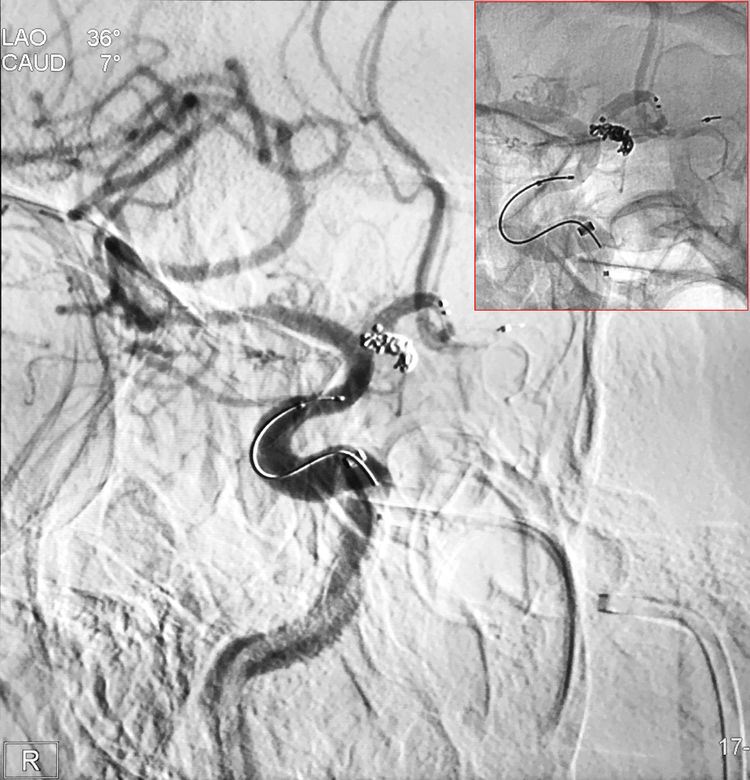
结束填塞,撤出Echelon-10微导管;解脱Solitaire支架,撤出Rebar-18支架导管;术后右颈内动脉工作位造影示动脉瘤完全栓塞,右A1段及双干A2段均血流畅通: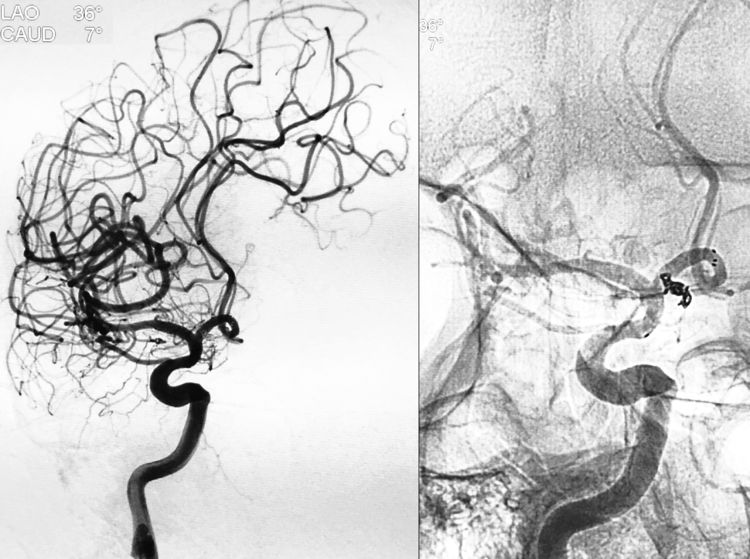
右颈内动脉正、侧位造影示动脉瘤完全栓塞,载瘤动脉畅通;蒙片可见有一环弹簧圈突至子瘤轮廓外(红箭):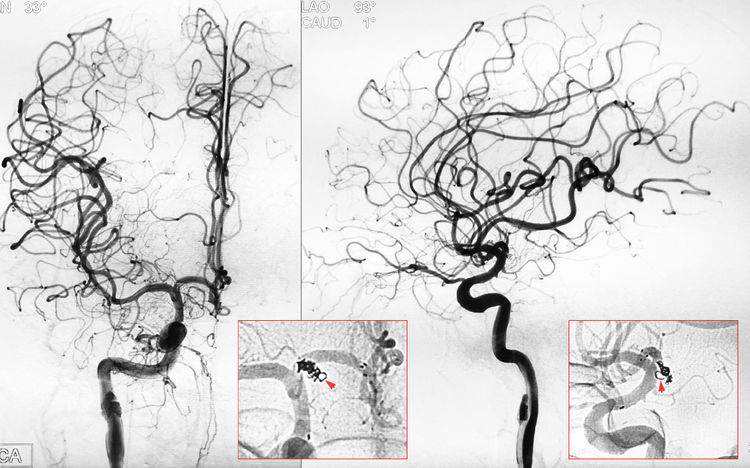
右颈内动脉三维旋转造影示收尾弹簧圈逸至载瘤动脉内的部分被支架牢牢压在A1段起始处后壁;有一环弹簧圈向前偏内突至子瘤轮廓外:
左颈内动脉正、侧位造影见左侧不发达的A1段保持畅通: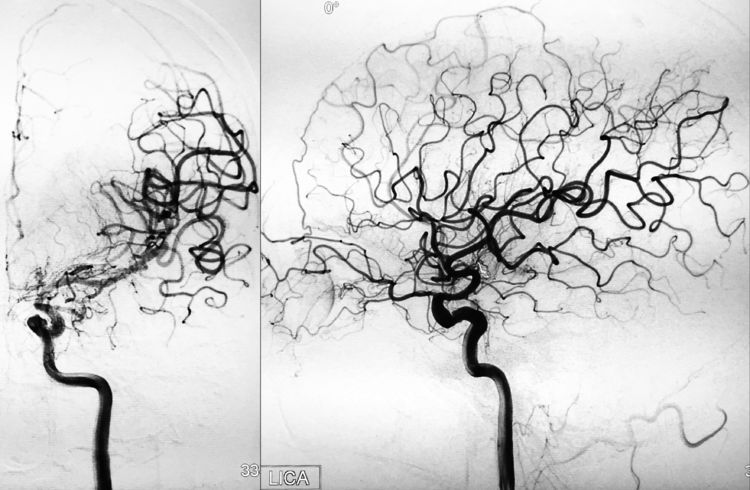
术后即刻XperCT示术中出血量不大: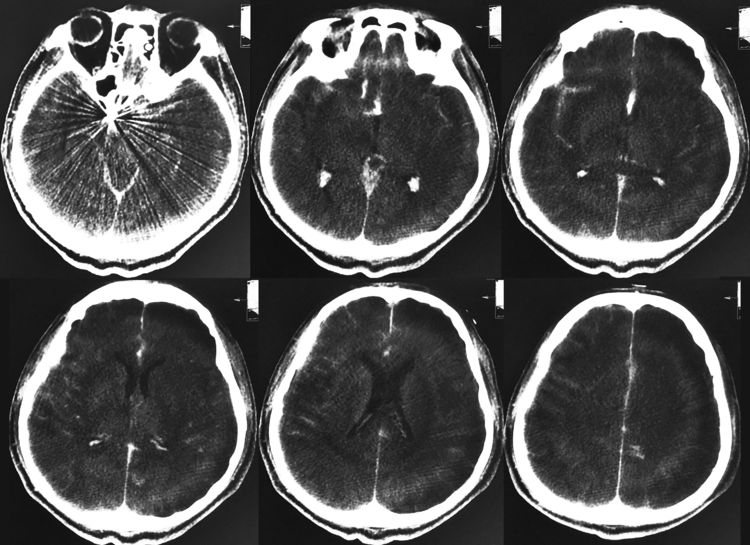
术后患者麻醉复苏顺利,神清语利,四肢活动好;术后18小时复查脑CT,跟术前CT相比出血量无增加: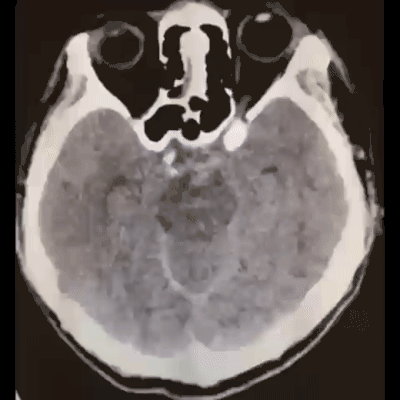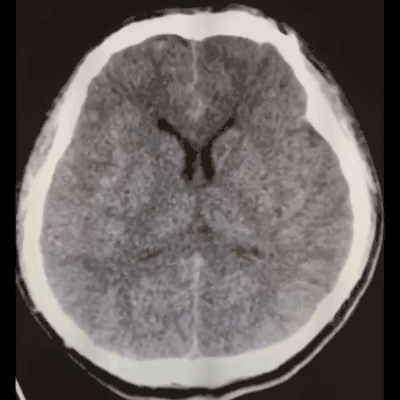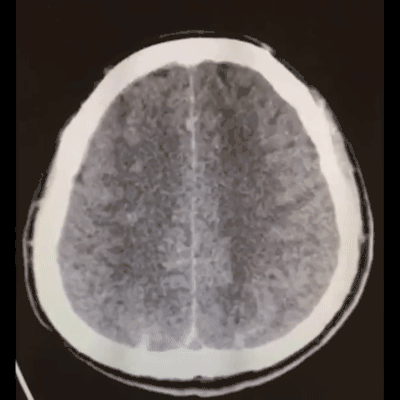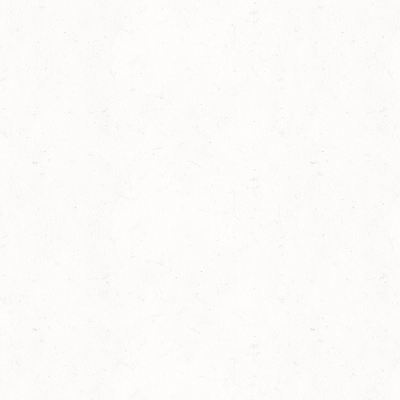
讨论
对于A1段起始部朝向后下方生长的小型或微小动脉瘤,譬如该例,微导管的成功到位极富挑战性。我科霍晓川博士早年曾在一篇论文里探讨过针对不同指向的A1段动脉瘤如何塑形微导管头的问题: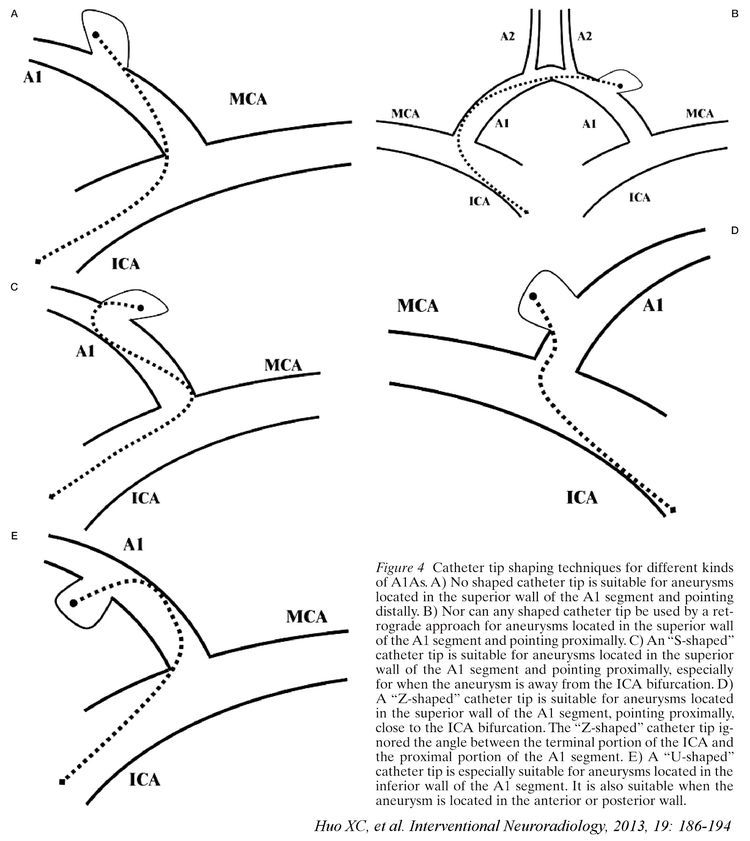
图E的情况部分符合该例动脉瘤的特点,只是该瘤的位置更邻近A1段起始处或颈内动脉分叉处。当患侧颈内动脉入路微导管到位困难的时候,我们果断改用对侧颈内动脉-前交通动脉入路,微导管经长途跋涉终于到位:
个人感觉如果微导管头塑形精准,经同侧颈内动脉入路栓塞该动脉瘤不应该无解,假设你是术者,会如何塑形微导管头呢?
动脉瘤微小,新鲜破裂,合并子瘤,生长方向刁钻,超选困难,均是发生IPR的高危因素。好在IPR发生在填塞过程中,而不是超选过程中,有弹簧圈防线的保护,仅仅表现少量渗血。术后工作位蒙片可见弹簧圈铸型似乎全部位于瘤腔和血管轮廓内,但正、侧位及三维旋转蒙片显示有一环弹簧圈向前偏内突至子瘤轮廓外,应为头两枚弹簧圈其中的一枚“挤”破子瘤,但到底是哪枚惹的祸已无从溯源。
2月15日行DSA+介入治疗。术前左颈内动脉造影示前交通动脉微小动脉瘤,左大脑前动脉A2段双干;左颈内动脉床突上段宽颈动脉瘤,窝头状: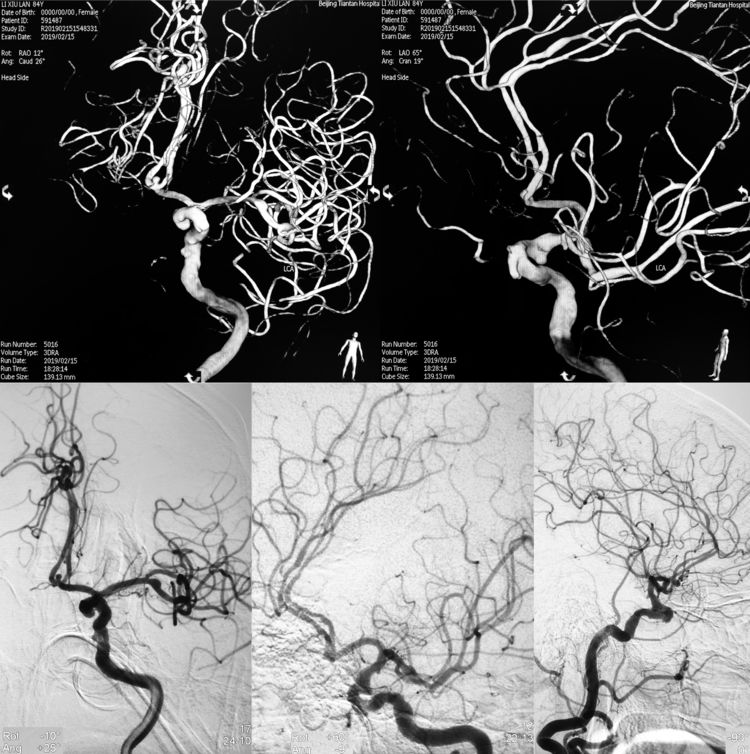
左颈内动脉造影三维重建下测量,前交通动脉瘤大小1.86 mm×1.93 mm,颈宽1.67 mm;床突上段动脉瘤大小2.62 mm×2.40 mm,颈宽4.60 mm: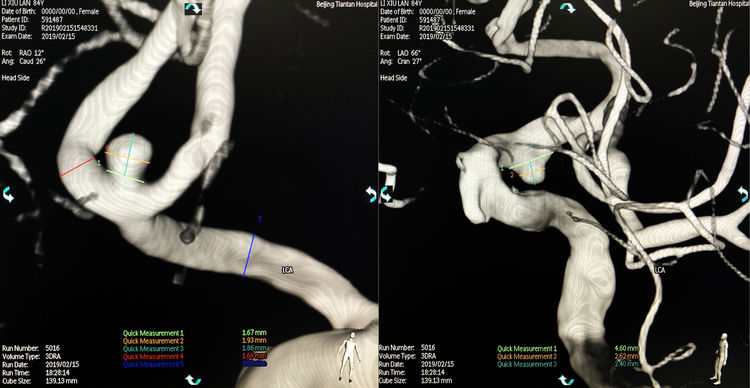
右颈总动脉造影示右大脑前动脉A1段几近缺如: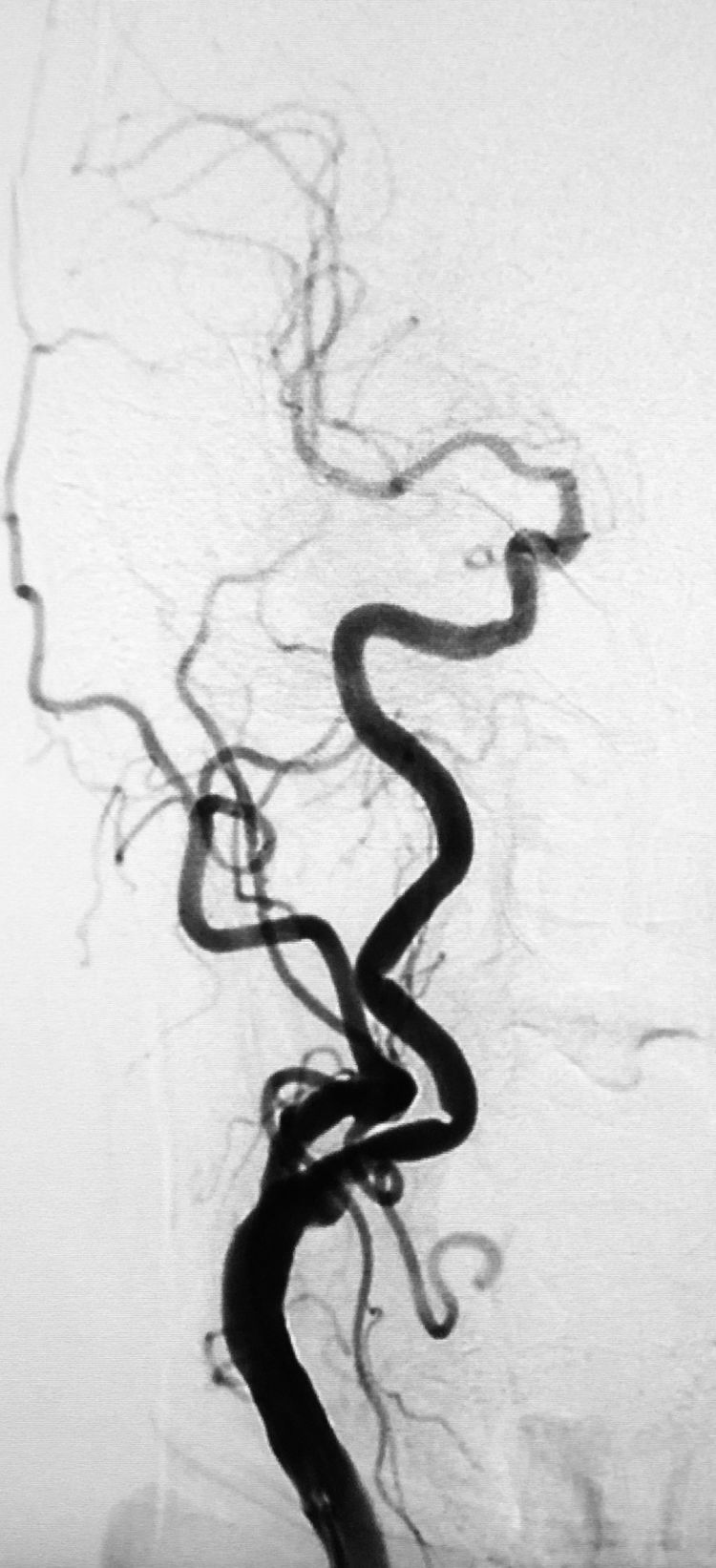
考虑前交通动脉瘤为SAH责任动脉瘤,拟采取支架辅助弹簧圈技术栓塞,因右A1段缺如,左A2段双干,故前交通动脉的保留至关重要,计划将支架跨前交通动脉置放于右A2-左A1;考虑左颈内动脉床突上段动脉瘤未破裂,给予保守观察: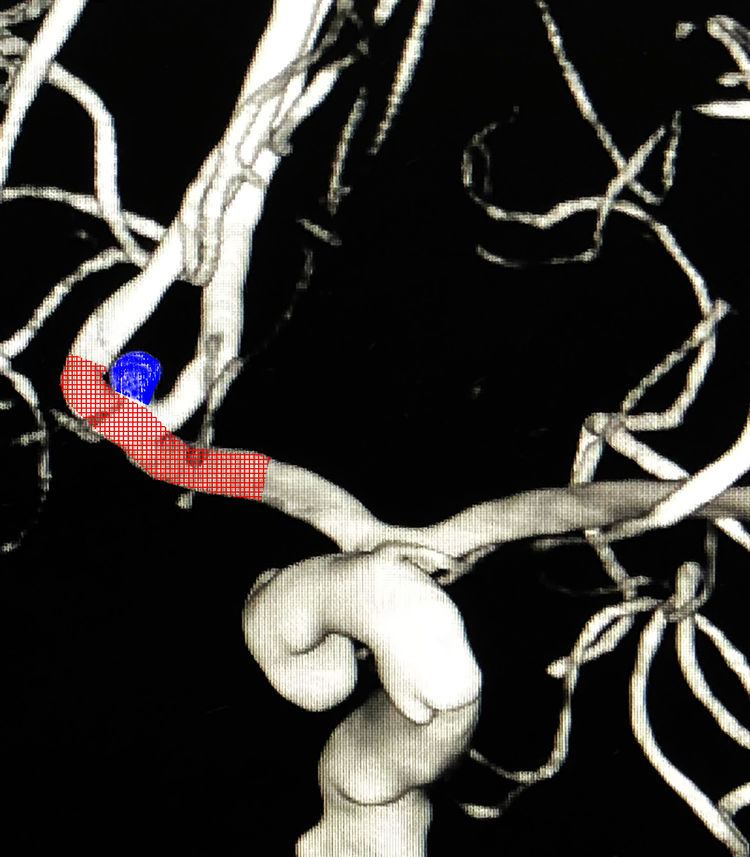
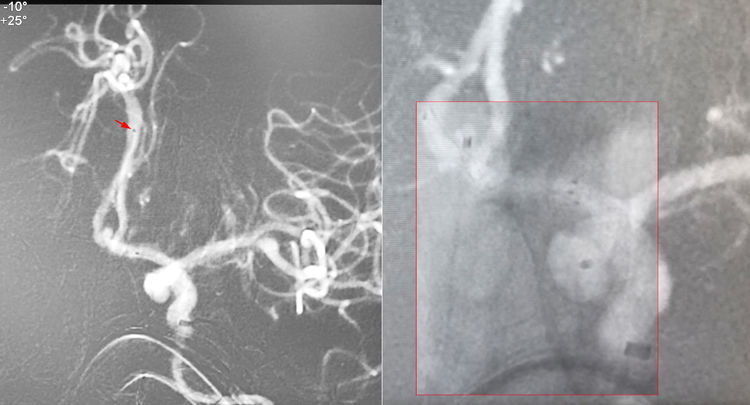
6F长鞘(COOK,90 cm长)+072 Navien中间导管同轴进入左颈内动脉;工作位(右斜10°+反汤25°)路图下,Synchro-14微导丝携第一根Echelon-10微导管送入Navien,经左A1段越过前交通动脉进入右A2段-胼周动脉(红箭指示管头位置),备放LVIS Jr支架;第二根Echelon-10微导管(头端塑成S形)在Synchro-14微导丝引导下超选入瘤腔;经第一根Echelon-10微导管送入LVIS Jr支架(2.5-17),跨瘤颈释放于右A2-左A1内(红框内为透视图像,显示支架本体和第二根微导管头端的双标记,经PS技术半透明化叠加于血管路图上):
经第二根Echelon-10微导管向瘤腔内送入首枚弹簧圈(QC-1.5-2-HELIX),发现弹簧圈突至瘤顶路图外面,考虑动脉瘤破裂,未予“冒烟”或造影确认,迅速再填入两枚弹簧圈(TARGET HELICAL NANO-1-1,QC-1.5-2-HELIX),此时手推造影见造影剂外溢,证明出血仍未止住: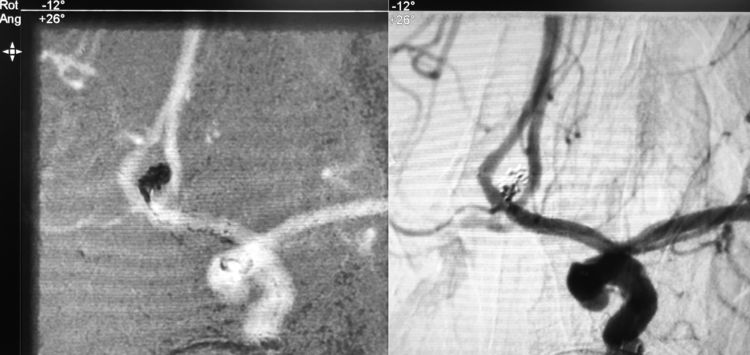
手推造影视频可见出血不“猛”,心电监护仪发出的心跳声节奏平稳。危急一刻,患者依然如故的心跳声不似天籁胜似天籁,使术者心绪稍安:
二助下台徒手压迫左颈总动脉;术者和一助接茬儿快速再填入两枚微弹簧圈(TARGET HELICAL NANO-1-1,TARGET HELICAL NANO-1-1),手推造影示止血成功: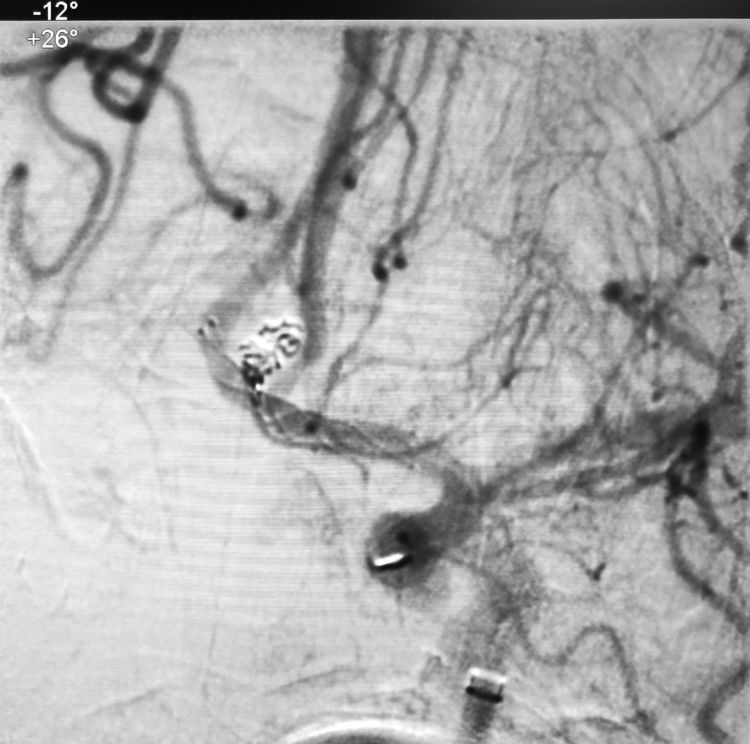
填入最后一枚弹簧圈(MicroPlex10-1-1-HyperSoft Helical)收尾,再次手推造影确认无造影剂外溢: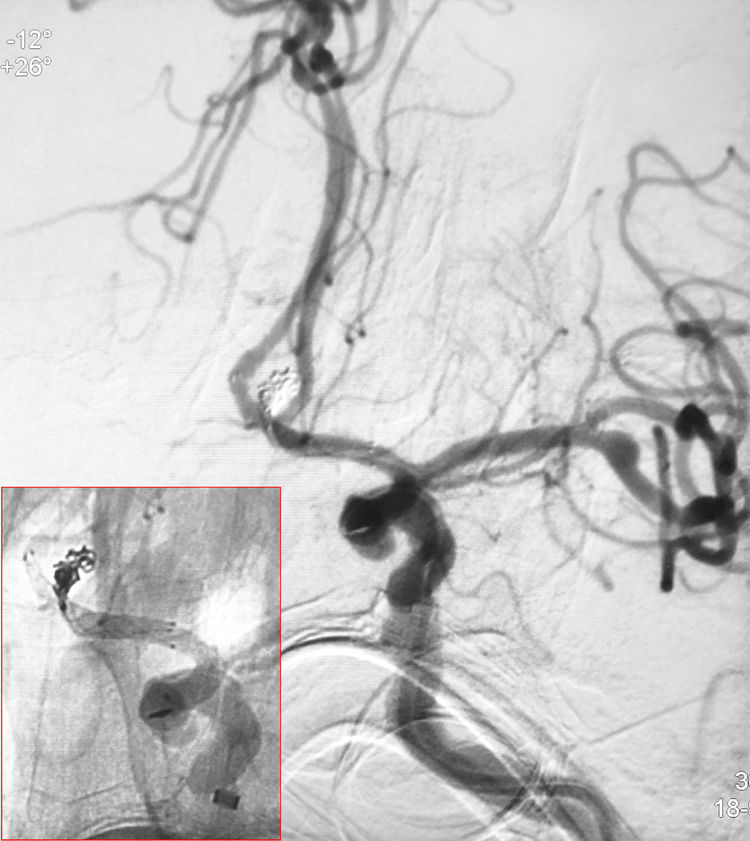
术后左颈内动脉工作位、正侧位造影显示动脉瘤完全栓塞,前交通动脉畅通;蒙片可见弹簧圈的形态,红圈内为瘤顶处破入蛛网膜下腔的弹簧圈: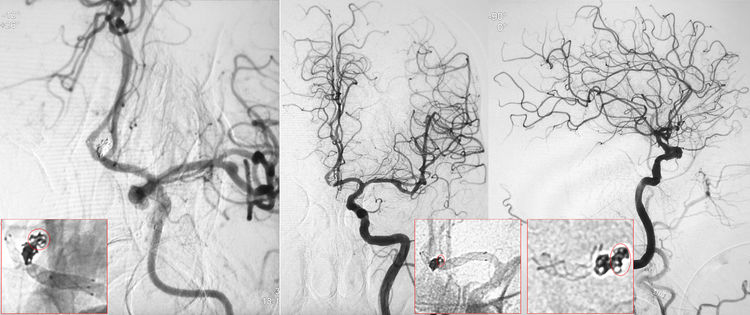
术后即刻行XperCT示出血量不大: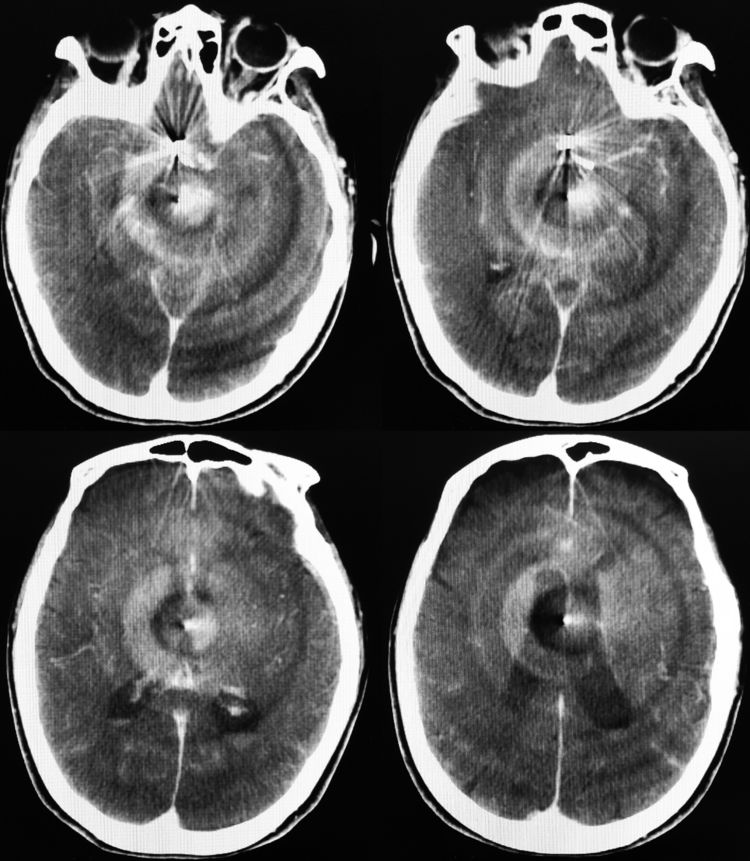
术后患者麻醉复苏顺利,神清语利,四肢活动自如。次日复查脑CT示蛛网膜下腔及侧脑室枕角少量积血: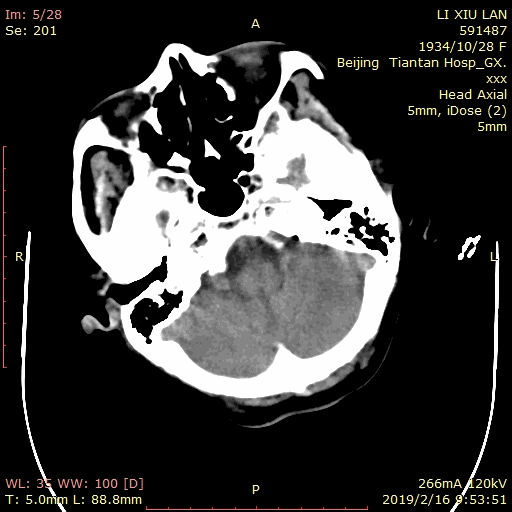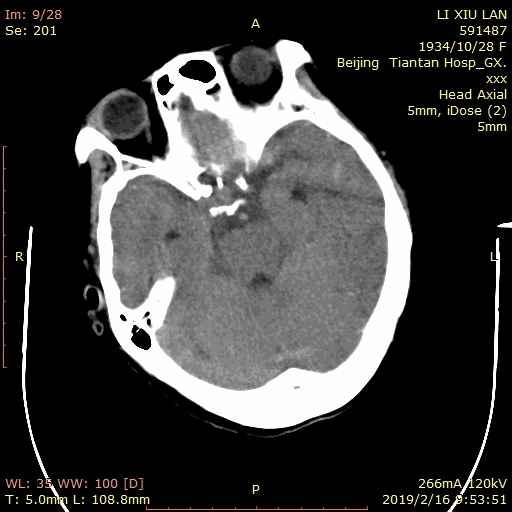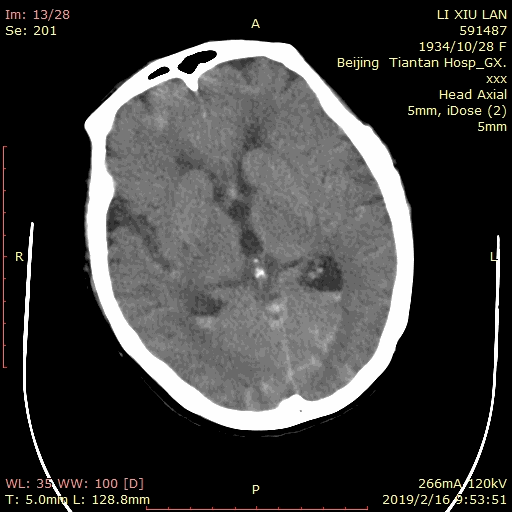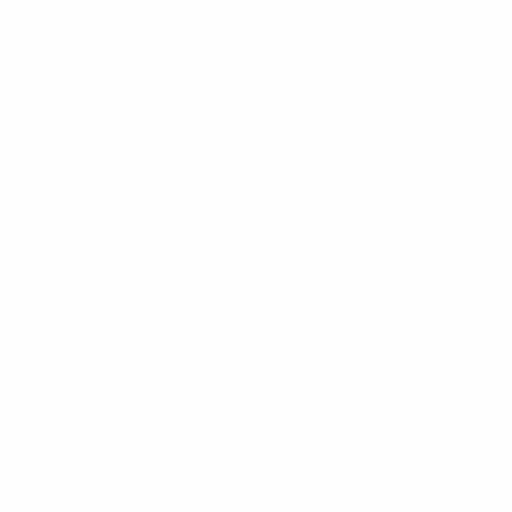
讨论
该瘤微小,瘤体1.86 mm×1.93 mm,瘤颈1.67 mm,属于相对宽颈。首枚弹簧圈选用直径为1.5 mm的螺旋弹簧圈,不求成篮,只求填充。支架释放方式(详见第二十六回)采用“羁留”技术(Jailing technique),即释放支架压住(羁留)预置于瘤腔内的微导管头,支架的压迫限制了微导管头的“保护性自动回退”,可能是导致首枚弹簧圈“挤”破瘤顶的原因。假设我们采用“千斤顶”技术(Stent-jack technique),即先填入一枚弹簧圈,再贴支架,是否能避免IPR呢?应该会有帮助,但带来的新问题是,失去支架的制动作用,微导管头有可能在输送首枚弹簧圈(哪怕是只输送一部分)的过程中过度回退,甚至需要重新超选定位;特别是在微小动脉瘤,弹簧圈的轻微“踢管”就可能把管头“踢”出瘤腔。
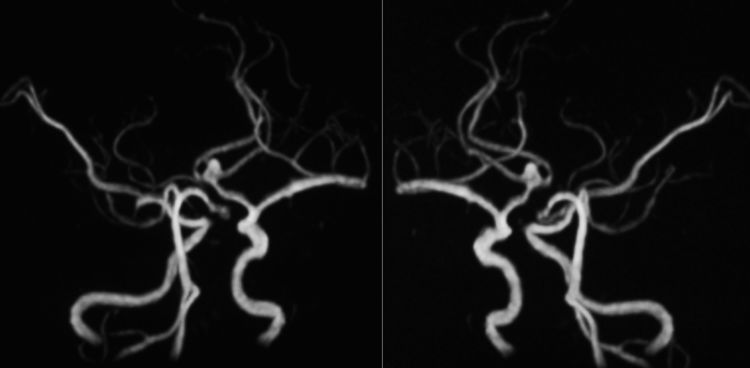
2019年7月25日行DSA+介入治疗。术前左颈内动脉造影示前交通动脉瘤,左A2段双干;右A1段(红箭)发育差: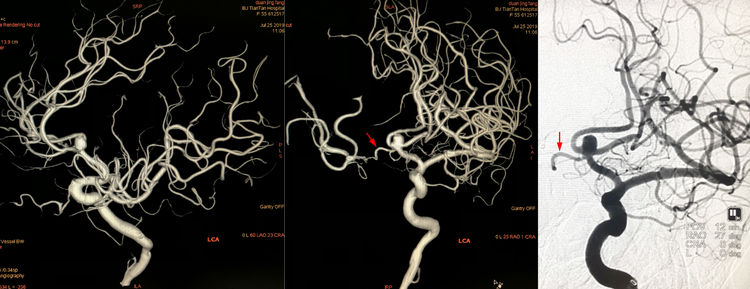
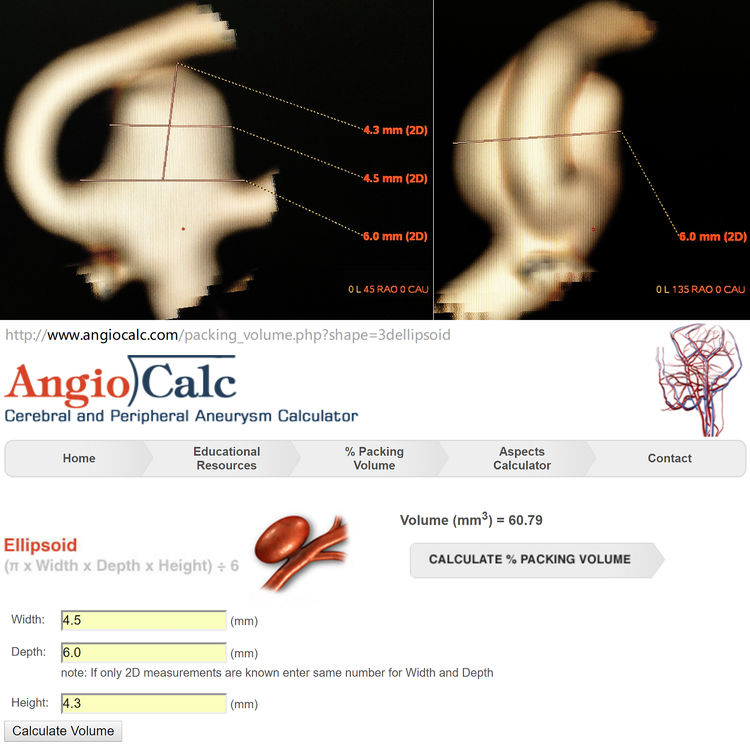
左颈内动脉造影三维重建下测量瘤体,4.3 mm×4.5 mm×6.0 mm,颈宽6.0 mm;粗算动脉瘤体积为60.79 mm3:
拟采用支架辅助弹簧圈技术栓塞,LVIS支架置放于一侧A1-A2内,与跨前交通动脉置放于对侧A2内相比,似能更多覆盖瘤颈: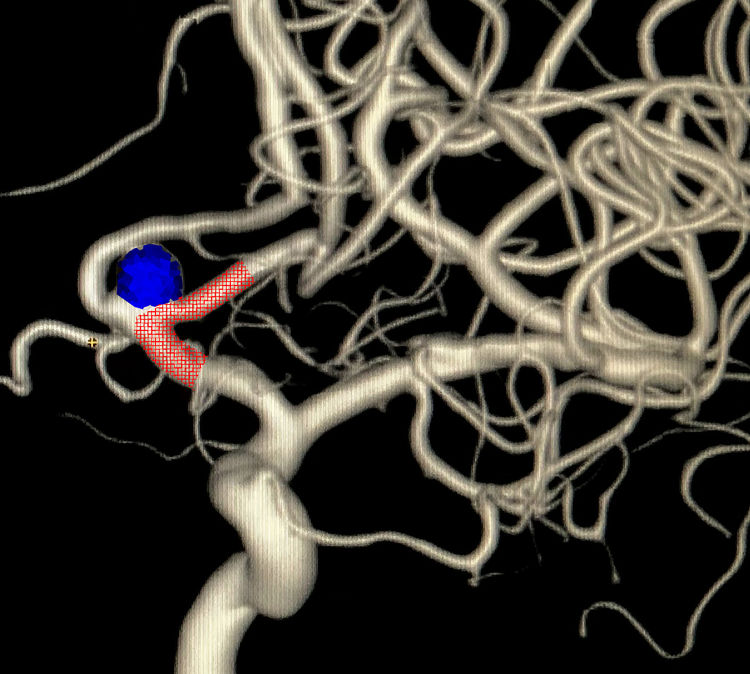
6F长鞘+072 Navien中间导管同轴进入左颈内动脉;工作位(右斜27°)路图下,Synchro-14微导丝携Headway-21支架导管经Navien超选入左A2段(左图);随后Synchro-14微导丝依次携两根Echelon-10微导管超选入瘤腔(右图):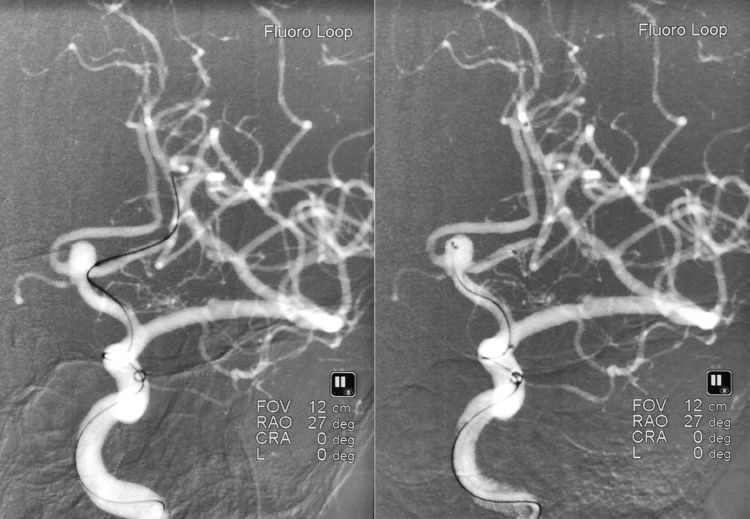
经Headway-21支架导管送入LVIS支架(3.5-15),跨瘤颈释放于左侧A2-A1内(左图红双线);撤出Headway-21后,Synchro-14微导丝携第三根Echelon-10微导管超选入左侧A1段,微导丝能够穿过支架网眼经前交通动脉抵达右侧A2段以远,微导管卡在支架网眼处无法跟进,遂留置该根微导丝保护右侧A2段;经管头位于瘤腔偏右的Echelon-10微导管依次送入两枚弹簧圈(MicroPlex 10-4-8-Cosmos Complex,APB-3-6-3D-ES),成篮好(右图):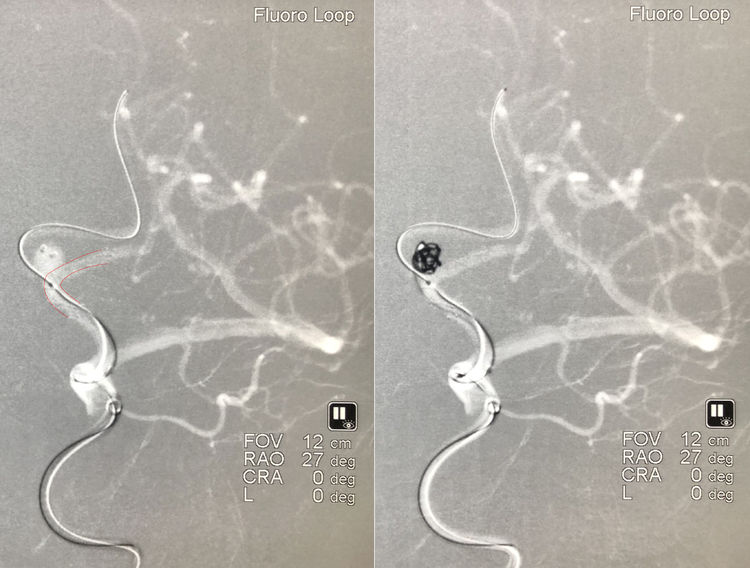
经管头位于瘤腔偏左的Echelon-10微导管继续送入两枚弹簧圈(APB-2-4-3D-ES,APB-2-4-3D-ES),突然发现瘤顶部有两个环“支棱”出来,呈猫耳状,手推造影见造影剂外溢,证实动脉瘤破裂: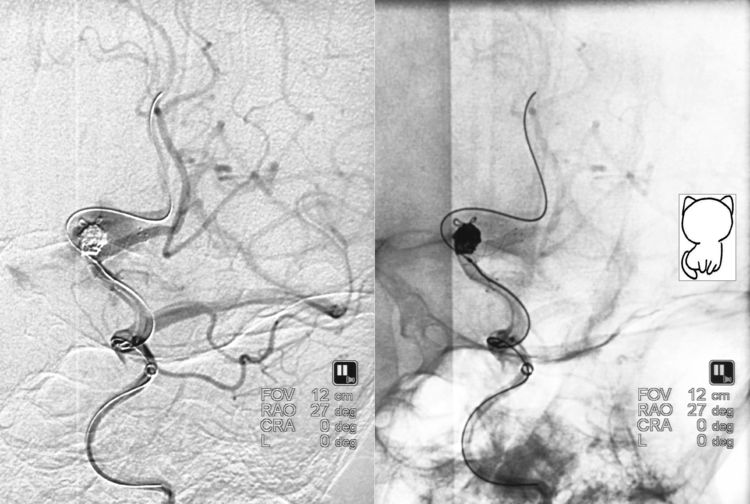
二助下台徒手压迫左颈总动脉;术者和一助在透视监视下快速填圈,经双微导管交替填入6枚微型弹簧圈(APB-1-4-3D-ES,APB-1-2-3D-ES,APB-1-3-3D-ES,APB-1-3-HX-ES,MicroPlex 10-1-3-HyperSoft Helical,MicroPlex 10-1-4-HyperSoft Helical),手推造影示止血成功,动脉瘤不显影,无过度栓塞: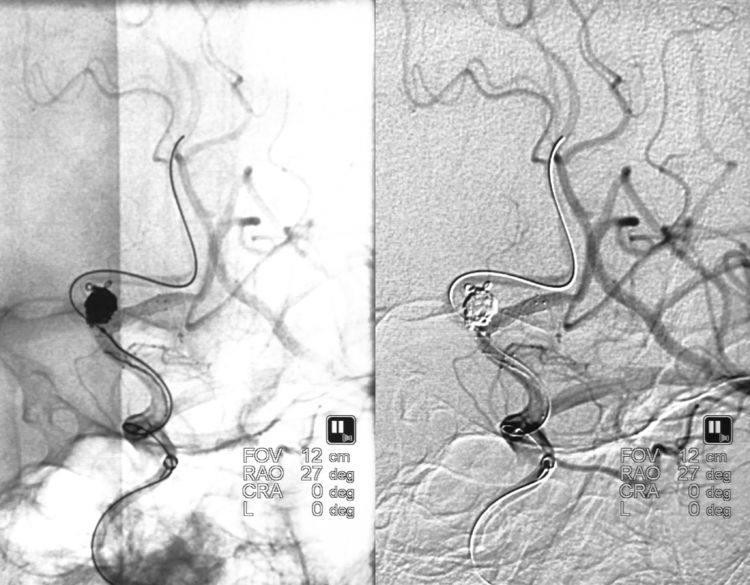
撤出保护微导丝和双微导管,术后左颈内动脉工作位和正侧位造影示动脉瘤完全栓塞,载瘤动脉畅通: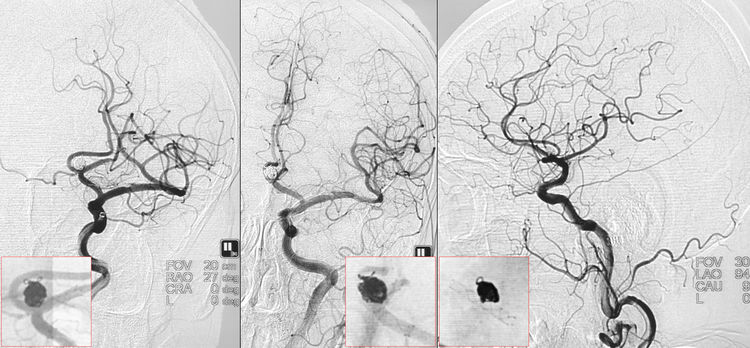
术后即刻CTHD提示出血不多:
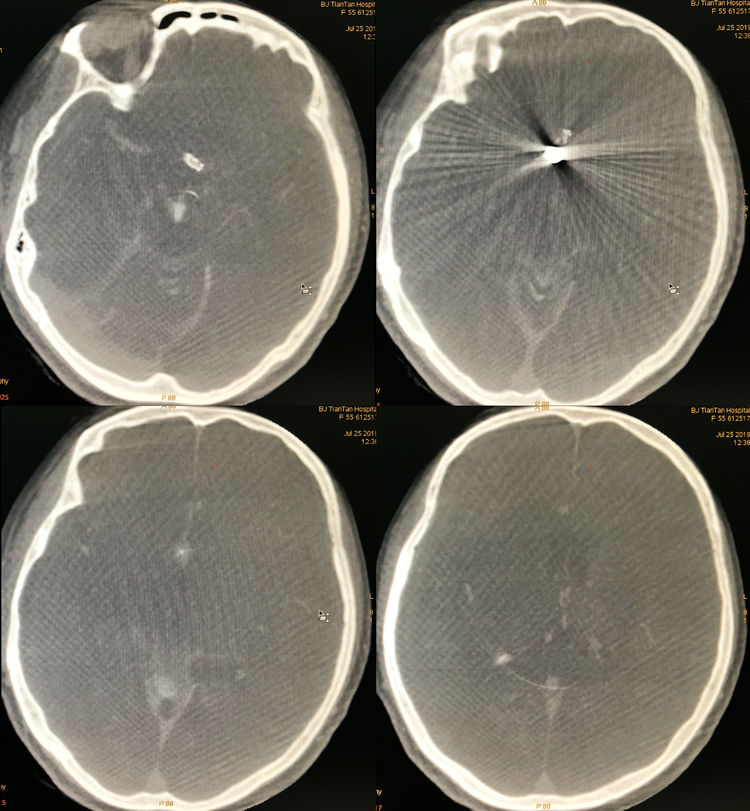
术后患者麻醉复苏顺利,神清语利,四肢活动好。次日复查脑CT仅见四叠体池稍高密度影:
讨论
该例动脉瘤IPR发生于填塞第4枚弹簧圈(APB-2-4-3D-ES)时,考虑微导管头位置过深以及支架对管头的制动作用导致弹簧圈“挤”破瘤顶。突入蛛网膜下腔的两个环呈猫耳状分离,手推造影见造影剂弥漫性外溢,提示瘤壁破口较大,好在随后快速填塞多枚1 mm直径的微型弹簧圈,配合助手压颈,及时止住血,术后脑CT证实出血不多。
该瘤粗算体积为60.79 mm3;共填入10枚弹簧圈,计算弹簧圈的总体积为5.84+3.55+15.37=24.76 mm3;则该动脉瘤的栓塞体积比=24.76÷60.79=40.7%,相当致密了!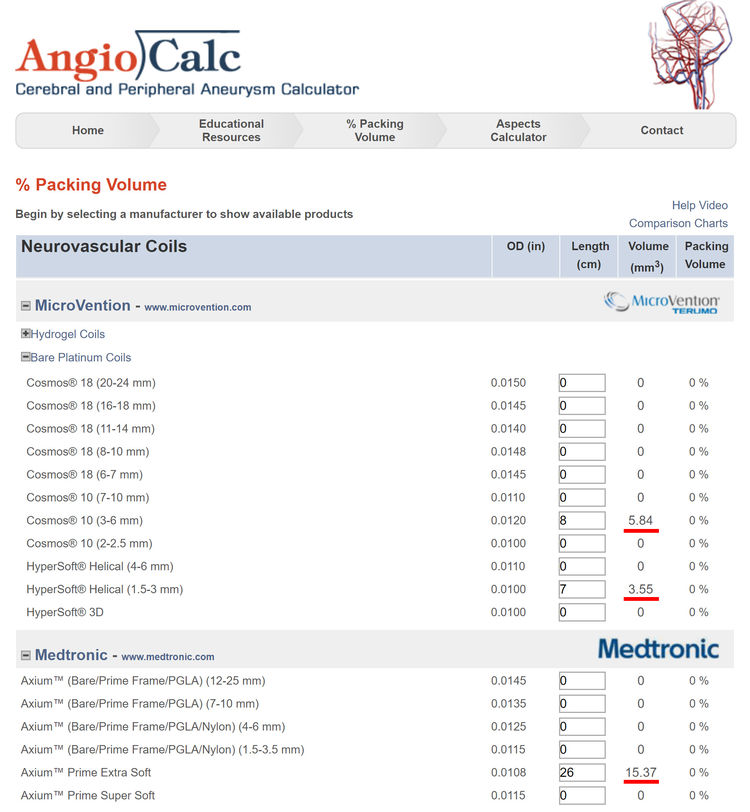
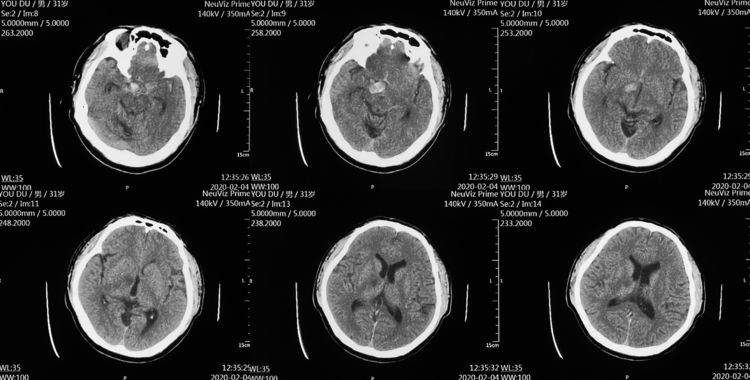
2月12日行DSA+介入治疗。左椎动脉造影示右大脑后动脉P1段动脉瘤,考虑为夹层起源: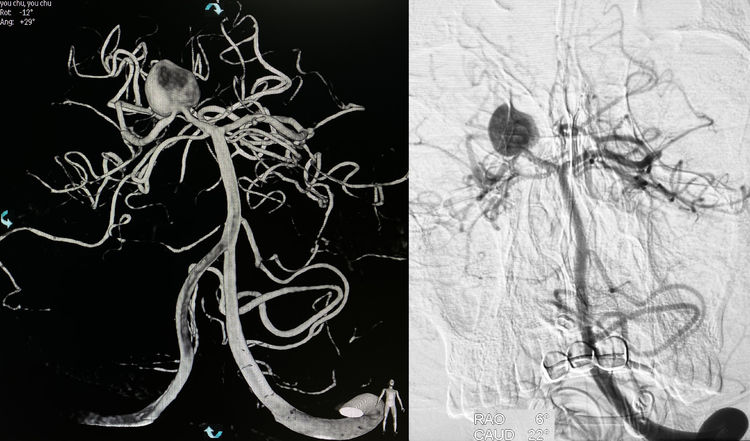
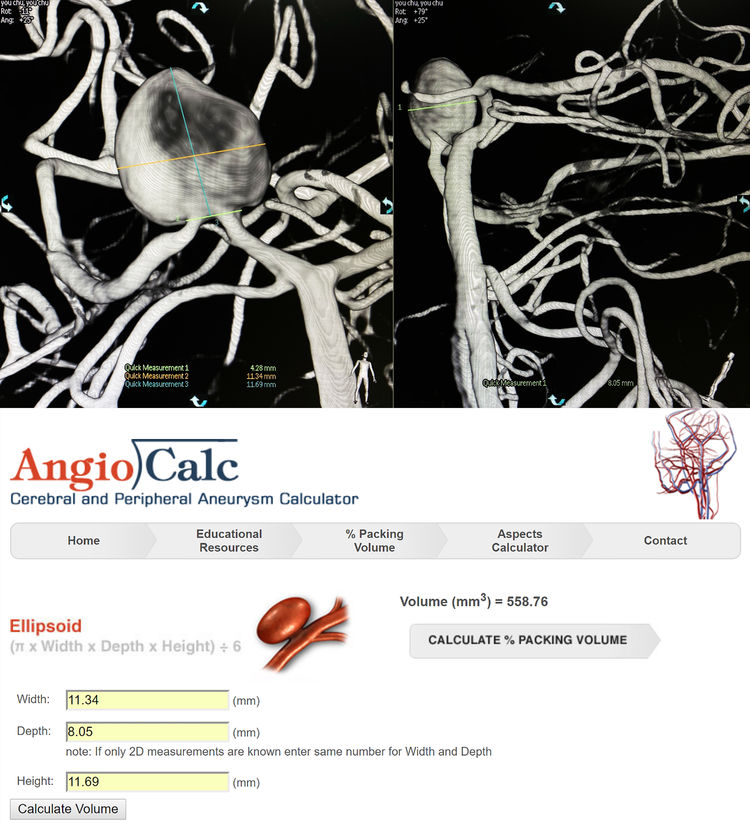
左椎动脉造影三维重建下测量,瘤体11.34 mm×11.69 mm×8.05 mm,颈宽4.28 mm(夹层动脉瘤实际上没有真正的瘤颈);粗算动脉瘤体积为558.76 mm3:
大脑后动脉大型夹层动脉瘤,近期破裂史,介入治疗的唯二之选只能是载瘤动脉闭塞或密网支架重建:
①载瘤动脉闭塞是传统方案,也是预防夹层再破裂及复发最保险的方案,标准闭塞范围是夹层动脉瘤本身加近心端一小段正常动脉;但P1段发出丘脑穿支,且该例患者的P1段于夹层近心端还发出脉络膜后内侧动脉(红箭),因而闭塞P1段很可能导致丘脑和中脑梗死。脉络膜后内侧动脉起源多变,可起自P1段,也可起自P2段,它和丘脑穿支都不具备充分的侧支吻合,不过脉络膜后内侧动脉闭塞引起的感觉和运动障碍一般能恢复。相比之下,脉络膜后外侧动脉(大多起自P2段)跟脉络膜前动脉联系密切,P2段以远的皮层支则能获得来自分水岭的丰富代偿,故闭塞P2段及以远往往比较安全。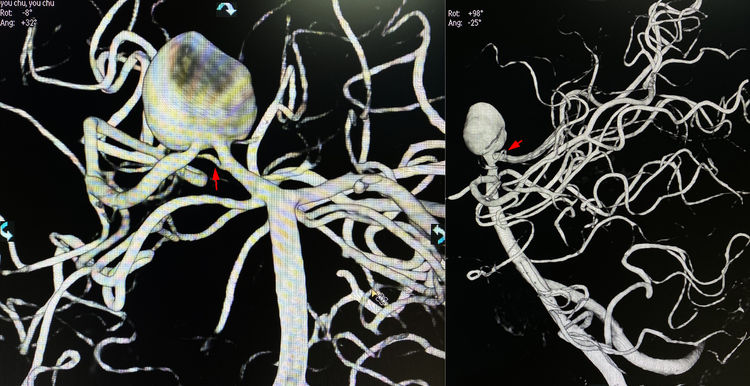
②后循环动脉瘤目前尚属于密网支架的超适应症,原因是密网支架对后循环丰富穿支的长期影响尚不明确,但越来越多的临床证据支持密网支架在后循环的选择性应用。密网支架带来的血管修复和重建的神奇效果是诱人的前景,即便伴随穿支受累的风险,转念试想,牺牲载瘤动脉伴发脑缺血的风险岂非更大?因此,我对该例动脉瘤首选密网支架方案,鉴于近期破裂出血,弹簧圈填塞免不了。
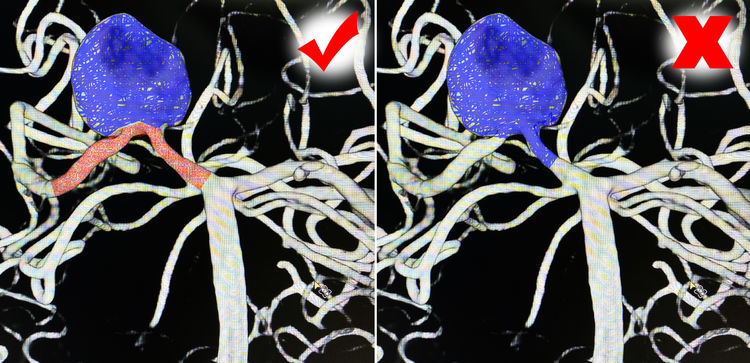
拟先双微导管技术填塞瘤腔,后置密网支架。6F Envoy导引导管送入左椎动脉;Synchro-14交换型微导丝(300 cm长)越过瘤颈预置于右大脑后动脉远端皮层支内,以备引入Marksman支架导管,后置Pipeline密网支架;两根Headway-17微导管分别在Synchro-14微导丝引导下进入瘤腔,红管管头位于瘤腔右侧,蓝管管头成襻弯向瘤腔左侧;经红管送入首枚弹簧圈(Target 360 SOFT-14-30),经蓝管送入第2枚弹簧圈(MicroPlex 18-20-65-Cosmos 18,太长,无法完全送入,回收后剪短为30 cm的长度,成功送入):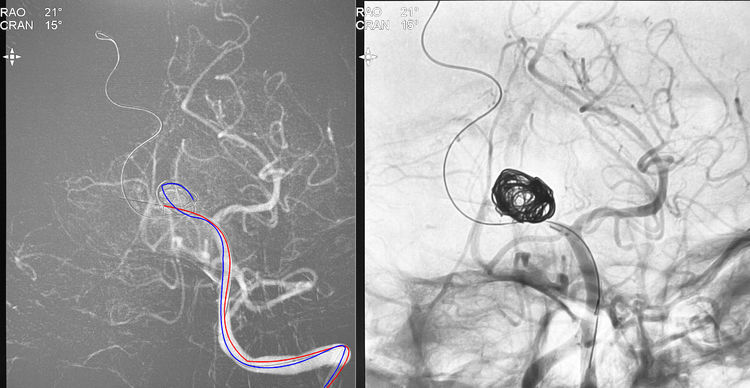
继续经双微管轮流填塞:
红管——
Target 360 SOFT-12-30;
MicroPlex 10-9-33-cosmos 10;
MicroPlex 10-8-37-Cosmos 10;
MicroPlex 10-8-37-Cosmos 10;
MicroPlex 10-7-31-Cosmos Complex;
蓝管——
MicroPlex 10-6-20-Helical 10 Regular(圈进入瘤颈左侧角);
MicroPlex 10-6-26-Cosmos 10;
MicroPlex 10-5-22-Cosmos 10(管头回退至瘤顶右侧);
QC-5-15-3D(管头回退至瘤颈右侧角);
此时透视突然发现中线部位有造影剂沉积(蓝箭),有一小环弹簧圈(红箭)突出于瘤腔轮廓之外,暗叫不好,破了……
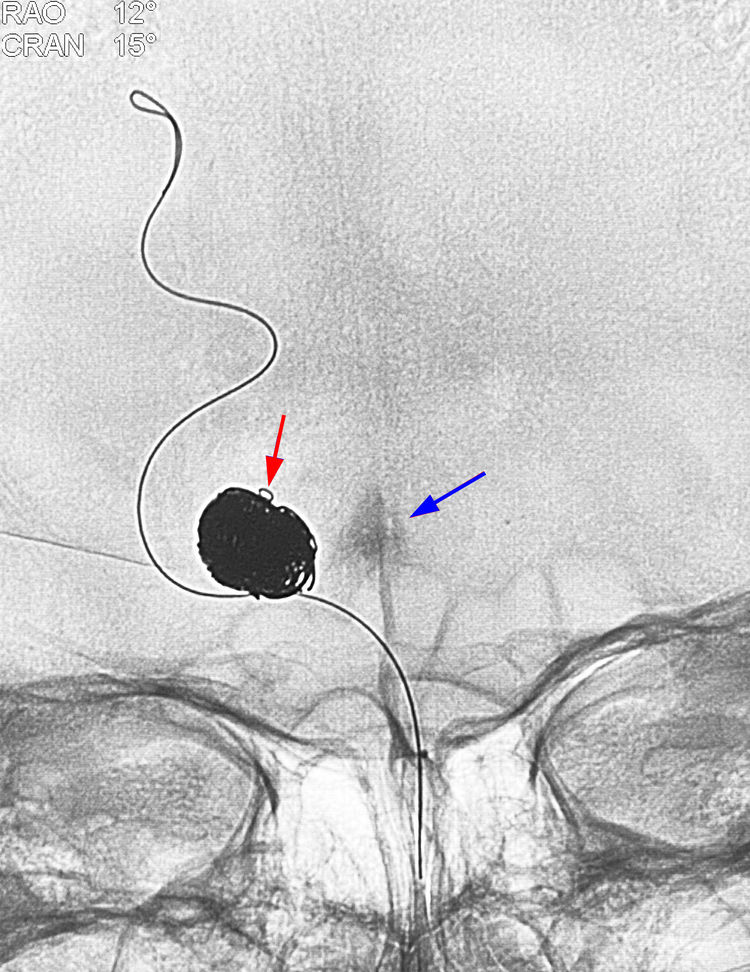
经管头已退至瘤颈右侧角的蓝管行微量造影,见造影剂外溢,向后流入四叠体池(蓝箭),证实动脉瘤破裂,破裂点应该位于瘤顶前方弹簧圈小环突出处(红箭):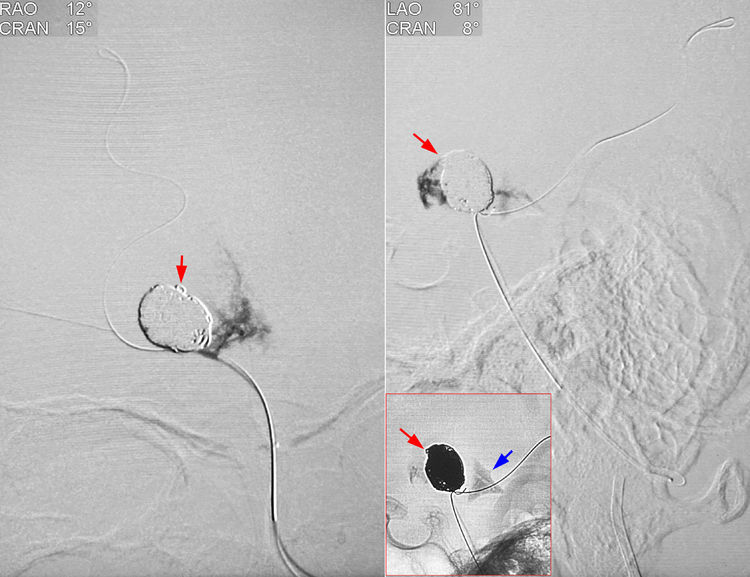
随机应变,果断放弃密网支架方案,改行载瘤动脉闭塞。经红蓝两管交替送入3枚弹簧圈(QC-3-8-3D,QC-1.5-2-HELIX,QC-2-4-3D),严密闭塞夹层近心端一小段正常动脉。有一丝弹簧圈突入右脉络膜后内侧动脉(红箭),微量造影显示右脉络膜后内侧动脉不显影,丘脑穿支(蓝箭)畅通,出血已止住: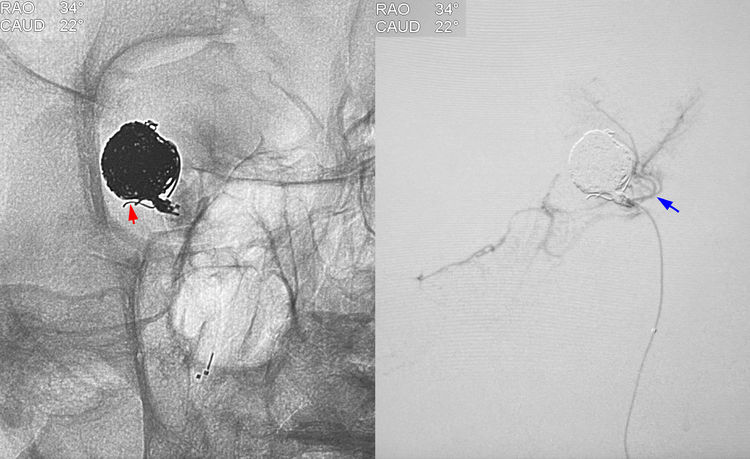
术后左椎动脉不同角度造影示右P1段远心半及动脉瘤完全闭塞;右P1段近心半发出的丘脑穿支畅通;右脉络膜后内侧动脉闭塞,红箭所指为突入其内的一丝弹簧圈: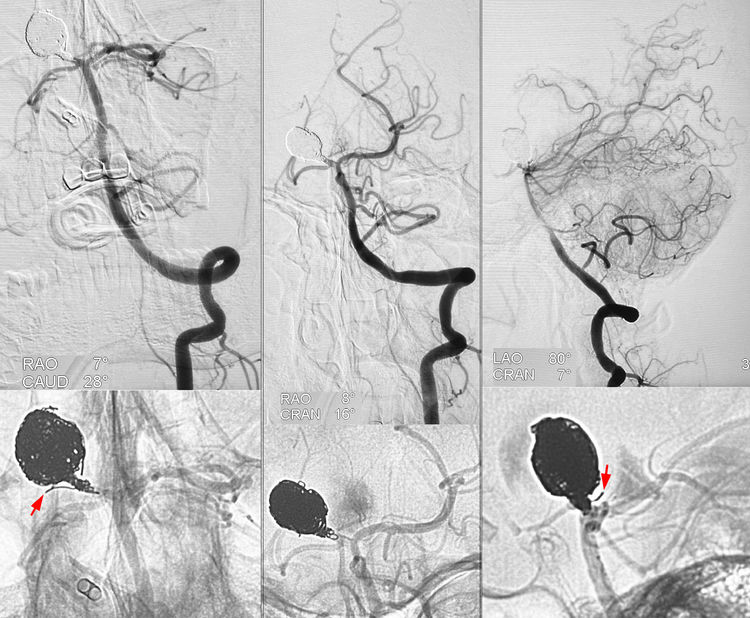
术后右颈内动脉正、侧位造影毛细血管期可见右大脑中动脉软膜支逆向灌注右大脑后动脉皮层支(红箭):
术后即刻XperCT示出血量不大,蛛网膜下腔的高密度主要成分是造影剂,丘脑区高密度为原发梗死灶内的造影剂蓄积:
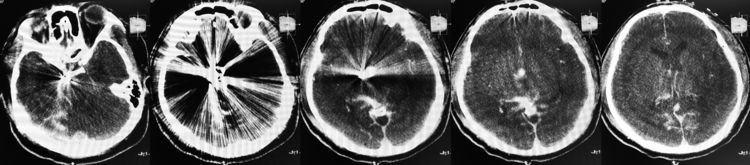
术后患者麻醉复苏顺利,神清语利,左侧中枢性面瘫,左侧肢体肌力3-4级。2周后新发症状完全消失,术前原有的右上睑下垂也有缓解。
讨论
该例动脉瘤IPR发生于填塞过程中,应该是经蓝管填入的某枚弹簧圈(MicroPlex 10-6-26-Cosmos 10或MicroPlex 10-5-22-Cosmos 10其中之一)惹的祸。我在推送这两枚弹簧圈时手头并未感受到任何需要克服的阻力,可见瘤壁是何等薄弱,一触即破。计划不如变化,为避免动脉瘤术后再破裂,我们果断废止原定的密网支架重建方案,改行载瘤动脉闭塞术。患者付出一过性轻偏瘫的代价赚了一条命,值得!
不妨计算一下该动脉瘤的栓塞体积比,共计使用14枚弹簧圈,但最后3枚填在载瘤动脉内,未填入瘤腔,需要刨除;第2枚弹簧圈MicroPlex 18-20-65-Cosmos 18修剪成30 cm的长度才完全送入瘤腔,需要按照实际送入的长度计算体积;如此算来,瘤腔内11枚弹簧圈的总体积为172.04 mm3。栓塞体积比=172.04÷558.76=30.8%,其实也算致密栓塞了。
假设按原计划铺入密网支架,加上30%的瘤内栓塞体积比,能确保术后不再破裂吗?对这种大型夹层,似乎没有十足把握,所以果断改弦更张。
韩非子曰:“千丈之堤,以蝼蚁之穴溃;百尺之室,以突隙之烟焚”,予曰:“七尺之躯,以弹丸之瘤倾”,动脉瘤破裂就是这么凶险!欲知后事如何,且听下回分解。



