D. Schiff 和 M.J. Van den Bent主编的《Handbook of Clinical Neurology》149卷(149:129-135)《神经系统转移性疾病Metastatic Disease of the Nervous System》中美国纽约Langone医学中心的AMPARO WOLF 和 DOUGLAS KONDZIOLKA撰写的《脑转移瘤:放射外科Brain metastases: radiosurgery》(DOI:10.1016/B978-0-12-811161-1.00010-4)

立体定向放射外科治疗给脑转移瘤的治疗带来了变革。治疗借助使用高分辨率影像,对肿瘤给予聚焦的、高适形性,电离辐射,而对邻近的大脑结构低毒副作用。随机对照和前瞻性试验证实立体定向放射治疗中枢神经系统转移性疾病后,包括多达10个脑转移瘤,具有生存优势和高的局部控制率。治疗的微侵袭性质使治疗成为具有吸引力的手术切除的替代方法。此外,除了化疗以外,(additive or synergistic effects),加速对颅外和颅内疾病的治疗。对脑转移瘤患者的现代治疗应包括考虑对较高分级的患者进行常规的分期和磁共振成像扫描监控(surveillance)以较早发现颅内转移瘤并及时放射外科治疗以避免神经症状的进展和避免需要手术切除治疗。
介绍
立体定向放射治疗(SRS)彻底改变了脑转移瘤的治疗放射。通过聚焦照射高度适形的电离辐射到使用高分辨率成像勾画的靶区对邻近的大脑结构,毒性最小。治疗的精准度对位于重要功能组织,如脑干,丘脑,和基底节,的肿瘤特别有价值。治疗效果以时间和剂量依赖的方式通过引起DNA损伤,导致对肿瘤细胞分裂的抑制,诱导凋亡或坏死,以及肿瘤血管的血栓形成(Kondziolka等,1992年;Kamiryo 等,1996年;Witham等,2005年)。放射外科可以作为治疗脑转移瘤的主要的方式或作为外科手术切除的辅助治疗。
本章将回顾放射外科的适应证和循证证据,以及治疗脑转移瘤的预后结果,与手术切除和全脑放疗(WBRT)对比。此外,作者将回顾最新的文献,关注同时进行放射外科治疗和靶向治疗或免疫治疗的有效性和安全性。
放射外科治疗与全脑放疗
目前放射外科治疗最常见的适应证是脑转移瘤,包括单发的转移瘤,多发的转移瘤,或手术后瘤床的放射外科治疗。
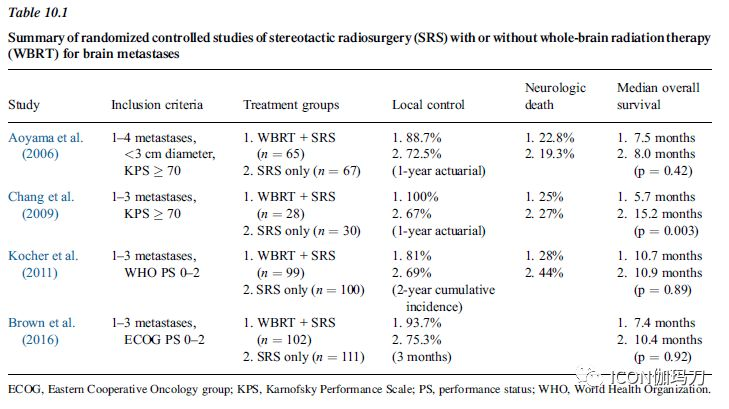
放射外科在脑转移瘤治疗中的作用在显著加强,期目标不仅仅是达到高的局部肿瘤控制率,也要延迟或避免进行全脑放疗WBRT。这种临床实践中的演变是四个随机对照试验比较单独放射外科治疗和放射外科联合全脑放疗治疗1到4个脑转移瘤患者(Aoyama等,2006年;Chang等,2009年Kocher等,2011Brown等,2016年)。联合放射外科和全脑放疗的试验表明,尽管局部肿瘤控制率有所改善,增加全脑放疗(表10.1)并未获得生存优势。事实上,上述三个试验的荟萃分析都支持相比50岁以上的患者,年轻的患者接受单独放射外科治疗具有生存优势(Sahgal等,2015年)。最近的试验中,北方中心癌症治疗组(NCCTG)的N0574试验,显示使用全脑放疗联合放射外科治疗后认知能力显著下降,出现即时回忆(immediate recall,)、记忆和语言流畅性的损伤(Brown等,2016年)。全脑放疗对认知的影响会导致总体生活质量下降。根据这些试验的结果,现在建议出现脑转移瘤的患者可以接受放射外科治疗作为初始治疗,通过密切监测来更好地保护认知功能。发表的随机对照试验报告中包括1到4个脑转移瘤的患者。
一项多中心前瞻性观察研究表明,比较2到4个转移瘤患者人和5-10个脑转移瘤患者的总体生存期具有等效性。
放射外科与手术切除
有几项回顾性研究和一项(由于应累计数目有限)不完全的前瞻性随机对照试验研究比较放射外科联合全脑放疗相比手术切除联合全脑放疗,或单独放射外科与切除联合全脑放疗相比,主要针对最大直径小于3厘米的肿瘤。总的来说,这些研究表明各组预后结果在功能表现预后结果、神经性死亡、或中位数生存期之间没有显著差异。(Bindal等,1996年;Muacevic等,1999年,2008年;Schoggl等,2000年;O’Neil等,2003年;Rades等;,2007年)。考虑到在手术不管是否联合全脑放疗(+WBRT),与放射外科SRS不管是否联合全脑放疗(+WBRT)之间有相似的总体生存率结果,一些机构对组织学不清楚的肿瘤、有明显占位效应的肿瘤,或患者有神经功能障碍症状时,暂不进行手术切除。放射外科治疗常作为优先选择,特别是对于最大直径小于3厘米的肿瘤,由于放射外科治疗侵袭性最小,因此避免了与手术切除相关的并发症,包括全身麻醉的风险,感染,和卒中。此外,放射外科治疗避免推迟进行全身性治疗。而避免推迟全身性治疗对许多病人来说是至关重要的。
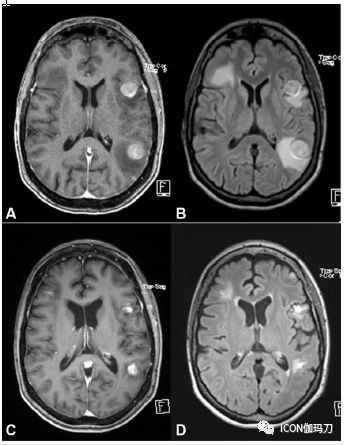
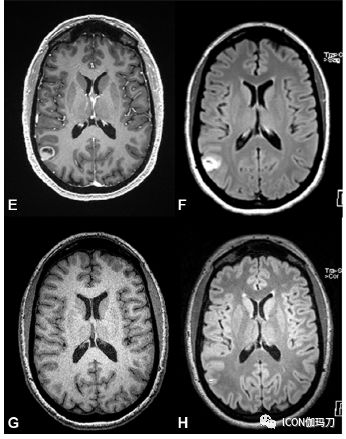

图10.1. 图示60岁男性BRAF-突变型脑转移瘤患者,同时使用BRAF抑制剂和立体定向放射外科(SRS)治疗黑色素瘤脑转移的轴位磁共振(MR)图像,包括:(A)T1钆剂增强扫描;(B)FLAIR序列扫描。在治疗后6个月的随访中的(C)T1钆剂增强;和(D)FLAIR序列 MR影像,显示出明显的局部反应。
52岁女性右顶BRAF-突变型脑转移瘤患者接受放射外科治疗,同时使用BRAF抑制剂进行治疗。(E)T1钆剂增强扫描;(F)FLAIR序列 MR影像;治疗后1年随访(G)T1钆剂增强扫描;和(H)FLAIR序列 MR影像;显示肿瘤几乎完全缩小。治疗后三年,患者仍无肿瘤证像。
放射外科治疗难以手术的肿瘤
脑干转移瘤占颅内转移瘤的3%-5%,病变很少能通过手术切除(Delattre等,1988年)。脑干转移瘤的存在传统转移通常预示预后不良,平均总体生存期为4-6个月。(Trifiletti等,2016a,b)。脑干内的肿瘤更有可能出现症状,包括进行性无力(progressive weakness),复视(diplopia),步态困难(gait difficulties),吞咽困难(dysphagia),和构音障碍(dysarthria)。
几项回顾性研究评估了放射外科在脑干转移瘤治疗中的作用,证明其有效性(Fuentes等,2006年;Yen等,2006年;Kased等,2008;Koyfman等,2010年)。在最大的接受放射外科治疗脑干转移瘤的患者研究队列中,国际伽玛刀研究基金会最近发表547例患者596处脑干转移瘤的治疗结果(Trifiletti人,2016a,b)。报告的放射外科治疗精1年后算局部控制率约为82%,应用较高的边缘剂量改善局部控制。1年的总体生存率为33%。总体生存率的预测因素包括年龄,转移瘤的总数目,肿瘤的组织学,和总体的表现得分。按照不良副反应事件通用术语标准(the Common Terminology Criteria for Adverse Events),严重毒副反应,是指3级或以上,有7.4%的患者发生严重副反应。不良副反应事件往往发生在肿瘤体积较大的患者,边缘剂量较高的,和既往有全脑放疗史的患者。总的来说,放射外科治疗脑干转移瘤,与边缘剂量相关联,能达到相当高的局部肿瘤控制率,治疗毒副作用总体偏低。全身系统性疾病的严重程度仍然是脑干转移瘤预后的主要决定因素。
放射外科治疗后局部控制的预测因素
放射外科能达到很高的局部控制率,从70%到超过90%(Vogelbaum等,2006年;Baschnagel等,2013;Wolf等,2017年)。关键的局部控制预测因素包括处方边缘剂量,肿瘤体积大小,以及如果能得到的组织学诊断。常用的处方边缘剂量在16到24Gy。较低的边缘剂量用于较大的肿瘤或位于如脑干等重要结构的肿瘤。放射外科通常能对许多组织学亚型达到相当高的局部控制率,尽管一些研究表明黑色素瘤的肿瘤控制率可能较低(Black等,2015)。同时进行的全脑放疗WBRT与提高局部控制率相关;然而,如前所述,放射外科和全脑放疗的联合应用不会产生(incur)生存优势,更确切地说,与值得注意的认知副作用有关(Brown等,2016年)。
肿瘤体积大小是放射外科治疗效应的重要预测因素。作者研究组最近的一项研究表明,存在局部控制率接近100%的肿瘤体积和最大直径的临界阈值(Wolf等,2017年)。最小的肿瘤(最大直径小于6毫米或体积小于100 立方毫米)的局部控制率非常高。最大直径小于10毫米的肿瘤,放射外科治疗后12和18个月,继续保持超过90%的高的精算局部控制率。这些结果是由对在纽约大学登记,从2012年至2015年,共200例患者的1237处脑转移瘤接受放射外科治疗,(不包括对肿瘤床的放射外科治疗),的回顾性前瞻的伽玛刀治疗脑转移瘤患者中推导出的。正如预期,大多数常见的组织学亚型是非小细胞肺癌、乳腺癌和黑素瘤。这项研究的结果强调在肿瘤小而且无症状时识别的重要性,以期使肿瘤的局部控制率和潜在的总体生存率最大化。患者第一次接受放射外科治疗时的肿瘤小于10毫米或250 立方毫米,能提高总体生存率(Wolf等,2017年)。此外,肿瘤体积大小和总的体积,而不是脑转移瘤的数目,更能预测总体生存率和局部控制率(Baschnagel等,2013年)。
放射外科治疗后的放射性副反应
放射外科治疗后出现的放射副反应(AREs),要么是早期的,要么是迟发的。一般在放射外科治疗后的数周到数月,会由于血脑屏障破坏引起血管性脑脑水肿短暂性的和无症状的加重。急性症状性放射副反应(AREs)通常是短暂的,并且一般使用短疗程的皮质类固醇激素能顺利得到控制。有症状的放射性副反应,据报道,约占脑转移瘤患者的5-15%(Sneed等,2015)。研究也显示贝伐单抗(Bevacuzimab) 在帮助控制放射外科治疗后的瘤周脑水肿中的作用(Boothe 等.2013;Yomo和Hayashi,2016年)。迟发的放射性副反应的出现是在放射外科治疗后的数月到数年才发生的,由新区域出现的瘤周的信号改变所组成,包括磁共振成像(MRI)上的增强,难以区分肿瘤复发。这种迟发效应通常与放射性血管病变有关。密切随访影像和使用新的MRI模式,包括灌注和弥散MRI,可以帮助区分肿瘤复发与一定程度的辐射炎性作用(Lee等,2014年)。
放射外科治疗结合靶向治疗
脑转移瘤的治疗正在发展(is evolving with)利用联合的策略以专注于延长生存期,包括手术切除,放射治疗,靶向药物,和免疫治疗。同时进行系统治疗和全脑放疗,通常是避免使用的,因为会增加神经毒性和骨髓抑制,从而推迟系统治疗,通常会延迟一个月以上。放射外科的一个关键优势在于通常不需要中断系统性治疗。与报道中大剂量的辐射会形成放射性皮炎对比,放射外科和原癌基因BRAF抑制剂可以安全地联合应用在黑色素瘤脑转移的治疗中,没有报告毒性增加(Narayana等,2013年;;Ahmed等,2015年)。
尽管人们对生物机制知之甚少,将放射外科与靶向药物和免疫治疗联合,可能存在叠加或协同效应。放射外科可以改善到达中枢神经系统的药物透过血-脑屏障,以及对免疫系统的刺激。几项研究报告称,放射外科治疗联合靶向治疗治疗脑转移瘤患者,包括原癌基因BRAF-突变型黑色素瘤患者(图10.1和10.2)和EGFR-突变的非小细胞肺癌患者,的中位数总体生存期会延长。接受放射外科治疗的非小细胞肺癌脑转移瘤患者中,与野生型队列相比,EGFRr-突变的脑转移瘤患者的生存期改善(Shin等,2016年)。
作者研究组的另一项研究表明使用BRAF抑制剂治疗的原癌基因BRAF野生型(BRAF-WT)患者和原癌基因BRAF突变型(BRAF-M)患者的中位数总体生存期存在显著不同,分别为4.5个月和11.2个月(Wolf等,2016)。使用靶向抑制剂的原癌基因BRAF突变型(BRAF-M)患者的精算生存率,放射外科治疗后6个月为54%,12个月为41%。与之相比,原癌基因BRAF野生型(BRAF-WT)患者的精算生存率28%,放射外科治疗后6个月为28%,12个月为19%。在这两组之间局部肿瘤控制率没有显著差异。
其他研究也显示联合应用BRAF抑制剂和放射外科治疗总体生存期较长。(Ahmed等,2016a; Xu等,2017年),而其他人的研究则未能显示获益(Ly等,2015年;Patel等,2016)。这种差异的一种可能性是缺乏BRAF突变的患者的治疗方法中有很多的治疗策略,包括最近的免疫治疗,(例如,PD-1抑制剂)可能会改善患者的中位数生存期。同时,在放射外科治疗前,患者服用BRAF抑制剂的时间长短也可能影响总体的中位数生存期。Wolf等,2016)。联合放射外科应用达拉菲尼(dabrafenib)疗BRAF V600E黑色素瘤脑转移中的第二阶段前瞻性试验治最近已经完成,结果仍有待公布。
总的来说,大多数研究都支持系统性治疗的安全性。脑转移瘤患者SRS治疗的同时进行系统性治疗,从而推进颅内和颅外疾病的治疗。根据组织学亚型使用靶向药物,可能带来生存优势。
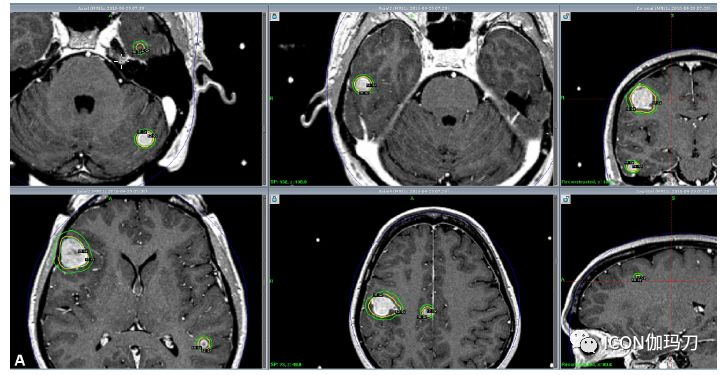
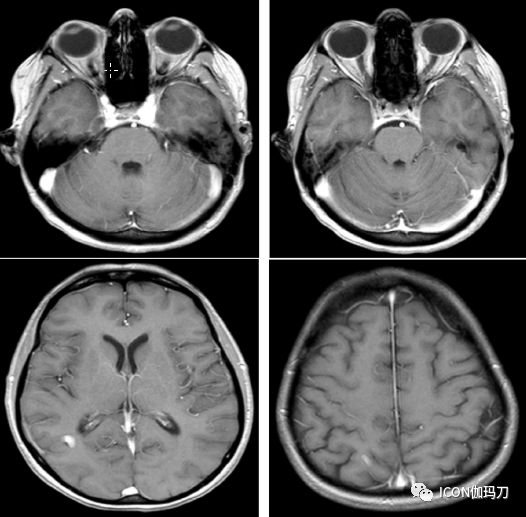

图10.2. 立体定向放射外科治疗一个有多发性黑色素瘤脑转移患者。一个43岁的患有BRAF-突变黑色素瘤患者出现癫痫发作。她的16处脑转移瘤接受放射外科治疗,每处肿瘤的边缘剂量为18Gy。(A)多个脑转移的伽玛刀放射外科计划,肿瘤边缘剂量18 Gy。(B)治疗后9个月随访时,钆剂增强轴位T1磁共振图像显示肿瘤完全缩小。患者使用达拉菲尼(dabrafenib)和曲美替尼(trametinib)治疗,没有神经系统症状。
结合放射外科治疗和免疫治疗
用立体定向放射外科和免疫治疗相结合治疗脑转移瘤是当前研究的一个重要方面。同时进行放射外科治疗和免疫治疗能利用免疫治疗潜在的远隔效应(abscopal effect)的优势,提高放射外科治疗的有效性。最近的几项研究表明,放射外科SRS联合免疫治疗能改善黑色素瘤脑转移的预后结果(Knisely 等,2012;Kiess等,2015年;Sharabi等;,2015年;Ahmed等,2016a,b)。然而,需要警惕的是,联合治疗会导致加重的(exaggerated)炎症反应,导致瘤周脑水肿加重,并有可能出现神经系统症状加重(Kiess等,2015;Cohen-Inbar等,2017年)。的功效
同时进行放射外科治疗和免疫治疗的有效性和安全性,包括检查点抑制剂的阻断,需要作进一步的调查。
结论
监测筛查和立体定向
放射外科治疗
随着系统性癌症治疗的有效性的进步脑转移瘤的发生率也在上升。脑转移瘤治疗的现代目标是在在对颅外癌症不间断的治疗过程中防止神经系统恶化。可以通过高分辨率的对比度增强MRI常规监测,得以识别小的无症状的肿瘤。放射外科治疗然后可以针对这些肿瘤上进行以最低限度的侵袭方式开展治疗,尽可能延迟对全脑放疗WBRT的需求。对小的(最大直径小于1厘米的)肿瘤的治疗能达到高的局部控制率超过90%。出现的肿瘤体积大小较小可能与总体存活率的提高相关。并非所有的病人都接受常规定期脑部磁共振成像检查或者是常规监测,大约50%的机会,病人会出现症状。现在在没有神经症状的情况下,对于新诊断的IB期到IV期非小细胞肺癌患者和IV期黑素瘤患者建议行脑磁共振检查(NCCN指南1.2016版)。按NCCN指南推荐只有对复发或IV期的乳腺癌患者,考虑出现中枢神经系统症状时,建议行脑磁共振检查。作者认为对高分级癌症患者进行常规定期MRI检查和监测,以较早发现的颅内转移瘤并及时治疗,目的在避免神经系统症状进展展,以致于需要手术切除。



