《Neurology 》杂志2020年10月1日 在线发表美国University of Virginia School of Medicine等医院的Ching-Jen Chen, Dale Ding, Colin P Derdeyn,等撰写的综述《脑动静脉畸形:自然病史、病理生物学和干预措施的综述。Brain arteriovenous malformations: A review of natural history, pathobiology, and interventions》(doi: 10.1212/WNL.0000000000010968.)。
脑动静脉畸形(AVMs)是脑动脉和静脉之间的异常直接分流(anomalous direct shunts),逐渐形成畸形血管巢(convalesce into a vascular nidus)。AVMs的治疗策略是具有挑战性的和多样性的。颅内出血和癫痫发作是AVMs最常见的表现。然而,由于非侵袭性神经影像学的广泛应用,偶发的AVMs被诊断的频率越来越高。估计的终生累积出血风险与干预风险之间的平衡通常是治疗的主要决定因素。目前的治疗方案包括手术切除、栓塞、立体定向放射外科治疗(SRS)和观察。完全闭塞畸形血管巢是AVM干预的目标。干预的风险和获益各不相同,可以组合使用。切除AVM病灶可提供较高的即刻闭塞率,但它是有创性的,并有中等的神经系统并发症风险。AVM栓塞是微创的,但只少数病变能达到治愈。SRS也是微创性的,几乎没有直接的并发症发生,但是AVM的闭塞是延迟发生的,因此患者在潜伏期仍有出血的风险。与AVMs的自然病史相比,未破裂的AVMs是否能以较低的卒中或死亡风险实现闭塞仍存存在争议。在过去的5年里,描述AVM自然史和治疗结果的多中心前瞻性和回顾性研究已经发表。这篇综述提供对脑动静脉畸形自然病史、病理生物学、和干预措施的的当代的和全面的讨论。
引言
![]()
脑动静脉畸形(AVMs)是一种罕见的异常动静脉分流,由发育不良(dysplastic)的脑动脉和静脉缠结而成(comprising tangles),汇集在血管畸形巢处,没有正常的中间实质。传统上,AVMs实质被认为是先天性病变。然而,有少数关于新生动静脉形成(de novo AVM formation)的报道,而产前超声观察未见脑实质动静脉畸形(不同于像Galen动静脉畸形),对这一武断的意见提出了挑战。随着无创神经影像学越来越得到普遍的使用(Concordant with the increasingly pervasive use),偶发的(incidental)AVMs被检测出的频率越来越高。出血通常被认为是AVMs致死致残的主要原因,所以,自然病史研究试图确定预测破裂的因素。因此,评估终生累积出血风险与干预风险之间的平衡通常指导着AVM的管理。
目前AVM患者的治疗选择包括观察、手术切除、栓塞、立体定向放射外科治疗(SRS)或多种治疗策略。AVM干预的目标是彻底的腔内关闭(complete endoluminal closure)或闭塞畸形血管巢。脑血管学界(cerebrovascular community)仍在争论是否干预未破裂的AVM达到闭塞所发生卒中或死亡的风险比其自然病史的要低。最近的多中心研究有助于改进AVM的管理,澄清自然病史和治疗结果。在这篇综述中,我们提供对脑动静脉畸形自然病史、病理生物学、和干预措施的当代和全面的讨论。
自然病史
![]()
仍不能完全确定脑AVMs的真正患病率和发病率。在尸检研究中,AVMs的估计患病率差异很大,在每10万人5至613例之间。在以人群为基础的研究中,AVMs的总发病率(the overall incidence)为1.10 - 1.42 / 100,000(表1)。

颅内出血是AVMs最常见的症状表现。虽然AVM出血的预后优于原发自发性脑出血,但有文献报道AVM 一个月病死率(the one month case fatality)为11%,不良结果率(poor outcome rates)为40%。未经治疗的未破裂AVM的总体出血风险率估计为每年1% - 3%(表2)。


尤其是在初次出血后的第一年,破裂的AVM的出血风险高于未破裂的AVM的。先前的出血是以后出血最一致的预测因子(Prior hemorrhage is the most consistent spandictor of subsequent hemorrhage)(表3)。包括静脉引流模式、引流静脉较少、病灶位置、畸形血管巢大小、有无相关动脉瘤或静脉曲张(venous varices)等AVM血管结构特征,是其他潜在的危险因素。尚不清楚如年龄和性别等患者的人口统计特征(patient demographics),是否会影响AVM的出血风险。


(约三分之一的病例有的)癫痫发作是第二常见的AVM临床表现。然而,由于AVM出血的致死致残率,癫痫发作并不是治疗结果或自然病史研究的重点。在偶然发现的AVMs患者中,在诊断后5年内约有8%的风险有首次癫痫发作。然而,对于表现为出血或局灶性神经功能障碍的患者,这种风险估计为23%。无出血或神经功能障碍的患者在出现时或随访期间首次发作癫痫,其发生癫痫的风险估计为58%。皮质性动静脉畸形(Cortical AVMs,),特别是那些累及颞叶的动静脉畸形,具有癫痫发作的最高风险。与 AVM相关的癫痫发作的其他潜在危险因素是畸形血管巢较大、浅表静脉引流和位于动脉边缘区(arterial border zone location)。
病理生物学
![]()
遗传性疾病,如遗传性出血性毛细血管扩张症(hereditary hemorrhagic telangiectasia)和Sturge-Weber综合征,提供了一些关于控制AVM发病机制的关键信号通路(the crucial signaling pathways)的观点。AVM表型已被证明表现为转化生长因子-β( TGF-β) 信号通路受损和MAPK通路激活。在散发性AVMs中还检测到激活受体样激酶1 (ALK1)、内皮糖蛋白(ENG)、整合蛋白β8 (ITGB8)、白细胞介素-1β(IL1B)、血管生成素样4 (ANGPTL4)、G蛋白偶联受体124 (GPR124)、血管内皮生长因子(VEGF)和金属肽酶3 (MMP3)的多态性。还不确定这些遗传危险因素是否增加了个体对AVM发展的易感性。VEGF是调控血管生成的信号分子的重要家族,其在AVM 畸形血管巢和邻近的星形胶质细胞内对诱导缺氧因子的过度表达被认为有助于AVM的形成。
血管生成素(ANG)的差异表达与AVM血管稳定性有关,而血管生成素(和血管内皮生长因子之间的相互作用可能在AVM的发展中发挥作用。尽管遗传危险因素已被确定,但AVM一般不是遗传性的,因此对AVM患者亲属的遗传咨询也没有典型的必要性。
炎症和细胞外基质重构(Inflammation and extracellular matrix remodeling)与AVM的生长和破裂有关。白细胞介素-6 (IL6)、IL1-、配体(ephrin) B型受体4 (EPHB4)、载脂蛋白E (APOE)ε2等位基因(allele)和肿瘤坏死因子- TNF-)- 238G>A等位基因的多态性是与AVM出血相关的遗传修饰因子。嗜中性粒细胞增多(Neutrophilia)和巨噬细胞迁移抑制因子(macrophage migration inhibitory factor)增高会促进血管系统的不稳定。金属蛋白酶(Metalloproteinases)似乎在AVM的生长和稳定中也有重要作用,其中蛋白水解酶(proteolytic enzymes)降解细胞外物质(pericellular substances)导致血管不稳定和改变血管生成。
除了AVM破裂的后果外,畸形血管巢本身还可由于对邻近脑区的脑部区域的局部效应(locoregional effects on the adjacent brain regions)而引起神经系统疾病发生(neurological morbidity)。畸形血管巢内的高流量动静脉分流可以将血液从正常脑实质周围的毛细血管网中分流出去。随之而来(ensuing)的低灌注状态可导致畸形血管巢周的毛细血管网扩张和软脑膜血管的募集(dilatation of the perinidal capillary network and recruitment of leptomeningeal collaterals)。由于引流静脉狭窄而导致的高流量分流或限制流出而引起的静脉充血和静默高压可诱发神经症状和癫痫(Venous congestion and hypertension resulting from high-flow shunts or restricted outflow due to stenosis of draining veins can actuate neurological symptoms and epilepsy)。神经细胞丢失、胶质增生和胶质生理异常、神经递质水平改变、自由基生成和细胞信号异常都被认为是慢性缺血引起的与AVM相关的癫痫发作的发病机制。AVM和畸形血管巢周脑实质之间的分子和生理相互作用不是静态的(static),而是随着时间而演变的。
干预措施
![]()
显微外科切除是动静脉畸形的主要治疗方式,这项干预措施的渐进目标(the stepwise goals)是广泛暴露相关的解剖、闭塞供血动脉,同时保留行径血管(en-passage vessel),环周分离解剖(circumferential dissection)病变,断开引流静脉,最后整体根除畸形血管巢(en-bloc extirpation of the nidus)。辅助切除的包括先进的术前神经影像,术前血管内栓塞,无框架立体定向神经导航,和术中血管成像(如数字减影血管造影,吲哚菁绿视频血管成像,和荧光素视频血管成像),术中电生理监测和映射,每项技术进步改善了AVM手术的安全性和有效性。许多回顾性队列研究已经描述了AVM显微手术的风险获益情况(表4)。与其他AVM的干预措施相比,显微手术的优势是完全闭塞率高、出血风险立即消除和长期持久性。 AVM切除术的缺点是需要开颅,住院时间长,康复时间长,并有围手术期神经系统和全身系统性并发症的风险。


为了按照手术风险对患者进行分层,已经制定了分级量表来预测AVM手术后的预后(表5)。Spetzler-Martin (SM)分级量表是最常用的分级系统。高级别SM分级由按大小,静脉引流方式和位置的评分分五层组成。虽然变量的选择和积分分配主要基于临床经验和直觉,没有详细的统计方法,但分级量表已被证明是估计AVM手术风险的可靠工具。
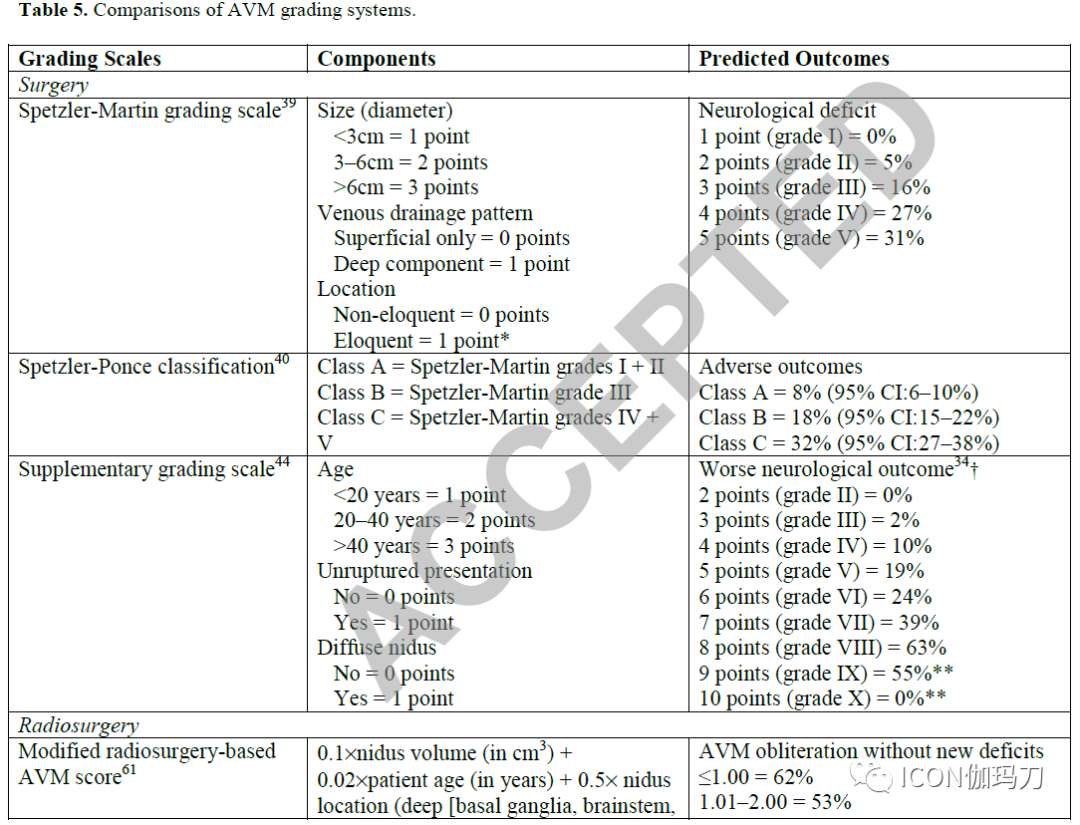

将SM分级量表简化为Spetzler-Ponce三层分类体系。 SM I级和II级分为Spetzler-Ponce A级,SM III级分为Spetzler-Ponce B级,和SM IV级和V级 分为Spetzler-Ponce C级。报道Spetzler-Ponce A, B和C级AVM不良手术结果的风险发生率分别是8%(95%CI: 6-10%), 18%(95%-CI: 15-22%)和32%(95%-CI: 27-38%)。不良结果的定义和截断阈值的异质性可能导致对Spetzler-Ponce A级AVMs的高估。相反,选择偏倚可能导致Spetzler-Ponce C级AVMs的不良结果发生率被低估。这些结果表明,切除术最适合低级别AVMs(即SM等级I和II级或Spetzler-Ponce A级类),而高级别AVMs(即SM IV和V级或Spetzler-Ponce C级)通常应保守处理。中等级别(即SM III级或Spetzler-Ponce B级)AVMs的异质性组合的手术效果取决于大小、位置和静脉引流的具体组合。位于重要功能区、有深静脉引流的小型中等级别的动静脉畸形,其手术风险与低级别动静脉畸形相似。然而,中等大小的中等级别的动静脉畸形,位于非重要功能区伴深静脉引流或位于重要功区且只有浅静脉引流的,其手术风险与高级别动静脉畸形相当。
为提高SM分级方案的预测能力,设计了补充分级量表。补充分级在SM分级中增加了患者的年龄、既往出血史和畸形血管巢形态,在联合补充SM分级系统后,最高总分为10分。一项针对1009例手术治疗的AVMs的多中心分析发现,补充的SM分级得分6是考虑手术的合理的截断值。补充SM分级≦ 6分的患者术后出现不良结果的风险发生率为0-24%,而SM分级>6分的患者术后出现不良结果的风险发生率为39-63%。这些分级量表只能被视为评估AVM可操作性的一个起点,而不是决定切除是否适当的整个基础。影响AVM患者手术决策的其他因素包括自然病史、内科合并症、预期寿命、替代治疗方式、患者期望和外科专业知识。
栓塞常用于AVMs的多模态治疗(表4)。术前栓塞是血管内AVM干预最常见的应用,其目的是减少术中出血,促进畸形血管巢的安全剥离,从而减少手术并发症。术前栓塞可以扩大AVMs的可手术范围。根据畸形血管巢的血管构造的复杂程度,栓塞可分单个阶段或多个阶段进行,以在切除前逐渐减少流入AVM的血流。供血动脉蒂供应的畸形血管巢深部部分,在剥离早期不容易到达,遂优先针对(spanferentially targeted)。包括聚乙烯醇(polyvinyl alcohol,PVA)泡沫颗粒、铂金圈和液态氰基丙烯酸正丁酯(NBCA)在内的一系列栓塞剂已被用于血管内治疗AVMs。最近,乙烯乙烯醇(ethylene vinyl alcohol,EVOH, Onyx)已成为AVMs的栓塞选择。
有治愈目的的栓塞已被作为AVMs的独立治疗方法。虽然血管构造简单的AVM中可以获得更高的治愈率,仅用AVM栓塞治疗的完全闭塞率高达51%。虽然绝大多数的AVM栓塞是通过动脉途径进行的,但最近对适当选择病变,经静脉栓塞已成为一种可能的治疗技术。一项正在进行的前瞻性、随机、II期试验,比较经静脉和经动脉AVM栓塞达到完全闭塞的有效性。
在SRS之前,栓塞也被用来减少大的AVM的体积。虽然理论上很有吸引力,但这种策略的有效性最近受到了质疑,SRS前栓塞可能降低SRS后闭塞率。提出的降低SRS栓塞AVMs后闭塞率的机制包括:栓塞物对射线束的吸收或散射,栓塞铸型对残余病灶的遮蔽,阻碍准确充分的放射外科靶向,畸形血管巢栓塞部分的再通,栓塞诱发的血管生成。栓塞对SRS治疗AVM 结果的影响也可能被病灶血管结构的复杂性所混淆。目前,SRS治疗前栓塞主要用于选择性地针对易使AVM在SRS治疗到闭塞之间的潜伏期破裂的高危血管造影特征(例如,畸形血管巢内或巢周的动脉动脉瘤,畸形血管巢内动静脉瘘)。最后,栓塞被用于不能手术的AVMs,以减轻静脉高压。
AVM栓塞最常见的并发症是术中或术后出血和缺血性脑卒中,约7%的病例出现永久性神经系统并发症和死亡。出血可由(术中)医源性(iatrogenic)血管壁损伤或(术后)引流静脉过早闭塞(spanmature draining vein occlusion)导致AVM破裂引起,而缺血性卒中可由导管插入术或脱靶栓塞(offtarget embolization)引起的血栓栓塞并发症引起。一些评估AVM栓塞后不良后果的分级标准已经被开发出来,但是没有一个被常规用于当代的血管内神经实践。对AVM栓塞分级系统缺乏广泛采用的合理解释包括栓塞的种类、血管内技术、微导管技术和栓塞的意图方面的不同。
立体定向放射外科(SRS)是一种明确的治疗AVMs最初保留手术高风险的病变。然而,随着经验的增加和可用性的提高,它已成为AVMs患者管理中不可或缺的一部分(表4)。SRS最适合位于深部或重要区域的中小型AVMs(体积<12cm3或直径≦3cm)。与AVM切除术或栓塞治疗不同,SRS的有利和不利影响可能在几个月到几年之后才完全显现。辐射刺激血管内皮诱导平滑肌细胞增殖和细胞外胶原积累,导致受照射血管的进行性内膜增厚,血栓形成,血管内腔最终闭塞。对于理想选择的病灶(体积小,年纪轻),在3-5年随访后,可观察到高达60% - 80%的闭塞率。潜伏期出血的风险仍然存在,SRS在闭塞前假设的对AVM破裂给予部分保护存在争议。在放射影像学边缘剂量和闭塞率之间存在着一种函数剂量-反应(sigmoid dose-response)关系,而闭塞率和对周围实质的放射副反应之间的平衡已得到广泛研究。
建立SRS治疗AVM 预测预后的评分系统(表5)。改良的基于放射外科的AVM评分(RBAS)将畸形血管巢体积、患者年龄和畸形血管巢位置纳入如下计算:0.1病灶体积+0.02患者年龄+0.5病灶位置。RBAS与定义为AVM闭塞,且无新的神经功能障碍的极好的结果率呈负相关。然而,年龄预测 SRS治疗AVM结果的价值被最近的多中心研究所反驳(refute)。弗吉尼亚放射外科AVM量表(VRAS)的预测因子包括既往出血,而不是年龄。VRAS包括畸形血管巢体积、位置和既往出血。在VRAS评分为0-1、2和3-4的患者中,有80%、70%和45%的患者的预后良好,定义为SRS治疗后无出血或永久性有症状的放射性并发症。
放射性改变(RIC)是 SRS治疗AVMs后最常见的并发症,在36%的患者中有明显的放射影像学表现。在SRS治疗后的6-18个月间,放射性改变(RIC)在磁共振成像上表现为畸形血管巢周围T2加权高强度。大多数放射性改变(RIC)是无症状的和短暂的。然而在所有接受SRS治疗的AVM患者中,约有10%会出现继发于RIC的神经症状,包括头痛、癫痫发作和局灶性神经功能障碍。一小部分患者,大约占整体的3%,将罹患与RIC相关的永久性神经变性(permanent neurological deterioration)。既往AVM出血、重复SRS和AVM深部位置是RIC的潜在危险因素。
SRS的延迟效应并不常见,但可能在最初的治疗后数年才显现。在接受SRS治疗的AVM患者中,大约有1-3%的患者在接受干预后平均6.5年发生囊肿形成。约70%的SRS治疗后的囊肿是无症状的,可以被观察到。对于有症状的或增大的囊肿,应考虑手术干预,包括立体定向引流、切除或分流。SRS治疗后的囊肿被认为是由脆弱的毛细血管扩张的畸形血管巢周围的血管形成的,这些血管容易破裂,从而促进血清和蛋白质渗出,水肿积累,最终形成囊肿。囊肿形成的危险因素包括高放射外科剂量、大的畸形血管巢体积和叶状畸形血管巢的位置。在接受SRS治疗的患者中,继发性颅内恶性肿瘤的风险非常低,而且它看起来与一般人群中原发性脑瘤的风险相似。
AVM干预的癫痫发作和头痛结果
![]()
由于AVM治疗的首要目标仍然是降低出血性风险,因此通过干预来改善或停止(ameliorating or abolishing)与AVM相关的癫痫发作的重要性往往不受重视(undeapspanciated)。70% - 80%的与AVM相关的癫痫患者在显微外科切除后可无癫痫发作。与其他干预措施相比,在治疗前有癫痫发作的AVM患者中,切除可提供最高的无癫痫发作率,以及达到这一终点的最短的时间间隔。虽然不常见,。在那些没有先前存在癫痫发作的患者接受AVM干预可刺激新生的癫痫发作(de novo seizures)。在没有治疗前的癫痫发作的患者中,AVM栓塞与新发病的癫痫发作的最高发生率相关,其后从高到低依次是切除和SRS。尽管尚不清楚与AVM相关的癫痫的发病机制,但切除术后和SRS治疗后的畸形血管巢闭塞已被发现可以提高癫痫发作的控制率。然而,SRS治疗后癫痫发作改善的显著程度似乎与残留动静脉分流无关。SRS治疗抗惊厥作用的原因假设为抑制蛋白质合成和电离辐射的神经调节作用。
与干预病例系列相反,对照研究没有报道AVM治疗改善癫痫的结局。在一项未破裂脑动静脉畸形(ARUBA)的随机试验中,干预和保守治疗获得了类似的癫痫发作结果,在长期随访中,干预可能与较高的癫痫发作发生几率相关。在苏格兰的颅内血管畸形调查(SAIVM)的前瞻,以人群为基础的研究,干预并不影响在AVM患者中第一次或复发的无端癫痫发作(unprovoked seizure)的5年风险,在干预或观察后超过5年的随访中,有癫痫发作表现的患者获得2年无癫痫发作的概率是相似的。此外,相当的癫痫发作的结局并不因AVM干预方式或得到闭塞的程度而异。尽管报告对照研究癫痫发作结果的数据数量有限,但随后的荟萃分析发现,在治疗与AVM相关癫痫方面,干预是否优于保守治疗的证据不足。在未来的AVM试验中,似乎有必要纳入标准化的癫痫特异性筛查方案和结果测量。
在AVM文献中关于头痛结果的资料很少,这可能意味着到目前为止对这类患者的主诉缺乏必要的关注。与保守治疗相比,ARUBA的干预并没有减少头痛的频率。治疗AVM患者头痛的药物疗法及其长期疗效有待进一步研究和优化。在未来的AVM干预病例系列和对照研究中,持续报道头痛预后可为患者咨询提供重要信息。
保守处理与干预
![]()
AVM患者的管理决策是基于干预风险和观察之间的平衡。尽管随机对照试验的证据有限,但如果确定患者有复发出血的高风险,治疗破裂的AVMs是可以接受的。SAIVM前瞻性AVM队列研究和ARUBA对未破裂的AVM进行干预的动力(The impetus to intervene)受到了挑战。先前的SAIVM分析是一项前瞻性、基于人群的队列研究,比较了未破裂的AVM的保守治疗(n=101)与干预(n=103)。在这项研究中,在长达12年的随访中,保守治疗与较好的临床结果相关。ARUBA将未破裂的AVMs患者随机分配到医疗管理组(n=109)或干预组(n=114),由于内科管理组的优势(10%死亡或有症状性卒中相比31%死亡或有症状性卒中;危险比0.27,95%CI:0.14-0.54)。特别是,多中心AVM研究(MARS)报告的未破裂的AVM出血率与ARUBA和SAIVM的AVM保守治疗组的出血率相当。
随后对ARUBA进行的事后分析(post-hoc)发现,保守治疗与功能障碍有一致的优越性。通过延长随访,ARUBA的结果得以维持。然而,因为ARUBA的随访持续时间、治疗方式的异质性、与之前的观察研究相比干预组中高于预期的主要终点和出血率,对ARUBA试验的方法和结果一直存在争议。值得注意的是,尽管有国家卫生研究院(NIH)的资金支持,但美国中心的参与和登记人数相对较低。
在ARUBA干预组和SAIVM AVM研究中,栓塞分别是26%和21%的患者唯一的治疗方法.与降格为主要作为辅助治疗的现代AVM治疗相比,独立栓塞的应用相对广泛。低级别AVM是切除或SRS的有利靶区,占ARUBA干预组(67%)和SAIVM AVM研究干预组(55%)的大部分。
在SAIVM AVM研究中,栓塞的闭塞率为45%,切除术的闭塞率为83%。在ARUBA中,栓塞的闭塞率为50%,切除率为100%。因此,在两项前瞻性研究中,手术切除相比单独栓塞,AVMs的闭塞率要高得多。在ARUBA中,单独SRS就产生了18%的低闭塞率。综上所述,栓塞的频繁使用,尤其是可操作的低级别AVM,和SRS后短期随访可能导致ARUBA干预组的适度的整体闭塞率为44%。
主要终点(即死亡或症状性卒中)发生在50%单独或与另一个治疗模式相结合的ARUBA栓塞患者中。在ARUBA中大多数达到主要终点的患者都有出血性卒中(67%)。人们可以把内科组和干预组之间出血性卒中发生率的早期差异归因于与治疗措施相关的出血。然而,两组的生存曲线并没有随着时间的推移而收敛或相交,这可能是由于大量未完全闭塞的动静脉畸形所造成的迟发性出血所致。因此,在ARUBA中分配接受干预的患者所接受的治疗(例如,通过减少血流或闭塞畸形血管巢)可能不能充分改善其AVMs的自然病史。
在ARUBA之后,许多回顾性研究对用现代治疗措施处理未破裂的AVMs的治疗的结果进行调查。总的来说,在ARUBA发表后,在美国未破裂动静脉畸形的干预率的没有出现显著的改变。一项对使用SRS治疗509例符合ARUBA标准的患者的多中心研究报告闭塞率为75%,不良神经结果(定义为任何新的或恶化的神经症状或死亡)发生率为13%,平均86个月的随访中,SRS治疗后的年出血率为0.9%。对于未破裂的动静脉畸形而言,实现SRS获益的随访时间估计超过10年,但大多数动静脉畸形患者的年轻年龄似乎转化为患者一生中SRS干预的总体益处,尤其是在儿科人群中。在未破裂的AVMs手术中,与ARUBA相比,低级别AVMs的治疗效果较好,闭塞率接近100%,永久性神经功能障碍发生率不到4%。一项61例符合ARUBA资格的患者接受ONYX栓塞治疗的研究中,包括41%接受单独栓塞, 57%接受栓塞联合SRS治疗,2%接受栓塞联合切除术,,中位随访60个月,报告的闭塞率为77%,卒中或死亡率为20%,与治疗相关的死亡率为7%。
最近比较142例接受多模式治疗和进入ARUBA的符合ARUBA资格的患者之间的 Kaplan-Meier平面图发现在符合ARUBA资格队列中有显著较低的症状性卒中或死亡的发生率。虽然符合ARUBA资格的队列和ARUBA内科管理组之间的结果比较,符合ARUBA资格的队列的年卒中率优于ARUBA内科管理组和其他自然病史研究。因此,通过适当对患者和治疗方法的选择,对于未破裂的AVMs子集,经过5 - 10年的随访,自然病史的风险可能超过干预的风险。然而,必须承认这些回顾性、观察性数据可能存在偏倚和混淆,因此有必要进行额外的前瞻性研究来进一步指导对未破裂的AVMs的正确处理。
根据现有的文献,对破裂的低至中级的AVM的干预治疗是经常进行的,而多模态的治疗偶尔被用于破裂的高级别的AVM。大多数未破裂的低级别AVMs患者可能受益于切除术,但应该由神经外科医生、神经介入科医生、血管神经科医生和放射肿瘤科医生组成的多学科团队作出决定。对于预期寿命至少为10年的中小型未破裂的中等级AVMs患者,以及对于医学上不适合手术或拒绝开颅的未破裂的低级别AVMs患者,SRS是一种合理的干预措施。虽然没有足够的证据支持栓塞作为未破裂的动静脉畸形的主要干预手段,但它在多种治疗方法中仍然具有重要的辅助作用。保守治疗通常是大多数未破裂的高级别AVM和大体积中等级别的AVM的首选,因为对这些病变的干预效果不佳。
来自正在进行的试验和观察性研究的数据可能进一步阐明AVM干预及其相关风险。脑AVMs治疗研究(TOBAS)自2015年开始招募,是一项随机对照试验,比较破裂或未破裂的AVMs的保守治疗和干预在导致残疾卒中或死亡的10年风险,并对随机试验以外的AVMs管理注册。TOBAS还包括一个嵌套的试验,评估栓塞在分配接受手术或放射治疗的病人中的作用。美国国立卫生研究院资助的MARS联盟正在调查未破裂的AVMs的长期结果和治疗风险。这些研究结果将为未来AVM临床试验提供重要的依据。
结论
![]()
这篇综述提供了一个对脑动静脉畸形自然病史,病理生物学,和管理策略的最新的,全面的讨论。目前可用的数据支持对大多数破裂的AVM进行干预,并适当选择未破裂的AVM。在每个患者的预期寿命和偏好的背景下,应仔细权衡现有治疗模式(单独或联合治疗)的获益风险和AVM预期自然史。开发AVM切除和SRS的分级量表有助于指导治疗决定。对未破裂的AVMs进行干预和保守治疗的前瞻性研究的评论限制了其在指导循证实践方面的影响。此外,还需要对采用现代治疗措施治疗未破裂的AVMs和保守治疗进行前瞻性比较试验。





