EDITORIALS
1.在危机中蕴藏着希望
In the midst of crisis, a great opportunity
Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1056–1057, https://doi.org/10.1093/neuonc/noaa143自从WHO在2020年3月11号宣布COVID-19大流行,国家开始限制非必要的手术、操作和门诊,节约个人防护用品,住院患者减少,戴口罩和保持距离已植入我们的日常生活。作为医疗工作者,我们迅速适应变化。COVID-19有神经系统并发症如脑血管事件增加,意识受损,神经肌肉障碍等。癌症患者严重感染的几率高,重症监测率高,死亡率高达28%。神经肿瘤学界迅速制定了共识,发表了如何治疗脑肿瘤患者的指导意见,很多人远程进行术前评估,查房时家属远程接入,远程进行临床试验知情同意,日常治疗和随访甚至紧急情况也远程进行。在本刊中,Wen等总结了目前对IDH野生型胶质母细胞瘤的治疗,这是美国和欧洲神经肿瘤学会(SNO和EANO)的共识。虽然这一领域有重要进展,但鲜有新的治疗亮点,分子分类目前尚没有带来像其他癌症一样的成功的靶向治疗。存在的挑战有:1.新诊断胶质母细胞瘤患者临床试验参与率低;2.血脑屏障和血肿瘤屏障限制;3.患者在对药物敏感性、耐药、肿瘤复发上的异质性;4.免疫机制复杂,需要在正确的时间使用正确的免疫相关治疗。爱因斯坦说过“在困难中存在机遇”。胶质母细胞瘤患者的治疗存在创新和进步的机会但需要我们改变思维和方法。我们需要问出能带来改变的问题。我们需要看到机遇。2.新诊断的老年胶质母细胞瘤:何时单用替莫唑胺化疗就足够了?Newly diagnosed glioblastoma in the elderly: when is temozolomide alone enough?
Aya Haggiagi, Andrew B LassmanNeuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1058–1059, https://doi.org/10.1093/neuonc/noaa136
近40年来,放疗(RT)一直是治疗新诊断的胶质母细胞瘤的重要方法。EORTC的试验证实放射治疗联合替莫唑胺可以延长胶质母细胞瘤患者的生存期。CCTG的试验是针对65岁以上的老年患者,该实验表明替莫唑胺联合大分割放疗的疗效优于单独应用大分割放疗。在GBM患者中,老年人占比较大,EORTC的试验排除了70岁以上的老年患者,其它研究证实老年患者应用放疗的相对收益随着年龄的增大而减小。所以,在老年GBM患者的治疗方案中是否可以考虑推迟或省略放疗呢?NOA-08试验的初期结果表明单独替莫唑胺治疗与标准放疗的疗效无差别;而长期随访结果扩展了之前的结论:MGMT启动子甲基化患者应用替莫唑胺剂量密度方案的总生存期是标准放射治疗的两倍;故老年GBM患者建议治疗方案是:先应用替莫唑胺,只有在确定MGMT启动子无甲基化的情况下才联合RT。结合目前COVID-19流行,老年患者在放疗过程中,会增加感染COVID-19的风险,此种方案相对更为安全。NOA-08试验认为替莫唑胺对MGMT启动子甲基化的老年肿瘤患者疗效较好,而CATNON试验表明替莫唑胺对IDH野生型肿瘤患者无效,两个实验结果存在的矛盾还需要深入研究。Receptor discordance in breast cancer brain metastases: when knowledge is power
Sarah Sammons, Amanda E D Van Swearingen, Carey K AndersNeuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1060–1061, https://doi.org/10.1093/neuonc/noaa131
Hulsbergen等人进行了目前规模最大的多中心研究,旨在比较脑转移瘤和非脑转移瘤的雌激素受体(ER)、孕酮受体(PR)和人表皮生长因子受体2(HER2)的状态。近半数患者在脑转移诊断时有颅外转移(58.9%)。这项分析的关键结果表明(i)36.3%的乳腺癌和脑转移病例的ER、PR或HER2表达不一致;(ii)22.8%的病例因受体改变而转换亚型;(iii)脑转移瘤中HER2表达增加更常见,而脑转移瘤中ER和PR的丢失更常见。在比较脑转移瘤和非脑转移瘤的受体状态时,不一致率为63.6%;而非脑转移瘤与原发性乳腺癌的受体一致性为59.1%。脑转移瘤中ER丢失预示生存率更差,而HER2的增加则显示出提高生存率的趋势。接受针对亚型的靶向治疗,尤其是HER2靶向治疗,可以改善患者预后。这一研究展现学术界了对颅内转移、颅外转移和原发性乳腺肿瘤之间的受体不一致性的新认识。同时为颅内肿瘤受体研究提供了临床可操作的重要信息,为个体患者提供了新的治疗方向。就在几年前,从脑转移瘤组织活检中获得的受体和/或分子信息可能还不具备可操作性。然而,现在受体状态和分子信息已经能够为治疗决策提供信息。如肿瘤学临床试验联盟(Alliance for Clinical Trials in Oncology)的“脑转移瘤基因组引导治疗试验”(NCT03994796)。该试验治疗分配是基于脑转移瘤本身的分子特征,并将患者分配至相应的靶向药物治疗。又如HER2阳性的晚期乳腺癌和脑转移,FDA已经批准了使用图卡替尼(一种HER2的脑渗透性小分子抑制剂)与卡培他滨和曲妥珠单抗联合治疗HER2阳性脑转移瘤的患者。脑转移组织中受体的不一致性涉及脑转移瘤中1/10的HER2增加。如果缺乏这方面的知识,符合条件的患者将可能失去使用有效的靶向药物治疗的机会。4.初诊胶质母细胞瘤患者的极低分割放疗:原理、剂量、技术与结局Extreme hypofractionation for newly diagnosed glioblastoma: rationale, dose, techniques, and outcomes
Rupesh Kotecha, Minesh P MehtaNeuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1062–1064, https://doi.org/10.1093/neuonc/noaa133
尽管在当前发布的前瞻性临床试验结果中,新发胶质母细胞瘤GBM患者的总生存期约16个月,但大型人群分析中位生存期仅为8.1个月,若行为期6周的标准放化疗,则会占据患者剩余时间的10-20%。因此研究人员提出利用立体定向放射外科行极低分割放疗。这种放疗方式以患者为中心,增加了患者及医护人员的便利性,提高患者治疗依从性及生活质量。同时,短期疗程放疗可能还具有减少肿瘤的放疗抵抗,并且削弱常规放疗引起的免疫抑制效应。在本期《Neuro-Oncology》中,Azoulay等报告了一项立体定向放射外科(SRS)的临床Ⅰ/Ⅱ期试验结果。该临床试验对新发的成人幕上胶质母细胞瘤患者行40Gy/5F的低分割立体定向放射外科,期间辅以替莫唑胺化疗。结果表明,患者无进展生存期为8.2(95%CI:4.6-10.5)个月,总生存期为14.8(95%CI:10.9-19.9)个月。8名患者仅出现轻度(1-2级)不良放疗反应,2名患者在40Gy出现剂量限制性毒性反应(4级与5级)。大部分患者在试验期间使用了贝伐单抗用于治疗疾病进展/假性进展、不良放疗反应。但研究结果表明,对于新发GBM患者,可耐受替莫唑胺联合40Gy/5F的放疗。在此项研究前,也有部分研究报道相关低分割放疗治疗胶质母细胞瘤的结果,但因各项研究中纳入患者数目较少,纳入排除标准不同,患者的治疗方式、肿瘤特征均不同,故无法直接比较各项研究间的生存结局,但低分割放疗需要注意两项关键点,即放疗靶区的勾画以及总分割放疗的疗程方案。放疗靶区勾画当前并无明确的专家共识,本研究仅勾画了病灶外5mm的扩展空间,笔者认为在当前T2Flair范围扩大切除GBM的积极手术策略下,应当适当扩张靶区的勾勒边缘,以延长患者的生存期与总生存期。放疗靶区边界的精准需在现今成像技术辅助下进行,以明确肿瘤复发风险最高的高灌注区域。在本试验中,研究人员对受试人员在一周内行40Gy/5F的放疗,患者耐受良好。使用单次高剂量的立体定向反射外科可降低放疗抵抗及淋巴细胞细胞减少的几率,但这种低分割大剂量放疗需要注意放射性坏死的产生,使用该种放疗方式应当同时联用贝伐单抗。以上即为低分割放疗的优势,未来该疗法可通过与免疫治疗相联用,有助于使患者获益,需要进一步大规模临床试验进行评估。5.青少年和年轻人的高级别胶质瘤与成人和儿童的组织分子差异High-grade gliomas in adolescents and young adults reveal histomolecular differences vis-à-vis their adult and pediatric counterparts
Maura Massimino, Felice GiangasperoNeuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1065–1067, https://doi.org/10.1093/neuonc/noaa135
青少年和年轻人(AYA)的恶性肿瘤对儿童肿瘤科医生提出了挑战,脑瘤因发病率,复杂性和预后而需要在AYA中进行重点治疗。高级别胶质瘤(HGG)就是这种复杂性的典型例子。小儿HGG在组织学上与成人HGG相似,但在生物学上不同。组蛋白基因(H3.3,H3.1)的突变在儿童HGG中占主导地位。根据WHO 2016分类标准,使用“常规技术”(即特异性抗体和标准测序程序)75%的病例中获得了综合诊断。全外显子组测序(WES)在所有情况下均证实了诊断,并通过检测6种H3/IDH野生型肿瘤的罕见突变来完善诊断。DNA甲基化图谱仅在一种情况下(1.2%)有用,它鉴定出标准技术无法检测到的HGNET-MN1。这表明,特定分子相关的形态学和特定抗体的免疫表型足以在大多数HGG中获得充分的组织学诊断。WES和DNA甲基化分析等更复杂的分子分析仅在少数特别复杂的情况下有用。AYA中分子亚组的分布(图1),表明“小儿型”组蛋白突变型肿瘤(40%)比“成人型”IDH突变型(27.5%)的患病率高。H3K27突变型神经胶质瘤的发病率在AYA中为26.3%,2例H3K27突变型弥漫性非中线神经胶质瘤的发生,凸显了在所有HGGs中常规筛查这些突变的重要性。H3G34突变型HGG(13.7%)为AYA患者中最典型的幕上半球恶性神经胶质瘤,平均年龄18岁(范围15-25),组织学特征从星形细胞瘤到胚胎样瘤。研究还证实了小儿HGG中分级的预后价值有限(WHO III级与IV级相比),并强调了年龄,表现状态,切除范围和综合分子分类作为最终预后的独立决定因素的作用。总之,在患有HGG的AYA中:1)病例分配和分层治疗应遵循临床和分子综合诊断;2)考虑到该年龄组儿童年龄中典型的组蛋白基因突变的比例,老年也不应阻止纳入儿童试验,3)满足前两个条件的唯一方法是将其强制纳入临床方案以改善AYA合并HGG的预后。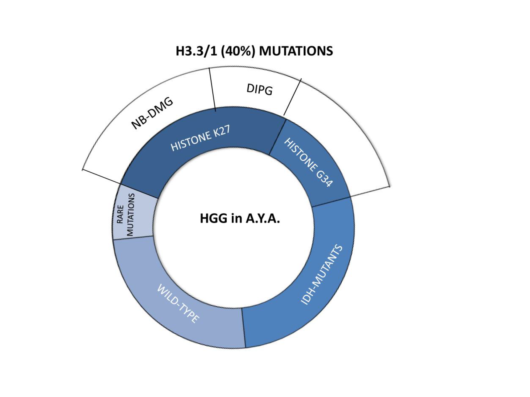
6.放射治疗儿童低级别胶质瘤:谁将受益?什么时候做才够早?Radiation for pediatric low-grade gliomas: who will benefit and how late is soon enough?
Bree R Eaton, Torunn I YockNeuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1068–1069, https://doi.org/10.1093/neuonc/noaa144
由于种种原因,放疗并不作为儿童LGG的主要治疗手段。Archarya等的文章已经确定高危儿童LGG患者可能受益于早期放疗。评价这篇文章时须考虑以下三点:1. 尽管儿童LGG患者的长期生存率总体上很好,但约有10%需要治疗的患者会在诊断后5年内死亡,了解儿童LGG患者危险分层的预后因素对确定最佳治疗策略至关重要;2. 原发肿瘤的进展是儿童LGG患者死亡的主要原因,所有死亡患儿中,丘脑/中脑是最常见的肿瘤位置。放疗通常用于通过进展(通常是多次)表现出侵袭性临床行为的肿瘤,Archarya等的文章提出早期放疗可能提高高危组的生存率。3. 放疗具有多重迟发风险,随着放疗技术的不断进步,迟发风险已大大降低,要平衡放疗的风险和原发肿瘤进展的风险。总之,Acharya等工作值得称赞,他们发现一组可能受益于早期放疗的生存率不高的高危儿童LGG患者。重要的是,风险分层是基于肿瘤病理和位置,比较容易应用于临床。【张韫泽】
REVIEWS
1.成人胶质母细胞瘤:美国神经肿瘤学会(SNO)和欧洲神经肿瘤学会(EANO)对目前治疗现状和未来方向的共识
Glioblastoma in adults: a Society for Neuro-Oncology (SNO) and European Society of Neuro-Oncology (EANO) consensus review on current management and future directions
Patrick Y Wen, Michael Weller, Eudocia Quant Lee, Brian M Alexander, Jill S Barnholtz-Sloan ...
Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1073–1113, https://doi.org/10.1093/neuonc/noaa106
本共识着重于占胶质母细胞瘤90-95%的预后更差、无IDH突变的IDHwt胶质母细胞瘤,讨论了近期胶质母细胞瘤治疗的进展,目前存在的挑战和将来研究的方向。
流行病学
胶质母细胞瘤的总发病率为3.22/10万人口,五年生存率仅为6.8%(图)。大约5%的胶质瘤为家族性,13%的胶质瘤患者有致病性的体细胞突变。
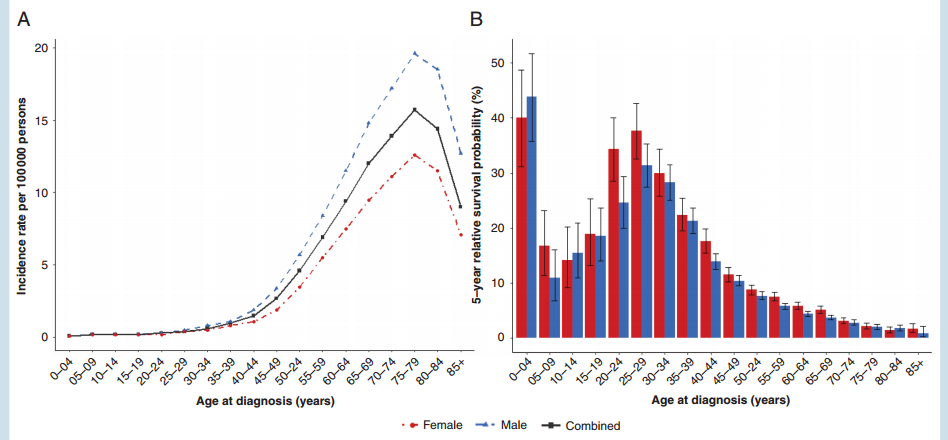
A.美国2012-2016年每十万人口分年龄和性别的发病率。B.美国2012-2016年间胶质母细胞瘤患者分年龄和性别的5年生存率。
生物学
胶质母细胞瘤根据基因表达和甲基化分为三个亚型:前神经元、经典型和间质型。三种类型均与TERT启动子突变相关。这些分子分型为研究提供了框架,但临床上其用处不明。胶质母细胞瘤患者的治疗效果并未因基因测序知识的增加而有所进展。
最近的研究还发现一些分子特征如ATRX突变导致端粒延长,FGF3-TACC3融合基因,H3F3A或HIST1H3B突变等。有10%接受过TMZ治疗的复发胶质母细胞瘤出现高突变负荷。染色体外DNA上的癌基因扩增可能是癌细胞的另一进展机制。肿瘤复发时较初次诊断80%的突变不变,而PDGFRA扩增,EGFR突变,EGFRvIII突变往往会变化。因此如果临床试验靶向的是常发生变化的突变,可能需要再次活检。
胶质母细胞瘤病理和分类
在无IDH突变的情况下,如果肿瘤有TERT启动子突变,或者7号染色体增加和10号染色体缺失,或者EGFR扩增,即使组织学上是WHO II级或者III级,临床预后也会和胶质母细胞瘤一样,应诊断为“弥漫性星形细胞肿瘤,IDH野生型,具有胶质母细胞瘤分子特征,WHO IV级”。由于IDH突变状态不同的IV级胶质瘤生物学和临床预后完全不同,cIMPACT-NOW共识组建议对IDH突变的肿瘤,不再用“胶质母细胞瘤”这个词,而使用“星形细胞瘤,IDH突变,WHO IV级”诊断。
标准治疗
手术的目标是尽可能全切增强的肿瘤。防止出现新的永久神经功能缺失比扩大切除范围更重要。
在最大程度切除后,一般采用放化疗同步然后TMZ维持化疗6个28天周期。MGMT启动子甲基化能预测TMZ疗效。TMZ维持化疗期间加用低强度中频(200kHz)交流电场治疗(TTF)能延长中位生存期4.9个月。增加TMZ剂量、延长TMZ治疗时间或者加用贝伐单抗都不能增加生存期。近期发现对MGMT启动子甲基化的新诊断胶质母细胞瘤,采用洛莫司汀联合TMZ放化疗,中位生存期由标准治疗的31.4个月延长到洛莫司汀-TMZ的48.1个月。
放疗:多采用60Gy分30次每次2Gy的方法照射术后MRI上选定的靶标。EORTC(欧洲癌症研究治疗组织)推荐不间断放疗60Gy每次2Gy。RTOG(癌症放疗协会)采用46Gy分23次每次2Gy照射FLAIR异常区域边缘外放2cm,并对术腔和残留增强肿瘤另加14Gy。
胶质母细胞瘤的患者使用VEGF抗体贝伐单抗不能延长生存期,但能有效减轻瘤周水肿和相关的临床症状。贝伐单抗还能有效治疗放射性坏死,但使用的剂量(7.5mg/kg每三周一次,最多给4次)比治疗肿瘤的剂量低。
胶质母细胞瘤的患者中位复发时间不足7个月,没有标准的挽救治疗方案。停用了TMZ一段时间后复发的患者可以再次TMZ化疗。也可使用硫脲类化疗药:洛莫司汀(CCNU)六疗程单药治疗中位生存期为7.1-8.6个月,无进展生存期为1.5-3个月。伊立替康、卡铂、甲基苄肼和依托泊苷有时也用于复发胶质母细胞瘤患者的化疗。
复发胶质母细胞瘤二次放疗多采用放射外科或低分割放疗(30-35Gy分5-15次)治疗。贝伐单抗加放疗较单贝伐单抗治疗能延长无进展生存期(联合治疗7.1月,单贝伐单抗3.8月),但总生存期没有改善。
新型治疗
靶向治疗(精准治疗):靶向治疗的临床试验尚无成功报道。有多个临床试验正在进行。靶标有EGFR扩增、EGFRvIII突变、BRAFV600E突变、NTRK融合基因,H3K27M突变,FGFR突变和FGFR3-TACC3融合基因等。对既往临床试验的分析发现,前神经元型胶质母细胞瘤可能对贝伐单抗敏感。CD95L启动子G2甲基化的患者采用靶向CD95的asunercept(APG101)有效。另外mTOR的Ser2448磷酸化和PTEN缺失能预测mTOR靶向药物的疗效。
靶向DNA损伤应答通路:放疗和细胞毒性药物主要使DNA双链断裂,目前发现单链断裂也是重要的抗瘤机制。但PARP抑制剂与损伤DNA的化疗药联用可能会引起骨髓抑制。
靶向肿瘤代谢:PINK1(PTEN induced kinase 1)和HK2(hexokinase 2)与肿瘤中无氧糖酵解有关,在临床前模型中靶向这两者能抑制肿瘤。另外在EGFR信号通路激活的肿瘤中胆固醇摄取增高。
免疫治疗:与其他固体肿瘤不同,胶质母细胞瘤的免疫治疗没有获得进展。靶向TGF-β、集落刺激因子抑制剂、疫苗、免疫检查点阻断PD1抗体均未获成功。溶瘤病毒、立体定向放射外科、激光毁损、局部化疗、手术之前给抗PD1治疗都是潜在的克服胶质母细胞瘤免疫抑制性的方法。CAR T细胞治疗胶质母细胞瘤的结果目前普遍不佳,今后努力方向主要在多靶点CAR T,力求使其免疫表型扩散,联合使用免疫检查点抑制剂或放疗,或者直接将其注射进肿瘤。
病毒治疗:溶瘤病毒能使肿瘤坏死,然后通过释放肿瘤抗原诱导继发的抗肿瘤固有免疫和调节免疫。在胶质母细胞瘤中有几个I期临床试验正在进行。然而Toca511的三期临床试验中患者生存期没有延长,另一个靶向肿瘤内皮细胞的病毒试验VB-111也未见明显疗效。
其他:细胞毒性药物Val083,BAL101553,以及增加TMZ活性的药物ibudilast正在临床试验中。
总结
胶质母细胞瘤分子生物学上的进展还没有带来明显的患者预后改善。已经发现了重要的治疗方法并正往临床转化。除了发现新疗法的科学基础,我们还需要改进临床试验的效率,希望能够为胶质母细胞瘤患者带来更有效的治疗。
【林毅】
BASIC AND TRANSLATIONAL INVESTIGATIONS
1.BRD4可作为无功能和生长激素垂体腺瘤的治疗靶点
BRD4 as a therapeutic target for nonfunctioning and growth hormone pituitary adenoma
Chengzhang Shi, Zhao Ye, Jie Han, Xiaoqing Ye, Wenchao Lu ...Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1114–1125, https://doi.org/10.1093/neuonc/noaa084
无功能垂体腺瘤和生长激素垂体腺瘤是垂体腺瘤的主要亚型。目前的主要治疗方法是手术切除。根治性切除仍然具有挑战性,且缺乏有效的药物治疗手段,迫切寻找新的药物治疗靶点。溴域结合蛋白4(BRD4)是一种表观遗传调控因子,可激活癌基因的异常转录。本文中,作者研究了BRD4的病理作用,并评估了BRD4抑制剂在治疗无功能垂体腺瘤和生长激素垂体腺瘤中的有效性。作者在无功能垂体腺瘤和生长激素垂体腺瘤及正常垂体组织中检测到BRD4的表达。同时在GH3和MMQ细胞系、患者源性肿瘤细胞和体内小鼠移植瘤模型中评估了BRD4抑制剂的治疗效果。通过WB、PCR和流式细胞术实验研究BRD4是通过对细胞周期和下游基因表达模式影响到肿瘤的进展和凋亡。IHC研究显示BRD4在无功能垂体腺瘤和生长激素垂体腺瘤中过表达。体外和体内研究表明,BRD4抑制剂ZBC-260显著抑制了垂体腺瘤细胞的增殖。进一步的机制研究显示ZBC-260可下调垂体肿瘤发生的重要因子c-Myc、Bcl2及其相关基因的表达。在本研究中,作者检测了BRD4在无功能垂体腺瘤和生长激素垂体腺瘤中的表达,并在体内外评估了BRD4抑制剂对垂体腺瘤细胞的影响。研究结果表明BRD4对无功能垂体腺瘤和生长激素垂体腺瘤是一个有治疗前途的分子靶点。这是首次探索靶向BRD4治疗垂体腺瘤潜力的研究。BRD4抑制剂ZBC-260对BRD4基因的抑制和药理抑制都显著降低了无功能垂体腺瘤和生长激素垂体腺瘤细胞的增殖。这为BRD4抑制剂在未来的发展提供了强有力的理论基础。Long-term clinically relevant rodent model of methotrexate-induced cognitive impairment
Connor Berlin, Katharine Lange, H Carl Lekaye, Kelsey Hopland, Samantha Phillips ...Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1126–1137, https://doi.org/10.1093/neuonc/noaa086
化疗有效提高了癌症患者的总生存时间,但是在化疗后的几年里,多数患者也会随之出现化疗相关的神经功能障碍。甲氨蝶呤(MTX)是多种肿瘤,尤其是血液系统肿瘤化疗方案的主要成分。此前,关于MTX相关的脑灰质损伤已经在动物模型得到了验证,本文作者使用大剂量甲氨蝶呤和亚叶酸钙解救治疗来建立认知损害的动物模型,通过体视学、行为学和扩散张量成像(DTI)来评估全身大剂量MTX对体内白质细胞的长期影响。作者首先通过体视学的方法对胼胝体中表达Olig2的细胞进行计数,发现MTX可以导致脑白质的长期破坏,并且可以抑制小胶质细胞的生长,此外,作者还通过体视学实验发现MTX对海马体的神经发生有长期抑制过程。而行为学实验也再次证实了MTX对认知功能的负面影响,本文使用新的物体识别来评估注意力和短期记忆,发现与对照组大鼠相比,在16个月时,甲氨蝶呤大鼠不再能够区分新的和熟悉的物体。表明MTX化疗所致的认知功能障碍是持续性的,DTI成像还证实了脑白质束的损害,显示了MTX损害的新的脑区。以上结果均表明MTX化疗会导致神经系统认知功能的长期损害。3.利用人脑类器官和单细胞转录组学模拟胶质母细胞瘤侵袭的模型Modeling glioblastoma invasion using human brain organoids and single-cell transcriptomics
Teresa G Krieger, Stephan M Tirier, Jeongbin Park, Katharina Jechow, Tanja Eisemann ...Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1138–1149, https://doi.org/10.1093/neuonc/noaa091
胶质母细胞瘤(GBM)恶性程度高,具有很高的侵袭性,其治疗受到肿瘤异质性以及包括放化疗抵抗在内等其他因素的限制。为了解决这些问题,作者建立了一种利用人脑类器官作为骨架的研究GBM细胞侵袭的实验模型,通过将组织透明技术与单细胞测序技术结合,研究GBM细胞与类器官共培养前后的变化。首先证实与乳腺癌细胞系和神经母细胞瘤细胞系相比,多能诱导干细胞来源的人脑类器官为GBM细胞的侵袭提供了骨架,接着,通过半自动处理图像技术发现在GBM细胞在类器官中的肿瘤微管形成与其体内的侵袭行为是一致的。作者将没有与GBM细胞共培养前的类器官、不同患者来源的GBM细胞以及与类器官共培养后的GBM细胞进行单细胞测序分析发现与类器官共培养前后的GBM细胞在转录水平存在差异,不同患者来源的GBM细胞与类器官共培养之后,均有45个基因表达水平上调。同时作者还筛选了GBM细胞与类器官之间潜在的受体-配体相互作用,提示了新的功能性治疗靶点。以上结果显示,人脑类器官共培养模型可以在体外很好的模拟GBM细胞的侵袭途径,可以考虑应用于临床药物的筛选。4.利用PDGF-AA和P53-无功能神经祖细胞对GBM启动进行体外建模In vitro modeling of glioblastoma initiation using PDGF-AA and p53-null neural progenitors
Alexandra K Bohm, Jessica DePetro, Carmen E Binding, Amanda Gerber, Nicholas Chahley ...Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1150–1161, https://doi.org/10.1093/neuonc/noaa093
异柠檬酸脱氢酶(IDH)野生型GBM基因组结构常见于老年人,由特异的染色体缺失、倍增造成。尽管对这些和其他分子改变的越来越详细的描述,以及不断深入的了解受这些变影响的过程,但对这类患者的预后变化不大。为了探索和了解其起源,利用TCGA进行了分析多个组的其他基因组数据已经确定7号染色体的倍增是一个IDH野生型GBM起始的早期事件。基于这些分析,小泽等人进一步假设当伴有p53、CDKN2A或染色体10丢失时PDGF-AA在7p22.3处的过度表达引发野生型GBM。作者使用比较成熟的方法建立神经干细胞培养,研究了PDGF-AA对室下区(SVZ)细胞的影响。他们显微解剖p53纯小鼠和野生型成年小鼠中SVZ组织,在添加PDGF-AA的培养基中培养细胞,并评估细胞活力、增殖、基因组稳定性和致瘤性。作者观察到突然和大量的细胞PDGF-AA中的死亡,违反了它作为生长因子的典型作用,观察到p53野生型细胞不存活,而一小部分p53无功能细胞逃避凋亡,存活,表现出弱增殖,伴随着全染色体的得失。在PDGF-AA大约100天后,细胞突然快速增殖,获得生长因子独立性,并在免疫缺陷小鼠中成为致瘤性。转化细胞具有少突胶质细胞前体样谱系标记谱,对PDGFR-α抑制具有抗性,并具有与人类GBM高度相似的异常核型。
CLINICAL INVESTIGATIONS
1.替莫唑胺优于放疗——针对MGMT启动子与RTKⅡ甲基化的老年恶性星形细胞肿瘤患者
Superiority of temozolomide over radiotherapy for elderly patients with RTK II methylation class, MGMT promoter methylated malignant astrocytoma
Antje Wick, Tobias Kessler, Michael Platten, Christoph Meisner, Michael Bamberg ...Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1162–1172, https://doi.org/10.1093/neuonc/noaa033
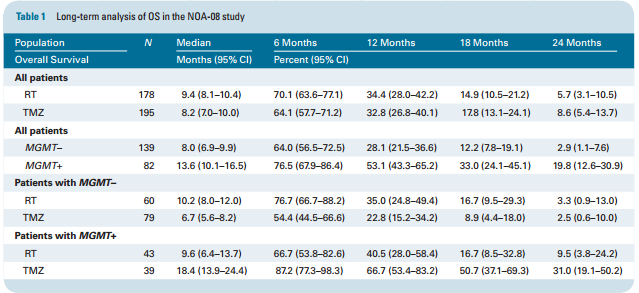
德国癌症协会神经肿瘤工作小组(NOA)重新分析了NOA-08(01502241)试验结果:65岁以上老年恶性星形细胞肿瘤患者分别进行放疗(RT,n=176)或替莫唑胺7/14剂量密度方案治疗(TMZ,n=193),比较两种治疗方案的长期疗效和安全性。研究人员对其中104名患者的DNA甲基化状态和拷贝数变化与在海德堡大学医院接受RT+TMZ治疗的188名病例进行比较研究。在NOA-08队列中,替莫唑胺组与放疗组总生存期分别为8.2月和9.4月、无症状生存期分别为3.4月与4.6月,两组间无明显差异;MGMT甲基化患者,替莫唑胺组(总生存期与无症状生存期分别为18.4月与8.5月)明显优于放疗组(9.6月与4.8月)(附表1)。在MGMT启动子甲基化的胶质母细胞瘤患者中,RTKⅡ亚组TMZ单药治疗具有良好的长期疗效,而在RTKⅠ亚组和间充质亚组均未能得到相应结果。因此,MGMT启动子甲基化可以作为强有力的预测性生物标志物指导胶质母细胞瘤RT与TMZ治疗方案的选择;其中RTKⅡ亚组可以从替莫唑胺单药治疗中获益。
Subtype switching in breast cancer brain metastases: a multicenter analysis
Alexander F C Hulsbergen, An Claes, Vasileios K Kavouridis, Ali Ansaripour, Claudine Nogarede ...Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1173–1181, https://doi.org/10.1093/neuonc/noaa013
乳腺癌脑转移(BM)可与原发性乳腺癌(BC)的受体表达不一致。BM在遗传和表型水平上与原发肿瘤不同。虽然以往报道已经指出BCBM可能具有不一致的雌激素、孕酮或HER2表达,但先前的研究受到样本量的限制,目前尚不清楚哪些患者可能会出现临床相关的亚型转换。Hulsbergen等人进行了目前规模最大的多中心研究,目的在于揭示原发性乳腺癌和脑转移瘤患者中ER、PR和HER2的表达。主要目的是探索受体表达不一致的发生率和由此产生的亚型转换。第二个目标是对受体表达不一致患者进行预后风险预测,比较颅内外受体的表达情况差异。作者回顾了来自于四家三级医院的接受过脑转移瘤切除或活检的乳腺癌脑转移患者的临床数据。首先对手术病理报告进行回顾性评估,以确定原发肿瘤与BCBM之间的不一致性。在不一致的病例中,还评估了颅外转移瘤的表达。结果表明,在219名脑转移瘤患者中,受体表达不一致的发生率为36.3%;雌激素受体不一致率为16.7%,孕酮为25.2%,HER2为10.4%。雌激素和黄体酮一起被用于评估患者激素状态,因此有50名(22.8%)的患者出现了亚型转换,其中20名是HER2转换。而不同基线亚型能够用于预测发生亚型转换的风险,如高达37.5%的原发性HR+患者发生转换。此外,14.8%初期HER2阴性的患者在发生颅内转移后获得HER2表达。绝大多数(63.6%)BM患者其原发灶与颅外亚型也不一致。受体表达缺失通常与较差的生存率相关,这可能是由雌激素缺失引起(OR=1.80,P=0.03)。获得HER2状态的患者(n=8)的生存率无明显改善趋势(OR=0.64,P=0.17)。在这项多中心研究中,该研究报告了亚型转换的发生率和预测因子,其风险因基线亚型的不同而有很大的差异。亚型转换对预后和治疗选择有重要的临床意义。Hulsbergen等人提供的数据继续建立在学术界对乳腺癌脑转移生物学和中枢神经系统时空变化积累知识的基础之上。未来仍然需要研发有效的、非侵入性方法(例如通过脑脊液检测循环肿瘤DNA或新的成像技术)来帮助我们了解脑转移瘤的分子特征,从而为患者提供最佳的治疗方案,同时将风险降到最低。3.新发胶质母细胞瘤患者行病灶边缘5mm的5次立体定向放射外科辅以替莫唑胺化疗的临床Ⅰ/Ⅱ期试验:主要结局A phase I/II trial of 5-fraction stereotactic radiosurgery with 5-mm margins with concurrent temozolomide in newly diagnosed glioblastoma: primary outcomes
Melissa Azoulay, Steven D Chang, Iris C Gibbs, Steven L Hancock, Erqi L Pollom ...Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1182–1189, https://doi.org/10.1093/neuonc/noaa019
目前针对胶质母细胞瘤(GBM)患者的标准疗法为术后行60Gy/30F的放疗的同时,使用替莫唑胺(TMZ)化疗和/或电场治疗。GBM患者预后差,中位生存期仅21个月,五年生存率为13%。考虑到放疗疗程较长(约6周),研究人员希望增大单次放疗剂量(低分割放疗),通过缩短放疗时间,以改善患者生活质量及预后。本研究为前瞻性剂量递增试验,旨在确定新发GBM患者术后联合替莫唑胺化疗时,使用以病灶边缘5mm勾画靶区,行5次立体定向放射外科(SRS)的最大耐受剂量(MTD)。本研究共纳入30例初发成人GBM患者,接受5天的立体定向放疗,放疗递增剂量水平为25,30,35和40Gy,观察患者的不良放疗反应(ARE)及剂量限制性毒性(DLT)。结果表明,患者无进展生存期为8.2(95%CI:4.6-10.5)个月,总生存期为14.8(95%CI:10.9-19.9)个月。8名患者仅出现轻度(1-2级)不良放疗反应,2名患者在40Gy出现剂量限制性毒性反应(4级与5级)。大部分患者(26,86%)在试验期间使用了贝伐单抗用于治疗疾病进展/假性进展、不良放疗反应。作者认为,相较于未发生不良反应患者,出现ARE患者总生存期无明显统计学差异(P=0.08)。因此,作者认为对于新发GBM患者可耐受TMZ联合40Gy/5F的放疗。【黄麒霖】
PEDIATRIC NEURO-ONCOLOGY
1.青少年和年轻人中的高级别神经胶质瘤突出显示了与成人和儿童对应组的组织分子差异
High-grade gliomas in adolescents and young adults highlight histomolecular differences from their adult and pediatric counterparts
Alexandre Roux, Johan Pallud, Raphaël Saffroy, Myriam Edjlali-Goujon, Marie-Anne Debily ...
Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1190–1202, https://doi.org/10.1093/neuonc/noaa024
考虑到儿童高级神经胶质瘤(HGGs)在生物学上与成人神经胶质瘤不同,因此本研究的目的是确定青少年和青年人(AYAs)中HGGs的概况。
我们对来自法兰西岛大区成人和儿童神经外科1998年至2013年之间的112例AYA进行了多中心回顾性研究,以分析其临床放射学和组织分子学特征。纳入标准为年龄在15至25岁之间,组织病理学HGG诊断,可获得的临床数据,术前和随访MRI。MRI和肿瘤标本被集中审核。根据2016 WHO分类标准,进行了免疫组织化学和辅助分子技术,例如靶向/下一代测序,全外显子组测序和DNA甲基化分析,以实现综合诊断。
基于80名有记录的AYA患者,HGGs构成了多种不同的临床病理和分子组,主要表现为儿童亚型(组蛋白H3突变体,占40%),但也有成人亚型(IDH突变体,占28%),其特征是罕见少突胶质细胞瘤,IDH突变和1p/19q共同缺失,“罕见的成人IDH突变”的发生频率相对较高(20%)。H3G34突变体(占14%)代表了AYA中最独特的亚组。与儿童相反,在H3K27突变亚组中,非脑干弥漫性中线神经胶质瘤比弥散性桥脑神经胶质瘤(23.8%)更常见(66.7%)。我们发现WHO分级没有预后价值,但分子亚组具有重要的预后价值。
AYA中的HGG可以受益于特定的分类,这是由分子亚型而非年龄组决定的。儿童和成人神经肿瘤学团队需要共同努力,以改善AYA患者中HGG的管理。
【杨涛】
2.放射治疗儿童低级别胶质瘤和胶质神经细胞瘤的危险分层:临床病理和分子学的综合分析
Risk stratification in pediatric low-grade glioma and glioneuronal tumor treated with radiation therapy: an integrated clinicopathologic and molecular analysis
Sahaja Acharya, Jo-Fen Liu, Ruth G Tatevossian, Jason Chiang, Ibrahim Qaddoumi ...
Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1203–1213, https://doi.org/10.1093/neuonc/noaa031
目前尚无明确的指标来指导不能切除的儿童低级别胶质瘤和胶质神经细胞瘤(LGG/LGGNT)的放射治疗(RT),这些肿瘤的最佳治疗是有争议的。我们通过分析一组在圣犹大儿童研究医院(St. Jude)接受统一RT的儿童LGG/LGGNT患者的临床资料、临床病理和分子特征,采用递归分区分析(RPA)根据总生存率(OS)将患者分成高危和低危组,高危组包括弥漫性星形细胞瘤或位于丘脑/中脑的肿瘤,低危组肿瘤包括位于丘脑/中脑外的毛细胞星形细胞瘤/神经节胶质瘤,高低危组10年OS分别为76.4%和95.6%,在已知BRAF状态的亚组(n=49)中,风险分层与BRAF改变(V600E或融合)无关。在高危组中,延迟RT与总生存率较低相关(p=0.021)。高危组长期生存率不佳,可能受益于早期RT,该结果需要更多的研究进一步验证。
【张韫泽】
3.脑室内注射自体培养NK细胞治疗儿童复发髓母细胞瘤/室管膜瘤的I期研究
Phase I study of intraventricular infusions of autologous ex vivo expanded NK cells in children with recurrent medulloblastoma and ependymoma
Soumen Khatua, Laurence J N Cooper, David I Sandberg, Leena Ketonen, Jason M Johnson ...
Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1214–1225, https://doi.org/10.1093/neuonc/noaa047
复发性髓母细胞瘤和室管膜瘤的儿童预后仍然很差。迫切需要一种疗法,在没有全身毒性的情况下,治疗该疾病。此研究评估这些未满足的临床需求,通过进行第一期人类阶段自体、体外扩增NK细胞脑室内输注的研究。这是第一个应用放射工具从接受免疫治疗儿童的临床放射影像中挖掘数据。此研究表明有必要重新评估心室的频率输注NK细胞,从而纳入更长的随访期,并评估的使用情况放射组学促进下一代NK细胞试验的临床决策。
12名患者接受了治疗,9名接受了治疗,每周3次,从3×106不断增加的剂量至3×108NK细胞/m²输液,最多3个周期。检测脑脊液中NK细胞的细胞轮廓、持久性和表型分析。对7例患者进行了前处理MRI扫描的放射学特征,以建立一个基于无创成像的印象。在所有均获得脑室内NK细胞输注9例患者中,获得112个的NK细胞收获、扩增、释放和安全的数据。没有毒性反应。所有患者均表现为疾病进展(PD),除1例患者在研究结束时随访一个月表现为稳定(SD)。另一个病人脑室内肿瘤5次输注NK细胞出现短暂的放疗反应,后进展为PD的反应。在较高剂量水平,在重复输注治疗期间,脑脊液中NK细胞增加(平均11.6倍)。频繁输注NK细胞导致脑脊液多细胞增多。描述了7名患者放射特征,评估了预测前期放射学变化的能力,尽管没有达到统计学意义。
LETTERS TO THE EDITOR
1.5-札西替丁治疗IDH突变型复发胶质瘤
5-Azacitidine in patients with IDH1/2-mutant recurrent glioma
Laetitia Federici, Laurent Capelle, Maxime Annereau, Franck Bielle, Christophe Willekens ...
Neuro-Oncology, Volume 22, Issue 8, August 2020, Pages 1226–1228, https://doi.org/10.1093/neuonc/noaa074
异柠檬酸脱氢酶基因(IDH1或IDH2)在大约在40%的胶质瘤中被发现,虽然IDH1/2突变与良好结果有关,但是患者复发后却很少有二线治疗。推测IDH1/2突变胶质瘤患者可能受益于DNA甲基转移酶(DNMT)抑制剂治疗。在IDH1/2突变胶质瘤临床前模型中,DNM T抑制剂降低参与胶质分化基因启动子位点的DNA甲基化并抑制肿瘤生长。5-札西替丁是一种DNMT抑制剂目前批准用于治疗高危骨髓增生异常综合征(MDS)和急性髓系白血病(AML)。
12例患者参加了临床试验,接受6个周期的5札西替丁(范围1-27)治疗,治疗强度为常规的一半(范围75-100)。三例(25%)患者同时接受贝伐单抗(10mg/kgQ2W)。最常见的导致剂量减少的不良事件是9例(75%)患者的3-4级中性粒细胞减少,其中7例在接下来的周期中同时接受G-CSF注射。最后一次随访(中位持续时间20.0个月,范围1.2-33.3),所有12例患者均有进展。没有病人有放射反应。5人(41.7%)患有疾病稳定作为最佳反应,其中两人(16.7%)的疾病稳定超过18个月。虽然临床前数据表明IDH1/2突变胶质瘤患者可能受益于DNMT抑制剂,作者观察到大肿瘤和快速进展的患者有较短的PFS和OS。相对缓慢生长的肿瘤可能是更好的候选治疗5-札西替丁。
【王焕宇】