提示
“浙二神外周刊”不定期接收外院投稿,审核后发表。欢迎各专业同道联系我们,分享精彩病例、研究热点或前沿资讯。投稿请联系:shishi74@163.com
前言
浙医二院神经外科神经内镜工作由上世纪九十年代科室创始人之一的陶祥洛教授及刘伟国教授首先开展,是国内较早开展神经内镜工作的单位之一。目前亚专科由吴群主任医师牵头,以及洪远主任医师和闫伟副主任医师为骨干的团队,主要从事以颅底内镜为主的神经内镜工作。团队骨干都有包括匹茨堡大学及UCLA等国外进修学习的经历,经过十余年的发展,积累了较丰富的经验,取得了丰硕成果。自257期开始系列报道科室神经内镜亚专业组的相关病例,与同道共享。
病史简介
患者,女性,24岁,因“停经溢乳10月,复发两月”收住浙医二院内分泌科。
患者10月前停止哺乳1年后发现月经推迟20天。伴皮肤毛发增粗,面部出现痤疮,颈部、腋部、腹股沟皮肤黑色增厚粗糙,呈小乳头状。无出汗、心悸,无夜尿增多,无高血压,无骨质疏松。至本地医院就诊,查泌乳素456.00mlU/L,垂体MRI提示:垂体左侧微腺瘤;妇科B超:子宫内膜回声不均,双侧卵巢多囊样改变。予溴隐亭1片/日治疗,停经溢乳症状逐渐消失。5月前复查泌乳素76.00mlU/L,改溴隐亭为0.5片/日。两月前患者再次出现月经推迟,饮水量增多,食量增大,夜尿增多,出汗多、心悸,尿频尿急。无血尿、泡沫尿,查泌乳素359.78mlU/L。为进一步治疗,半月余前来浙医二院内分泌门诊,查胰岛素(空腹-餐后2小时)275.9-1543.9pmol/L;葡萄糖(空腹-餐后2小时)5.88-9.68mmol/L;糖化血红蛋白A1c6.9%。
门诊拟“1.垂体瘤;2.月经紊乱:多囊卵巢综合征;3.高泌乳素血症;4.糖耐量异常”收住入院。患者起病来神志清,精神可,胃纳睡眠可,大便无异常,小便如上述,近两月体重下降5kg。既往体健,无高血压、糖尿病、心脏病等基础疾病。
诊治经过
患者入院查体:体重指数(BMI)35.81kg/㎡,神清,精神可,面部散在红色丘疹及色素沉着斑,皮肤汗毛粗,颈部、腋部、腹股沟皮肤黑色增厚粗糙,呈小乳头状,视野粗测无明显异常,甲状腺无明显肿大,双侧乳房对称,心肺无殊,下肢无水肿
入院后完善相关辅助检查:促肾上腺皮质激素(8:00-16:00-24:00):146.2pg/ml↑-88.0pg/ml-99.9pg/mL、(2020-06-30)血皮质醇(8:00-16:00-24:00):574.8nmol/L-393.4nmol/L-397.1nmol/L;24h尿游离皮质醇:24小时尿量1800ml/24h↑、24小时尿游离皮质醇>2724.7nmol/24h↑。进一步完善小剂量地塞米松抑制试验:不能抑制;大剂量地塞米松抑制试验:可抑制。血生化检查:葡萄糖(餐后2h):11.68mmol/L↑;谷丙转氨酶56U/L↑、谷草转氨酶20U/L;钾3.47mmol/L↓;糖化血红蛋白:糖化血红蛋白A1c6.8%↑。甲状旁腺激素:甲状旁腺激素PTH94.65pg/mL↑;渗透压检查:尿渗透压767.00mOsm/(kg·H₂O)、血渗透压312.00mOsm/(kg·H₂O)↑;凝血谱:凝血酶原时间11.8s↓、国际标准化比率0.89↓、抗凝血酶-III124.0%↑。GH、TSH、游离T4、泌乳素等结果均正常范围内。视力视野无殊。
B超:右侧甲状腺结节TI-RADS 4a类,左侧甲状腺未见明显异常,脂肪肝。胸部高分辨率CT:右肺上叶尖段磨玻璃结节,考虑AAH。妇科B超:子宫内膜回声不均,双侧卵巢多囊样改变。肾上腺CT增强扫描:双侧肾上腺CT扫描未见异常。盆腔磁共振:双侧卵巢多囊样改变,多囊卵巢综合症不除外,宫颈多发小囊肿。垂体增强磁共振(图1)提示:垂体腺显示清,左缘局部膨隆,上下径为9.8mm。垂体腺信号不均匀,于垂体左缘见类圆形稍高信号灶;增强后扫描,垂体强化不均匀,垂体左缘见7*7*5mm(前后*左右*上下)大小类圆形低信号。垂体上方低信号影,垂体柄向右稍偏移。影像诊断考虑:垂体微腺瘤,部分空泡蝶鞍。
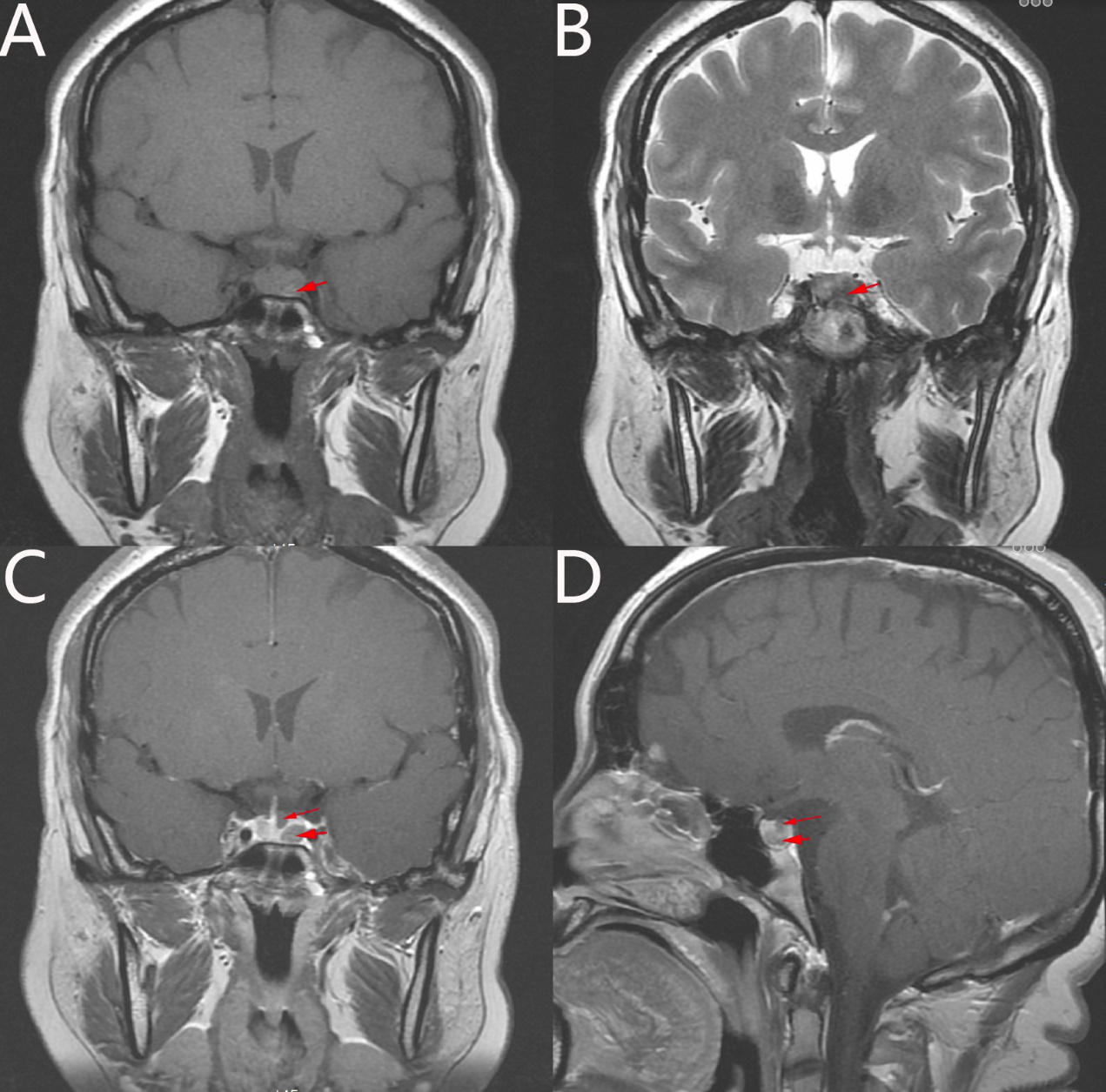
图1. 术前垂体增强磁共振。T1冠状位(A)及T2冠状位(B)扫描提示垂体左缘异常信号(粗箭头);增强磁共振冠状位(C)扫描可见左侧空泡蝶鞍(细箭头)、垂体柄略向右偏移,以及垂体左缘7*7*5mm(前后*左右*上下)低信号病灶(粗箭头);增强磁共振矢状位(D)提示垂体上方空泡蝶鞍(细箭头)及下方低信号病灶(粗箭头)。
结合以上结果,修订诊断为:1.垂体瘤、库欣病首先考虑,高泌乳素血症;2.糖尿病;3.脂肪肝;4.右侧甲状腺结节;5.右肺磨玻璃结节;6.多囊卵巢。患者遂转入神经外科。
患者转入神经外科后完善相关术前准备。科室讨论认为:根据患者临床症状、辅助检查及影像学表现,首先考虑垂体ACTH腺瘤;术前检查未见明显手术禁忌,患者及家属手术意愿强烈,有探查并肿瘤切除指证:决定行内镜下经鼻蝶肿瘤切除术。手术关键点在于:对肿瘤进行假包膜外切除,力争整块(En bloc)切除,以达到生化缓解目标,同时避免脑脊液鼻漏。
手术经过
患者全麻达成后,取仰卧位。鼻腔填塞肾上腺素棉片收缩粘膜。鼻腔周围PVP-I消毒,铺巾。再次鼻腔内消毒,肾上腺素棉片收缩粘膜。内镜下见明确双侧蝶窦开口,剥离周边粘膜、显露蝶窦前壁。磨钻磨开蝶窦前壁,剥离蝶窦粘膜。磨钻及鞍底咬钳充分打开鞍底骨窗,尤其向左侧显露至海绵窦内侧壁。海绵间窦出血使用流体明胶止血。小心切开鞍底硬膜,分离垂体包膜与鞍底硬膜粘连,即可见黄白色肿瘤组织。仔细辨认肿瘤假包膜,先剥离肿瘤前方垂体包膜,尽可能显露肿瘤前下全貌;再小心地环形分离肿瘤假包膜外间隙,直至瘤体与周围组织完全分离。探查术腔各部位,可见垂体前叶、后叶及鞍膈完整,未见肿瘤残留。鞍底重建。(手术简要过程参见图2)
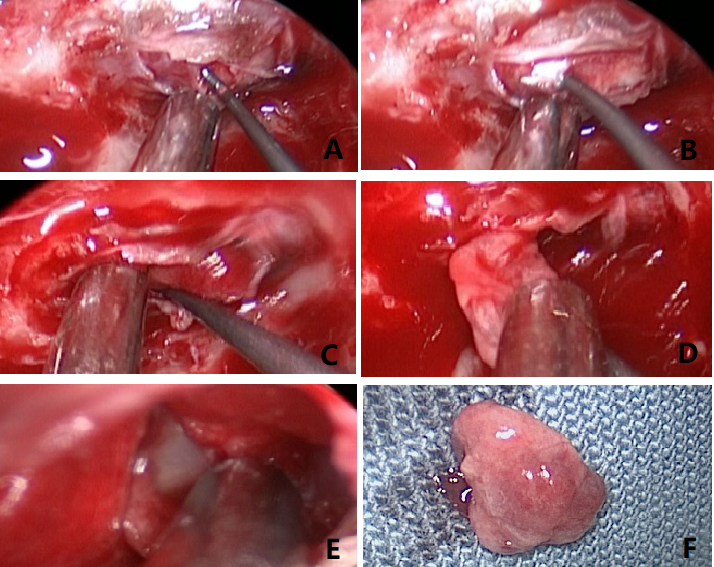
图2. 术中所见。A:剪开鞍底硬膜即可见肿瘤组织;B:剥离肿瘤前方的垂体包膜;C:沿肿瘤假包膜外分离;D:肿瘤被完整剥离;E:探查术腔,未见肿瘤残留,垂体及鞍膈保存完好;F:被整块剥离下来的肿瘤组织。
术后予抗炎、补液治疗,密观患者生命体征。患者无尿崩,无脑脊液漏;复查甲状腺激素、性激素、生长激素皆正常范围内。术后第一天查早八点皮质醇为10nmol/L(即0.4ug/dl),达到内分泌缓解标准。患者出现乏力、心慌等不适,考虑为皮质功能低下所致,符合库欣病术后内分泌缓解表现,予补充氢化可的松;并予出院后继续口服氢化可的松片,复查皮质醇及ACTH(图3),激素逐渐调整至正常范围。
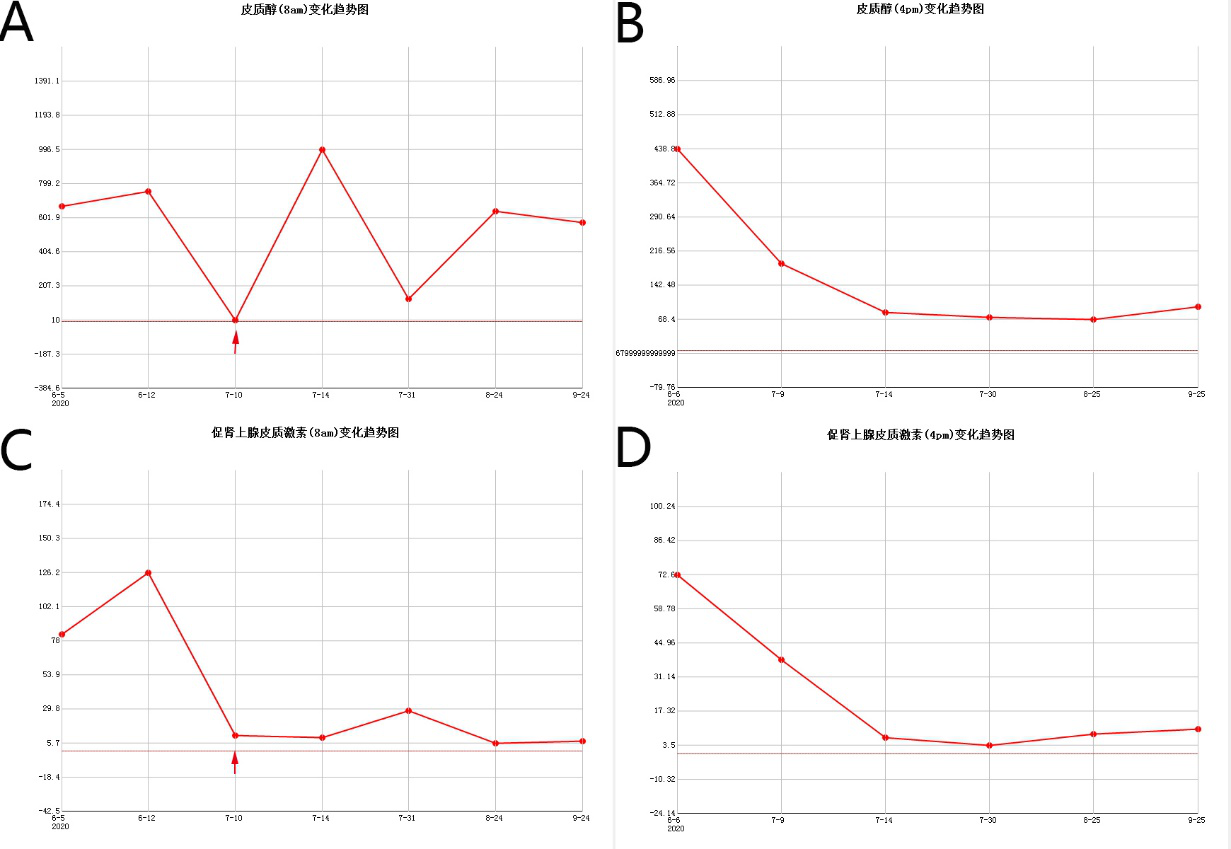
图3. 术后皮质醇及ACTH随访情况。其中7月10日为术后第一天,可见8am皮质醇(A)及ACTH(C)已达到生化缓解标准;术后予氢化可的松调整后,皮质醇恢复正常水平。
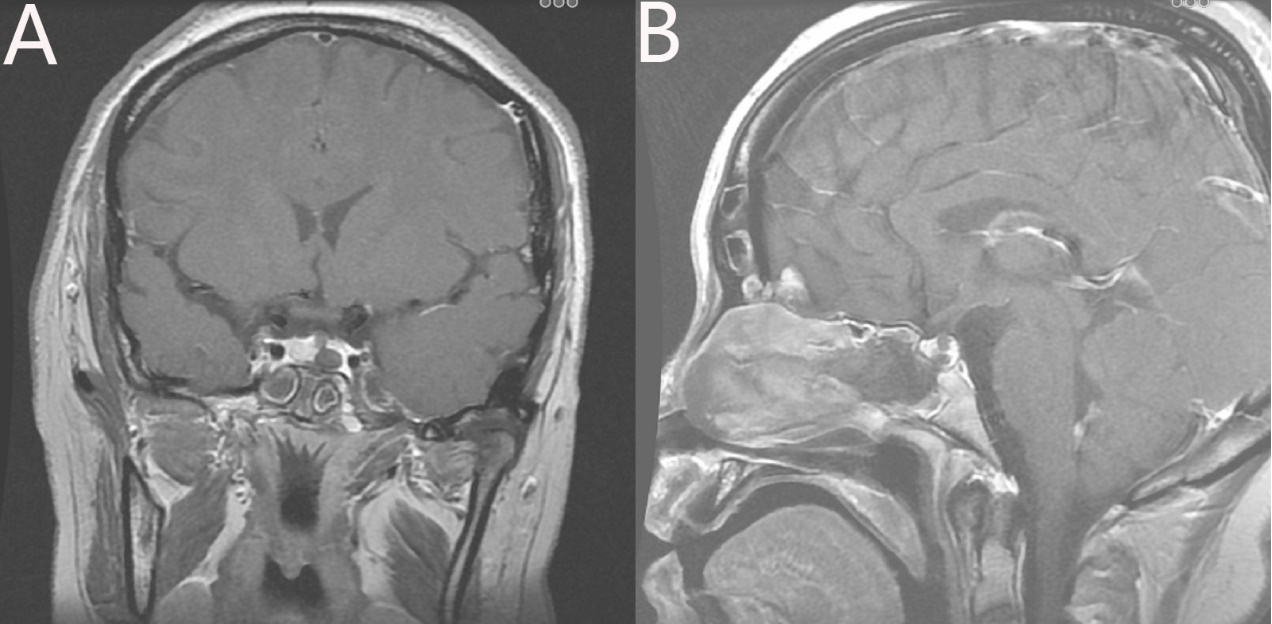
图4. 术后垂体增强MRI提示肿瘤全切。A:术后冠状位垂体增强;B:术后矢状位垂体增强。
病理结果:术后病理回报证实为垂体ACTH腺瘤(图5)。
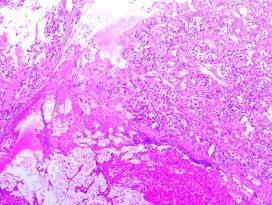
图5. 术后病理:垂体腺瘤,结合免疫组化及特殊染色结果,符合促肾上腺皮质激素腺瘤。免疫组化结果:ACTH +,Prolactin -,GH -,TSH -,LH -,FSH -,ER -,T-PIT +,PIT-1 -,SF-1 +,SSTR2散在+,CAM5.2 +,P53 -,Ki-67 <1%+,Syn +。特殊染色结果:PAS局部+,网状纤维染色 网状纤维破坏。
讨论
库欣综合征(cushing syndrome, CS)又称皮质醇增多症,是由各种病因导政的高皮质醇血症,作用于靶器官,引起的以向心性肥胖、高血压、糖代谢异常、低钾血症和骨质疏松为典型表现的一种综合征。从病因上分类,CS可以分为ACTH依赖性和ACTH非依赖性,前者包括ACTH垂体腺瘤和异位分泌ACTH的肿瘤;后者包括肾上腺腺瘤和腺癌、肾上腺增生、外源性糖皮质激素摄入过多。其中65%~70%的CS病例是由分泌ACTH的垂体腺瘤引起的,又称库欣病(cushing's disease, CD),是CS中最常见的病因[1]。
库欣病的诊断。第一步是在排除外源性激素使用后,确诊皮质醇增多症。敏感性和特异性的最好的试验是午夜唾液皮质醇测定,因为CS患者血ACTH和皮质醇水平在午夜的低谷会消失,而唾液中皮质醇呈游离状态,其浓度与血中游离皮质醇浓度平行。当使用1.8μg/dl(50nmol/L)的作为血皮质醇正常值上限时,1mg过夜地塞米松试验有95%的敏感度和80%的特异度。24小时尿游离皮质醇测定的敏感度和特异度更低,可能因高液体量摄入、高尿量、抑郁、酒精过多摄入和其他情况产生假阳性结果。其他方法还有经典小剂量地塞米松抑制试验。确诊皮质醇增多症常需2项及以上的试验[1]。第二步是确定皮质醇增多症的病因。垂体增强磁共振是诊断库欣病的常用方法,但超过80%的垂体ACTH腺瘤是微腺瘤,并且多达50%的病例MRI可能正常,因此常需其他方法。如经典大剂量地塞米松抑制试验,双侧岩下窦静脉取血+去氨加压素(DDAVP)兴奋试验[2]。本例患者初始症状以高泌乳素血症为主,后经完善实验室检查后,诊断为高皮质醇血症;因影像学病灶明确,故库欣病首先考虑。患者术后泌乳素恢复正常,结合影像特点,考虑其高泌乳素血症为垂体柄效应所致。
手术是治疗垂体ACTH腺瘤的首选方法。目前,ACTH腺瘤手术总体的内分泌缓解率仅为65~85%,复发率为10~35%,而在有经验的垂体外科医师中,治愈率可达80%~90%,复发率为10%~20%[3]。为进一步提高功能性垂体腺瘤的内分泌缓解率,假包膜外切除技术逐渐成为治疗此类疾病的主流术式。假包膜被认为是由于垂体自身对压力的反应而发展而成的,是受压缩的垂体组织形成的含有网状蛋白网络的多个薄层,在约50~70%的垂体腺瘤患者中存在。组织病理学表明,假包膜内经常存在肿瘤组织,有研究也表明假包膜可能是内分泌活动性肿瘤复发和未能达到生化缓解的原因,这证明了积极切除的合理性。En bloc切除技术即假包膜外整块切除,是经典假包膜外切除技术的进一步发展,并被认为较经典假包膜外切除具有肿瘤全切率更高、并发症更少的优点。
Sun Ho Kim等人对En bloc切除术疗效进行了相关研究,结果表明:经典假包膜外切除和分块切除的复发率差异并无统计学意义,258例假包膜外切除患者中使用En bloc方式切除的94例患者复发率为0;同样的,经典假包膜外切除和分块切除术后的生化缓解率差异(90.2% vs 85.3%)并无统计学意义,而使用En bloc方式切除的51例患者术后的生化缓解率为100%,与其他切除方式的差异(100% vs 85.2%)有统计学意义。在手术并发症方面,脑脊液漏的发生率En bloc切除组小于其他组(1.1% vs 5.9%),垂体功能减退的发生率则无明显差异[4]。
结合Aaron Cohen教授的总结(图6)[5],我们认为En bloc切除技术的要点如下:1.充分显露,鞍底骨窗两侧需暴露至海绵窦内侧壁,鞍底硬膜剪开范围可完全显示肿瘤;2.精准辨认假包膜外间隙,严格在该间隙内操作;3.动作轻柔,避免损伤假包膜或周围正常组织。由于内镜高清成像及视野更广阔灵活的特点,有助于准确及全面观察肿瘤假包膜,因此更有利于开展假包膜外En bloc切除。此外,假包膜的质地和完整性是实现En bloc切除的基础。本例患者虽然合并空泡蝶鞍,但通过遵循上述原则,对肿瘤整块切除的同时,避免了脑脊液漏。
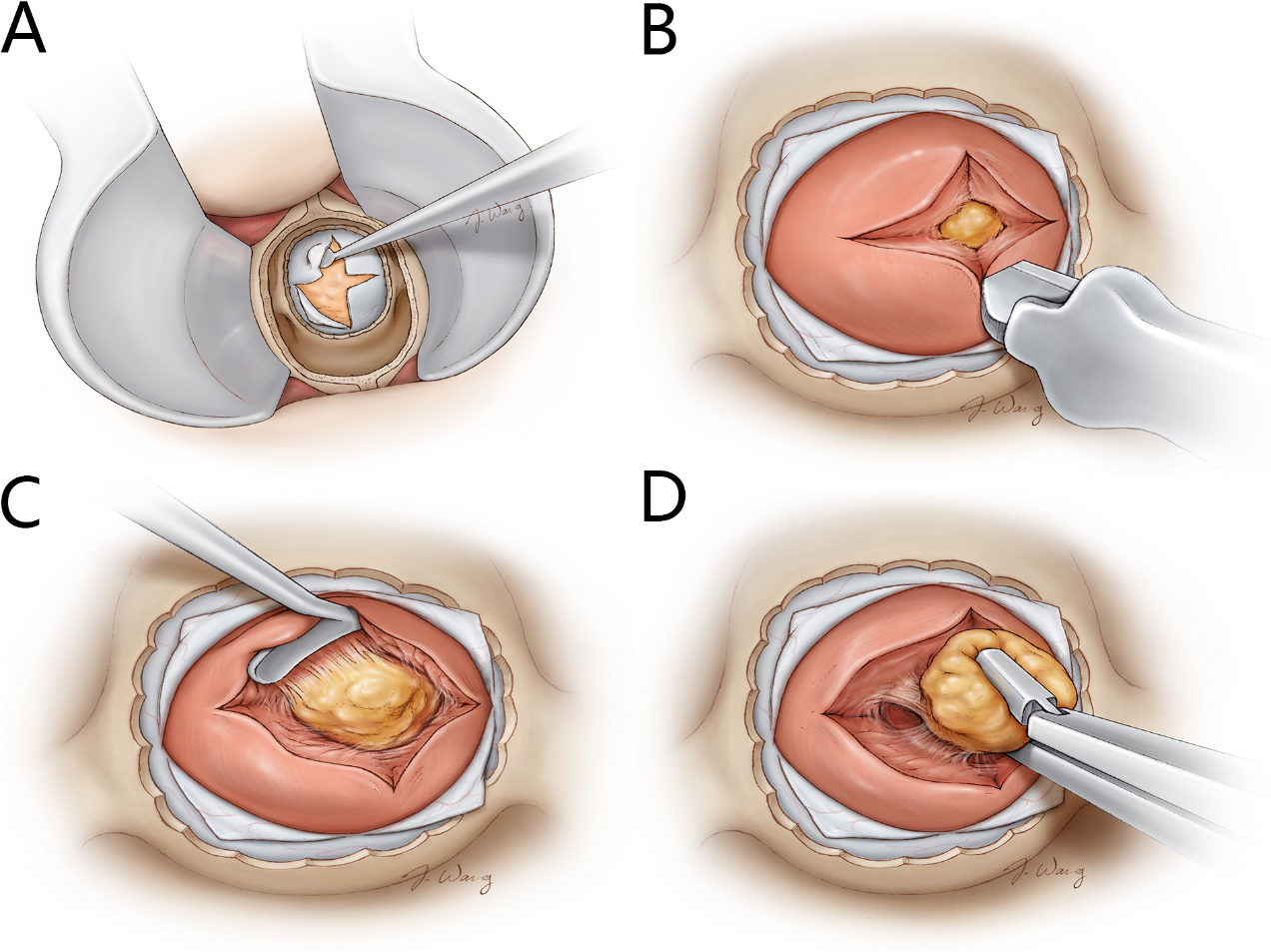
图6. 假包膜外En bloc切除技术。A:充分去除骨质、打开硬脑膜。B:腺体表面做十字切口,暴露中央的微腺瘤。C:分离微腺瘤和周围正常腺体组织,尝试保留肿瘤假包膜(假包膜外剥离)以便对肿瘤进行En bloc切除。D:肿瘤充分游离后,整块切除肿瘤。
围手术期管理。成功的ACTH腺瘤切除术后通常会发生肾上腺皮质功能减退,这是由于正常的垂体ACTH分泌受长期的皮质醇增多症的抑制。如术后激素检查及补充不及时,严重者可出现肾上腺危象。典型表现为绝对低血压(收缩压<100mmHg)或相对低血压(收缩压较平常下降≥20mmHg),同时可有低钠血症、高钾血症、低血糖等;伴随症状包括急性腹部症状、谵妄或遗忘(或两者均有),其余症状包括厌食、恶心、呕吐、疲劳、体位性头晕、腹痛、四肢和背部疼痛以及意识障碍等;在肠外途经给予糖皮质激素1~2个小时后症状缓解(标志是1小时内血压恢复、2小时左右临床症状明显改善)[6]。另一个值得注意的是术后静脉血栓栓塞事件(VTE)。与普通人群相比,CS中VTE(非手术和术后病例)的风险显著增加,可达10倍以上。这种高凝状态是由促凝因子如纤维蛋白原,凝血因子VIII和vWF的产生增加以及纤维蛋白溶解能力受损所引起的,这可通过PAI‐1,TAFI and α2-抗纤溶酶的血浆浓度升高来反映。最终,这些变化导致APTT缩短和纤溶能力降低。此类患者是否需要预防性抗凝治疗尚不明确。需要通过大规模的前瞻性对照试验来确定CS中抗凝的风险和获益。特别是抗凝治疗的确切时机、预防药物的类型、剂量和持续时间仍有待确定[7,8]。
综上所述,内镜下假包膜外En bloc切除对提高垂体ACTH腺瘤术后缓解率,降低手术并发症具备较好的优势。而此类患者围手术期管理的特殊性,是临床工作中尤其值得注意的内容。
参考文献
[1] Molitch M E. Diagnosis and treatment of pituitary adenomas: a review[J].Jama,2017,317(5):516-524.
[2]中国库欣病诊治专家共识(2015)[J].中华医学杂志,2016,96(11):835-840.
[3]Lonser R R,Nieman L, Oldfield E H. Cushing's disease: pathobiology, diagnosis, and management[J]. Journal of neurosurgery, 2017, 126(2): 404-417.
[4]Kim E H, Ku C R, Lee E J, et al. Extracapsular en bloc resection in pituitary adenoma surgery[J].Pituitary,2015,18(3):397-404.
[5] Aaron Cohen-Gadol. Pituitary Microadenoma, The Neurosurgical Atlas.
[6]Rushworth R L, Torpy D J, Falhammar H. Adrenal crisis[J].New England Journal of Medicine,2019,381(9):852-861.
[7]Wagner J, Langlois F, Lim D S T, et al. Hypercoagulability and risk of venous thromboembolic events in endogenous cushing's syndrome: asystematic meta-analysis[J].Frontiers in endocrinology,2019,9:805.
[8]van der Pas R, Leebeek F W G, Hofland L J, et al. Hypercoagulability in C ushing's syndrome: prevalence, pathogenesis and treatment[J]. Clinical endocrinology,2013,78(4):481-488.
(本文由浙二神外周刊原创,浙江大学医学院附属第二医院神经外科陈杨研究生整理,闫伟副主任医师审校,张建民主任终审。)




