《Reviews in Endocrine & Metabolic Disorders》 2020年9月10日在线发表美国、比利时、荷兰、巴西、波兰、挪威、德国、西班牙、法国、意大利、英国、墨西哥、以色列的Giustina A , Barkhoudarian G , Beckers A , 等43位学者联合撰写的共识《肢端肥大症的多学科管理。Multidisciplinary management of acromegaly: A consensus.》(doi: 10.1007/s11154-020-09588-z. )。
![]()
摘要
由包括内分泌医生和神经外科医生在内的肢端肥大症专家参加的第十三届肢端肥大症共识会议于2019年11月在佛罗里达州 Fort Lauderdale举行,,他们考虑了多学科治疗肢端肥大症的最佳方法。重点讨论了手术、放射治疗和药物治疗的技术、结果和副作用,以及技术的进步和新技术如何改变单独或联合使用这些模式的方式。考虑到治疗对病人结局的影响,以及优化和个体化治疗方法的策略。专家一致建议强调如何最好地实施可用的治疗方案,作为垂体肿瘤卓越中心多学科方法的一部分。
1.引言
肢端肥大症是一种由分泌生长激素(GH)的垂体腺瘤引起的慢性、进行性、和潜在致命性疾病,并会导致循环中GH和胰岛素样生长因子(IGF)-I水平过高。由于软组织增生引起面部和肢端的变化,以及影响骨骼和关节与心脏-呼吸系统的系统性并发症,且与代谢和肿瘤并发症相关,从而增加临床负担,导致生存质量降低和生存率下降。遗憾的是,由于从第一次症状出现到诊断的时间会延迟8 - 10年,大多数患者在出现时已经表现出晚期疾病的特征。肢端肥大症的治疗目标是使生化参数正常化,改善健康状况,控制症状和体征,降低过高的并发症发生率和死亡率。为了达到这些目的,通常需要包括神经外科、药物治疗和放射治疗的多模式治疗方法。因此,推荐多学科团队的方法用于有效的管理肢端肥大症及其并存疾病,由垂体医学专家协调个体化治疗和随访,优化结果。
2019年11月,肢端肥大症共识小组在佛罗里达州Fort Lauderdale召开会议,提供当前关于肢端肥大症综合多学科管理的共识。48名肢端肥大症专家,包括内分泌科医生和神经外科医生回顾当前的文献,评估当前的治疗选择和临床实践的优先顺序。讨论的重点是治疗结果目标;神经外科、放射治疗和药物治疗的结果和副作用;以及每一种可用治疗方案在指南中的拟议的位置。采用推荐评估、发展和分级评价(GRADE)体系对肢端肥大症患者治疗的最新共识建议进行分级。主要建议见表1,并在图1中概述。
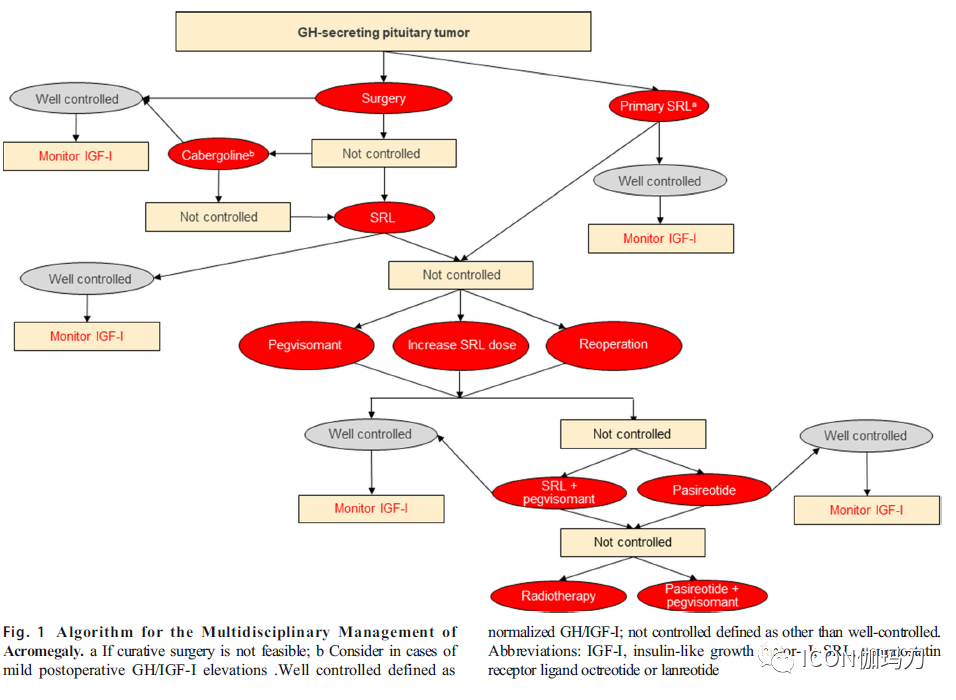
图1.多学科治疗肢端肥大症的流程。a如果治疗性手术不可行;b考虑术后GH/IGF-I轻度升高,控制良好的定义为GH/IGF-I的正常化;未受控制的定义为未得到良好控制。缩写:IGF-I,胰岛素样生长因子-I;SRL,生长抑素受体配体:奥曲肽或兰瑞肽(octreotide or lanreotide)。
2.方法
文献检索由会议参与者进行,以识别2014年1月至2019年10月间发表的英文论文中的新数据,以及PubMed的索引。检索词条包括“肢端肥大症(acromegaly)”和与每个主题相关的词条,包括“生化控制(biochemical control)、肿瘤体积(tumor volume)、临床症状(clinical symptoms)、副作用(side effects)、神经外科(neurosurgery)、放射治疗(radiotherapy)、生长抑素类似物( somatostatin analogue)、生长抑素受体配体(somatostatin receptor ligand)、培维索孟(pegvisomant)、并发症发生率(morbidity)、死亡率(mortality)、生活质量(quality of life)和指南(guideline)”。在对每个主题的技术现状进行简短的全体报告之后,参与者被分成分组,对分配的主题进行进一步分析,然后向整个小组报告他们的结论。
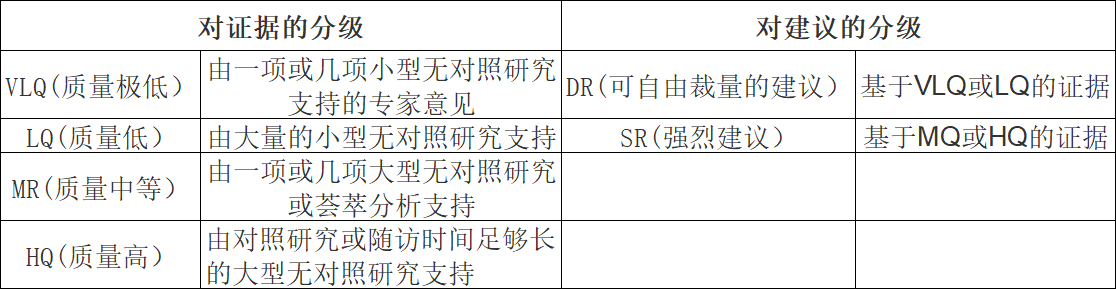
在发言者介绍、分组讨论和报告的基础上提出建议共识。会议结束后,科学委员会对支持建议的证据进行分级,然后根据证据质量对共识建议进行分级(表2)。最终的共识建议分级得到所有与会人员的认可。
表1.建议要点


表2.
3.对证据和建议的综述
3.1治疗方法的目标
3.1.1 GH与IGF-I
过量的生长激素(GH)和/或IGF-I导致肢端肥大症患者的系统性并存疾病,需要有效的治疗来减少疾病负担,降低或使超额死亡率(HQ) 正常化。虽然考虑肿瘤和临床变量对临床管理很重要,但生化控制是成功治疗的基础。因此,目前,GH和IGF-1的正常化仍是肢端肥大症治疗的首要目标,应采用生化指标来评价疾病的活动性(SR)。
口服葡萄糖耐量试验(OGTT)后的GH谷值(nadir)<1 μg /L最初被我们的共识组定义为术后缓解的标志;随后,考虑到使用超敏GH测定方法,该建议被修订为0.4μg/L。然而,OGTT期间GH谷值受患者年龄、身体质量指数(BMI)、性别和雌激素状态(LQ)、以及葡萄糖耐受不良、糖尿病或既往使用抗糖尿病治疗和生长抑素受体配体治疗(VLQ) 等因素的影响。不过,由于这些截断点(cutpoints)与的长期预后有很好的相关性,我们建议使用超敏分析进行诊断,并使用0.4μg/L截断阈值(SR)进行术后评估。
在随访中,IGF-I水平反映了疾病的临床活性(MQ)。然而,由于一些分析前和分析混淆因素(MQ),以及循环IGF-I水平的波动,特别是在术后早期或治疗后改变(MQ),已有报道称各试验之间存在较大的差异。因此,建议在整个患者随访中使用同样有效的IGF-I检测(SR)。此外,尽管定义生化控制的绝对截断值是正常的上限(ULN) (SR),但根据临床情况,略高于该截断值(例如,在1.2-1.3 ULN范围内)的值可视为治疗目标(DR)。血清GH值可用于评估控制,以达到达到空腹水平<1.0μg / L。对于术后3个月观察到GH和IGF-1水平差异的患者,建议密切随访;最常见的是生长激素控制但IGF-I升高,但也有相反的情况发生。在这些情况下,我们建议依赖IGF-I值(SR)。
3.1.2肿瘤大小
对于肢端肥大症患者来说,控制肿瘤生长,理想情况下,肿瘤大小缩小是临床的重要目标(SR)。我们建议继续评估肿块最大尺寸的缩小,而不是肿瘤的整体体积,这不是标准的(DR)。由于后者是较好的反应测量方法,对于测量肿瘤体积的方法的共识将受到医师团体的欢迎。
T2加权的MRI上的低信号,以及腺瘤的颗粒度和其他组织学标记物(VLQ),可能有助于预测生长抑素受体配体(SRL)治疗反应性(MQ),但目前还没有验证用于指导治疗。肿瘤特征,如腺瘤纤维化程度和一致性可以通过纹理分析来评估,目前仅限于临床试验来评估临床的精确性。
3.1.3临床症状
由于与肢端肥大症相关的症状和并存疾病影响生存质量和生存,其预防和控制是治疗的主要目标(SR)。我们建议评估和积极管理疾病相关并存疾病(SR)。然而,症状和临床表现可以与生化值分离(LQ),建议在生化参数之外进行具体的评估和临床监测(SR)。
提出的临床报告工具SAGIT(症状和体征,相关的并存疾病,GH水平,IGF1水平和肿瘤情况)和ACRODAT(肢端肥大症疾病活性工具)以及患者-报告的结果评估应对措施用来规范随着时间推移的随访(VLQ),且可考虑在治疗决策中使用它们(DR)。
3.2神经外科
3.2.1技术
在大多数患者中,经蝶窦手术切除肿瘤是最佳的初始治疗(HQ)(图1)。支持内镜手术而非显微镜手术的数据尚不完整,在推荐一种手术方式之前,需要进一步的比较结果的研究。目前,技术的选择取决于神经外科医生的专业知识和偏好。在肢端肥大症的患者中,开颅手术是非常罕见有指证的(HQ)。术中MRI和其他技术帮助在术中肿瘤残留可视化仍处于研究阶段(LQ)。
3.2.2结果
手术缓解可能性的主要预测因素是肿瘤大小和对周围结构,特别是海绵状窦,的侵袭性(HQ)。Knosp评分可能与结果相关。术前血清GH水平也是手术缓解的一个重要决定因素。
在专业的转诊中心,80% - 90%的微腺瘤和大约50% - 75%的大腺瘤可以得到缓解,虽然当肿瘤是侵袭性的或非常大的(例如,>4厘米)时,这些数字会显著下降(HQ)。在经验较少的中心,缓解率可能更低。
如果患者不能通过手术治愈(MQ),如果大量肿物能够成功切除和/或存在肿物效应[45]的症状,则可以考虑适当的候选方案,即在药物治疗之前进行手术肿瘤减积。在放射治疗之前,也可以适当地进行减积以减少靶区体积(DR)。
至少在术后3个月评估血清IGF-I水平才能确定缓解的可靠程度(HQ)。术后第1天或第2天测定禁食下GH可获得缓解的早期指征,其中最低水平(<1μg/L)对预测预后具有最好的敏感性。然而,如果患者术前接受SRL治疗,这些数据需要谨慎解释(VLQ)。肢端肥大症的外科治疗经验,加上肿瘤的初始尺寸,对疾病控制率有显著影响(HQ)。建议每位外科医生每年进行大量垂体手术并监测预后数据,以保持足够的外科专业知识(DR)。
3.2.3术前SRL治疗
随机研究表明,手术治疗前使用SRL 3-6个月后,术后缓解情况有所改善(MQ)。然而,数据是相互矛盾的,在许多情况下,长期随访的结果并不持续(LQ)。术前SRL在改善麻醉风险中的作用尚不清楚,目前的数据也不支持将术前SRL治疗作为一般建议(SR)。
3.2.4手术
对于有明显残留肿瘤且对术后使用的SRL没有充分反应的患者,或者在第一次手术不成功后有可能可切除的残留肿瘤的患者,可以考虑再手术(LQ)。再次手术,如初始手术一样,应在专科中心进行,并经过多学科评估(SR)。
3.2.5并发症
经蝶窦手术后的手术并发症是众所周知的,虽然经验丰富的外科医生很少发生。手术后垂体功能减退发生率为5%-10%,持续性脑脊液漏发生率为2%-3%。其他严重并发症(如视力恶化、颈动脉损伤、一过性动眼肌麻痹和脑膜炎)则很少见到(MQ)。尿崩症的发生率与手术治疗的垂体瘤相似(10 - 15%),通常是一过性的。术后5-14天可能出现抗利尿激素分泌不当综合征,需要保持警惕,经常监测血清钠水平和进行可能的液体限制(LQ)。
高龄、严重的心脏病和控制不佳的糖尿病是手术的相对禁忌症(VLQ)。
3.3放射治疗
3.3.1技术
现代放射治疗继续在治疗流程算法中占有一席之地,通常作为手术和最佳药物治疗后的三线选择。放疗有两个适应证:控制肿瘤生长和/或降低GH分泌(MQ)。早期的常规时代放射治疗与并发症有关,特别是脑血管疾病和继发性肿瘤,以及垂体功能低下(MQ)。现代立体定向放射治疗技术是在三维精确定位,并经单次分割或分割照射。接受垂体放射治疗的患者数量相对较少,且观察效果的潜伏期较长,因此很难对并发症发生率得出明确的结论。然而,与分割放射治疗相比,单次分割立体定向放射外科治疗似乎与类似但更少的副作用相关(LQ)。
放射治疗应在专业中心进行,患者的选择应由多学科小组讨论指导,治疗应由在治疗垂体疾病方面经验丰富的放射治疗师进行,以最大限度地提高疗效并防止长期并发症(SR)。
3.3.2结果
放射治疗是为失败、不适合或拒绝接受手术和/或药物治疗的患者保留的(SR)(图1),并可在选定的患者中作为二线治疗(VLQ)。放射治疗可控制60%以上患者的生化参数,并且在控制肿瘤生长方面具有很高的效率(90%),为停止高成本的终身药物治疗提供了前景(MQ)。然而,直到实施治疗后10年至15年,才能实现全面反应(MQ)。考虑到抑制GH和IGF-I水平的延迟,在其间的几年需要药物治疗(SR)。
3.3.3副作用及禁忌症
特别是随着其他治疗方法的安全性的提高,安全性成为应用放射治疗肢端肥大症的主要限制因素。目前还没有关于不同放疗方式引起的副作用的比较研究。非内分泌并发症(如继发性肿瘤、脑血管疾病、视神经炎、颅神经麻痹)的发生率可以观察到通过更为聚焦的技术以使其降低(LQ)。垂体功能低下是最常见的并发症,无论采用何种技术,且随时间增加,5年后发生率接近25-50% (MQ)。对内分泌功能应进行终身常规监测(SR)。
3.4药物治疗
对于术后未达到生化控制的患者,建议采用药物治疗(SR)。初始药物治疗只针对那些有手术禁忌证或拒绝手术的患者,并可在有良好预后和手术成功风险较低的特定患者中考虑(DR)(图1)。
3.4.1 生长抑素受体配体(SRL)
奥曲肽(Octreotide)LAR和兰瑞肽(lanreotide)被用作一线药物治疗,因为它们具有良好的风险/效益状况(SR)。30 %- 55%的患者在使用这些SRLs 长期治疗后IGF-I达到正常(MQ)[68 72]且超过一半的接受治疗的患者肿瘤体积缩小>20%(MQ)。较低的IGF-I基线水平和较年长的年龄是反应的有力预测因子(MQ)。增加奥曲肽LAR和兰瑞肽的剂量和/或剂量频率可以提高标准剂量控制不充分但对SRL治疗敏感的患者的生化控制率(LQ)。一种口服奥曲肽制剂最近在美国被批准作为长期维持治疗,用于对奥曲肽或兰瑞肽治疗有反应和耐受性的患者。帕瑞肽LAR可以有效地使奥曲肽LAR或兰瑞肽控制不充分的一些患者的IGF-1水平正常化(MQ),并可能导致更高的肿瘤缩小率(LQ)。
SRL的副作用主要包括胆结石和胃肠道症状。长期奥曲肽LAR和兰瑞肽总体上对糖代谢具有中性作用,但也有一些患者出现轻度高血糖(MQ)。相比之下,帕瑞肽LAR可引起高达70%的患者高血糖,包括25 - 40%的患者继发糖尿病(LQ)。因此,应仔细筛选候选帕瑞肽LAR,并监测其血糖不良反应(SR)。目前还没有关于帕瑞肽诱发高血糖的最佳治疗的对照研究。对口服降糖药,包括二甲双胍,没有控制的患者,可以使用胰高血糖素样肽-1受体激动剂,而不是胰岛素(DR)。
3.4.2卡麦角林
卡麦角林是一种作用时间相对较长的多巴胺激动剂,与SRL相比,具有成本有限和口服途径给药的优势。然而,其在治疗流程算法中的定位受到其诱导生化控制相对温和的作用的限制,主要局限于术后轻度生长激素/IGF-I升高(IGF-I水平<2.5 x ULN)[7]的患者,以及可能出现的逃逸现象。一些研究表明,对于最大剂量的SRL或培维索孟(pegvisomant)无法达到生化控制的患者,卡麦角林可能是有用的附加治疗(VLQ) (DR)。
3.4.3培维索孟(Pegvisomant)
与所有其他药物疗法不同,生长激素受体拮抗剂培维索孟(pegvisomant)的疗效不依赖于肿瘤特征。对于最大剂量SRL 不能达到生化控制的患者,培维索孟通常被用作二线治疗(SR),虽然观察数据表明,作为一线治疗,培维索孟也有效(VLQ)。由于随着剂量增加控制率通常就越高,治疗应从低剂量开始,并在可耐受的情况下增加滴定,直到能够得到控制(SR)。任何患者都可以通过适当剂量滴定加以控制(MQ),但治疗的高昂费用往往是适当剂量滴定的障碍(VLQ)。较年轻的患者的疾病进袭性(aggressive)更强,IGF-I基线水平较高,以及相关的并存疾病可能需要较高的剂量来达到生化控制(LQ)。
肿瘤再生长导致的生化控制缺失、先前的治疗修改、伴随的绝经以及睾酮给药的变化,都可以通过增加剂量来纠正(LQ)。培维索孟对临床结果的改善程度是可变的,取决于具体的并存疾病和病程(LQ)。与其他形式的药物治疗相比,培维索孟最有可能在糖耐量和胰岛素敏感性方面取得最大的改善(MQ)。因此,对于奥曲肽LAR/兰瑞肽 没有反应的既往高血糖或糖尿病患者,培维索孟是首选的药物治疗(SR)。肝功能异常可以在早期发生,应予以监测(SR)。从SRL换药治疗的患者肿瘤大小罕见增加,可能是停止SRL治疗后的反弹,但更可能是由于缺乏垂体靶向治疗(LQ)。因此培维索孟对于没有临床相关残留肿瘤的患者是首选(SR)。
3.4.4 培维索孟联合SRL治疗
相比单纯使用SRL的患者,更高的利率结合患者的生化控制使用培维索孟(pegvisomant)联合奥曲肽(octreotide)/ 兰瑞肽lanreotide(MQ),这个组合可能是考虑到对残留肿瘤的控制和葡萄糖耐量的担忧,而不是换药帕瑞肽(pasireotide)LAR治疗(DR)。联合使用培维索孟(pegvisomant)和帕瑞肽(pasireotide)LAR在降低培维索孟剂量实现生化控制方面是有效的,但在降低帕瑞肽的高血糖作用方面尚未显示出明显的优势(LQ)。然而,如果放疗有禁忌证的或不可用的,或者对于属较强的进袭性肿瘤,在等待放疗的肿瘤缩小效果时,这种联合治疗虽然昂贵,但可能是观察到有肿瘤生长的患者的选择(DR)。
3.4.5 替莫唑胺(Temozolomide)
替莫唑胺和其他化疗药物的使用应仅限于高度进袭性或真正恶性的垂体肿瘤患者,并应在神经肿瘤学家的监督下使用(DR)。
3.5多学科治疗方法
越来越多的管理选择使得肢端肥大症的多模式治疗更加有效,需要更高程度的个性化治疗。肢端肥大症的治疗最好由垂体肿瘤卓越中心(PTCOE)的多学科专家团队确定,最好在可行的单一医疗机构进行(SR)(MQ)。PTCOE应该有足够大的转诊人群,以能让神经外科医生在大型的垂体中心接受住院医师培训,持续的多学科经验,并有可能发表垂体肿瘤手术的结果(DR)。理想情况下,每个医疗中心应该有一个以上的外科医生。除了经蝶窦垂体手术和垂体疾病内分泌管理方面的专家,多学科团队还应包括神经放射科医生、神经病理科医生、放射肿瘤科医生和在垂体医疗方面具有特殊专长的护士(LQ)。PTCOE采用多学科治疗方法,实施当前的指南,定期使用最新的、经过验证的实验室和临床工具,这为优化结果和生春质量提供了最佳机会,同时也确保了疾病相关的并发症发生率和死亡率最小化(SR)。