病史简介
患者
男,44岁,明确手术史。
病史
患者因“右侧桥小脑角脑膜瘤术后10年余,右侧肢体不灵活3月”入院。
查体
意识清楚,回答切题,步态稍蹒跚,GCS评分15分。双侧瞳孔等大等圆2.5mm,直接、间接对光反射灵敏。

右侧周围性面瘫,右眼睑闭合不全,右耳听力丧失,张口左偏,伸舌偏左,饮水无呛咳,咽反射正常,颈软,四肢肌力V级,肌张力正常。右侧指鼻试验、跟膝胫试验阳性,双下肢Babinski征未能引出。
辅助检查
2020-04-13我院头颅MR提示“右侧桥小脑角占位性病变,考虑肿瘤复发”。
诊治经过
2009年8月
患者因“右耳鸣、听力下降8年,头晕、行走不稳3月”入我院治疗,诊断为右侧桥小脑角占位性病变。
2009年8月12日
患者行开颅切除,术后病理提示透明细胞型脑膜瘤,WHO分级Ⅱ级,术后遗留右侧周围性面瘫。
2011年
患者复查发现肿瘤稍有增大,行伽马刀治疗。而后9年未再复查。
2020年4月13日
我院头颅MR提示“右侧桥小脑角占位性病变,考虑肿瘤复发”。
1、右侧桥小脑角占位性病变
2、右侧桥小脑角脑膜瘤术后
3、伽马刀治疗术后
影像学检查
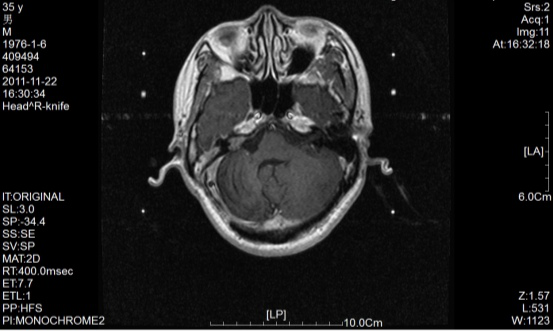
2011年11-22伽玛刀定位片
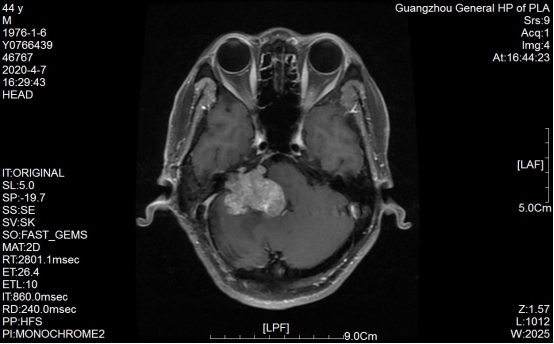
2020-4-7术前MR
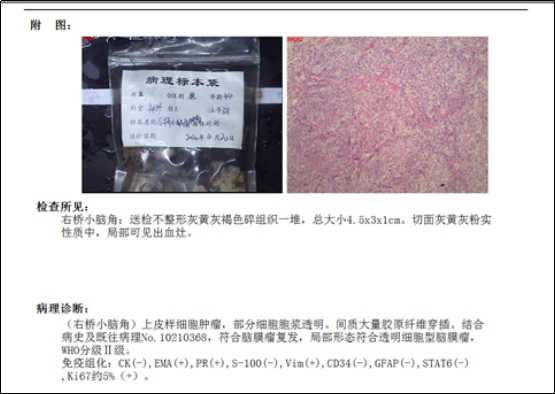
病理诊断结果
上皮样细胞肿瘤(右桥小脑角),部分细胞浆透明。间质大量胶原纤维穿插。结合病史及既往病理,符合脑膜瘤复发,局部符合透明细胞型脑膜瘤,WHO Ⅱ级。
免疫组化
CK(-),EMA(+),PR(+),S-100(-), Vim(+), CD34(-) , GFAP(-), STAT6(-), Ki 67约5%(+)。
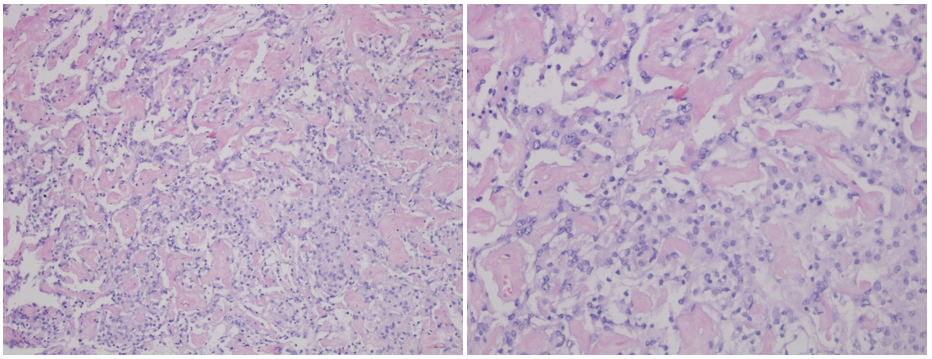
分子诊断结果
体细胞突变(somatic mutation)
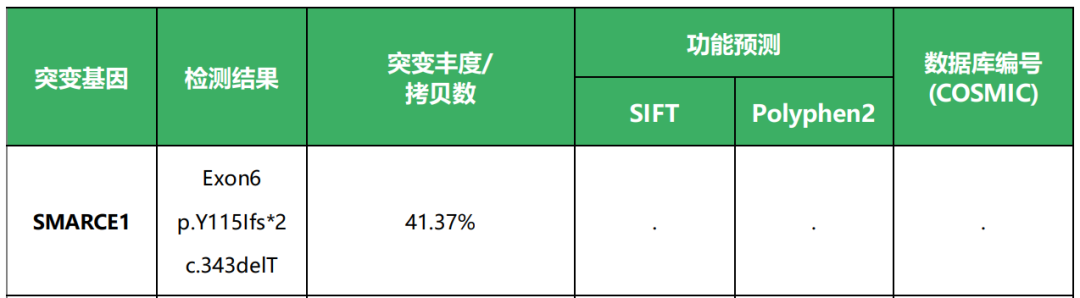
检出 SMARCE1 p.Y115Ifs*2 体细胞失活突变( 丰度 41.37%), 与透明细胞亚型脑膜瘤相关。
胚系突变(germline mutation)
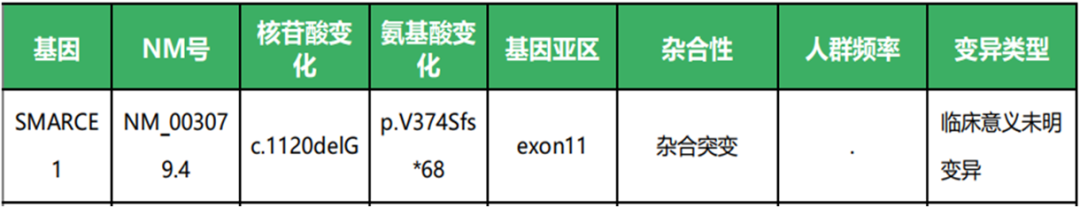
检出SMARCE1 c.1120del p.V374Sfs*68胚系杂合突变。SMARCE1与家族性脑膜瘤易感( Meningioma, familial, susceptibility to) 【OMIM607174】相关,是一种常染色体显性遗传病, SMARCE1失活突变导致疾病发生。
SMARCE1 c.1120del p.V374Sfs*68突变发生在11号外显子( 最后一个外显子), 第1120位碱基丢失,基因编码蛋白在第374位开始框移,在441位终止( 野生型编码 411 个氨基酸),导致编码蛋白延伸。该变异在正常人群中发生频频极低。
病例讨论
中枢神经系统透明细胞脑膜瘤
中枢神经系统透明细胞脑膜瘤(clear cell meningioma,CCM)。
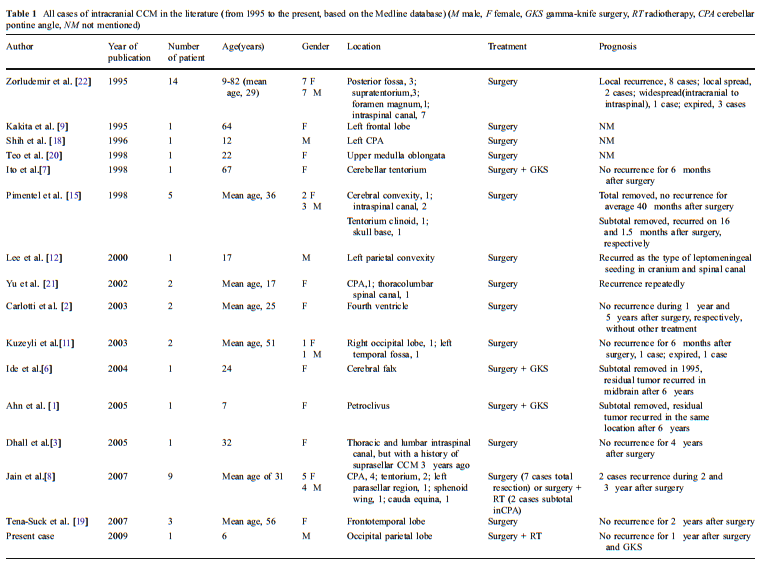
CCM较为罕见,颅内脑膜瘤中约占0.3%,椎管内脑膜瘤中约占1.4%。常见于桥小脑角和岩斜区。好发于儿童和年轻人,平均年龄约35岁,老年人也可发生。
患者CCM具有较高的局部复发率和脑脊液转移率的侵袭性生物学行为。一项对36例CCM患者的随访显示,其复发率高达42%,复发时间为术后10个月~12年,中位时间29个月。
Kaplan-Meier生存分析显示,在全切除(Simpson I级,II级切除)患者预后明显优于次全切除患者(Simpson III级,IV级切除)(log-rank test, p = 0.006)。
因CCM较强的侵袭性生物学行为,单纯手术治疗逐步转变为手术联合放疗治疗策略。对于颅内桥小脑角区或岩斜区CCM患者,因肿瘤临近脑干、小脑、椎动脉及颅神经,全切除肿瘤难度较大,而术后伽马刀治疗可见到明显的肿瘤萎缩。
因此,伽马刀治疗对手术后残余及手术难以治疗的CCM是安全有效的辅助治疗,对于复发脑膜瘤是手术之外另一有效治疗。
SMARCE1变异与透明细胞脑膜瘤
SMARCE1基因编码部分依赖ATP染色质重构复合物SWI/SNF,是通常情况下被染色质抑制的基因转录活化所必需的。
编码蛋白,或者单个,或者形成SWI/SNF复合体,可以结合到4通路交叉DNA上,在进出核小体时模拟DNA拓扑结构。该蛋白包括一个DNA结合HMG结构域,然而该结构域损伤并不会使SWI/SNF复合物的DNA结合或核小体替换活性完全丧失。
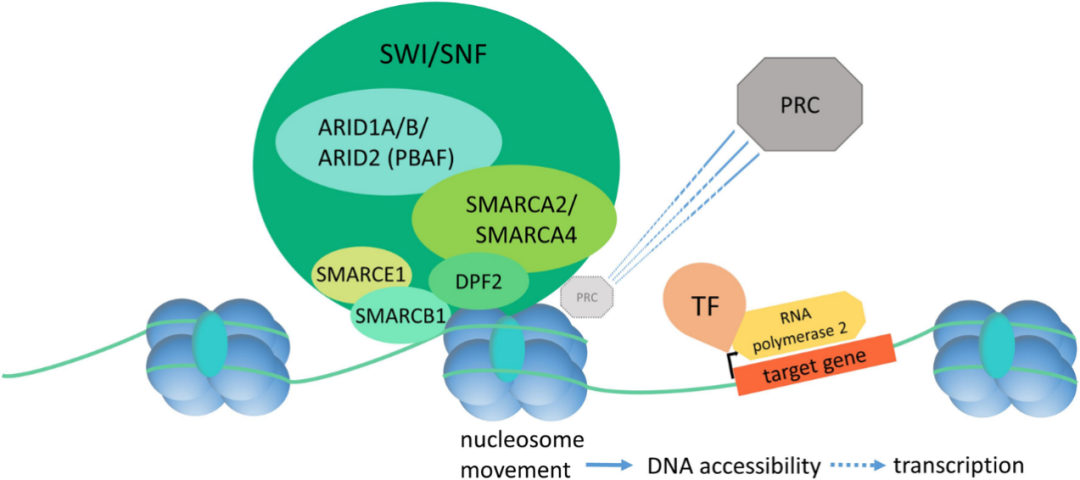
近些年发现SMARCE1突变导致CCM的发生,研究显示SMARCE1是CCM一个特异且敏感的标志物,所有CCM均显示SMARCE1基因突变(多为无义突变或框移突变),并且导致SMARCE1表达缺失,SMARCE1功能缺失导致SWI/SNF丧失对肿瘤的抑制作用,从而导致肿瘤发生。
脑膜瘤的早期诊断非常重要,能够防治肿瘤对周围组织的侵袭和损伤,提高手术全切的成功率。
有报道SMARCE1胚系突变更易罹患脊髓和颅骨透明细胞型脑膜瘤。有学者建议对无症状的SMARCE1突变携带者以及CCM患者定期进行神经系统检查及脑和脊柱MRI检查。儿童脑膜瘤往往具有更积极的生物行为,相比成人预后较差,在儿童中更积极的筛查方法可以在早期的状态中检测肿瘤。
[1] SmithMJ, WallaceAJ, BennettC, et al. Germline SMARCE1 mutations predispose to both spinal and cranial clear cell meningiomas[J]. J Pathol, 2014,234(4):436-440. DOI: 10.1002/path.4427.
[2] 张丽, 姚志刚, 连芳, 等. SMARCE1在透明细胞型脑膜瘤中的诊断意义 [J] . 中华病理学杂志,2020,49 (03): 234-238. DOI: 10.3760/cma.j.issn.0529-5807.2020.03.005
[3] LiP, YangZ, WangZ, et al. Clinical features of clear cell meningioma: a retrospective study of 36 cases among 10,529 patients in a single institution[J]. Acta Neurochir (Wien), 2016,158(1):67-76. DOI: 10.1007/s00701-015-2635-x.
[4] GerkesEH, FockJM, den DunnenWF, et al. A heritable form of SMARCE1-related meningiomas with important implications for follow-up and family screening[J]. Neurogenetics, 2016,17(2):83-89. DOI: 10.1007/s10048-015-0472-y.
[5] MaL,Liu WK,Wang K.et a1.Intracranial clear-cell meningioma[J].Acta Neurochir,2009,151: 373.




