《Best Practice & Research,Clinical Endocrinology & Metabolism 》 2020 年7月美国Georgetown University的Joseph G Verbalis 撰写的综述《中枢性尿崩症的获得性形式:疾病机制。Acquired forms of central diabetes insipidus: Mechanisms of disease》(doi: 10.1016/j.beem.2020.101449.)。

摘要
获得性中枢性尿崩症的大多数病例是由于以下原因造成的神经垂体破坏:1)解剖性损伤,因压力或浸润破坏加压血管加压素神经元(the vasopressin neurons);2)手术或头部创伤破坏血管加压素神经元;3)血管加压素神经元的自身免疫性破坏。由于血管加压素神经元位于下丘脑,而因为垂体后叶只是轴突末梢的位置,并且将血管加压素分泌到血液中,局限于蝶鞍的病变通常不会引起尿崩症。此外,神经垂体合成垂体血管加压素的能力大大超过人体的需要,需要破坏80-90%的下丘脑垂体血管加压素神经元才产生尿崩症。因此,即使是鞍区和鞍上区的大的病变,通常也不会与水稳态受损(impaired water homeostasis)有关,除非进行手术切除。无论中枢性尿崩症的病因如何,血管加压素分泌不足或缺失都会导致尿浓度受损,进而导致多尿。在大多数情况下,继发性多饮能够维持水的体内平衡,但代价是经常口渴和饮水。然而,调节血管加压素神经元活动的下丘脑前部的渗透压感受器(osmoreceptors)被破坏会导致口渴以及血管加压素部分的缺失,导致严重的慢性脱水和高渗透压。血管加压素不足还导致肾脏集合管主要细胞中水通道蛋白-2的合成下调,引起继发性肾源性尿失禁。因此,中枢性尿崩症(CDI)患者需要几天的血管加压素治疗才能达到最大的尿液浓度。因此,中枢性尿崩症的患者的表现可以差别很大,取决于病变的大小和位置,对神经垂体创害量级,血管加压素神经元受破坏的程度,以及因垂体前叶被破坏存在的其他激素缺乏。
实践要点
●中枢性尿崩症(CDI)通常是由于压迫或浸润破坏血管加压素神经元的解剖损伤而引起的。
●由于联加压素神经元位于下丘脑,局限于蝶鞍的病变一般不会引起中枢性尿崩症(CDI),因为垂体后叶只是将血管加压素分泌到血流中的轴突末梢的位置。
●神经垂体合成垂体血管加压素的能力大大超过人体的需要,需要破坏80-90%的下丘脑血管加压素神经元才会产生中枢性尿崩症(CDI)。
●即使鞍区和鞍上区出现大的病变,通常也不会损害水稳态,除非手术切除并破坏80-90%的下丘脑血管加压素神经元。
●在外科手术或头部外伤造成神经垂体的破坏性病变和损伤后,对下丘脑血管加压素神经元的自身免疫性破坏(如淋巴细胞性漏斗部神经垂体炎)是中枢性尿崩症的下一个最常见原因。
●下丘脑前部调节血管加压素神经元活动的渗透压感受器被破坏,导致口渴缺失和血管加压素部分(渴感减退性尿崩症adipsic diabetes insipidus),导致严重的慢性脱水(severe chronic dehydration)和高渗(hyperosmolality)。
●血管加压素缺乏导致肾脏集合管主细胞(the kidney collecting duct principal cells)中水通道蛋白2水通道(aquaporin-2 water channels)的合成下调,引起继发性肾源性尿崩症(secondary nephrogenic diabetes insipidus),这也是中枢性尿崩症(CDI)患者需要数天的血管加压素给药才能达到最大尿液浓度的原因。
●中枢性尿崩症(CDI)患者的表现可能有很大差异,取决于病变的大小和位置、对神经垂体的创害量级、对血管加压素的破坏程度、以及由于破坏垂体前叶出现其他的激素缺乏。
研究内容
●淋巴细胞性神经垂体炎免疫起因的识别。
●研发对血管加压素神经元自身免疫破坏的诊断性测试。
●阐明下丘脑渗透压感受器激活后调节口渴的神经通路。
●垂体手术或创伤后低钠血症(“孤立的第二期”)发展的预测因子。
●老年人口渴感减弱的病因(the reduced thirst perception of older individuals)。
获得性中枢性尿崩症的病因
中枢性尿尿症(CDI)是由于来自垂体腺后叶的精氨酸血管加压素(arginine vasopressin,AVP)在渗透刺激(osmotic stimulation)下分泌不足而引起的。在大多数情况下,这是由于神经垂体的破坏由多种获得性解剖病变破坏或损害神经垂体的压力或渗透(表1),神经垂体包括在下丘脑室旁和视上核合成精氨酸血管加压素(AVP)和催产素(oxytiocin)的大细胞(magnocellular)神经元运输合成的精氨酸血管加压素下到垂体柄的轴突(the axons),以及垂体后叶的轴突末端(the axon terminals of the posterior pituitary)。造成的低渗性多尿(hypotonic diuresis)的严重程度取决于神经垂体受破坏的程度,导致精氨酸血管加压素(AVP)分泌的完全或部分性缺乏。
虽然可能潜在引起中枢性尿崩症(CDI)的病变种类繁多(表1),但鞍区和/或鞍上病变中不发生中枢性尿崩症(CDI)的情况要比实际产生综合征的情况常见得多。这种明显的不一致性可以通过考虑与所有这些病因相关的神经垂体生理学和病理生理学的几个共同原则来理解。第一种是发生在下丘脑的AVP合成(图1);垂体后叶仅代表含有AVP的神经分泌颗粒的储存和分泌部位。因为合成AVP的大细胞性(magnocellular)神经元细胞体(the cell bodies)保持完整,而释放AVP的部位向上方移位,通常进入大脑底部的正中隆起的血管,因此,只破坏垂体后叶的蝶鞍内病变包含的病变一般不会引起中枢性尿崩症(CDI)。有这种现象的最好的例子可能是破坏垂体前叶和垂体后叶的大的垂体大腺瘤。对于这类垂体腺瘤,尿崩症是一个非常不寻常的表现,因为这种缓慢扩大的鞍内病变对垂体后叶的破坏仅仅破坏了AVP神经元的神经末梢,而没有破坏细胞体。当这种情况发生时,AVP释放的位置向垂体柄上和正中隆起方位移。有时在非对比平扫的MRI上可以检测到垂体“亮点(bright spot)”向漏斗或正中隆起上方移位(shift),但通常该过程太弥漫性(too diffuse)且不能通过这种方法检测到。从垂体腺瘤发生的尿崩症非常罕见,即使大腺瘤完全抹去鞍区内容物(completely obliterate sellar contents) 足以引起全垂体功能低下(panhypopituitarism),存在尿崩症应该导致考虑其他如颅咽管瘤等诊断,颅咽管瘤往往造成对正中隆起(median eminence)的损害。由于囊附着在下丘脑的底部鞍区/鞍上肿块迅速增大,不能有足够的时间将AVP的释放部位更向上移位(如转移性病灶),或肉芽肿性疾病伴更弥漫性的下丘脑受累(如结节病sarcoidosis、组织细胞增多症histiocytosis)。对于引起ACTH缺乏的非常大的垂体腺瘤,由于伴有肾上腺功能减退的游离水排泄受损患者,实际上更有可能出现类似SIADH(抗利尿激素分泌不当综合征)样的低渗(hypoosmolality)状态。
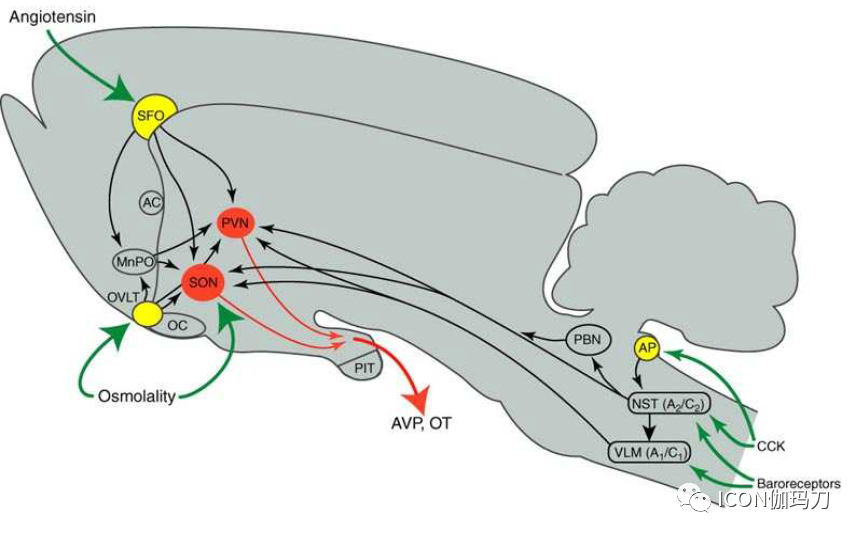
图1.概述了介导精氨酸血管加压素(AVP)和催产素(OT)分泌的下丘脑前部通路。终板的血管器官(OVLT)对高渗特别敏感。高渗透压也激活了下丘脑前部的其他神经元,如穹隆下器官(SFO)和中间视前核(MnPO)的神经元,以及本质上对渗透压敏感的大细胞性神经元。循环血管紧张素II (Ang II)激活SFO的神经元,这是Ang II活动的重要部位,以及贯穿终板和MnPO的细胞。作为对高渗或Ang II的反应,SFO和OVLT到MnPO的投射激活投射到视上核(SON)和室旁核(PVN)的兴奋性和抑制性中间神经元,以调节脑室周围器官对这些区域的直接输入。肠促胰肽酶(CCK)主要作用于终止于孤束核(NST)的胃迷走神经传入,但高剂量时也可作用于极后区(AP)。虽然在腹外侧髓质(VLM)和NST中神经元明显被激活,大多数神经垂体分泌似乎被NST的A2-C2细胞的单突触投射刺激,可能也有非儿茶胺能生长抑素B细胞刺激。压力感受器介导的刺激,如低血容量和低血压,更为复杂。大细胞AVP神经元的主要投射似乎来自于VLM的A1细胞,这些细胞被NST的兴奋性中间神经元激活。其他区域,如臂旁核(PBN),可能参与多突触的投射。终止于NST的颅神经IX和X也向大细胞AVP神经元提供输入。AC,前连合;OC,视交叉;PIT,垂体前叶。
第二个一般原则是,神经垂体合成AVP的能力大大超过了人体日常维持水稳态的需要。仔细地对照研究狗的垂体柄的手术部分已清楚地表明,需破要坏下丘脑中的80 - 90%大细胞性神经元才会产生这类多饮多尿(polyuria and polydipsia)。因此,即使导致破坏AVP大细胞性神经元细胞体病变,必然造成很大程度上的破坏产生中枢性尿崩症(CDI)。最能说明这一点的例子是人类垂体柄的外科切面(surgical section)。对这类患者的尸检研究显示垂体后叶萎缩(atrophy of the posterior pituitary),下丘脑中大细胞性细胞缺失。这种大细胞性细胞的缺失大概是由于手术中轴突被切断的神经元的逆行性变性(retrograde degeneration of neurons)造成的。对于所有的神经元来说,逆行性神经元变性的可能性取决于轴突显微外科手术,这种情况是指垂体柄切开术(in this case section of the pituitary stalk),与神经元细胞体的接近程度。在人类受试者的研究中清楚地显示,在人的鞍隔水平(即垂体柄的“低”位)对垂体柄的损伤,可产生一过性而不是永久性的尿崩症(DI),而在大多数情况下,需要漏斗部的水平(即垂体柄“高”位)的损伤,才会造成永久性尿崩症。
对神经垂体的外科或创伤性损伤后的尿崩症的发生是一种独特的情况,可以遵循几种不同的、明确的模式。有些患者在垂体手术后1-4天出现多尿,并自行消退。一过性尿崩症的发生率会随着蝶鞍手术入路的不同而不同,经鼻内镜下手术的一过性尿崩症发生率为5.1+3.5%,经鼻显微手术的发生率为25.2+13 %(5)。很少有永久性尿崩症。垂体微腺瘤(0.8-1.8%)和垂体大腺瘤(3.8%)切除术后永久性尿崩症的发生率较低,但颅咽管瘤等鞍上病变切除术后永久性尿崩症的发生率较为明显(从病灶次全切除术后的10%到病灶大体全切除术后的25%)。最有意思的是,“三相(triphasic)”反应可因垂体柄的横断(transection)而发生,在最初的尿崩症期之后是短暂的精氨酸血管加压素(AVP)不适当的分泌,然后是尿崩症(DI)复发。这在后续病理生理学中有更详细的讨论。
在一小部分患者中发生的最严重的中枢性尿崩症(CDI)的形式之一是渗透压感受器的功能障碍,也称为渴感缺失尿崩症(adipsic DI)。有大量的动物文献表明,控制AVP分泌和口渴的主要渗透压感受器位于下丘脑前部;在动物中,这一区域被称为“AV3V”区,病变是通过口渴受损和渗透刺激AVP分泌的结合而引起高渗性。最初的人类报告将这种综合征描述为原发性高钠口渴缺乏(11)。根据血症(essential hypernatremia),随后的研究使用渴感缺失的高钠血症(adipsic hypernatremia )一词来识别大多数患者的极度渴感缺乏(the profound thirst deficits)。根据已知的病理生理学,所有这些症状都可以统称为“渗透压感受器功能障碍(osmoreceptor dysfunction)”。虽然导致这种情况的病理原因差别很大,但迄今为止报告的所有患者都是由于与各种不同的脑部病变相关的不同程度的渗透压感受器被破坏所致,如表1所总结的。许多这些相同类型的病变会导致中枢性尿崩症(CDI),但与中枢性尿崩症(CDI)相比,这些病变通常更多发生在下丘脑的吻侧(rostrally in the hypothalamus),与下丘脑前部位置死亡主要渗透压感受器细胞相一致(图1)。这种疾病所特有的病变是前交通脑动脉动脉瘤。因为供应第三脑室前壁的小动脉起源的于前交通脑动脉,动脉瘤在这个区域,但更常见的是在对这类动脉瘤手术修复后可能引起(entail)前交通前动脉的结扎(ligation of the anterior communicating artery),产生包含渗透压感受器细胞的下丘脑部分的梗死。
除了垂体和下丘脑的破坏性和创伤性病变,在成人和儿童中特发性AVP缺乏症是一个大的致病类别。一项针对儿童的研究显示,超过一半(54%)的中枢性尿崩症患者被归类为特发性(idiopathic)。这些患者通常不具备可以与他们的尿崩症相联系的任何损伤或疾病的历史或临床证据,且垂体-下丘脑区域通常显示没有MRI的异常,除了缺失垂体后叶的亮点和有时有不同程度的垂体柄增粗。多项证据线表明,许多这类患者可能是由于自身免疫系统破坏神经垂体而导致他们出现尿崩症。首先,淋巴细胞性漏斗-神经垂体炎(lymphocytic infundibulo-neurohypophysitis)的实体已经被证明存在于特发性尿崩症患者的亚群中。垂体前叶的淋巴细胞浸润,淋巴细胞性垂体炎(lymphocytic hypophysitis),被认为是多年垂体前叶缺乏的原因,但直到对一例尿崩症患者的尸检引起对其垂体后叶的类似发现的注意,才认识到这种病理也出现在神经垂体上。自第一次报告以来,报道了不少类似的病例,包括以淋巴细胞性垂体炎为特征的产后期患者。随着磁共振成像的出现,对于新发病的中枢性尿崩症(CDI)的患者,淋巴细胞性漏斗部垂体炎可以通过在T1加权非对比平扫图像上出现垂体柄增粗和/或垂体后叶亮点的缺失来诊断。垂体柄的增粗可以类似肿瘤的过程,有些病人因为怀疑是垂体瘤而接受手术,但发现垂体柄有淋巴细胞浸润。从那时起,我们追踪了一些怀疑为漏斗部神经垂体炎且无其他明显尿崩症病因的患者,发现随着时间的推移,增粗的垂体柄逐渐消退。有报道数例中枢性尿崩症和腺垂体炎并存的患者,可能是淋巴细胞性漏斗部神经垂体炎和垂体炎的合并的患者)。二线的证据支持在特发性尿崩症的许多情况下,发现在1/3的特发性尿崩症(DI)患者的血清中和2/3的朗格汉斯细胞组织细胞增生症患者的血清中,但不在肿瘤引起的尿崩症患者中有一种自身免疫性病因。最近发现的一种漏斗部神经垂体炎发生在中老年男性,与免疫球蛋白G4 (IgG4)相关的系统性疾病有关。该病中,IgG4浆细胞浸润胰腺等多种器官,神经垂体炎只是可能包括其他内分泌腺体的多器官疾病的一种表现。
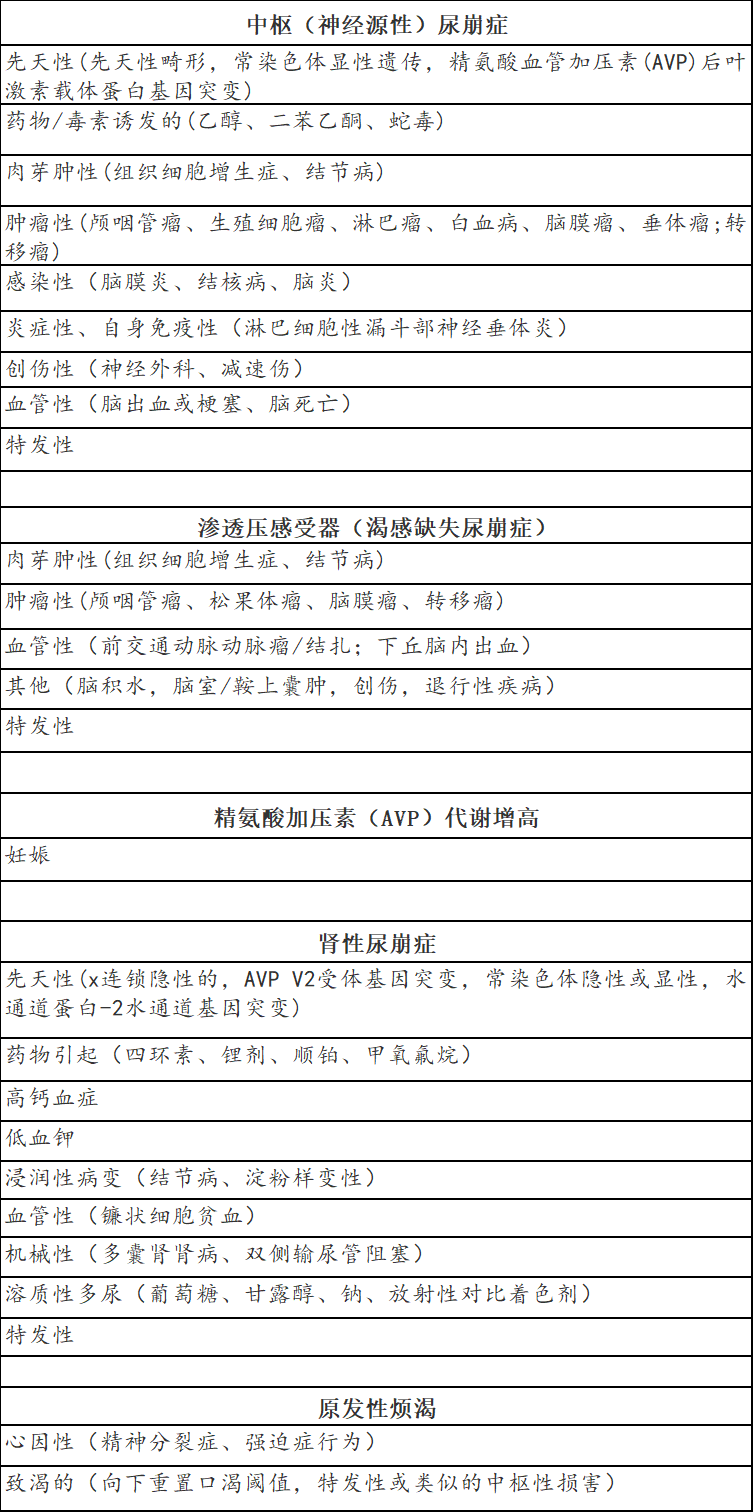
表1.低渗性多尿的病因。
获得性中枢性尿崩症的
病理生理学
尿量与尿液渗透压呈正常的逆相关关系,意味着最初最大AVP分泌量的减少不会引起足以在临床上因为多尿而被检测到的尿量的增加(will not cause an increase in urine volume sufficient to bedetected clinically by polyuria)。一般来说,基础AVP分泌量必须降至<正常的10-20%,然后基础尿液渗透压降至<300 mOsm/kg H2O,尿液流量增加至有症状的水平(即,>50ml/kg BW/d[毫升/公斤体重/天])。由此造成的体内水分的流失会导致血浆渗透压的轻微升高,从而刺激口渴,诱发补偿性多饮(compensatory polydipsia)。因此水摄入量的增加恢复了排尿量的平衡,并使体液渗透压稳定在一个新的略高但仍然正常的水平。随着AVP缺失的增加,这一新的血浆渗透压稳定状态水平接近口渴的渗透压阈值(the osmotic threshold)(图2)。重要的是,要认识到,并不一定要完全的AVP缺失,才会出现多饮多尿;只有当血浆中AVP的最大浓度达到或低于口渴的渗透压阈值时,才不足以浓缩尿液。发生这种失效的神经垂体的破坏程度因人而异,这主要是因为渗透调节系统的设定值和敏感性的个体遗传差异。一般来说,不同严重程度、持续时间,和原因的尿崩症患者的AVP水平功能测试表明AVP分泌能力必须减少至少75 - 80%,才会发生显著的多尿症,这也与接受实验性垂体柄切断的狗的视上核的细胞损失神经解剖学的研究、以及接受垂体手术的病人相符。
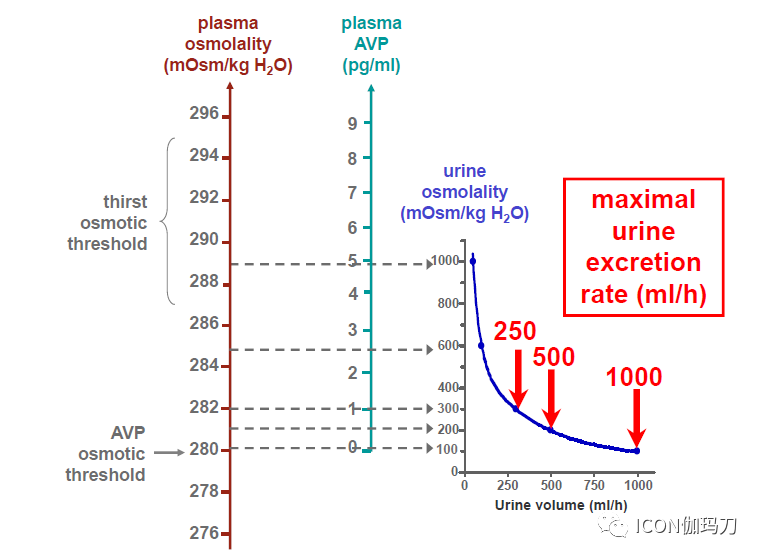
图2.人的血浆渗透压、血浆AVP浓度、尿液渗透压和尿量的关系。AVP分泌的渗透压阈值确定了尿液浓度开始升高的点,但渴感的渗透压阈值稍高,接近尿液浓度达到最大值的点。还需注意的是,由于尿液渗透压与尿液量呈反比关系,在低血浆AVP浓度时,血浆AVP浓度的变化对尿液量的影响要比高血浆AVP浓度时大得多。
由于AVP分泌减少或缺失的肾钠保留机制未受影响,因此不伴有钠缺乏。尽管未经治疗的尿崩症(DI)会导致高渗性和容量耗尽(hyperosmolality and volume depletion),但在水损失变得严重之前,通过将水从细胞内液体(ICF)空间渗透转移到渗透性更浓缩的细胞外液体(ECF)空间,可以使容量耗尽最小化。这种现象在ECF钠浓度([Na+])增加后并不明显,因为这种渗透转移导致血清[Na+]的增加比其他情况下要慢。然而,当注入甘露醇等非钠溶质时,由于细胞内水的转运导致ECF空间,血清[Na+]逐渐稀释减少,这种作用更为明显。因为尿崩症(DI)患者的尿钠保存没有受损,ECF容量一般不会明显减少,维持渗透稳态的调节机制首选被激活(primarily activated):刺激口渴和AVP分泌(无论神经垂体在何种程度上仍能分泌AVP)。在AVP分泌完全缺失(完全性尿崩症[DI])的情况下,患者完全依赖饮水来维持水平衡。然而,在分泌AVP的剩余能力仍然存在(部分性尿崩症[DI])的情况下,血浆渗透压最终可达到尿浓度的中等程度(例如200-500 mOsm/kg H2O)。
在垂体柄的横断或损伤后,会出现典型的三相反应(图3A)。最初的尿崩症(DI)(第一相)是由于轴突休克和受损神经元的功能缺失。这一相持续数小时至数天,随后是第二相,是由于分离退化的垂体后叶不受控制地释放AVP。在第二相过度积极输液不会抑制AVP分泌,并可导致低钠血症。抗利尿可持续2-14天,在此之后,由于退化的垂体后叶耗竭AVP,尿崩症复发(第三相)。在经蝶窦入路垂体微腺瘤手术后,曾有不伴有之前或之后的尿崩症的一过性低钠血症的报道,通常发生于术后5-10天。仔细随访此类患者时,发生率可高达30%,尽管大多数病例为轻度和自限性。这是因为通过在三相反应中的相同的机制不适当地AVP分泌,但只有在第二相(“孤立的第二相”)才会发生这种情况,因为最初的垂体神经叶/垂体柄的破坏不足以损害AVP分泌,而足以产生尿崩症(DI)的临床表现(图3 B)。
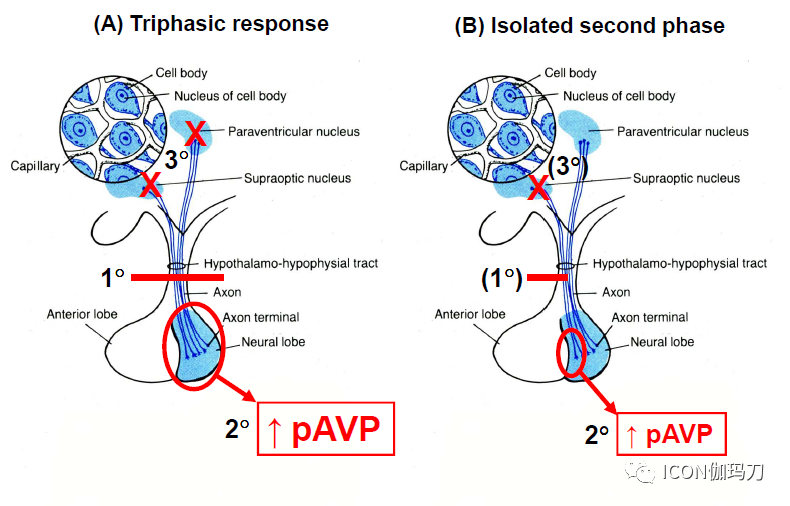
图3.尿崩症(DI)三相模式和孤立的第二相的病理生理学机制。A,在三相反应中,第一相的尿崩症在作为下丘脑AVP神经元体与垂体后叶神经末梢之间的连接垂体柄被部分或完全切断后开始,从而阻止受刺激的AVP分泌(1)。几天后是由于从垂体后叶的退化神经末梢不加控制地释放AVP进入血流造成的SIADH的第二相(2)。储存在垂体后叶的所有AVP被释放后,如果下丘脑中超过80% - 90%的AVP神经元体发生了逆行性变性,则尿崩症再次进入第三相(3)。B,在孤立的第二相,垂体柄受伤,但未完全被切断。虽然由于垂体柄受伤最大的AVP分泌反应将减少,如果所受损伤留下至少10%到20%的完整的神经纤维连接在下丘脑中的AVP神经元细胞体和垂体腺后叶的神经终端,不会导致尿崩症(1)。然而,几天之后是第二相是由受伤或切断的垂体后叶退化的神经末梢不加控制地释放AVP引起的的SIADH(2)。由于垂体后叶的一小部分被去神经支配,AVP的大小量级被释放为垂体退化比完全三相反应更小,持续时间更短。储存在垂体后叶损伤部位的AVP全部释放后,第二相中止,但如果下丘脑中低于80% - 90%的AVP神经元体发生退行性变性,就不会发生临床尿崩症(3)。
一旦AVP分泌不足出现数天或数周,即使导致神经垂体破坏的根本原因被消除,也很少会再有改善。主要的例外发生在术后尿崩症患者中,通常会自行消退。虽然持续超过几周的术后中枢性尿崩症(CDI)恢复较为少见,但有文献证明有长期恢复的病例报道。从垂体柄切断后的神经垂体组织的病理学和组织学检查可以明显看出改善和解决的原因。有完整核周体(intact perikarya)的神经垂体神经元能够再生轴突,形成新的神经末梢,能够将AVP释放到附近的毛细血管中。在动物中,这可能伴随着在切断的垂体柄末端的球形生长(a bulbous growth at the end of the severed stalk),这代表一个新的,虽然很小的神经叶(a new, albeit small, neural lobe)。在人类,再生过程似乎进行得更慢,新的神经叶的形成还没有被检测到。尽管如此,在垂体切除术18个月后,对病人的切断的人垂体柄的组织学检查显示,神经垂体部纤维与神经分泌颗粒在附近的血管附近重组,与正常垂体后叶的组织学非常相似。
人们认识到大多数中枢性尿崩症(CDI)患者保留有限的能力,以分泌一些AVP,从而让人理解该疾病一些其他令人费解的特点。例如,在许多患者中,长时间限制饮水只会使血浆渗透压升高1-2%,从而导致分泌足够的AVP使尿液浓缩。随着血浆渗透压的进一步增加,部分尿崩症(DI)患者甚至可以分泌足够的AVP,达到接近最大的尿渗透压。然而,这并不会导致对尿崩症诊断的混淆,因为在这类患者中,在血浆渗透压正常范围内,尿液渗透压仍将处于不适当的低水平,而外源性AVP给药会使尿液渗透压进一步升高。这些对脱水的反应说明在大多数情况下AVP缺乏症的相对性质,强调了口渴机制的重要性,以限制在随意饮水的基本条件下(under basal conditions of ad libitum water intake),使用剩余的AVP分泌能力的必要性。
中枢性尿崩症(CDI)还与AVP的肾脏反应变化有关。最明显的变化是由慢性多尿引起的最大浓缩能力的降低。这方面缺陷的严重程度与多尿的程度成正比,与病因无关。正因为如此,在所有类型的尿崩症(DI)中,达到最大有效血浆AVP水平的尿液浓度水平都降低了。从实验动物中AQP2表达的研究中获得的关于肾浓度机制的信息表明,一种肾源性尿崩症 (NDI)可能与所有类型的尿崩症以及原发性多饮症有关。有中枢性尿崩症(CDI)基因的Brattleboro大鼠肾脏水通道蛋白-2 (AQP2)表达水平较Long-Evans对照大鼠组低;用AVP或去氨加压素治疗可以纠正AQP2水平,但这一过程需要3至5天,在此期间尿液浓度仍然低于正常水平,虽然药理上AVP浓度很高。同样,慢性过度饮水对AVP的生理抑制会导致肾集尿管中AQP2的下调。临床上,中枢性尿崩症(CDI)和原发性多饮症患者在进行水剥夺试验以区分不同的尿崩症(DI)病因时,给予去氨加压素往往不能达到最大浓度的尿液。长期以来,该效应被归因于多尿患者高尿流量率(the high urine flow rates)导致的髓质浓度梯度的冲刷(washout of the medullary concentration gradient);然而,根据动物研究的结果,似乎对AVP的反应下降至少部分是由于肾脏AQP2表达的下调。因此,未经治疗的中枢性尿崩症(CDI)患者也有肾性尿崩症(NDI)的组成部分,这在AVP或AVP类似物治疗后是可逆的,可以恢复肾集尿管中正常的AQP2水平。这就解释了为什么中枢性尿崩症(CDI)患者在接受抗利尿剂治疗后需要一段时间,通常是几天,才能恢复最大的尿液浓度。
渗透压感受器功能障碍,又称(a.k.a)渴感消失尿崩症(adipsic DI),的患者的主要缺陷是调节渴感的渗透压感受器的缺乏或功能障碍。除了罕见的例外,虽然激素对非渗透性刺激的反应保持完整,AVP的渗透压调节也受损。四种主要的渗透压感受器功能障碍的模式被描述为口渴和/或AVP分泌反应的缺陷:(a)对渴感和AVP分泌两方面的渗透稳定器(osmostat)的向上重置(在异常的高血浆渗透度下正常的渴感和AVP的反应),(b)部分渗透压感受器破坏(在所有的血浆渗透度下钝化的AVP和渴感反应),(c)全部的渗透压感受器破坏(无论血浆渗透度如何,缺乏AVP分泌和渴感),和(d)伴有完整的AVP分泌的渴感渗透压调节(thirst osmoregulation)选择性障碍(12)渗透调节。不管实际的模式如何,这种疾病的标志是除了AVP分泌的各种缺陷之外,属于异常的渴感反应。因此,当血浆渗透压升高时,这些患者不能充分饮水,从而导致新的血浆渗透压设定值远远高于正常的渴感阈值。与多饮的中枢性尿崩症患者血浆渗透压维持在正常范围不同,渗透压感受器体功能障碍的患者的渗透压通常在300-340 mOsm/kg H2O范围内。这再次强调了正常的渴感机制在维持体液内稳态中的关键作用;在这种情况下,仅靠完整的肾功能不足以将血浆渗透压维持在正常范围内。
渗透压感受器功能障碍的患者的高渗和高渗性脱水(hyperosmolality and hypertonic dehydration)的发展速度和严重程度受多种因素的影响。首先是维持一定程度的渗透刺激渴感和AVP分泌的能力,这将决定血浆渗透压的新设定点。第二,影响水排出率(the rate of water output)的环境影响。当身体活动很少且环境温度不升高时,肾脏失水和不显性失水(insensible water loss)的总体比率较低,而患者的饮食可能足以长时间维持相对正常的水平衡。任何增加排汗、呼吸、或排尿量的都会大大加快失水的速度,并暴露出患者无法适当地补充水分摄入。在这种情况下,严重甚至致命的高钠血症会较快发展。脱水只有中等度时(血浆渗透压在300 - 330 mOsm /kgH2O),病人通常无症状,有体积损耗最小的迹象,但如果脱水变得严重,病人会出现血容量减少的症状和体征,包括虚弱、姿势性头晕、意识模糊、昏迷、氮质血症(azotemia)、高血糖症、和继发伴有低血钾的醛固酮增多症(hyperaldosteronism with hypokalemia)。在严重的病例中,还可能出现横纹肌溶解症(rhabdomyolysis),伴血清肌酶明显升高(marked serum elevations in muscle enzymes),偶尔还会出现急性肾功能衰竭。
第三个因素也主要影响这些患者的高渗和脱水程度(the degree of hyperosmolality and dehydration)。对于所有渗透压感受器功能障碍的患者,重要的是要记住,从脑干到下丘脑的传入通路是完整的;因此,这些患者对如低血容量和低血压等压力感受器介导的刺激(baroreceptormediated stimuli)或如恶心等其他非渗透压刺激,通常有正常的AVP和肾浓缩反应。这样就有防止严重脱水的作用,因为随着血容量减少的发展凭借通过脑干的压力感受器通路将刺激AVP分泌(图1)。虽然有保护作用,这种效应经常引起意思模糊(confusion),因为有时这些病人似乎还而表现出经典的中枢性尿崩症,在其他时间他们可以浓缩尿液到正常水平。尽管如此,不管在不同时间尿液浓度是否明显正常,存在伴无渴感或不适当渴感的难治性高渗(refractory hyperosmolality with absent or inappropriate thirst),应提醒临床医师注意存在渗透压感受器的功能障碍。
在少数有渗透压感受器功能障碍的患者中,已发现强迫的水化(forced hydration)会导致低钠血症,与不适当的尿液浓度有关。这个矛盾的缺陷与抗利尿激素分泌不当综合症中的所见相似,被假定是由于两种不同的致病机制。一种是由于渗透抑制能力的丧失和激素分泌的刺激而持续或固定的AVP分泌。这些观察,以及电生理数据强烈表明渗透调节系统是双峰的(即,它是由对神经垂体的抑制和刺激输入组成)。稀释缺陷的另一个原因似乎是对AVP的抗利尿作用的超敏反应,因为在一些患者中,即使血浆中检测不到激素,尿液渗透压也可能升高。
在没有明显下丘脑病变的老年人中,渴感减退(Hypodipsia)也是一种常见现象。在这种情况下,尚不清楚是下丘脑渗透压感受器、在它们对皮质的投影中存在缺陷,还是存在于其他一些调节机制中。然而,在大多数情况下,渗透压感受器可能无关,因为基底的和刺激下的血浆AVP水平被发现是正常的,甚至是高度反应的(even hyper-responsive),与老年人血浆渗透压有关联,除了只有少数研究显示减少血浆AVP水平与血浆渗透压有关联。




