《Chinese Clinical Oncology》杂志2020年8月17日在线发表美国宾州费城Thomas Jefferson University的 Martinez NL, Khanna O, Farrell CJ.撰写的综述《靶向治疗颅底脑膜瘤、垂体腺瘤、颅咽管瘤的叙述性综述。A narrative review of targeted therapy in meningioma, pituitary adenoma, and craniopharyngioma of the skull base.》(doi: 10.21037/cco-20-168.) 。

累及颅底的实体瘤(solid tumors)的治疗主要通过手术和放射治疗,虽然靠近重要的血管和神经解剖结构,往往会限制切除术的范围和允许的放射剂量。脑膜瘤是成人最常见的原发性脑瘤,虽然大多数颅底脑膜瘤是低级别的,但由于其位置靠近关键解剖结构,因此妨碍(preclude)进行积极的手术切除,而较大的肿瘤往往对放射治疗产生抵抗性。在患有临床上进袭性(aggressive)、不可切除的脑膜瘤的患者中,几个血管生成的分子生物标志物以及基因突变(SMO、AKT1、PIK3CA、KLF4、POLR2、SMARCE1和TRAF7)已被证明在这些肿瘤的病理生理学中发挥了关键作用。垂体腺瘤通常是生长缓慢的肿瘤,适合手术切除,但Ki67增殖指数较高的肿瘤复发风险增加,与对标准治疗的抵抗性相关。虽然只有很少的成果(albeit with limited success),已经试验过化疗药物和检查点抑制剂,以治疗这类进袭性(aggressive)垂体腺瘤。颅咽管瘤被分类为造釉细胞型(adamantinomatous)和乳头型(papillary)亚型,每一类有独特的分子机制来驱动这些肿瘤的发病,而引入的靶向治疗可能被研发用来改善神经和内分泌结果的可能性。颅底肿瘤在手术切除和放射治疗后仍然复发是一个独特的挑战,而全身性药物为传统方法难治性(refractory)的肿瘤提供了一种非侵袭性的治疗选择。最近对分子畸变(the molecular aberrations)的认识阐明了这些难以治疗的肿瘤的病理生理学,为给药治疗(the drug delivery)提供了潜在的治疗靶点。在这篇综述中,作者讨论了对脑膜瘤、垂体腺瘤和颅咽管瘤研发有效靶向药物的前景和目前的知识空白。

颅底区域的肿瘤通常生长缓慢且呈良性,但当症状出现时通常会进行干预。这些疾病的管理具有挑战性,通常需要多学科的方法来优化治疗结果和质量。手术是治疗的核心,然而,完全切除可能被附近的关键血管和神经解剖结构(如颅神经)所阻止,并且随着时间的推移,残留的肿瘤可能会生长。放疗是有益的,经常用于不可切除的或残留的肿瘤,但它对多次复发的肿瘤的应用也受到限制。
全身系统性药物如化疗在过去已经被探索过,通常都是无效的,虽然肿瘤生物学知识的提高已经带来系统性药物选择的有前庭的发展。在这篇综述中,我们讨论与靶向治疗的发展有关的分子学和遗传学当前对脑膜瘤、垂体腺瘤和颅咽管瘤的理解。根据我们叙述性综述报告清单(Narrative Review reporting checklist)(http://dx.doi.org/10.21037/cco-20-168)提出以下文章。

检索PubMed的文献以确定与颅底脑膜瘤、垂体腺瘤和颅咽管瘤对标准手术和放疗抵抗性相关的基础科学研究、临床研究和病例报告。文献检索没有出版发表限制,也没有纳入或排除标准。作者提供了这些研究的发现和意义的叙述摘要,以及它们如何适用于改善我们自己的患这些疾病的患者的临床医疗。
脑膜瘤是成人原发性脑瘤的最常见类型。肿瘤起源于包裹大脑和脊髓的脑膜蛛网膜层的祖细胞,其临床表现是多样性的:30%表现为癫痫发作。由于沿脑部凸面或矢状窦旁区域的肿块占位效应,且有同等比例的可能会如因颅底侵蚀(encrochment of the skull base)造成听力受损、嗅觉丧失,或视觉变化出现症状。脑膜瘤的行为可以通过组织学分级部分地预测。目前世界卫生组织(WHO)根据核异型性(nuclear atypia )、有丝分裂活性(mitotic activity )、对邻近结构侵袭(invasion of adjacent structures )、和出现坏死(presence of necrosis )等特征,将复发风险划分为三个级别。此外,每个级别又细分为许多亚型,其中一些亚型对颅底有偏好。大约80%的脑膜瘤为良性(I级),复发率低(7-20%)。其余的被分类为不典型的(II级)或间变性(III级),并与显著缩短的复发间隔和较高的死亡率(40-70%)相关。
外科手术干预通常是处理大的或有症状的肿瘤的第一步。与次全切除术(STR)相比,大体全切除术(GTR)具有较好的局部控制和无进展生存,与分级无关。然而,由于肿瘤靠近关键的血管或重要的脑部结构,完整的切除术并不总是可行的,这通常发生在颅底区域。对选定的患者,特别是那些临床上进袭性的(aggressive),不能切除的脑膜瘤,可以采用放疗作为辅助或主要的治疗措施,希望改善局部控制而非单纯观察。分割外放射治疗(EBRT)和立体定向放射外科(SRS)均已得到使用,而且选择实施取决于靶体的大小和肿瘤的级别。对于小的I级或II级病变,SRS治疗是一种被广泛接受的技术,而EBRT则推荐用于需要较大剂量(50-60 Gy)以实现局部控制的III级脑膜瘤。然而,这些患者中仍有一小部分人对标准干预仍属难治性的(refractory);因此,已经探索了许多全身系统性药物,包括激素受体抑制剂、生长抑素类似物和常规化疗,但没有一种能证明有可重复的获益(reproducible benefit )。随着分子的和基因组技术的进步,我们对肿瘤生物学和治疗干预的潜在靶点的理解也在进步。
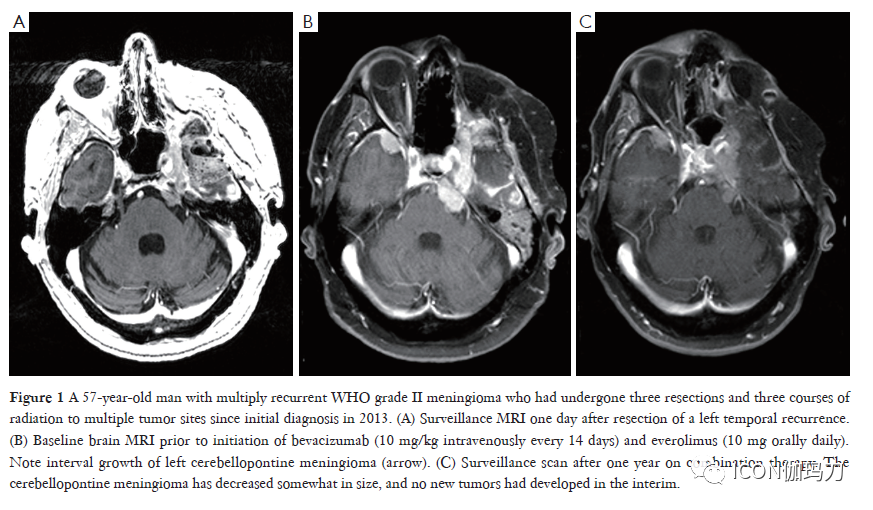
细胞信号通路的畸变(Aberrations)可启动下游效应,促进脑膜瘤的发展。阐明哪些生长因子和下游信号通路对发病机制至关重要是一个挑战,并将继续衍变(evolve)。血管内皮生长因子(VEGF)和血小板衍生生长因子(PDGF)与脑膜瘤的生长有关,是潜在的治疗靶点。脑膜瘤是高度血管化和有包括VEGFde 血管生成因子表达的。脑膜瘤提取物已被证明在体外诱导内皮细胞趋化( induce endothelial chemotaxis)和毛细血管样管腔形成( capillary-like tube formation),VEGF含量与脑膜瘤级别呈正相关,但与富血管分布(vascularity)或侵袭性无关。VEGF还参与瘤周水肿的发展,这是高级别脑膜瘤发病的一个原因。抗VEGF的抗体可有效控制症状性水肿和肿瘤生长。在一项回顾性研究中,与如细胞毒性化疗、生长抑素类似物和酪氨酸激酶抑制剂等其他系统性治疗相比,贝伐珠单抗(bevacizumab )(一种抗VEGF-A的人源化单克隆抗体)在减缓肿瘤生长和减少瘤周水肿方面最为有效。一项评估贝伐珠单抗联合哺乳动物雷帕霉素(mammalian target of rapamycin )靶向抑制剂依维莫司(everolimus )治疗难治性进行性颅内脑膜瘤的2期单组研究显示有良好的结果(图1)。虽然该研究因缓慢累积而提前终止,但在接受研究性治疗的患者中,88%(15/17)的病情稳定;在这15例患者中,有6例病情稳定超过一年。II级和III级脑膜瘤患者中位无进展生存期(mPFS)(22个月)高于I级患者的(17.5个月)。这种治疗的耐受性相当好,因为不常见3级和更高级别的毒性。然而,小型样本量是少的,结果需要更大型的试验确认。单药贝伐珠单抗在复发或进展性脑膜瘤患者中的前瞻性2期试验结果已关闭,结果(to accrual)即将到来(NCT01125046)。
图1. 1例57岁男性多发性复发的WHOII级脑膜瘤,自2013年首次诊断以来,多个肿瘤部位共接受过3次手术和3个疗程的放疗。(A)左侧颞部复发切除术后一天的MRI监查。(B)开始使用贝伐珠单抗(每14天静脉注射10 mg/kg)和依维莫司(每天口服10 mg)前的基线脑部MRI。注意左侧桥小脑角脑膜瘤的间隔生长(箭头)。(C)联合治疗一年后的扫描监测。脑桥小脑脑膜瘤大小有所缩小,在此期间未出现新的肿瘤。
也有证据表明血小板衍生生长因子(PDGF)在脑膜瘤细胞生长中的重要性,并为进行性或复发性脑膜瘤患者检测PDGF抑制剂提供了依据。北美脑肿瘤联盟(the North American Brain Tumor Consortium )(NABTC 01-08)进行了一项2期研究,评估了PDGF受体(PDGFR)抑制剂,甲磺酸伊马替尼(imatinib mesylate ,)的治疗潜力。口服药物的耐受性一般良好,虽然疗效数据令人失望。在19例可评估反应的患者中,10例患者在第一次扫描时进展,9例患者病情稳定。在另一项2期研究中,联合应用伊马替尼和羟基脲(hydroxyurea )的效果是适度的,只有30%(4/13)的II级或III级脑膜瘤患者病情稳定超过6个月。因此,开发新型的、多靶向的药物越来越受到人们的关注。舒尼替尼(sunitib)是一种靶向VEGF受体(VEGFR)和血小板衍生生长因子受体(PDGFR)的小分子多靶点受体酪氨酸激酶(RTK)抑制剂,甚至在接受过大量先前治疗的(in heavily pre-treated )高级别脑膜瘤患者中表现活跃;然而,毒性令人担忧。在2期试验中,42%的患者存活,且在6个月(PFS-6)时没有疾病进展,但有60%的患者出现严重不良反应(adverse event)。另一种多靶点受体酪氨酸激酶(RTK)抑制剂,Vatalanib(瓦拉他尼)在II级和III级脑膜瘤中显示6个月的无进展生存率(PFS-6)为54.4%,但由于该研究主要针对(was powered for )I级脑膜瘤,因此尚不清楚2期试验是否阳性,这仍然是该研究的主要局限性。
与专注于分子靶向的大量工作相比,理解脑膜瘤生长的基因组驱动因素的努力有所增加。脑膜瘤肿瘤发生中最常见的基因改变包括位于22号染色体上编码merlin蛋白的肿瘤抑制因子NF2基因的突变或杂合性的缺失(mutations or loss of heterozygosity of the tumor suppressor gene NF2 )。受NF2种系突变影响的个体发展为神经纤维瘤病2型(NF2),在其他良性肿瘤如神经鞘瘤和室管膜瘤中更容易发生脑膜瘤。虽然散发性脑膜瘤更为常见,但它们也常常是受这种突变驱动的,这种突变与(WHO I级的)纤维性或过渡性(fibrous or transitional )相关。与颅底相比,沿脑的凸面更为常见。Merlin参与了如调节细胞形状、生长固定的mTOR等关键信号通路。在缺乏merlin的脑膜瘤细胞中,由于雷帕霉素复合物2 (mTORC1)和mTORC2的下游作用解除,细胞增殖和存活增加。在临床前研究中,mTORC1抑制剂如依维莫司和替西罗莫司(temsirolimus ),以及mTORC1和mTORC2双抑制剂vistusertib (AZD2014)显示了抑制脑膜瘤细胞生长的良好活性,并已得到进一步的人体研究。在II期试验中,联合应用贝伐珠单抗(每14天10 mg/kg IV静注)和依维莫司(每日10 mg 口服PO),15/17(88%)的患者疾病稳定(SD);6例疾病稳定(SD)超过12个月。vistusertib对复发性、进行性或症状性脑膜瘤患者的疗效目前正在两个2期试验(NCT03071874、NCT02831257)中进行研究。在对神经纤维瘤病2型(NF2)和进展性或症状性脑膜瘤患者的单中心非盲(open-label )研究中,18例患者每周连续两天接受vistusertib 125 mg BID(一天两次)治疗。在5-10%的神经鞘瘤和脑膜瘤中发现有以较基线下降20%来定义的放射影像学的反应,但17%的靶脑膜瘤进展。此外,7例病人(39%)因难以耐受包括疲劳、厌食、恶心、呕吐、皮疹和粘膜炎(Plotkin S, 2018,未发表数据)的副作用,选择停止治疗。尚不清楚肿瘤缩小与TORC1/2通路激活之间的关系。
新一代测序技术可以识别在NF2以外的基因中反复出现的一些突变,包括SMO、AKT1、PIK3CA、KLF4、POLR2、SMARCE1和TRAF7,这些突变与NF2相互排斥。含有这些突变的脑膜瘤在颅底和组织学亚型中也表现出突变特异性位置。大多数SMO、AKT1和PIK3CA突变型脑膜瘤发生在前颅底,且与I级脑膜上皮亚型( meningothelial subtype )密切相关。Smoothened(Smo)是由SMO编码的跨膜蛋白,在Hedgehog (Hh)信号通路中不可或缺,在胚胎发生中发挥关键作用。小分子药物vismodegib对Smo的抑制,目前正与新型FAK抑制剂GSK2256098 (NCT02523014)联合研究中。
AKT1编码RAS -α丝氨酸酶/苏氨酸蛋白激酶(the enzyme RAS-alpha serine/ threonine-protein kinase ),通过磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinase PI3K)/Akt/mTOR通路激活,抑制细胞凋亡。与AKT1型脑膜瘤相比,含有激活AKT E17K突变的I级脑膜瘤复发时间较短。对有AKT1突变实体肿瘤患者的多队列篮子研究(A multicohort basket study )证明(全)pan-Akt抑制剂AZD5363治疗是安全有效的。虽然脑膜瘤患者没有包括在本研究中,但Weller等人报告了一个令人鼓舞的病例,其中一例患者多次复发,转移到肺部的脑膜内皮型脑膜瘤(meningothelial meningioma )在抢救性AZD5363(按四天每天两次给予480毫克/休息三天的方案),17个月后多处肿瘤部位达到疾病稳定的工作)。进一步探索对这个脑膜瘤亚组的靶向治疗是必要的。
约7%的NF2野生型脑膜瘤涉及与SMO和AKT1相互排斥的PIK3CA,约25%的与肿瘤坏死因子受体相关因子7 (TRAF7)有突变,TRAF7参与泛素化,可与AKT1或Kruppel样因子4 (KLF4)基因共发生(co-occur)。TRAF7和KLF4均见于(WHOI级)分泌性脑膜瘤,多位于岩斜或颅底中线。目前,尚不清楚TRAF7或KLF4的致瘤作用,需要进一步研究才能开发出有效的靶向药物。
与I级脑膜瘤相比,II级和III级脑膜瘤表现出较少的如SMO、AKT1或PIK3CAfrng 体细胞靶向性突变。相反,高级别脑膜瘤更有可能表现出高突变负担( high mutational burden)、高频微卫星不稳定性( high-frequency microsatellite instability)(MSI-H)和因拷贝数改变而导致的错配修复(MMR)缺陷。与特定的驱动程序改变相比,这些更具有挑战性的靶选择性,可能对更广泛的方法有更积极的反应。对如阻滞程序性死亡1受体(PD-1)等的免疫治疗的调查研究是由一些被观察的高级别脑膜瘤支持的:一些突变预测是免疫原性,表达PD-1及其配体(PD-L1)增加,以及脑膜瘤的微环境包含一个选择性的,抗原刺激过的(antigen-experienced)效应的T细胞有耗竭的表型(exhausted phenotype )的标志物数量丰富的表达。一些II期临床试验正在积极招募以评估如派姆单抗(pembrolizumab)、纳武单抗(nivolumab)和伊匹单抗(ipilimumab)等检查点抑制剂在复发或残留的高级别脑膜瘤治疗中的疗效(NCT02648997、NCT03279692,NCT03604978 NCT03173950)。
手术和放射治疗仍然是对扩大的、有症状的脑膜瘤的最初管理治疗的核心,对肿瘤生物学基础的更好的理解已经细化了系统性治疗的选择。药物的选择将可能取决于分子和遗传分析(molecular and genetic profiling ),而高级别脑膜瘤对高选择性药物的反应,并不像非NF2突变的WHOI级脑膜瘤那样有利。无论如何,早期的数据是有希望的,并给那些用尽了所有其他选择的病人控制疾病的希望。
垂体腺瘤(PA)约占原发性颅内肿瘤的10-20%,可能由于激素分泌过多或压迫视神经、视交叉和海绵窦等周围结构而引起临床症状。大多数这些肿瘤是良性的和缓慢生长的,是使用包括手术切除和辅助放射治疗等标准治疗高度可治疗的。而经蝶窦或经颅手术切除仍是大多数有症状的垂体腺瘤的主要治疗方法,切除的范围高度依赖于许多因素,包括肿瘤的大小、一致性和侵犯鞍旁和鞍上区域。次全切除术后,50-60%的腺瘤将继续进展,即使在大体全切除后,长期随访下复发的病例可达30%。辅助放射治疗常用于残留和复发垂体腺瘤的治疗,通常采用立体定向放射外科(SRS)、常规适形放疗或分割立体定向放射治疗(FSRT)。对于无功能腺瘤(NFPA),放射治疗的目的通常是控制肿瘤,对于有分泌激素功能的腺瘤,放射治疗的目的是控制肿瘤和缓解内分泌。SRS是治疗复发性垂体腺瘤最常见的方法,5年随访的无功能垂体腺瘤(NFPA)肿瘤控制率为94-100%,10年随访的无功能垂体腺瘤的肿瘤控制率为76-87%。SRS通常在单个疗程内实施,边缘剂量为12-18Gy。SR治疗后的照射后的神经功能减退和垂体功能低下的发生率分别占患者的7%和39%。放射治疗的其他潜在并发症包括有症状的放射坏死、继发性肿瘤和放射诱发的血管性病变。对于对药物治疗有抵抗耐药且不适于进一步手术的复发性功能性腺瘤,放射治疗在诱导激素缓解方面也起着重要作用。与无功能垂体腺瘤的肿瘤控制相比,接受SRS治疗的分泌ACTH的腺瘤的内分泌缓解率在28-70%之间,需要较高的辐射剂量来诱导缓解。
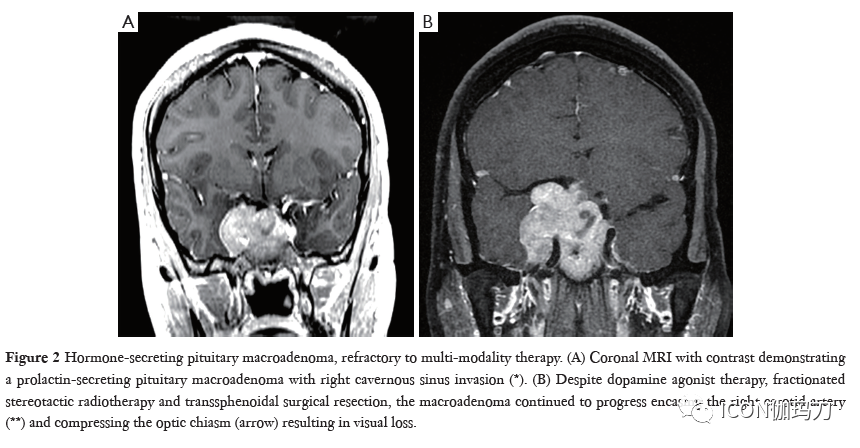
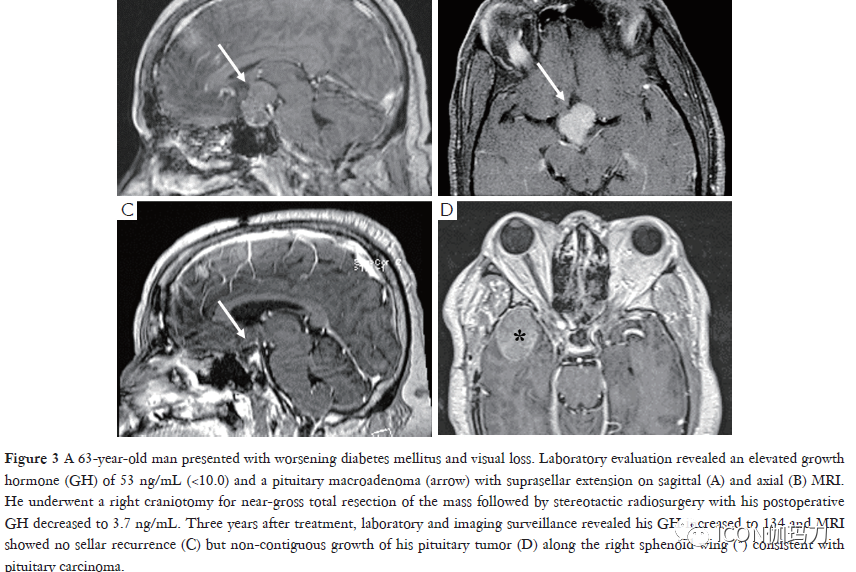
一小部分垂体肿瘤,根据其临床表现和对标准手术、放疗和药物治疗的抵抗性,被归类为进袭性(aggressive)垂体腺瘤(APA)。对进袭性垂体腺瘤(APA)的明确定义仍存在争议,但是,最新的第4版的EHO垂体腺肿瘤的分类(2017)承认的重要性有丝分裂计数增加,Ki67增殖指数(>3%)高,和肿瘤的侵袭性作为有增加的复发风险和抗标准化治疗的临床上进袭性腺瘤的病理标志物(图2)。此外,几个亚型有高复发概率的垂体神经内分泌肿瘤包括静默性促肾上腺皮质激素腺瘤、稀疏颗粒性生长激素细胞腺瘤、男性泌乳素细胞腺瘤、Crooke细胞腺瘤和多激素Pit-1阳性腺瘤。这个新的病理分型使肿瘤分型更为准确,并改善对进袭性临床行为的预测,以更好地评估和指导我们的治疗。2017年WHO指南继续定义垂体癌为存在非相邻的颅脑脊髓或系统性转移,而垂体癌和垂体腺瘤在组织学上无法区分(图3)。幸运的是,垂体癌仍然少见,仅占垂体肿瘤的0.2%,但相关的1年死亡率高达66%。在2016年欧洲内分泌学会(ESE)关于进袭性垂体瘤治疗的调查中,进袭性垂体腺瘤(APA)的死亡率接近于垂体癌,这表明需要改进化疗和靶向分子治疗来治疗这些具有挑战性的肿瘤。
图2.分泌激素的垂体大腺瘤,对多模式综合治疗呈难治性(refractory)。(A)冠状位磁共振对比显示垂体分泌泌乳素的大腺瘤,伴右侧海绵窦侵袭(*)。(B)虽然使用了多巴胺激动剂、分割立体定向放射治疗和蝶窦手术切除,大腺瘤仍继续进展,包绕右颈动脉(**),压迫视交叉(箭头),导致视力丧失。
图3.一例63岁男性患者,伴糖尿病加重,和视力下降。实验室评估显示生长激素(GH)升高53 ng/mL (<10.0)和垂体大腺瘤(箭头),矢状位(a)和轴位(B) MRI显示有鞍上伸展。他接受右侧开颅手术,肿块几乎被全部切除,随后接受了立体定向放射外科治疗,术后GH降至3.7 ng/mL。治疗3年后,实验室及影像检查显示其GH增加至134,MRI显示无鞍区复发(C),但垂体肿瘤沿右蝶骨翼非邻近生长(D),符合垂体癌(*)。
最近,在理解垂体腺瘤肿瘤发生的遗传景观方面取得了重大进展。垂体腺瘤的主要病理机制似乎涉及由于表观遗传学改变引起的细胞周期调节和生长因子信号的变化。分别携带GNAS和USP8基因的体细胞突变的分泌生长激素的腺瘤和分泌ACTH的腺瘤的体细胞和种系突变更为罕见。在USP8阴性的库欣病患者中也发现了USP48和BRAF的突变。更为罕见的是,种系突变与家族性肿瘤综合征相关,包括多发性内分泌瘤1型(MEN1)和4型(MEN4)综合征、Carney复合征和McCune-Albright综合征。而识别种系和体细胞的遗传缺陷有助于我们了解垂体腺瘤的发病机制,尚不清楚导致大多数垂体腺瘤的确切分子机制,完全阐明和这些分子亚群的差别在治疗方面仍然具有有限的临床相关性。
考虑到垂体腺瘤的复杂基因组景观,对进袭性垂体腺瘤和垂体癌已经尝试了各种各样的治疗方法,但大多效果不佳。迄今为止,最常用的治疗方法是烷基化化学疗法,此前已批准用于其他中枢神经系统恶性肿瘤。在2006年,一系列的病例报告描述了进袭性垂体腺瘤在使用替莫唑胺(TMZ)单药治疗后的退缩。最近,McCormack和同事们报告了欧洲内分泌学会(ESE)关于进袭性垂体腺瘤(APA)和垂体癌(PC)治疗的调查结果。该调查包括157例接受替莫唑胺(TMZ)一线化疗的患者,报告37%的患者表现出影像学应答,其中6%完全退缩。大多数患者按照胶质母细胞瘤患者所使用的“Stupp”标准方案给予TMZ治疗(TMZ 75mg /m2 /天,其后为TMZ 150 - 200mg / m2 /天,每28天连用5天)。治疗的中位持续时间为9个月,23%的患者在3个月内和59%的患者在6个月内出现最大的放射影像学反应。与无功能垂体腺瘤(NFPA)相比,TMZ对激素性功能肿瘤的反应较好,与对胶质母细胞瘤的反应相似,DNA修复酶O(6)-甲基鸟嘌呤甲基转移酶(MGMT)活性水平的降低与临床反应改善有关。基于这些结果,ESE关于进袭性垂体腺瘤(APA)和垂体癌(PC)的管理指南目前推荐使用TMZ单药治疗作为已经记录到有肿瘤生长的这些肿瘤的一线化疗。ESE建议在三个TMZ周期后评估放射影像学反应,对于表现有临床反应或稳定的肿瘤继续治疗至少6个月。关于进袭性垂体腺瘤(APA)和垂体癌(PC)长期治疗的数据很少,但TMZ的单药治疗通常持续到观察到有进展时。
只有有限的数据用来指导TMZ给药后继续进展的进袭性垂体腺瘤(APA)和垂体癌(PC)的二线治疗。临床前和临床研究已经确定了几个治疗垂体腺瘤的内在靶点,包括生长因子及其受体和细胞内信号通路。有13例报告了VEGF的抑制,其中9例对单药抗VEGF治疗或联合治疗(TMZ、帕瑞肽pasireotide、放疗)有明显的临床反应。与标准垂体腺瘤相比,已观察到在进袭性垂体腺瘤(APA)中有包括VEGF的表达的肿瘤血管生成的标志物。Ortiz等人描述一例患有静默性促肾上腺皮质激素细胞垂体癌的患者,虽经TMZ联合贝伐珠单抗治疗,但仍出现进展。贝伐珠单抗治疗26个月后,通过MRI和PET扫描成像观察疾病的稳定性。Wang等人报道使用TMZ和VEGFR-2抑制剂阿帕替尼(apatinib)治疗多发性复发性进袭性分泌生长激素的腺瘤后体积缩小超过90%。经过2年的随访,他们报告持续的生化的生长激素缓解和放射影像学上肿瘤复发。然而,阿帕替尼(apatinib )对临床反应的相对贡献仍不确定。基于这些有限的数据,对有疾病进展的患者应考虑VEGF靶向治疗。VEGF表达增加作为预测反应的生物标志物的临床相关性值得进一步评估。Raf/ MEK/ERK和PI3K/Akt/mTOR通路也被证明在垂体肿瘤中上调。这些级联反应(cascades)的抑制剂在体外和进袭性垂体腺瘤(APA)的小鼠模型中显示出抗肿瘤的作用,然而,在临床上观察到使用这些药物的效果有限。5例口服mTOR抑制剂依维莫司作为二线或三线的单药治疗无效。在16.5%的促肾上腺皮质激素细胞腺瘤中检测到致癌的V600E BRAF突变,但在其他类型的垂体腺瘤中未检测到。使用BRAF抑制剂vemurafenib治疗的小鼠促肾上腺皮质激素细胞腺瘤会降低ACTH的表达,提示该抑制剂在有BRAF突变肿瘤的库欣病患者中起着作用。
另一种新兴的治疗难治性垂体腺瘤的方法是使用免疫治疗。在Wang等人报道的最近一项研究中,常在高Ki-67指数的功能性垂体腺瘤中表达一种关键的预测免疫治疗反应的标志物,PD-L1。在59%的功能性肿瘤中检测到PD-L1的表达,而在NFPA中只有34%。同样,Mei等人显示功能腺瘤中PDL1水平和肿瘤浸润性淋巴细胞的表达显著升高,进一步提高了检查点阻滞免疫治疗对常规治疗难治性的功能腺瘤有效的可能性。目前,只有一个病例被报道为1例垂体癌患者,先前接受TMZ和卡培他滨(capecitabine )治疗,联合使用检查点抑制剂单克隆抗体纳武单抗(nivolumab)(抗-PD-1)和伊匹单抗(ipilimumab)(抗CTLA4)治疗效果明显。经过五个周期的治疗,颅内肿瘤体积减少59%,原发性肝转移减少92%。血浆ACTH水平从45,550 pg/mL下降到66 pg/mL。在六个月的监测中,没有观察到进展。重要的是,有免疫治疗的临床经验提示正常垂体细胞对检查点抑制剂敏感,4-15%的患者报道垂体炎是治疗的常见副作用,可能与CTLA-4在垂体内分泌的异位表达有关。虽然这种表达可能增强了检查点抑制剂的抗肿瘤免疫反应,但患者需要密切监测垂体功能低下的发生。
综上所述,对于进袭性垂体腺瘤和垂体癌,常规治疗包括由专业神经外科医生进行的手术切除和最大限度的放射治疗失败后,TMZ目前被推荐为一线治疗。第二和第三线的选择仍然不确定,可用来指导治疗的数据有限,然而,对使用VEGF抑制剂和免疫检查点抑制剂治疗似乎抱有希望,目前正在进行几项临床试验。
颅咽管瘤是发生于鞍区和鞍上区域的良性的(WHO I级)肿瘤,起源于来源于Rathke袋(pouch)胚胎上皮(embryonic epithelium )。颅咽管瘤是一种较为罕见的肿瘤,其发病率为每10万人年0.13例,占全部颅内肿瘤的3%。颅咽管瘤可靠地出现在双模态年龄分布中,最常出现在5-14岁的儿童患者中,第二个高峰出现在60 - 70岁的成年人中。有两种颅咽管瘤亚型,每一种都有可能发生在不同的患者人群中:造釉细胞(adamantinomatous)亚型最常发生在小儿患者,而乳头状(papillary)亚型主要发生在成人。放射影像学上,造釉细胞型颅咽管瘤包含明显的囊性成分,经常表现有钙化,而乳头状亚型更为实体性,很少包含有钙化。鉴于其位于鞍上空间,颅咽管瘤可对邻近结构产生肿块占位效应,因此可表现为由于视觉器官受压出现视觉改变、继发于下丘脑-垂体功能障碍引起的激素异常或因阻塞性脑积水引起的头痛。
颅咽管瘤是一种生长缓慢的肿瘤,直到病人开始表现出由于压迫邻近结构的症状,诊断常常被推迟。诊断时最常见的临床症状包括头痛、视力障碍和内分泌功能障碍。儿科患者经常在诊断时发现有内分泌疾病,最常见的是生长激素和促性腺激素缺乏。另一方面,成年人更常出现头痛和视野障碍。
儿童和成人颅咽管瘤的治疗通常包括手术切除,然后辅助放射治疗。手术切除可减少肿瘤对视神经和脑干的影响,恢复脑脊液流动,缓解脑积水。切除还可提供组织病理学诊断和分子基因分型,并在必要时减少后续放疗所需的总体肿瘤体积。手术切除可通过经颅或内镜鼻内镜入路,这两种入路与辅助放射治疗相结合时具有相似的总体生存率。放射治疗已被证明是肿瘤次全切除术或肿瘤复发后的有效的辅助治疗。
手术切除和放射治疗提供良好的肿瘤控制,总体10年生存率在80-90%之间,尽管局部复发很常见。即使在长期无进展生存的患者中,神经和心理疾病的患病率也很高。儿童时期诊断出颅咽管瘤的患者及其照顾者(caregivers)报告生存质量较差,并存在长期的心理社会障碍。此外,大部分患者中存在垂体功能不全在,高达75%的患者存在全垂体功能低下,易导致肥胖、高脂血症、糖尿病和心血管疾病的慢性发病率。神经认知和通过积极的外科手术切除和随后的放射治疗,与颅咽管瘤治疗相关的代谢性发病率强调了需要研究和开发新的药物疗法。近年来,从颅咽管瘤发病的分子机制中获得的见解引入有可能发展的靶向治疗来治疗这些肿瘤。
造釉细胞型颅咽管瘤中
CTNNB1/ catenin基因突变

通过激活Wnt信号通路介导的CTNNB1突变导致β-catenin(连环蛋白)的过表达,这与造釉细胞型颅咽管瘤的肿瘤发生有关。β-catenin(连环蛋白)是一种由CTNNB1编码的蛋白质,是介导细胞粘附的钙粘蛋白复合物(the cadherin protein complex )的一部分。β-catenin也是介导细胞增殖的Wnt信号通路的重要组成部分。β-catenin/Wnt信号通路的畸变与乳腺癌、结直肠癌和子宫内膜癌的发病机制有关。在其灭活形式,在细胞膜中发现β-catenin ,在那里它可以很容易被蛋白酶体降解。CTNNB1的突变已被证明可以激活Wnt通路,从而使β-catenin抵抗降解,并反过来将β-catenin调动到细胞核中促进肿瘤细胞迁移。
(略)
对乳头状颅咽管瘤中BRAF (V600E)突变的研究(略)

对于难治性或复发性脑膜瘤、垂体腺瘤或颅咽管瘤,缺乏有效的药物,尽管对致瘤驱动因素的研究带来有前景的治疗方法的发展,特别是对于有NF-2突变的脑膜瘤和V600E BRAF突变的颅咽管瘤。相比之下,NF-2野生型脑膜瘤往往表现出高的突变负担,可能对免疫治疗更为敏感。对垂体腺瘤发生发展的基因和表观遗传变化的说明仍在进行中,尽管MGMT免疫表达与垂体腺瘤发生发展呈负相关,对替莫唑胺的反应值得关注。